「D-セリン」の版間の差分
細 →統合失調症 |
細編集の要約なし |
||
| 3行目: | 3行目: | ||
<font size="+1">[http://researchmap.jp/torunishikawa/ 西川 徹]</font><br> | <font size="+1">[http://researchmap.jp/torunishikawa/ 西川 徹]</font><br> | ||
''昭和医科大学大学院医科薬理学、京都府立医科大学大学院精神機能病態学 ''<br> | ''昭和医科大学大学院医科薬理学、京都府立医科大学大学院精神機能病態学 ''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2025年6月18日 原稿完成日:2025年8月XX日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 11行目: | 11行目: | ||
<small>D</small>-2-Amino-3-hydroxypropionic Acid | <small>D</small>-2-Amino-3-hydroxypropionic Acid | ||
{{box|text= <small>D</small>- | {{box|text= <small>D</small>-セリンは、脊椎動物のみならず、環形動物や環形動物にも含有される内在性<small>D</small>体アミノ酸である。哺乳類では、脳優位に存在し、脳においてはNMDA型グルタミン酸受容体(NMDA受容体)と類似した分布および発達パターンを示す。NMDA受容体の内在性コアゴニストとして作用するとともに、δ型グルタミン酸受容体にも結合し、認知機能、精神・行動等の高次脳機能の発現・制御に重要な役割を果たすと考えられている。<small>D</small>-セリンの合成能を持つセリンラセマーゼおよび分解能をもつ<small>D</small>-アミノ酸酸化酵素が同定されているほか、貯蔵、細胞外遊離、取り込みなどの代謝過程の研究が進められている。}} | ||
[[ファイル:Nishikawa D-Ser Fig1.png|サムネイル|'''図1. <small>D</small>-セリンの化学構造''']] | [[ファイル:Nishikawa D-Ser Fig1.png|サムネイル|'''図1. <small>D</small>-セリンの化学構造''']] | ||
== 発見 == | == 発見 == | ||
<small>D</small>-セリン('''図1''' | <small>D</small>-セリン('''図1''')は遊離型として、ミミズ(環形動物)やカイコ(節足動物)の組織に含まれていることが1960年代から知られていたが、脊椎動物では、アミノ酸は<small>L</small>体で占められるというホモキラリテーが定説となっており、1980年代までは遊離体・結合型(タンパク質の成分)ともに検出されることはなかった<ref name=Corrigan1969><pubmed>5774186</pubmed></ref> [1]。1980年代になり、筆者らが統合失調症の新しい治療法を研究する過程で、遊離型<small>D</small>-セリンが哺乳類の脳に恒常的に高濃度で含まれることを見出し、NMDA型グルタミン酸受容体(NMDA受容体)の内在性コアゴニストであることを示唆した<ref name=Nishikawa2022>'''Nishikawa, T., Umino, A., Umino, M. (2022).'''<br> | ||
<small>D</small>-Serine: Basic Aspects with a Focus on Psychosis. In: Riederer, P., Laux, G., Nagatsu, T., Le, W., Riederer, C. (eds) NeuroPsychopharmacotherapy. pp 495-523, Springer, Cham. [https://doi.org/10.1007/978-3-030-62059-2_470 DOI]</ref> [2]。 | <small>D</small>-Serine: Basic Aspects with a Focus on Psychosis. In: Riederer, P., Laux, G., Nagatsu, T., Le, W., Riederer, C. (eds) NeuroPsychopharmacotherapy. pp 495-523, Springer, Cham. [https://doi.org/10.1007/978-3-030-62059-2_470 DOI]</ref> [2]。 | ||
NMDA受容体遮断薬が統合失調症と区別し難い精神症状を引き起こすことに基づいて、同受容体の機能低下が推測されている<ref name=Nishikawa2022 /> <ref name=Uno2019><pubmed>30666759</pubmed></ref> [2,3]。これらの精神症状には、既存の治療薬(抗精神病薬)が効果的な陽性症状だけでなく、改善が困難な陰性症状や認知機能障害が含まれる。そこで、本症の新規治療法を開発するため、NMDA受容体機能を促進する同受容体グリシン調節部位の作動薬('''図2''':グルタミン酸結合部位の作動薬のような高濃度での細胞傷害性がない)として知られていた<small>D</small>-セリンと、その血液脳関門の透過性向上を目的として合成した脂肪酸化合物をラットに投与したところ、いずれもNMDA受容体遮断薬による統合失調症の動物モデルとされる異常行動が抑制された。これらの抑制効果は、NMDA受容体グリシン調節部位の選択的拮抗薬により減弱することや、脂肪酸化合物はグリシン調節部位に結合したなかったことより、脂肪酸とのエステル結合が分解して遊離された<small>D</small>-セリンがグリシン調節部位に作用する可能性が示唆された。その検証を、キラルアミノ酸を分離定量可能な高速液体クロマトグラフィー(HPLC)、gas chromatograph(GC)、gas chromatograph-mass spectrometer(GC-MS)法等で行った結果、上記の脂肪酸化合物を投与していない動物の脳(大脳新皮質)において<small>D</small>- | NMDA受容体遮断薬が統合失調症と区別し難い精神症状を引き起こすことに基づいて、同受容体の機能低下が推測されている<ref name=Nishikawa2022 /> <ref name=Uno2019><pubmed>30666759</pubmed></ref> [2,3]。これらの精神症状には、既存の治療薬(抗精神病薬)が効果的な陽性症状だけでなく、改善が困難な陰性症状や認知機能障害が含まれる。そこで、本症の新規治療法を開発するため、NMDA受容体機能を促進する同受容体グリシン調節部位の作動薬('''図2''':グルタミン酸結合部位の作動薬のような高濃度での細胞傷害性がない)として知られていた<small>D</small>-セリンと、その血液脳関門の透過性向上を目的として合成した脂肪酸化合物をラットに投与したところ、いずれもNMDA受容体遮断薬による統合失調症の動物モデルとされる異常行動が抑制された。これらの抑制効果は、NMDA受容体グリシン調節部位の選択的拮抗薬により減弱することや、脂肪酸化合物はグリシン調節部位に結合したなかったことより、脂肪酸とのエステル結合が分解して遊離された<small>D</small>-セリンがグリシン調節部位に作用する可能性が示唆された。その検証を、キラルアミノ酸を分離定量可能な高速液体クロマトグラフィー(HPLC)、gas chromatograph(GC)、gas chromatograph-mass spectrometer(GC-MS)法等で行った結果、上記の脂肪酸化合物を投与していない動物の脳(大脳新皮質)において<small>D</small>-セリンが検出され、無菌ラットでも濃度が同等であることから、哺乳類の脳に細菌由来ではない内在性<small>D</small>-セリンが存在することがわかった<ref name=Hashimoto1992><pubmed>1730289</pubmed></ref><ref name=Hashimoto1993><pubmed>8419554</pubmed></ref> [4, 5]。 | ||
== 化学的性質 == | == 化学的性質 == | ||
1個のアミノ基と1個のカルボニル基をもつ<small>D</small>-αアミノ酸で、中性アミノ酸に分類される。水溶性。 | 1個のアミノ基と1個のカルボニル基をもつ<small>D</small>-αアミノ酸で、中性アミノ酸に分類される。水溶性。 | ||
実験に用いるときは、市販の標品が1.5~1%の<small>L</small>-セリンを含んでいることや、<small>D</small>-[<sup>3</sup>H]-セリンは保存中に組織に非特異的な結合を起こす分解物ができることがあるので、それを除くため使用前にイオン交換樹脂で再精製を要することに注意が必要である。 | |||
== 生体内分布 == | == 生体内分布 == | ||
ラット、マウス、ヒトなどの哺乳類においては、出生後生涯を通じ不均一で脳優位の体内分布を示す。組織中濃度は脳で高く、末梢組織では低濃度(腎臓、肝臓、脾臓、血液等)、痕跡程度または検出感度未満である<ref name=Hashimoto1993 /><ref name=Hashimoto1995><pubmed>7582120</pubmed></ref> [5, 6]。成熟期の脳内では、前脳部(大脳皮質、線条体、海馬など)で高濃度(0.25~0.35µmol/g tissue)、間脳、中脳などでは中等度〜低濃度、橋―延髄、小脳においては痕跡程度または検出感度未満であるが、出生時には各脳部位間でほぼ均一の濃度(0.1 µmol/g tissue程度)が認められる<ref name=Hashimoto1995 /> [6]。 | ラット、マウス、ヒトなどの哺乳類においては、出生後生涯を通じ不均一で脳優位の体内分布を示す。組織中濃度は脳で高く、末梢組織では低濃度(腎臓、肝臓、脾臓、血液等)、痕跡程度または検出感度未満である<ref name=Hashimoto1993 /><ref name=Hashimoto1995><pubmed>7582120</pubmed></ref> [5, 6]。成熟期の脳内では、前脳部(大脳皮質、線条体、海馬など)で高濃度(0.25~0.35µmol/g tissue)、間脳、中脳などでは中等度〜低濃度、橋―延髄、小脳においては痕跡程度または検出感度未満であるが、出生時には各脳部位間でほぼ均一の濃度(0.1 µmol/g tissue程度)が認められる<ref name=Hashimoto1995 /> [6]。 | ||
<small>D</small>-セリンの脳組織中の分布は、NMDA型グルタミン酸受容体(NMDA受容体) | |||
<small>D</small>-セリンの脳組織中の分布は、NMDA型グルタミン酸受容体(NMDA受容体)の、グルタミン酸結合部位、グリシン調節部位およびフェンサイクリジン結合部位と強い相関を示す<ref name=Hashimoto1992 /> [4]('''図2''')。また,生後の発達期から成熟期に至る脳内分布の変化は、GRIN2Bの発現分布の変化と類似している<ref name=Watanabe1992><pubmed>1493227</pubmed></ref>[7]。 | |||
== 代謝 == | == 代謝 == | ||
| 41行目: | 43行目: | ||
細胞外<small>D</small>-セリンの放出の分子細胞機構については結論が得られていないが、神経活動に応じたシナプス小胞の開口によって放出される神経伝達物質とは異なると推測されている。すなわち、in vivoの実験系では、細胞外液中<small>D</small>-セリン濃度は、脱分極刺激により低下し、神経伝導遮断や細胞外カルシウムの除去を行っても減少しない<ref name=Hashimoto1995b /> [20]。さらに、in vitroの条件下では<small>D</small>-セリンのシナプス小胞に含まれる物質の放出阻害薬の影響を受けない<ref name=Kartvelishvily2006 /> [19]。これらに対して、グリアの活動を抑制する薬剤で減少する<ref name=Kanematsu2006><pubmed>16736231</pubmed></ref><ref name=Henneberger2010><pubmed>20075918</pubmed></ref> [21,22]。これらの所見は、細胞外の<small>D</small>-セリンの放出にはニューロンおよびグリアの双方の活動が影響することを示唆しているが、放出細胞は未同定である。細胞外液中の<small>D</small>-セリン濃度の調節については、AMPA型グルタミン酸受容体<ref name=Ishiwata2008><pubmed>23298512</pubmed></ref> [23]、P2X7プリン受容体―pannexin複合体<ref name=Pan2015><pubmed>25630251</pubmed></ref> [24]、GABA<sub>A</sub>受容体<ref name=Umino2017><pubmed>28824371</pubmed></ref> [25]等の関与が報告されている。 | 細胞外<small>D</small>-セリンの放出の分子細胞機構については結論が得られていないが、神経活動に応じたシナプス小胞の開口によって放出される神経伝達物質とは異なると推測されている。すなわち、in vivoの実験系では、細胞外液中<small>D</small>-セリン濃度は、脱分極刺激により低下し、神経伝導遮断や細胞外カルシウムの除去を行っても減少しない<ref name=Hashimoto1995b /> [20]。さらに、in vitroの条件下では<small>D</small>-セリンのシナプス小胞に含まれる物質の放出阻害薬の影響を受けない<ref name=Kartvelishvily2006 /> [19]。これらに対して、グリアの活動を抑制する薬剤で減少する<ref name=Kanematsu2006><pubmed>16736231</pubmed></ref><ref name=Henneberger2010><pubmed>20075918</pubmed></ref> [21,22]。これらの所見は、細胞外の<small>D</small>-セリンの放出にはニューロンおよびグリアの双方の活動が影響することを示唆しているが、放出細胞は未同定である。細胞外液中の<small>D</small>-セリン濃度の調節については、AMPA型グルタミン酸受容体<ref name=Ishiwata2008><pubmed>23298512</pubmed></ref> [23]、P2X7プリン受容体―pannexin複合体<ref name=Pan2015><pubmed>25630251</pubmed></ref> [24]、GABA<sub>A</sub>受容体<ref name=Umino2017><pubmed>28824371</pubmed></ref> [25]等の関与が報告されている。 | ||
[[ファイル:Nishikawa D-Ser Fig2.png|サムネイル|'''図2. GluN1/GluN2型NMDA受容体'''<br>Gly | [[ファイル:Nishikawa D-Ser Fig2.png|サムネイル|'''図2. GluN1/GluN2型NMDA受容体'''<br>Gly:グリシン調節部位、Glu:グルタミン酸結合部位、SRR:セリンラセマーゼ、DAO:<small>D</small>-アミノ酸酸化酵素、Poly:ポリアミン結合部位、PCP:フェンサイクリジン]] | ||
=== 受容体結合 === | === 受容体結合 === | ||
グルタミン酸受容体のうち、NMDA受容体(GluN1/GluN2型('''図2''')およびGluN1/GluN3型)に結合する<ref name=Danysz1998><pubmed>9860805</pubmed></ref><ref name=Matsui1995><pubmed>7790891</pubmed></ref><ref name=Chatterton2002><pubmed>11823786</pubmed></ref> [26,27,28]、またδ受容体GluD1およびGluD2にも結合する<ref name=Naur2007><pubmed>17715062</pubmed></ref> [29](生理機能参照)。 | グルタミン酸受容体のうち、NMDA受容体(GluN1/GluN2型('''図2''')およびGluN1/GluN3型)に結合する<ref name=Danysz1998><pubmed>9860805</pubmed></ref><ref name=Matsui1995><pubmed>7790891</pubmed></ref><ref name=Chatterton2002><pubmed>11823786</pubmed></ref> [26,27,28]、またδ受容体GluD1およびGluD2にも結合する<ref name=Naur2007><pubmed>17715062</pubmed></ref> [29](生理機能参照)。 | ||
| 75行目: | 77行目: | ||
==== GluN1/GluN3型NMDA受容体 ==== | ==== GluN1/GluN3型NMDA受容体 ==== | ||
GluN1、GluN3サブユニットから成るNMDA受容体は、グルタミン酸には応答せずグリシンや<small>D</small>-セリン単独で活性化される興奮性グリシン受容体(eGlyR)を構成することが報告された<ref name=Chatterton2002><pubmed>11823786</pubmed></ref> [28]。本受容体は、ミエリンに存在するだけでなく<ref name=Pina-Crespo2010><pubmed>20739572</pubmed></ref> [42]、大脳皮質・手綱核・扁桃体において内在性グリシンが持続的に神経細胞を脱分極させることによってその興奮性を調節すると考えられている<ref name=Bossi2022><pubmed>35700736</pubmed></ref> [43]。セリンラセマーゼ欠損マウスでは、このような持続性脱分極が影響を受けないことから、<small>D</small>-セリンの生理的役割についてはさらに検討が必要である<ref name=Bossi2022><pubmed>35700736</pubmed></ref> [43]。一方、<small>D</small>-セリンはeGlyRの弱い部分アゴニストとして作用し、グリシンにより前活性化されたeGlyRを抑制する <ref name=Bossi2022><pubmed>35700736</pubmed></ref> [43]。 | |||
==== δ受容体リガンド ==== | ==== δ受容体リガンド ==== | ||
| 95行目: | 97行目: | ||
# 組織中の<small>D</small>-セリン濃度の変化は認められず<ref name=Kumashiro1995><pubmed>7552268</pubmed></ref><ref name=Bendikov2007><pubmed>17156977</pubmed></ref> [50, 51] | # 組織中の<small>D</small>-セリン濃度の変化は認められず<ref name=Kumashiro1995><pubmed>7552268</pubmed></ref><ref name=Bendikov2007><pubmed>17156977</pubmed></ref> [50, 51] | ||
# セリンラセマーゼ発現量の変化は研究者間で一致しないが<ref name=Bendikov2007><pubmed>17156977</pubmed></ref><ref name=Steffek2006><pubmed>16837850</pubmed></ref> [51,52] | # セリンラセマーゼ発現量の変化は研究者間で一致しないが<ref name=Bendikov2007><pubmed>17156977</pubmed></ref><ref name=Steffek2006><pubmed>16837850</pubmed></ref> [51,52] | ||
# D-アミノ酸酸化酵素発現が増加<ref name=Bendikov2007><pubmed>17156977</pubmed></ref><ref name=Madeira2008><pubmed>18378121</pubmed></ref><ref name=Habl2009><pubmed>19823762</pubmed></ref><ref name=Ono2009><pubmed>19685198</pubmed></ref> [51, 53, 54, 55] | # <small>D</small>-アミノ酸酸化酵素発現が増加<ref name=Bendikov2007><pubmed>17156977</pubmed></ref><ref name=Madeira2008><pubmed>18378121</pubmed></ref><ref name=Habl2009><pubmed>19823762</pubmed></ref><ref name=Ono2009><pubmed>19685198</pubmed></ref> [51, 53, 54, 55] | ||
# <small>D</small>-セリンが結合するNMDA受容体グリシン調節部位の増加<ref name=Ishimaru1994><pubmed>7909453</pubmed></ref> [56] | # <small>D</small>-セリンが結合するNMDA受容体グリシン調節部位の増加<ref name=Ishimaru1994><pubmed>7909453</pubmed></ref> [56] | ||
は、細胞外<small>D</small>-セリンシグナルの減少に繋がる所見として注目される。 | は、細胞外<small>D</small>-セリンシグナルの減少に繋がる所見として注目される。 | ||
<small>D</small>-セリンは、統合失調症様症状を引き起こすNMDA受容体遮断薬を投与した動物の異常行動(統合失調症の薬理学的モデル)<ref name=Contreras1990><pubmed>2109276</pubmed></ref><ref name=Tanii1994><pubmed>8014848</pubmed></ref> [57, 58]や、統合失調症患者において既存の治療薬が奏功しない陰性症状や陽性症状を改善すること<ref name=Tsai2008a><pubmed>9836012</pubmed></ref> [59] | <small>D</small>-セリンは、統合失調症様症状を引き起こすNMDA受容体遮断薬を投与した動物の異常行動(統合失調症の薬理学的モデル)<ref name=Contreras1990><pubmed>2109276</pubmed></ref><ref name=Tanii1994><pubmed>8014848</pubmed></ref> [57, 58]や、統合失調症患者において既存の治療薬が奏功しない陰性症状や陽性症状を改善すること<ref name=Tsai2008a><pubmed>9836012</pubmed></ref> [59]が報告されている。これらの効果は、別のNMDA受容体グリシン調節部位作動薬の<small>D</small>-アラニンにも認められるのに対して<ref name=Ishimaru1994><pubmed>7909453</pubmed></ref><ref name=Tsai2008b><pubmed>16154544</pubmed></ref> [56, 60]、動物実験で、同調節部位には作用しないL体のセリンやアラニンにはないことや<ref name=Tanii1994><pubmed>8014848</pubmed></ref> [58]、同調節部位の拮抗薬で阻害されること<ref name=Tanii1994><pubmed>8014848</pubmed></ref> [58]が確認されている。以上の結果から、グリシン調節部位を刺激する薬物や、内在性<small>D</small>-セリンシグナルを増強する薬物が、既存薬よりも治療スペクトラムの広い新しい合失調症治療薬の治療薬として開発が進められている<ref name=Nishikawa2022 /> <ref name=Nishikawa2022b>'''Nishikawa, T., Umino, A., Umino, M. (2022).'''<br> <small>D</small>-Serine in the Treatment of Psychosis. In: Riederer, P., Laux, G., Nagatsu, T., Le, W., Riederer, C. (eds) NeuroPsychopharmacotherapy. pp 1963–1976, Springer, Cham. https://doi.org/10.1007/978-3-030-62059-2_391</ref> [2, 61]。 | ||
=== 興奮毒性 === | === 興奮毒性 === | ||
セリンラセマーゼ欠損マウスの大脳皮質では、NMDAやAβ1-42による神経細胞死が著明に抑制され、<small>D</small>-セリン濃度が10%程度まで減少するのに対して、グリシン、L-セリンおよびL-グルタミン酸は変化しない<ref name=Inoue2008><pubmed>19118183</pubmed></ref> [40]。これらの結果から、アルツハイマー病、筋萎縮性側索硬化症をはじめとする神経変性疾患や、脳血管障害における神経細胞傷害に、<small>D</small>-セリンが関与する可能性が注目されている。 | セリンラセマーゼ欠損マウスの大脳皮質では、NMDAやAβ1-42による神経細胞死が著明に抑制され、<small>D</small>-セリン濃度が10%程度まで減少するのに対して、グリシン、L-セリンおよびL-グルタミン酸は変化しない<ref name=Inoue2008><pubmed>19118183</pubmed></ref> [40]。これらの結果から、アルツハイマー病、筋萎縮性側索硬化症をはじめとする神経変性疾患や、脳血管障害における神経細胞傷害に、<small>D</small>-セリンが関与する可能性が注目されている。 | ||
=== 腎障害 === | === 腎障害 === | ||
末梢の<small>D</small>-セリンに関しては、腎臓における生理的・病態生理学的な意義の解析が進んでいる<ref name=Nakade2019>'''中出 祐介,岩田 恭宜,和田 隆志(2019).'''<br><small>D</small>-セリンと腎臓病 生化学, 91(3),349‒354. PDF: https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2019.910349/data/index.html></ref> [62]。腎臓には<small>D</small>- | 末梢の<small>D</small>-セリンに関しては、腎臓における生理的・病態生理学的な意義の解析が進んでいる<ref name=Nakade2019>'''中出 祐介,岩田 恭宜,和田 隆志(2019).'''<br><small>D</small>-セリンと腎臓病 生化学, 91(3),349‒354. PDF: https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2019.910349/data/index.html></ref> [62]。腎臓には<small>D</small>-セリン、セリンラセマーゼ、<small>D</small>-アミノ酸酸化酵素および中性アミノ酸トランスポーター等が存在し、尿中にはL体より高い濃度の<small>D</small>-セリンが検出されることから腎排泄機能への関与が示唆されている。腎障害患者では血液中<small>D</small>-セリンの上昇が認められ、腎機能のマーカーとしての可能性が検討されている。 | ||
== 関連項目 == | == 関連項目 == | ||
2025年8月14日 (木) 10:48時点における版
西川 徹
昭和医科大学大学院医科薬理学、京都府立医科大学大学院精神機能病態学
DOI:10.14931/bsd.11184 原稿受付日:2025年6月18日 原稿完成日:2025年8月XX日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英:D-serine 独:D-Serin 仏:D-sérine
英略称:D-Ser
別名:D-2-アミノ-3-ヒドロキシプロピオン酸
D-2-Amino-3-hydroxypropionic Acid
D-セリンは、脊椎動物のみならず、環形動物や環形動物にも含有される内在性D体アミノ酸である。哺乳類では、脳優位に存在し、脳においてはNMDA型グルタミン酸受容体(NMDA受容体)と類似した分布および発達パターンを示す。NMDA受容体の内在性コアゴニストとして作用するとともに、δ型グルタミン酸受容体にも結合し、認知機能、精神・行動等の高次脳機能の発現・制御に重要な役割を果たすと考えられている。D-セリンの合成能を持つセリンラセマーゼおよび分解能をもつD-アミノ酸酸化酵素が同定されているほか、貯蔵、細胞外遊離、取り込みなどの代謝過程の研究が進められている。
発見
D-セリン(図1)は遊離型として、ミミズ(環形動物)やカイコ(節足動物)の組織に含まれていることが1960年代から知られていたが、脊椎動物では、アミノ酸はL体で占められるというホモキラリテーが定説となっており、1980年代までは遊離体・結合型(タンパク質の成分)ともに検出されることはなかった[1] [1]。1980年代になり、筆者らが統合失調症の新しい治療法を研究する過程で、遊離型D-セリンが哺乳類の脳に恒常的に高濃度で含まれることを見出し、NMDA型グルタミン酸受容体(NMDA受容体)の内在性コアゴニストであることを示唆した[2] [2]。
NMDA受容体遮断薬が統合失調症と区別し難い精神症状を引き起こすことに基づいて、同受容体の機能低下が推測されている[2] [3] [2,3]。これらの精神症状には、既存の治療薬(抗精神病薬)が効果的な陽性症状だけでなく、改善が困難な陰性症状や認知機能障害が含まれる。そこで、本症の新規治療法を開発するため、NMDA受容体機能を促進する同受容体グリシン調節部位の作動薬(図2:グルタミン酸結合部位の作動薬のような高濃度での細胞傷害性がない)として知られていたD-セリンと、その血液脳関門の透過性向上を目的として合成した脂肪酸化合物をラットに投与したところ、いずれもNMDA受容体遮断薬による統合失調症の動物モデルとされる異常行動が抑制された。これらの抑制効果は、NMDA受容体グリシン調節部位の選択的拮抗薬により減弱することや、脂肪酸化合物はグリシン調節部位に結合したなかったことより、脂肪酸とのエステル結合が分解して遊離されたD-セリンがグリシン調節部位に作用する可能性が示唆された。その検証を、キラルアミノ酸を分離定量可能な高速液体クロマトグラフィー(HPLC)、gas chromatograph(GC)、gas chromatograph-mass spectrometer(GC-MS)法等で行った結果、上記の脂肪酸化合物を投与していない動物の脳(大脳新皮質)においてD-セリンが検出され、無菌ラットでも濃度が同等であることから、哺乳類の脳に細菌由来ではない内在性D-セリンが存在することがわかった[4][5] [4, 5]。
化学的性質
1個のアミノ基と1個のカルボニル基をもつD-αアミノ酸で、中性アミノ酸に分類される。水溶性。
実験に用いるときは、市販の標品が1.5~1%のL-セリンを含んでいることや、D-[3H]-セリンは保存中に組織に非特異的な結合を起こす分解物ができることがあるので、それを除くため使用前にイオン交換樹脂で再精製を要することに注意が必要である。
生体内分布
ラット、マウス、ヒトなどの哺乳類においては、出生後生涯を通じ不均一で脳優位の体内分布を示す。組織中濃度は脳で高く、末梢組織では低濃度(腎臓、肝臓、脾臓、血液等)、痕跡程度または検出感度未満である[5][6] [5, 6]。成熟期の脳内では、前脳部(大脳皮質、線条体、海馬など)で高濃度(0.25~0.35µmol/g tissue)、間脳、中脳などでは中等度〜低濃度、橋―延髄、小脳においては痕跡程度または検出感度未満であるが、出生時には各脳部位間でほぼ均一の濃度(0.1 µmol/g tissue程度)が認められる[6] [6]。
D-セリンの脳組織中の分布は、NMDA型グルタミン酸受容体(NMDA受容体)の、グルタミン酸結合部位、グリシン調節部位およびフェンサイクリジン結合部位と強い相関を示す[4] [4](図2)。また,生後の発達期から成熟期に至る脳内分布の変化は、GRIN2Bの発現分布の変化と類似している[7][7]。
代謝
種々のD体アミノ酸は哺乳類の腸内細菌で産生されることが知られているが、D-セリンは、無菌ラットまたはマウスの脳や腎臓[5][8] [5, 8]においても組織中濃度は変化が見られないことから、生合成される内在性アミノ酸と考えられる。
生合成
L-セリンをD-セリンに変換するセリンラセマーゼが同定された[9][10] [9,10]。本酵素遺伝子の欠損マウスの脳組織ではD-セリン濃度が9〜22%に減少するため[11][12][13][14] [11,12,13,14]、セリンラセマーゼがD-セリンの主要な生合成酵素と考えられている。L-セリンの合成酵素であるホスホグリセリン酸デヒドロゲナーゼ(phosphoglycerate dehydrogenase,Phgdh)の遺伝子をアストログリア特異的に欠損するマウスでは、セリンラセマーゼ欠損マウスと同程度のD-セリン濃度の減少が認められることより[15] [15]、セリンラセマーゼはアストログリアから供給されるL-セリンからD-セリンを合成している可能性が高い。
セリンラセマーゼは、免疫組織化学的にニューロンに局在することが示され[16] [16]、ニューロン選択的に本酵素遺伝子を欠損するマウスにおいてはD-セリン濃度が低下し、アストログリア選択的に欠損させる遺伝子操作ではD-セリン濃度に変化がないことから[17] [17]、主にニューロンに発現していることが支持されている。
貯蔵
脳の細胞内では、シナプトソーム分画でミトコンドリア分画の約3.8倍の濃度のD-セリンが検出されるが[5][5]、細胞内局在や貯蔵形態は未解明である。抗D-セリン抗体を用いた免疫組織化学的検討では、アストログリアの細胞質あるいは小胞様構造や、ニューロンの樹状突起またはシナプス後肥厚に含まれているという報告がある[18][19] [18,19]。
細胞外遊離
D-セリンは、in vivo脳内微小透析法(microdialysis)で自由運動下の齧歯類の脳組織から回収した透析液中に検出され[20] [20]、細胞外に放出されていると考えられている。前頭前野および線条体における細胞外液中濃度は6〜7 µM程度で、神経伝達物質のドーパミンと比較すると、前者では約20,000倍、後者では約500倍程度高い。成熟した齧歯類の脳における細胞外液中濃度の部位差は、組織中濃度と相関し前脳部で高く小脳で低い[20] [20]。
細胞外D-セリンの放出の分子細胞機構については結論が得られていないが、神経活動に応じたシナプス小胞の開口によって放出される神経伝達物質とは異なると推測されている。すなわち、in vivoの実験系では、細胞外液中D-セリン濃度は、脱分極刺激により低下し、神経伝導遮断や細胞外カルシウムの除去を行っても減少しない[20] [20]。さらに、in vitroの条件下ではD-セリンのシナプス小胞に含まれる物質の放出阻害薬の影響を受けない[19] [19]。これらに対して、グリアの活動を抑制する薬剤で減少する[21][22] [21,22]。これらの所見は、細胞外のD-セリンの放出にはニューロンおよびグリアの双方の活動が影響することを示唆しているが、放出細胞は未同定である。細胞外液中のD-セリン濃度の調節については、AMPA型グルタミン酸受容体[23] [23]、P2X7プリン受容体―pannexin複合体[24] [24]、GABAA受容体[25] [25]等の関与が報告されている。
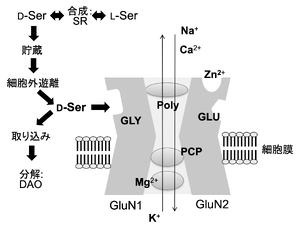
Gly:グリシン調節部位、Glu:グルタミン酸結合部位、SRR:セリンラセマーゼ、DAO:D-アミノ酸酸化酵素、Poly:ポリアミン結合部位、PCP:フェンサイクリジン
受容体結合
グルタミン酸受容体のうち、NMDA受容体(GluN1/GluN2型(図2)およびGluN1/GluN3型)に結合する[26][27][28] [26,27,28]、またδ受容体GluD1およびGluD2にも結合する[29] [29](生理機能参照)。
取り込み
D-セリンに特異的な輸送体は同定されていない。ナトリウム非依存性中性アミノ酸輸送体のAsc-1(Na+-independent alanine-serine-cysteine transporter 1)[30] [31] [30, 31]、ナトリウム依存性中性アミノ酸輸送体(Na+-dependent broad-spectrum neutral amino acid transporter)のASCT1[32] [32]およびASCT2[33][33]などが、D-セリンの生理的な取り込みや遊離に関与することが示唆されているが、D-セリンに対する親和性はAsc-1が最も高い。
分解
内在性D-セリンの分解にはD-アミノ酸酸化酵素が関与すると考えられている[34] [34]。本酵素はKrebsらによって1935年に発見され、酵母から哺乳類まで生物界に広く存在し、D体中性アミノ酸を基質とするがL体には作用しないことが知られてきた[34] [34]。外来性の不要なD体アミノ酸を除去することが生理的機能と推測されていたが、内在性D-セリンが証明された後、その生理的分解酵素として注目されている[34] [34]。哺乳類では、脳、腎臓、肝臓に分布し、本酵素活性を欠損するマウスやラットでは、これらの部位でD-セリンの組織中濃度が増大する[14] [14, 35] [35]。齧歯類の脳では生後7日頃から発現し、成熟期にはD-セリンと逆相関を示すことから、D-セリンの濃度勾配の構築に寄与している可能性がある[34][36] [34,36]。
セリンラセマーゼにはD体およびL体のセリンをピルビン酸とアンモニアに分解する、デヒドラターゼ活性が見出されているが[37] [37]、本酵素の欠損マウスではD-セリンが著明に減少し、D-セリンの生理的な分解における役割は未解明である。
生理的機能
NMDA受容体リガンド
GluN1/GluN2型NMDA受容体
GluN1/GluN2A~ GluN2D型NMDA受容体においては、D-セリンがGluN1サブユニットのグリシン調節部位に結合し(図2:GLY)、同時にGluN2サブユニットにグルタミン酸が結合することによって(図2:GLU)初めてNMDA受容体チャネルが開口することから、D-セリンはNMDA受容体のコアゴニストであることが、in vitro[22][27][38] [22,27,38]およびin vivo[25][39][25,39]の実験系で示されている。グリシンもNMDA受容体のコアゴニストとして機能するが、大脳新皮質、海馬などの前脳部では、
等の方法で細胞外D-セリンを選択的に除去または減少させると、グリシン濃度が正常であってもNMDA受容体機能が低下することより、D-セリンが内在性コアゴニストと考えられている。D-セリンの代謝過程(「代謝」の項)の特徴が古典的な神経伝達物質と大きく異なるのは、神経伝達物質がニューロンの電気活動に即応して急速に細胞外に放出され、速やかに除去されるのに対し、D-セリンはシナプス間隙において一定レベルの濃度が維持されることでコアゴニストとして機能する点にある。
セリンラセマーゼを欠損しD-セリンが著明に減少しているマウスの海馬では、NMDA受容体刺激による、
D-セリンの欠損マウスでは、記憶、学習、注意、遂行機能等の認知機能が障害される[11][13] [11,13]。
グリシンとD-セリンのNMDA受容体に対する生理的役割の違いについての結論は得られていないが、電気生理学的な研究から、D-セリンはシナプスのNMDA受容体に、グリシンはシナプス外NMDA受容体に作用することが示唆されている[41] [41]。
GluN1/GluN3型NMDA受容体
GluN1、GluN3サブユニットから成るNMDA受容体は、グルタミン酸には応答せずグリシンやD-セリン単独で活性化される興奮性グリシン受容体(eGlyR)を構成することが報告された[28] [28]。本受容体は、ミエリンに存在するだけでなく[42] [42]、大脳皮質・手綱核・扁桃体において内在性グリシンが持続的に神経細胞を脱分極させることによってその興奮性を調節すると考えられている[43] [43]。セリンラセマーゼ欠損マウスでは、このような持続性脱分極が影響を受けないことから、D-セリンの生理的役割についてはさらに検討が必要である[43] [43]。一方、D-セリンはeGlyRの弱い部分アゴニストとして作用し、グリシンにより前活性化されたeGlyRを抑制する [43] [43]。
δ受容体リガンド
齧歯類の脳では、NMDA受容体グリシン調節部位以外にもD-セリンが結合する部位が検出される[44] [44]。δ型受容体GluD1およびGluD2には、グルタミン酸は結合しないがグリシンやD-セリンが結合する[29] [45] [29,45]。小脳では、幼若期にはD-アミノ酸酸化酵素の発現が低く、運動学習に伴う神経活動によって細胞外D-セリン濃度が上昇する。小脳プルキンエ細胞にはδ2受容体(GluD2)が強く発現しているため、増加したD-セリンがGluD2に作用することによって長期抑圧が誘導され易く、発達期の小脳では容易に運動学習が起きることが見出されている[46] [46]。
疾患との関係
統合失調症
統合失調症ではNMDA受容体の機能障害が推測されているが、D-セリンの本受容体コアゴニストとしての特性から、シナプスにおけるD-セリンシグナルの低下が、この障害を引き起こしている可能性が考えられている。D-セリン合成酵素欠損マウスでは、
- 運動量増加
- 不安・驚愕反応の増大
- 海馬の樹状突起および体積の減少
- プレパルス抑制の障害(感覚運動フィルター機能異常)
- 社会性行動の障害
- 統合失調症様症状発現薬による異常行動の増悪
等の、本症の患者で観察される異常と類似の変化、あるいは症状のモデルが報告され、前記の仮説を支持している[11] [12] [47] [11,12, 47]。統合失調症患者についての大規模ゲノムワイド関連解析において、セリンラセマーゼと本症の有意な相関が認められたが(GWAS)[48] [48]、否定する遺伝子関連研究もある[49] [49]。死後脳の研究では、
- 組織中のD-セリン濃度の変化は認められず[50][51] [50, 51]
- セリンラセマーゼ発現量の変化は研究者間で一致しないが[51][52] [51,52]
- D-アミノ酸酸化酵素発現が増加[51][53][54][55] [51, 53, 54, 55]
- D-セリンが結合するNMDA受容体グリシン調節部位の増加[56] [56]
は、細胞外D-セリンシグナルの減少に繋がる所見として注目される。
D-セリンは、統合失調症様症状を引き起こすNMDA受容体遮断薬を投与した動物の異常行動(統合失調症の薬理学的モデル)[57][58] [57, 58]や、統合失調症患者において既存の治療薬が奏功しない陰性症状や陽性症状を改善すること[59] [59]が報告されている。これらの効果は、別のNMDA受容体グリシン調節部位作動薬のD-アラニンにも認められるのに対して[56][60] [56, 60]、動物実験で、同調節部位には作用しないL体のセリンやアラニンにはないことや[58] [58]、同調節部位の拮抗薬で阻害されること[58] [58]が確認されている。以上の結果から、グリシン調節部位を刺激する薬物や、内在性D-セリンシグナルを増強する薬物が、既存薬よりも治療スペクトラムの広い新しい合失調症治療薬の治療薬として開発が進められている[2] [61] [2, 61]。
興奮毒性
セリンラセマーゼ欠損マウスの大脳皮質では、NMDAやAβ1-42による神経細胞死が著明に抑制され、D-セリン濃度が10%程度まで減少するのに対して、グリシン、L-セリンおよびL-グルタミン酸は変化しない[40] [40]。これらの結果から、アルツハイマー病、筋萎縮性側索硬化症をはじめとする神経変性疾患や、脳血管障害における神経細胞傷害に、D-セリンが関与する可能性が注目されている。
腎障害
末梢のD-セリンに関しては、腎臓における生理的・病態生理学的な意義の解析が進んでいる[62] [62]。腎臓にはD-セリン、セリンラセマーゼ、D-アミノ酸酸化酵素および中性アミノ酸トランスポーター等が存在し、尿中にはL体より高い濃度のD-セリンが検出されることから腎排泄機能への関与が示唆されている。腎障害患者では血液中D-セリンの上昇が認められ、腎機能のマーカーとしての可能性が検討されている。
関連項目
参考文献
- ↑
Corrigan, J.J. (1969).
D-amino acids in animals. Science (New York, N.Y.), 164(3876), 142-9. [PubMed:5774186] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 Nishikawa, T., Umino, A., Umino, M. (2022).
D-Serine: Basic Aspects with a Focus on Psychosis. In: Riederer, P., Laux, G., Nagatsu, T., Le, W., Riederer, C. (eds) NeuroPsychopharmacotherapy. pp 495-523, Springer, Cham. DOI - ↑
Uno, Y., & Coyle, J.T. (2019).
Glutamate hypothesis in schizophrenia. Psychiatry and clinical neurosciences, 73(5), 204-215. [PubMed:30666759] [WorldCat] [DOI] - ↑ 4.0 4.1
Hashimoto, A., Nishikawa, T., Hayashi, T., Fujii, N., Harada, K., Oka, T., & Takahashi, K. (1992).
The presence of free D-serine in rat brain. FEBS letters, 296(1), 33-6. [PubMed:1730289] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3
Hashimoto, A., Nishikawa, T., Oka, T., & Takahashi, K. (1993).
Endogenous D-serine in rat brain: N-methyl-D-aspartate receptor-related distribution and aging. Journal of neurochemistry, 60(2), 783-6. [PubMed:8419554] [WorldCat] [DOI] - ↑ 6.0 6.1
Hashimoto, A., Oka, T., & Nishikawa, T. (1995).
Anatomical distribution and postnatal changes in endogenous free D-aspartate and D-serine in rat brain and periphery. The European journal of neuroscience, 7(8), 1657-63. [PubMed:7582120] [WorldCat] [DOI] - ↑
Watanabe, M., Inoue, Y., Sakimura, K., & Mishina, M. (1992).
Developmental changes in distribution of NMDA receptor channel subunit mRNAs. Neuroreport, 3(12), 1138-40. [PubMed:1493227] [WorldCat] [DOI] - ↑
Nagata, Y., Yamamoto, K., Shimojo, T., Konno, R., Yasumura, Y., & Akino, T. (1992).
The presence of free D-alanine, D-proline and D-serine in mice. Biochimica et biophysica acta, 1115(3), 208-11. [PubMed:1346751] [WorldCat] [DOI] - ↑
Wolosker, H., Sheth, K.N., Takahashi, M., Mothet, J.P., Brady, R.O., Ferris, C.D., & Snyder, S.H. (1999).
Purification of serine racemase: biosynthesis of the neuromodulator D-serine. Proceedings of the National Academy of Sciences of the United States of America, 96(2), 721-5. [PubMed:9892700] [PMC] [WorldCat] [DOI] - ↑
Wolosker, H., Blackshaw, S., & Snyder, S.H. (1999).
Serine racemase: a glial enzyme synthesizing D-serine to regulate glutamate-N-methyl-D-aspartate neurotransmission. Proceedings of the National Academy of Sciences of the United States of America, 96(23), 13409-14. [PubMed:10557334] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2 11.3
Basu, A.C., Tsai, G.E., Ma, C.L., Ehmsen, J.T., Mustafa, A.K., Han, L., ..., & Coyle, J.T. (2009).
Targeted disruption of serine racemase affects glutamatergic neurotransmission and behavior. Molecular psychiatry, 14(7), 719-27. [PubMed:19065142] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Horio, M., Kohno, M., Fujita, Y., Ishima, T., Inoue, R., Mori, H., & Hashimoto, K. (2011).
Levels of D-serine in the brain and peripheral organs of serine racemase (Srr) knock-out mice. Neurochemistry international, 59(6), 853-9. [PubMed:21906644] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Labrie, V., Fukumura, R., Rastogi, A., Fick, L.J., Wang, W., Boutros, P.C., ..., & Roder, J.C. (2009).
Serine racemase is associated with schizophrenia susceptibility in humans and in a mouse model. Human molecular genetics, 18(17), 3227-43. [PubMed:19483194] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Miyoshi, Y., Konno, R., Sasabe, J., Ueno, K., Tojo, Y., Mita, M., ..., & Hamase, K. (2012).
Alteration of intrinsic amounts of D-serine in the mice lacking serine racemase and D-amino acid oxidase. Amino acids, 43(5), 1919-31. [PubMed:22990841] [WorldCat] [DOI] - ↑
Yang, J.H., Wada, A., Yoshida, K., Miyoshi, Y., Sayano, T., Esaki, K., ..., & Furuya, S. (2010).
Brain-specific Phgdh deletion reveals a pivotal role for L-serine biosynthesis in controlling the level of D-serine, an N-methyl-D-aspartate receptor co-agonist, in adult brain. The Journal of biological chemistry, 285(53), 41380-90. [PubMed:20966073] [PMC] [WorldCat] [DOI] - ↑
Miya, K., Inoue, R., Takata, Y., Abe, M., Natsume, R., Sakimura, K., ..., & Mori, H. (2008).
Serine racemase is predominantly localized in neurons in mouse brain. The Journal of comparative neurology, 510(6), 641-54. [PubMed:18698599] [WorldCat] [DOI] - ↑
Benneyworth, M.A., Li, Y., Basu, A.C., Bolshakov, V.Y., & Coyle, J.T. (2012).
Cell selective conditional null mutations of serine racemase demonstrate a predominate localization in cortical glutamatergic neurons. Cellular and molecular neurobiology, 32(4), 613-24. [PubMed:22362148] [PMC] [WorldCat] [DOI] - ↑
Martineau, M., Shi, T., Puyal, J., Knolhoff, A.M., Dulong, J., Gasnier, B., ..., & Mothet, J.P. (2013).
Storage and uptake of D-serine into astrocytic synaptic-like vesicles specify gliotransmission. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(8), 3413-23. [PubMed:23426669] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Kartvelishvily, E., Shleper, M., Balan, L., Dumin, E., & Wolosker, H. (2006).
Neuron-derived D-serine release provides a novel means to activate N-methyl-D-aspartate receptors. The Journal of biological chemistry, 281(20), 14151-62. [PubMed:16551623] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Hashimoto, A., Oka, T., & Nishikawa, T. (1995).
Extracellular concentration of endogenous free D-serine in the rat brain as revealed by in vivo microdialysis. Neuroscience, 66(3), 635-43. [PubMed:7644027] [WorldCat] [DOI] - ↑
Kanematsu, S., Ishii, S., Umino, A., Fujihira, T., Kashiwa, A., Yamamoto, N., ..., & Nishikawa, T. (2006).
Evidence for involvement of glial cell activity in the control of extracellular D-serine contents in the rat brain. Journal of neural transmission (Vienna, Austria : 1996), 113(11), 1717-21. [PubMed:16736231] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2
Henneberger, C., Papouin, T., Oliet, S.H., & Rusakov, D.A. (2010).
Long-term potentiation depends on release of D-serine from astrocytes. Nature, 463(7278), 232-6. [PubMed:20075918] [PMC] [WorldCat] [DOI] - ↑
Ishiwata, S., Umino, A., Umino, M., Yorita, K., Fukui, K., & Nishikawa, T. (2013).
Modulation of extracellular d-serine content by calcium permeable AMPA receptors in rat medial prefrontal cortex as revealed by in vivo microdialysis. The international journal of neuropsychopharmacology, 16(6), 1395-406. [PubMed:23298512] [WorldCat] [DOI] - ↑
Pan, H.C., Chou, Y.C., & Sun, S.H. (2015).
P2X7 R-mediated Ca(2+) -independent d-serine release via pannexin-1 of the P2X7 R-pannexin-1 complex in astrocytes. Glia, 63(5), 877-93. [PubMed:25630251] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2
Umino, A., Ishiwata, S., Iwama, H., & Nishikawa, T. (2017).
Evidence for Tonic Control by the GABAA Receptor of Extracellular D-Serine Concentrations in the Medial Prefrontal Cortex of Rodents. Frontiers in molecular neuroscience, 10, 240. [PubMed:28824371] [PMC] [WorldCat] [DOI] - ↑
Danysz, W., & Parsons, C.G. (1998).
Glycine and N-methyl-D-aspartate receptors: physiological significance and possible therapeutic applications. Pharmacological reviews, 50(4), 597-664. [PubMed:9860805] [WorldCat] - ↑ 27.0 27.1
Matsui, T., Sekiguchi, M., Hashimoto, A., Tomita, U., Nishikawa, T., & Wada, K. (1995).
Functional comparison of D-serine and glycine in rodents: the effect on cloned NMDA receptors and the extracellular concentration. Journal of neurochemistry, 65(1), 454-8. [PubMed:7790891] [WorldCat] [DOI] - ↑ 28.0 28.1
Chatterton, J.E., Awobuluyi, M., Premkumar, L.S., Takahashi, H., Talantova, M., Shin, Y., ..., & Zhang, D. (2002).
Excitatory glycine receptors containing the NR3 family of NMDA receptor subunits. Nature, 415(6873), 793-8. [PubMed:11823786] [WorldCat] [DOI] - ↑ 29.0 29.1
Naur, P., Hansen, K.B., Kristensen, A.S., Dravid, S.M., Pickering, D.S., Olsen, L., ..., & Kastrup, J.S. (2007).
Ionotropic glutamate-like receptor delta2 binds D-serine and glycine. Proceedings of the National Academy of Sciences of the United States of America, 104(35), 14116-21. [PubMed:17715062] [PMC] [WorldCat] [DOI] - ↑
Fukasawa, Y., Segawa, H., Kim, J.Y., Chairoungdua, A., Kim, D.K., Matsuo, H., ..., & Kanai, Y. (2000).
Identification and characterization of a Na(+)-independent neutral amino acid transporter that associates with the 4F2 heavy chain and exhibits substrate selectivity for small neutral D- and L-amino acids. The Journal of biological chemistry, 275(13), 9690-8. [PubMed:10734121] [WorldCat] [DOI] - ↑
Ishiwata, S., Ogata, S., Umino, A., Shiraku, H., Ohashi, Y., Kajii, Y., & Nishikawa, T. (2013).
Increasing effects of S-methyl-L-cysteine on the extracellular D-serine concentrations in the rat medial frontal cortex. Amino acids, 44(5), 1391-5. [PubMed:23417484] [WorldCat] [DOI] - ↑
Kaplan, E., Zubedat, S., Radzishevsky, I., Valenta, A.C., Rechnitz, O., Sason, H., ..., & Wolosker, H. (2018).
ASCT1 (Slc1a4) transporter is a physiologic regulator of brain d-serine and neurodevelopment. Proceedings of the National Academy of Sciences of the United States of America, 115(38), 9628-9633. [PubMed:30185558] [PMC] [WorldCat] [DOI] - ↑
Foster, A.C., Farnsworth, J., Lind, G.E., Li, Y.X., Yang, J.Y., Dang, V., ..., & Kavanaugh, M.P. (2016).
D-Serine Is a Substrate for Neutral Amino Acid Transporters ASCT1/SLC1A4 and ASCT2/SLC1A5, and Is Transported by Both Subtypes in Rat Hippocampal Astrocyte Cultures. PloS one, 11(6), e0156551. [PubMed:27272177] [PMC] [WorldCat] [DOI] - ↑ 34.0 34.1 34.2 34.3
Koga, R., Miyoshi, Y., Sakaue, H., Hamase, K., & Konno, R. (2017).
Mouse d-Amino-Acid Oxidase: Distribution and Physiological Substrates. Frontiers in molecular biosciences, 4, 82. [PubMed:29255714] [PMC] [WorldCat] [DOI] - ↑
Hashimoto, A., Nishikawa, T., Konno, R., Niwa, A., Yasumura, Y., Oka, T., & Takahashi, K. (1993).
Free D-serine, D-aspartate and D-alanine in central nervous system and serum in mutant mice lacking D-amino acid oxidase. Neuroscience letters, 152(1-2), 33-6. [PubMed:8100053] [WorldCat] [DOI] - ↑
Wang, L.Z., & Zhu, X.Z. (2003).
Spatiotemporal relationships among D-serine, serine racemase, and D-amino acid oxidase during mouse postnatal development. Acta pharmacologica Sinica, 24(10), 965-74. [PubMed:14531937] [WorldCat] - ↑
Foltyn, V.N., Bendikov, I., De Miranda, J., Panizzutti, R., Dumin, E., Shleper, M., ..., & Wolosker, H. (2005).
Serine racemase modulates intracellular D-serine levels through an alpha,beta-elimination activity. The Journal of biological chemistry, 280(3), 1754-63. [PubMed:15536068] [WorldCat] [DOI] - ↑ 38.0 38.1
Mothet, J.P., Parent, A.T., Wolosker, H., Brady, R.O., Linden, D.J., Ferris, C.D., ..., & Snyder, S.H. (2000).
D-serine is an endogenous ligand for the glycine site of the N-methyl-D-aspartate receptor. Proceedings of the National Academy of Sciences of the United States of America, 97(9), 4926-31. [PubMed:10781100] [PMC] [WorldCat] [DOI] - ↑ 39.0 39.1
Ishiwata, S., Umino, A., Balu, D.T., Coyle, J.T., & Nishikawa, T. (2015).
Neuronal serine racemase regulates extracellular D-serine levels in the adult mouse hippocampus. Journal of neural transmission (Vienna, Austria : 1996), 122(8), 1099-103. [PubMed:25782690] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Inoue, R., Hashimoto, K., Harai, T., & Mori, H. (2008).
NMDA- and beta-amyloid1-42-induced neurotoxicity is attenuated in serine racemase knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(53), 14486-91. [PubMed:19118183] [PMC] [WorldCat] [DOI] - ↑
Papouin, T., Ladépêche, L., Ruel, J., Sacchi, S., Labasque, M., Hanini, M., ..., & Oliet, S.H. (2012).
Synaptic and extrasynaptic NMDA receptors are gated by different endogenous coagonists. Cell, 150(3), 633-46. [PubMed:22863013] [WorldCat] [DOI] - ↑
Piña-Crespo, J.C., Talantova, M., Micu, I., States, B., Chen, H.S., Tu, S., ..., & Lipton, S.A. (2010).
Excitatory glycine responses of CNS myelin mediated by NR1/NR3 "NMDA" receptor subunits. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(34), 11501-5. [PubMed:20739572] [PMC] [WorldCat] [DOI] - ↑ 43.0 43.1 43.2
Bossi, S., Dhanasobhon, D., Ellis-Davies, G.C.R., Frontera, J., de Brito Van Velze, M., Lourenço, J., ..., & Rebola, N. (2022).
GluN3A excitatory glycine receptors control adult cortical and amygdalar circuits. Neuron, 110(15), 2438-2454.e8. [PubMed:35700736] [PMC] [WorldCat] [DOI] - ↑
Matoba, M., Tomita, U., & Nishikawa, T. (1997).
Characterization of 5,7-dichlorokynurenate-insensitive D-[3H]serine binding to synaptosomal fraction isolated from rat brain tissues. Journal of neurochemistry, 69(1), 399-405. [PubMed:9202334] [WorldCat] [DOI] - ↑
Masternak, M., Koch, A., Laulumaa, S., Tapken, D., Hollmann, M., Jørgensen, F.S., & Kastrup, J.S. (2023).
Differences between the GluD1 and GluD2 receptors revealed by GluD1 X-ray crystallography, binding studies and molecular dynamics. The FEBS journal, 290(15), 3781-3801. [PubMed:36128700] [WorldCat] [DOI] - ↑
Kakegawa, W., Miyoshi, Y., Hamase, K., Matsuda, S., Matsuda, K., Kohda, K., ..., & Yuzaki, M. (2011).
D-serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor. Nature neuroscience, 14(5), 603-11. [PubMed:21460832] [WorldCat] [DOI] - ↑
Balu, D.T., Li, Y., Puhl, M.D., Benneyworth, M.A., Basu, A.C., Takagi, S., ..., & Coyle, J.T. (2013).
Multiple risk pathways for schizophrenia converge in serine racemase knockout mice, a mouse model of NMDA receptor hypofunction. Proceedings of the National Academy of Sciences of the United States of America, 110(26), E2400-9. [PubMed:23729812] [PMC] [WorldCat] [DOI] - ↑
Schizophrenia Working Group of the Psychiatric Genomics Consortium (2014).
Biological insights from 108 schizophrenia-associated genetic loci. Nature, 511(7510), 421-7. [PubMed:25056061] [PMC] [WorldCat] [DOI] - ↑
Yamada, K., Ohnishi, T., Hashimoto, K., Ohba, H., Iwayama-Shigeno, Y., Toyoshima, M., ..., & Yoshikawa, T. (2005).
Identification of multiple serine racemase (SRR) mRNA isoforms and genetic analyses of SRR and DAO in schizophrenia and D-serine levels. Biological psychiatry, 57(12), 1493-503. [PubMed:15953485] [WorldCat] [DOI] - ↑
Kumashiro, S., Hashimoto, A., & Nishikawa, T. (1995).
Free D-serine in post-mortem brains and spinal cords of individuals with and without neuropsychiatric diseases. Brain research, 681(1-2), 117-25. [PubMed:7552268] [WorldCat] [DOI] - ↑ 51.0 51.1 51.2
Bendikov, I., Nadri, C., Amar, S., Panizzutti, R., De Miranda, J., Wolosker, H., & Agam, G. (2007).
A CSF and postmortem brain study of D-serine metabolic parameters in schizophrenia. Schizophrenia research, 90(1-3), 41-51. [PubMed:17156977] [WorldCat] [DOI] - ↑
Steffek, A.E., Haroutunian, V., & Meador-Woodruff, J.H. (2006).
Serine racemase protein expression in cortex and hippocampus in schizophrenia. Neuroreport, 17(11), 1181-5. [PubMed:16837850] [WorldCat] [DOI] - ↑
Madeira, C., Freitas, M.E., Vargas-Lopes, C., Wolosker, H., & Panizzutti, R. (2008).
Increased brain D-amino acid oxidase (DAAO) activity in schizophrenia. Schizophrenia research, 101(1-3), 76-83. [PubMed:18378121] [WorldCat] [DOI] - ↑
Habl, G., Zink, M., Petroianu, G., Bauer, M., Schneider-Axmann, T., von Wilmsdorff, M., ..., & Schmitt, A. (2009).
Increased D-amino acid oxidase expression in the bilateral hippocampal CA4 of schizophrenic patients: a post-mortem study. Journal of neural transmission (Vienna, Austria : 1996), 116(12), 1657-65. [PubMed:19823762] [PMC] [WorldCat] [DOI] - ↑
Ono, K., Shishido, Y., Park, H.K., Kawazoe, T., Iwana, S., Chung, S.P., ..., & Fukui, K. (2009).
Potential pathophysiological role of D-amino acid oxidase in schizophrenia: immunohistochemical and in situ hybridization study of the expression in human and rat brain. Journal of neural transmission (Vienna, Austria : 1996), 116(10), 1335-47. [PubMed:19685198] [WorldCat] [DOI] - ↑ 56.0 56.1
Ishimaru, M., Kurumaji, A., & Toru, M. (1994).
Increases in strychnine-insensitive glycine binding sites in cerebral cortex of chronic schizophrenics: evidence for glutamate hypothesis. Biological psychiatry, 35(2), 84-95. [PubMed:7909453] [WorldCat] [DOI] - ↑
Contreras, P.C. (1990).
D-serine antagonized phencyclidine- and MK-801-induced stereotyped behavior and ataxia. Neuropharmacology, 29(3), 291-3. [PubMed:2109276] [WorldCat] [DOI] - ↑ 58.0 58.1 58.2
Tanii, Y., Nishikawa, T., Hashimoto, A., & Takahashi, K. (1994).
Stereoselective antagonism by enantiomers of alanine and serine of phencyclidine-induced hyperactivity, stereotypy and ataxia in the rat. The Journal of pharmacology and experimental therapeutics, 269(3), 1040-8. [PubMed:8014848] [WorldCat] - ↑
Tsai, G., Yang, P., Chung, L.C., Lange, N., & Coyle, J.T. (1998).
D-serine added to antipsychotics for the treatment of schizophrenia. Biological psychiatry, 44(11), 1081-9. [PubMed:9836012] [WorldCat] [DOI] - ↑
Tsai, G.E., Yang, P., Chang, Y.C., & Chong, M.Y. (2006).
D-alanine added to antipsychotics for the treatment of schizophrenia. Biological psychiatry, 59(3), 230-4. [PubMed:16154544] [WorldCat] [DOI] - ↑ Nishikawa, T., Umino, A., Umino, M. (2022).
D-Serine in the Treatment of Psychosis. In: Riederer, P., Laux, G., Nagatsu, T., Le, W., Riederer, C. (eds) NeuroPsychopharmacotherapy. pp 1963–1976, Springer, Cham. https://doi.org/10.1007/978-3-030-62059-2_391 - ↑ 中出 祐介,岩田 恭宜,和田 隆志(2019).
D-セリンと腎臓病 生化学, 91(3),349‒354. PDF: https://seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2019.910349/data/index.html>