セリンラセミ化酵素
井上 蘭、森 寿
富山大学 大学院医学薬学研究部
DOI:10.14931/bsd.766 原稿受付日:2012年3月27日 原稿完成日:2012年4月13日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:serine racemase 独:Serin Racemase 英略称:SR
同義語:セリンラセマーゼ
活性とその制御
L-セリンからのラセミ化反応およびD,L-セリンのデヒドラターゼ反応(α,β-脱離)を触媒する[1][2]。ラセミ化反応ではD-セリン、デヒドラターゼ反応によりピルビン酸とアンモニアが産生される。
種々の生物に広く存在しており、これまでにカイコ、ラット、wマウス、ヒト、シロイヌナズナなどから精製、クローニングされている。動物型SRは、補因子としてPLPを必要とし、Mg2+、Ca2+などの2価カチオンやATPにより活性が上昇する[3][4]。 SRは翻訳後修飾を受けており、リン酸化により酵素が活性化され、Sニトロシル化により酵素活性が抑制される[5][6]。
また、様々なタンパク質との結合により活性制御を受ける。Glutamate receptor interacting protein (GRIP)およびProtein interacting with C kinase 1 (PICK1)との結合はSRを活性化し、Golgi-localized protein (Golga 3)との結合は、SRのユビキチン化を低下させることで、その分解を抑制する[7][8][9]。細胞膜に存在するホスファチジルイノシトール 4,5-二リン酸 (PlP2)はSRと結合し、SRの活性を抑制する[10][11]。
リコンビナントマウスSRを用いたin vitroの研究では、SRのデヒドラターゼ活性がセリンラセミ化活性の3.7倍であるが[2]、in vivoでもデヒドラターゼ活性がセリンラセミ化活性より高いかどうかは不明である。
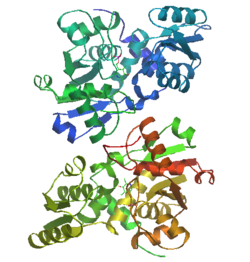
構造
動物型SRは、fold-type II型のPLP酵素であり、二つのドメインからなるダイマー構造をとる[12]。PLPを含む大ドメインは10本のαへリックスに囲まれた7本のβシートをコアとしてもつ。小ドメインは、コアとなる4本のβシートと3本のαへリックスからなる構造をとる。小ドメインの動きは、基質認識部位の形成と酵素の触媒作用において重要な役割を担っている。
脳内発現
マウス脳におけるSRの発現は発達過程に伴って変化し、脳部位によって異なる。大脳皮質および海馬では、生後7日から徐々に発現量が増加し、生後28日で成体レベルに達する。小脳では、生後14日から28日まで一過性に発現が増加した後、急速に減少する[13]。成体マウス脳では、大脳皮質、海馬、線条体、嗅球などの終脳においてSRが強く発現する。細胞レベルでは、SRは主に神経細胞に発現し、大脳皮質や海馬ではグルタミン酸作動性錐体細胞、線条体ではGABA作動性中型有棘ニューロン、小脳ではGABA作動性プルキンエ細胞に発現する[13]。一方、マウス海馬の初代培養系では、SRは神経細胞とアストロサイトの両方に発現する[13]。
生理機能
動物型SRは、大脳皮質および海馬の組織に含まれるD-セリンの約90%の合成を担っている[14][15]。SRのセリンラセミ化反応により産生される D-セリンは、グルタミン酸受容体の一つであるNMDA型グルタミン酸受容体の内在性コ・アゴニストとして脳の高次機能発現に関与すると考えられている。
アストロサイト由来の内在性のD-セリンがNMDARの主なコ・アゴニストとしてシナプス可塑性の制御に関わることが示唆されている。乳汁分泌期のラットの視床下部視索上核では、シナプスを取り巻くアストロサイトが減少するとともに、シナプスにおけるNMDAR電流が減少し、シナプス可塑性の長期増強(long-term potentiation, LTP)が誘導されない。しかし、乳汁分泌期のラット脳スライスにD-セリンを投与すると、NMDAR依存性の神経伝達が回復し、LTPが誘導できる[16]。またHennebergerらは、アストロサイトがカルシウム依存的なD-セリンの放出によりNMDAR活動を制御し、LTP誘導を調節していることを報告している[17]。SRが主に神経細胞に発現していることから、アストロサイトがD-セリンの放出によりNMDARの機能を制御するには、神経細胞で合成されたD-セリンが細胞外に放出され、アストロサイトに取り込まれる必要があるが、そのメカニズムに関しては未だに不明である。
NMDARのグリシンサイトにはD-セリンのほかグリシンも結合するが、D-セリンはグリシンと比較して、リコンビナントNMDARに対して約3倍高い親和性を示す[18]。。脳スライスにD-セリンの分解酵素であるD-アミノ酸酸化酵素(D-amino acid oxidase; DAO)を作用させD-セリンのみを分解し、グリシンの量が変化しない実験条件において、NMDAR依存的な電流が減少し、LTPが誘導されない[19]。ことから、D-セリンがNMDARの生理的な内在性コ・アゴニストとして機能し、シナプス可塑性制御に関わると考えられている。
現在、3系統のSRノックアウト(KO)マウスが確立されており、個体レベルにおけるSRの機能が明らかにされつつある。SRKOマウスでは、NMDAR 依存的な興奮性シナプス後電流(EPSCs)の減弱速度(decay) が遅くなり、海馬CA1のシナプスにおいてLTPが誘導されない[15]。また、NMDAおよびアミロイドβ1-42(Aβ1-42)の脳内注入により誘導される神経細胞変性が野生型マウスに比べ有意に低下し、脳虚血により引き起こされる障害が緩和されることが報告されている[14][20]。これらの結果から、SRにより産生される内在性のD-セリンがNMDAR機能制御に関与すると考えられる。SRKOマウスでは、空間記憶の異常などの認知機能および社会性行動の障害も認められている[15][21]。
関連項目
参考文献
- ↑
Wolosker, H., Sheth, K.N., Takahashi, M., Mothet, J.P., Brady, R.O., Ferris, C.D., & Snyder, S.H. (1999).
Purification of serine racemase: biosynthesis of the neuromodulator D-serine. Proceedings of the National Academy of Sciences of the United States of America, 96(2), 721-5. [PubMed:9892700] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Foltyn, V.N., Bendikov, I., De Miranda, J., Panizzutti, R., Dumin, E., Shleper, M., ..., & Wolosker, H. (2005).
Serine racemase modulates intracellular D-serine levels through an alpha,beta-elimination activity. The Journal of biological chemistry, 280(3), 1754-63. [PubMed:15536068] [WorldCat] [DOI] - ↑
De Miranda, J., Panizzutti, R., Foltyn, V.N., & Wolosker, H. (2002).
Cofactors of serine racemase that physiologically stimulate the synthesis of the N-methyl-D-aspartate (NMDA) receptor coagonist D-serine. Proceedings of the National Academy of Sciences of the United States of America, 99(22), 14542-7. [PubMed:12393813] [PMC] [WorldCat] [DOI] - ↑
Neidle, A., & Dunlop, D.S. (2002).
Allosteric regulation of mouse brain serine racemase. Neurochemical research, 27(12), 1719-24. [PubMed:12515328] [WorldCat] [DOI] - ↑
Foltyn, V.N., Zehl, M., Dikopoltsev, E., Jensen, O.N., & Wolosker, H. (2010).
Phosphorylation of mouse serine racemase regulates D-serine synthesis. FEBS letters, 584(13), 2937-41. [PubMed:20493854] [WorldCat] [DOI] - ↑
Mustafa, A.K., Kumar, M., Selvakumar, B., Ho, G.P., Ehmsen, J.T., Barrow, R.K., ..., & Snyder, S.H. (2007).
Nitric oxide S-nitrosylates serine racemase, mediating feedback inhibition of D-serine formation. Proceedings of the National Academy of Sciences of the United States of America, 104(8), 2950-5. [PubMed:17293453] [PMC] [WorldCat] [DOI] - ↑
Fujii, K., Maeda, K., Hikida, T., Mustafa, A.K., Balkissoon, R., Xia, J., ..., & Sawa, A. (2006).
Serine racemase binds to PICK1: potential relevance to schizophrenia. Molecular psychiatry, 11(2), 150-7. [PubMed:16314870] [WorldCat] [DOI] - ↑
Neidle, A., & Dunlop, D.S. (2002).
Allosteric regulation of mouse brain serine racemase. Neurochemical research, 27(12), 1719-24. [PubMed:12515328] [WorldCat] [DOI] - ↑
Dumin, E., Bendikov, I., Foltyn, V.N., Misumi, Y., Ikehara, Y., Kartvelishvily, E., & Wolosker, H. (2006).
Modulation of D-serine levels via ubiquitin-dependent proteasomal degradation of serine racemase. The Journal of biological chemistry, 281(29), 20291-302. [PubMed:16714286] [WorldCat] [DOI] - ↑
Balan, L., Foltyn, V.N., Zehl, M., Dumin, E., Dikopoltsev, E., Knoh, D., ..., & Wolosker, H. (2009).
Feedback inactivation of D-serine synthesis by NMDA receptor-elicited translocation of serine racemase to the membrane. Proceedings of the National Academy of Sciences of the United States of America, 106(18), 7589-94. [PubMed:19380732] [PMC] [WorldCat] [DOI] - ↑
Mustafa, A.K., van Rossum, D.B., Patterson, R.L., Maag, D., Ehmsen, J.T., Gazi, S.K., ..., & Snyder, S.H. (2009).
Glutamatergic regulation of serine racemase via reversal of PIP2 inhibition. Proceedings of the National Academy of Sciences of the United States of America, 106(8), 2921-6. [PubMed:19193859] [PMC] [WorldCat] [DOI] - ↑
Smith, M.A., Mack, V., Ebneth, A., Moraes, I., Felicetti, B., Wood, M., ..., & Barker, J. (2010).
The structure of mammalian serine racemase: evidence for conformational changes upon inhibitor binding. The Journal of biological chemistry, 285(17), 12873-81. [PubMed:20106978] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Miya, K., Inoue, R., Takata, Y., Abe, M., Natsume, R., Sakimura, K., ..., & Mori, H. (2008).
Serine racemase is predominantly localized in neurons in mouse brain. The Journal of comparative neurology, 510(6), 641-54. [PubMed:18698599] [WorldCat] [DOI] - ↑ 14.0 14.1
Inoue, R., Hashimoto, K., Harai, T., & Mori, H. (2008).
NMDA- and beta-amyloid1-42-induced neurotoxicity is attenuated in serine racemase knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(53), 14486-91. [PubMed:19118183] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
Basu, A.C., Tsai, G.E., Ma, C.L., Ehmsen, J.T., Mustafa, A.K., Han, L., ..., & Coyle, J.T. (2009).
Targeted disruption of serine racemase affects glutamatergic neurotransmission and behavior. Molecular psychiatry, 14(7), 719-27. [PubMed:19065142] [PMC] [WorldCat] [DOI] - ↑
Panatier, A., Theodosis, D.T., Mothet, J.P., Touquet, B., Pollegioni, L., Poulain, D.A., & Oliet, S.H. (2006).
Glia-derived D-serine controls NMDA receptor activity and synaptic memory. Cell, 125(4), 775-84. [PubMed:16713567] [WorldCat] [DOI] - ↑
Henneberger, C., Papouin, T., Oliet, S.H., & Rusakov, D.A. (2010).
Long-term potentiation depends on release of D-serine from astrocytes. Nature, 463(7278), 232-6. [PubMed:20075918] [PMC] [WorldCat] [DOI] - ↑
Matsui, T., Sekiguchi, M., Hashimoto, A., Tomita, U., Nishikawa, T., & Wada, K. (1995).
Functional comparison of D-serine and glycine in rodents: the effect on cloned NMDA receptors and the extracellular concentration. Journal of neurochemistry, 65(1), 454-8. [PubMed:7790891] [WorldCat] [DOI] - ↑
Yang, Y., Ge, W., Chen, Y., Zhang, Z., Shen, W., Wu, C., ..., & Duan, S. (2003).
Contribution of astrocytes to hippocampal long-term potentiation through release of D-serine. Proceedings of the National Academy of Sciences of the United States of America, 100(25), 15194-9. [PubMed:14638938] [PMC] [WorldCat] [DOI] - ↑
Mustafa, A.K., Ahmad, A.S., Zeynalov, E., Gazi, S.K., Sikka, G., Ehmsen, J.T., ..., & Doré, S. (2010).
Serine racemase deletion protects against cerebral ischemia and excitotoxicity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(4), 1413-6. [PubMed:20107067] [PMC] [WorldCat] [DOI] - ↑
Labrie, V., Fukumura, R., Rastogi, A., Fick, L.J., Wang, W., Boutros, P.C., ..., & Roder, J.C. (2009).
Serine racemase is associated with schizophrenia susceptibility in humans and in a mouse model. Human molecular genetics, 18(17), 3227-43. [PubMed:19483194] [PMC] [WorldCat] [DOI]