「セクエストソーム-1」の版間の差分
| 15行目: | 15行目: | ||
p62は自己相互作用ドメインを介して自己相互作用することでオリゴマーやフィラメント構造を形成する。p62フィラメントはp62内のユビキチン結合ドメインを介してユビキチン鎖と多価相互作用することでLLPSを引き起こしp62 bodyを形成する。p62 body上で隔離膜が形成され、ウエッティング効果によりp62 bodyに沿って伸長し、最終的に液滴の一部をちぎり取り、リソソームで分解する。]] | p62は自己相互作用ドメインを介して自己相互作用することでオリゴマーやフィラメント構造を形成する。p62フィラメントはp62内のユビキチン結合ドメインを介してユビキチン鎖と多価相互作用することでLLPSを引き起こしp62 bodyを形成する。p62 body上で隔離膜が形成され、ウエッティング効果によりp62 bodyに沿って伸長し、最終的に液滴の一部をちぎり取り、リソソームで分解する。]] | ||
== セクエストソーム-1とは == | == セクエストソーム-1とは == | ||
セクエストソーム-1 (別名p62)は、2005年[[wikipedia:no:Terje Johansen|Terje Johansen]]らによって発見されたタンパク質であり<ref name=Bjorkoy2005><pubmed>16286508</pubmed></ref>、[[ユビキチン]]化された[[オートファジー]]の[[基質]]と[[隔離膜]]を繋ぐ[[アダプタータンパク質]]([[オートファジー受容体]])として機能する。以降、基質認識領域と隔離膜上の[[microtubule-associated proteins 1A/1B light chain 3]] ([[LC3]])/[[Gamma-aminobutyric acid receptor–associated protein]] ([[GABARAP]])によって特異的に認識される領域(LC3-interacting region、LIR)を有する様々なオートファジー受容体が発見され、オートファジーが特定のタンパク質や[[オルガネラ]]を選択的に認識し分解する「[[選択的オートファジー]]」という概念が確立した('''図1''')。 | セクエストソーム-1 (別名p62)は、2005年[[wikipedia:no:Terje Johansen (medisinsk biolog)|Terje Johansen]]らによって発見されたタンパク質であり<ref name=Bjorkoy2005><pubmed>16286508</pubmed></ref>、[[ユビキチン]]化された[[オートファジー]]の[[基質]]と[[隔離膜]]を繋ぐ[[アダプタータンパク質]]([[オートファジー受容体]])として機能する。以降、基質認識領域と隔離膜上の[[microtubule-associated proteins 1A/1B light chain 3]] ([[LC3]])/[[Gamma-aminobutyric acid receptor–associated protein]] ([[GABARAP]])によって特異的に認識される領域(LC3-interacting region、LIR)を有する様々なオートファジー受容体が発見され、オートファジーが特定のタンパク質や[[オルガネラ]]を選択的に認識し分解する「[[選択的オートファジー]]」という概念が確立した('''図1''')。 | ||
2007年には小松らによりp62自身もオートファジーにより分解されること、オートファジー障害によりp62およびユビキチン陽性の構造体が蓄積することが明らかになった <ref name=Komatsu2007><pubmed>18083104</pubmed></ref><ref name=Nezis2008><pubmed>18347073</pubmed></ref>。その後、p62内に隔離膜上のLC3/GABARAPによって特異的に認識される領域であるLIRが存在することが報告された<ref name=Ichimura2008><pubmed>18524774</pubmed></ref><ref name=Pankiv2007><pubmed>17580304</pubmed></ref>。一方、2010年には、p62が[[ユビキチンリガーゼ]]複合体の構成因子である[[kelch-like ECH-associated protein 1]] ([[KEAP1]])と[[転写因子]][[nuclear factor erythroid 2–related factor 2]] ([[NRF2]])の結合を競合阻害し、NRF2による抗[[酸化ストレス]]応答を誘導するという新たな機能が発見された <ref name=Jain2010><pubmed>20452972</pubmed></ref><ref name=Komatsu2010><pubmed>20173742</pubmed></ref><ref name=Lau2010><pubmed>20421418</pubmed></ref>。2018年にLi Yuらによって、p62の自己相互作用とユビキチンとの相互作用により[[液–液相分離]](細胞内で特定の分子が局所的に集まり、液体のような性質を持つ構造体を形成する現象)を引き起こし、液滴様の構造体である[[p62 body]]を形成することが報告され、p62による細胞内[[恒常性]]維持機構の理解は新たな局面を迎えた('''図2''')<ref name=Sun2018><pubmed>29507397</pubmed></ref>。 | 2007年には小松らによりp62自身もオートファジーにより分解されること、オートファジー障害によりp62およびユビキチン陽性の構造体が蓄積することが明らかになった <ref name=Komatsu2007><pubmed>18083104</pubmed></ref><ref name=Nezis2008><pubmed>18347073</pubmed></ref>。その後、p62内に隔離膜上のLC3/GABARAPによって特異的に認識される領域であるLIRが存在することが報告された<ref name=Ichimura2008><pubmed>18524774</pubmed></ref><ref name=Pankiv2007><pubmed>17580304</pubmed></ref>。一方、2010年には、p62が[[ユビキチンリガーゼ]]複合体の構成因子である[[kelch-like ECH-associated protein 1]] ([[KEAP1]])と[[転写因子]][[nuclear factor erythroid 2–related factor 2]] ([[NRF2]])の結合を競合阻害し、NRF2による抗[[酸化ストレス]]応答を誘導するという新たな機能が発見された <ref name=Jain2010><pubmed>20452972</pubmed></ref><ref name=Komatsu2010><pubmed>20173742</pubmed></ref><ref name=Lau2010><pubmed>20421418</pubmed></ref>。2018年にLi Yuらによって、p62の自己相互作用とユビキチンとの相互作用により[[液–液相分離]](細胞内で特定の分子が局所的に集まり、液体のような性質を持つ構造体を形成する現象)を引き起こし、液滴様の構造体である[[p62 body]]を形成することが報告され、p62による細胞内[[恒常性]]維持機構の理解は新たな局面を迎えた('''図2''')<ref name=Sun2018><pubmed>29507397</pubmed></ref>。 | ||
2025年9月13日 (土) 22:22時点における版
坂巻 純一、小松 雅明
順天堂大学 大学院医学研究科
DOI:10.14931/bsd.11360 原稿受付日:2025年3月24日 原稿完成日:2025年9月6日
担当編集委員:山中 宏二(名古屋大学 環境医学研究所 病態神経科学)
同義語:シクエストソーム-1
英:sequestosome 1、p62
略称:SQSTM1
セクエストソーム-1 (別名p62)はユビキチン化されたタンパク質やオルガネラ(細胞小器官)を認識し、オートファジーによる分解へと導くアダプタータンパク質である。ストレスにより細胞内にユビキチン化タンパク質が蓄積すると、p62とユビキチン化タンパク質が多点で相互作用することにより、液‒液相分離を引き起こし、液体様の性質を持つ構造体であるp62 bodyを形成する。p62 bodyはオートファジーによる分解の場として機能し、液滴内に取り込まれたタンパク質やオルガネラと共にオートファジーにより分解される。また、p62 bodyはユビキチンリガーゼ複合体の構成因子であるKEAP1をその内部に隔離することで、転写因子NRF2を安定化し、抗酸化ストレス応答を誘導する多機能性の液滴である。オートファジーによるp62の分解の不全は神経変性疾患や肝疾患の発症、そして腫瘍形成と関連することが示唆されている。様々な肝疾患患者の肝細胞で蓄積するマロリー小体はp62 bodyと類似した構成因子からなり、p62 bodyと病態形成の関連が示唆されている。また、p62をコードするSQSTM1遺伝子の変異が筋萎縮性側索硬化症、前頭側頭型認知症、骨パジェット病で報告されており、p62あるいはp62 bodyの機能異常とこれら疾患との関連も示唆されている。
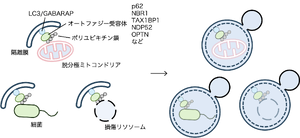
脱分極したミトコンドリアや損傷リソソーム、細胞内に侵入した細菌などはユビキチン化され、p62、NBR1、NDP52 TAX1BP1 OPTNなどのオートファジー受容体に認識される。オートファジー受容体は隔離膜上のLC3と結合することで、基質がオートファゴソームに取り込まれ分解される。
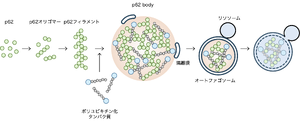
p62は自己相互作用ドメインを介して自己相互作用することでオリゴマーやフィラメント構造を形成する。p62フィラメントはp62内のユビキチン結合ドメインを介してユビキチン鎖と多価相互作用することでLLPSを引き起こしp62 bodyを形成する。p62 body上で隔離膜が形成され、ウエッティング効果によりp62 bodyに沿って伸長し、最終的に液滴の一部をちぎり取り、リソソームで分解する。
セクエストソーム-1とは
セクエストソーム-1 (別名p62)は、2005年Terje Johansenらによって発見されたタンパク質であり[1]、ユビキチン化されたオートファジーの基質と隔離膜を繋ぐアダプタータンパク質(オートファジー受容体)として機能する。以降、基質認識領域と隔離膜上のmicrotubule-associated proteins 1A/1B light chain 3 (LC3)/Gamma-aminobutyric acid receptor–associated protein (GABARAP)によって特異的に認識される領域(LC3-interacting region、LIR)を有する様々なオートファジー受容体が発見され、オートファジーが特定のタンパク質やオルガネラを選択的に認識し分解する「選択的オートファジー」という概念が確立した(図1)。
2007年には小松らによりp62自身もオートファジーにより分解されること、オートファジー障害によりp62およびユビキチン陽性の構造体が蓄積することが明らかになった [2][3]。その後、p62内に隔離膜上のLC3/GABARAPによって特異的に認識される領域であるLIRが存在することが報告された[4][5]。一方、2010年には、p62がユビキチンリガーゼ複合体の構成因子であるkelch-like ECH-associated protein 1 (KEAP1)と転写因子nuclear factor erythroid 2–related factor 2 (NRF2)の結合を競合阻害し、NRF2による抗酸化ストレス応答を誘導するという新たな機能が発見された [6][7][8]。2018年にLi Yuらによって、p62の自己相互作用とユビキチンとの相互作用により液–液相分離(細胞内で特定の分子が局所的に集まり、液体のような性質を持つ構造体を形成する現象)を引き起こし、液滴様の構造体であるp62 bodyを形成することが報告され、p62による細胞内恒常性維持機構の理解は新たな局面を迎えた(図2)[9]。
さらに最近、p62 bodyはオートファジーによる分解の場として働くだけでなく、KEAP1を隔離することで転写因子NRF2による酸化ストレス応答を制御するという多面的な機能を持っていることが明らかとなった [10][11]。
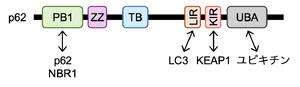
N末端のPB1自己相互作用ドメインは、p62や他のオートファジー受容体であるNBR1などPB1ドメインを持つタンパク質と相互作用する。LIRは隔離膜上のLC3/GABARAPタンパク質と結合し、KIRはKEAP1と結合する。C末端にユビキチンと結合するUBAドメインを持つ。PB1:Phox1 and Bem1p、ZZ:ZZ-type zinc finger、TB:TRAF6-binding domain、LIR:LC3-interacting region、KIR:KEAP1-interacting region、UBA:Ubiquitin-associated。
構造
ヒトでは440アミノ酸、マウスでは442アミノ酸からなる。N末端にPB1(Phox1 and Bem1p)自己相互作用ドメインを有し、p62や他のオートファジー受容体であるnext to BRCA1 gene 1 protein (NBR1)などPB1ドメインを持つタンパク質と相互作用する(図3)。p62はPB1ドメインを介してオリゴマー化することで、フィラメント構造を形成する [12][13][14]。LIRは隔離膜上のLC3/GABARAPタンパク質と結合し、選択的オートファジーで機能する。典型的LIR(酵母ではAtg8-family interacting motif(AIM)と呼ばれる)は 哺乳類のp62[4][5]と出芽酵母のカーゴ受容体Atg19[15] で初めて発見され、 [W/F/Y]xx[L/I/V]の疎水性モチーフからなる。KEAP1-interacting region (KIR)でKEAP1と結合し、KEAP1をp62 body内に隔離する。C末端にユビキチンと結合するUBA(ubiquitin-associated)ドメインを持つ。UBAドメインはユビキチン化されたタンパク質、損傷オルガネラ、液滴などの選択的オートファジー基質の認識や、ユビキチン化タンパク質との相互作用を介した液‒液相分離の駆動に関与する。
サブファミリー
セクエストソーム-1遺伝子SQSTM1は後生動物ではよく保存されている。植物ではp62とNBR1のハイブリッド型が存在する。サブファミリーは存在しない。
発現
p62の発現は様々な組織で認められ、細胞内では主に細胞質に存在するが、核内にも局在する。細胞質中では散在もしくはp62 bodyとして存在する。また、オートファジーの過程でLC3/GABARAPと結合することで隔離膜に局在する。
機能
分子機能
選択的オートファジー受容体
オートファジーはユビキチン化されたタンパク質の集合体や障害を受けたオルガネラ、細胞内に侵入した細菌など特定の基質を選択的に認識し分解することができる。この過程は「選択的オートファジー」と呼ばれる(図1)。選択性を生み出しているのが、分解される基質を認識し、隔離膜へと繋ぐアダプタータンパク質(オートファジー受容体)である。オートファジー受容体には基質上のユビキチン鎖を認識する受容体と基質上に局在する受容体がある。前者にはp62、neighbor of BRCA1 gene 1 (NBR1)、nuclear domain 10 protein 52 (NDP52)、Tax1-binding protein 1 (TAX1BP1)、optineurin (OPTN)などがあり、LIRとユビキチン結合ドメインを有する [16][17]。後者にはマイトファジー(ミトコンドリアのオートファジー)に関与するBCL2 interacting protein 3 (BNIP3)、BCL2 interacting protein 3 like (BNIP3L/NIX)、FUN14 domain containing 1 (FUNDC1)、ERファジー(小胞体のオートファジー)に関与するcell cycle progression 1 (CCPG1)、testis expressed 264 (TEX264)、family with sequence similarity 134 (FAM134)、translocation protein SEC62 homolog b (SEC62b)、ゴルジファジー(ゴルジ体のオートファジー)に関与するYip1 domain family member 3 (YIPF3)、Yip1 domain family member 4 (YIPF4)などが一例として挙げられ、それぞれLIRを持つ。
p62は後述のように、p62 bodyを形成することで、液滴に取り込まれたタンパク質やオルガネラ、ユビキチン化タンパク質を効率的にオートファジーで分解する [18]。p62はユビキチン鎖を介して脱分極したミトコンドリア、損傷リソソーム、細菌などにも結合するものの、オートファジー受容体欠損細胞を用いた解析などにより、これらの分解に必須ではないと言われている [19][20][21][22]。
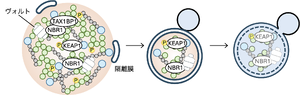
p62 bodyにはオートファジー受容体NBR1やTAX1BP1、ユビキチンリガーゼ複合体の構成因子KEAP1や機能未知のヴォルト粒子が取りこまれ、液滴と共にオートファジーにより分解される。
p62 body形成と選択的オートファジーによる分解
p62は通常、自己相互作用ドメインであるPB1ドメインを介してオリゴマーとなり、フィラメント構造を形成する。p62フィラメントはユビキチン鎖と結合することで液‒液相分離を引き起こし、p62 bodyを形成する [9][23]。p62のUBAドメインは通常ホモ二量体を形成しユビキチンと結合できないが、p62のUBAドメイン内のセリン残基のリン酸化によりこの結合が阻害され、ユビキチンとの結合が増強される。そのリン酸化を制御するのがUNC-51 Like Kinase 1 (ULK1)(ヒト場合の407番目のセリン残基をリン酸化する)やTANK-binding kinase 1 (TBK1)、casein kinase 2 (CK2)(ヒト場合の403番目のセリン残基)である [24][25][26]。
p62 bodyにはKEAP1や機能未知のVault粒子、オートファジー受容体であるNBR1やTax1 binding protein 1 (TAX1BP)1が取りこまれ、p62 bodyと共に選択的オートファジーにより分解される [11](図4)。オートファジー受容体はKEAP1(p62と結合)やVault粒子(NBR1と結合)のp62 bodyへの取り込みと、オートファジー機構の呼び込みに関与する [7][27][28]。p62やTAX1BP1はオートファジー機構の最上流因子FAK family kinase-interacting protein of 200 kDa (FIP200)を呼び込み、p62 body上で隔離膜が形成される。隔離膜はウエッティング効果によりp62 bodyに沿い伸長し、最終的に液滴の一部をちぎり取り、分解する [29][30]。p62 bodyの選択的オートファジーはユビキチン化タンパク質を効率的に分解することができ、それによりタンパク質の恒常性の維持に働いていると考えられる。
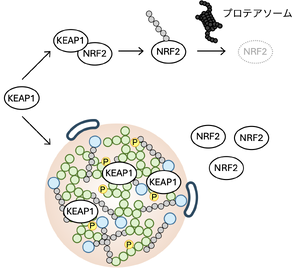
KEAP1は転写因子NRF2をユビキチン化し、プロテアソームで分解する。KEAP1は細胞質とp62 bodyを移動しているが、p62のセリンの349番目がULK1によりリン酸化されるとKEAP1との結合親和性が増大し、KEAP1がp62 bodyに保持されるようになる。その結果、NRF2が安定化し酸化ストレス応答遺伝子の転写が活性化される。
KEAP1の隔離による抗酸化ストレス応答
p62 bodyは上記のようにオートファジーによる分解の場として働くだけでなく、KEAP1を隔離することで、転写因子NRF2による抗酸化ストレス応答を調節する働きを持つ。KEAP1はCullin3型のユビキチンリガーゼの基質認識アダプターであり、NRF2と結合しユビキチン化することで、プロテアソームによる分解へと誘導する。KEAP1によるNRF2の分解は2つの経路で制御されている。1つは、細胞内の酸化ストレスや親電子性物質などにより、KEAP1のシステイン残基が酸化修飾を受けることで、この結合が解離し、NRF2が核内に移行し、標的遺伝子の発現が亢進する機構である [31]。もう1つは、p62がKEAP1とNRF2の結合を競合阻害する機構である [7]。KEAP1は通常、細胞質とp62 bodyを移動しているが、p62のセリン349番目がULK1によりリン酸化されるとKEAP1との結合親和性が増大し、KEAP1がp62bodyに保持されるようになる [32][10] (図5)。その結果、KEAP1によるNRF2のユビキチン化が抑制され、NRF2による転写が活性化される。
個体での機能
オートファジー遺伝子autophagy related 7 (Atg7)の肝臓特異的なノックアウトマウスでは、重篤な肝腫大と肝機能障害を引き起こす [33]。肝実質細胞ではユビキチン陽性の構造体が観察され、その構造体にはp62が含まれている。また、肝臓でのオートファジーの長期的な抑制は腫瘍形成を引き起こす。このオートファジー欠損マウス肝臓においてp62あるいはNRF2を同時に欠損させると、肝腫大と肝機能障害が改善することより、p62によるNRF2の持続的な過剰活性化が主な病因であると考えられる [34][35][36]。神経細胞においても、オートファジー不全で見られる封入体構造(p62 bodyあるいは固体化したp62 bodyと考えられる)はp62の同時欠損により形成が見られなくなることより、p62は封入体形成を仲介する因子であると言える [2]。
疾患との関わり
SQSTM1のミスセンス変異は筋萎縮性側索硬化症(amyotrophic lateral sclerosis, ALS)、前頭側頭型認知症(frontotemporal dementia, FTD)、骨パジェット病(Paget's disease of bone, PDB)などの疾患で報告されている。変異はPB1、LIR、KIR、UBAドメインに相当する領域を含む様々な箇所で見られる。
筋萎縮性側索硬化症、前頭側頭型認知症
筋萎縮性側索硬化症では、一次運動ニューロンおよび二次運動ニューロンの選択的かつ進行性の変性により手や足、顔の筋肉を動かすことが困難になる。前頭側頭型認知症は、前頭葉や側頭葉など脳の一部に異常タンパク質が蓄積し、神経細胞変性や脳萎縮の結果生じる認知症である。家族性及び孤発性の筋萎縮性側索硬化症と前頭側頭型認知症でSQSTM1遺伝子の変異が報告されており、筋萎縮性側索硬化症の2~3%がSQSTM1の変異であると言われている [37]。SQSTM1遺伝子内の様々な領域のミスセンス変異が報告されているが、特にUBAに相当する領域に多く見られ、他にもPB1、LIR、KIR領域の変異も存在する。Pro388del、M87V、K102E変異などでは運動ニューロンにp62を含む封入体が観察される。また、筋萎縮性側索硬化症や前頭側頭型認知症で見られる変異のうちLIRやKIR内のミスセンス変異体はp62 bodyの流動性を減少させることが報告されている [38]。また、p62のセリンの403番目をリン酸化し、p62 body形成に関与することが想定されるTBK1の遺伝子変異も筋萎縮性側索硬化症と前頭側頭型認知症で報告されている [39][40][41][26]。
骨パジェット病
骨パジェット病は破骨細胞の活性化により、一部の骨の骨吸収と骨形成の骨代謝回転が亢進し、骨の軟化、変形、肥大が起こる疾患である [42]。家族性と孤発性の症例でそれぞれ30〜40%と10%の割合でSQSTM1遺伝子の変異が見られる [43]。P392L変異(UBAドメイン内の変異)が最も頻繁に見られる。他の変異もUBAドメイン内が多い。SQSTM1 P392Lノックインマウスが作製されており、遺伝子変異単独では骨病変を示すものの、破骨細胞の病変は認められない。遺伝子変異と麻疹ウイルスの感染(骨パジェット病患者の70%に麻疹ウイルスの感染が認められる)が病態発症に関与することが示唆されている [44]。
肝疾患
マロリー小体は肝細胞癌、アルコール性肝疾患、非アルコール性脂肪性肝炎、肝硬変などの肝疾患患者の肝細胞で見られる構造体で、主にp62、ユビキチン、ケラチンで構成される [45]。マロリー小体には、セリンの349番目がリン酸化されたp62、KEAP1、Vault粒子などp62 bodyを構成する因子が含まれる [11][46]。このことより、マロリー小体はp62 bodyあるいは固体化したp62 bodyである可能性が考えられる。
関連語
参考文献
- ↑
Bjørkøy, G., Lamark, T., Brech, A., Outzen, H., Perander, M., Overvatn, A., ..., & Johansen, T. (2005).
p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death. The Journal of cell biology, 171(4), 603-14. [PubMed:16286508] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Komatsu, M., Waguri, S., Koike, M., Sou, Y.S., Ueno, T., Hara, T., ..., & Tanaka, K. (2007).
Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell, 131(6), 1149-63. [PubMed:18083104] [WorldCat] [DOI] - ↑
Nezis, I.P., Simonsen, A., Sagona, A.P., Finley, K., Gaumer, S., Contamine, D., ..., & Brech, A. (2008).
Ref(2)P, the Drosophila melanogaster homologue of mammalian p62, is required for the formation of protein aggregates in adult brain. The Journal of cell biology, 180(6), 1065-71. [PubMed:18347073] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Ichimura, Y., Kumanomidou, T., Sou, Y.S., Mizushima, T., Ezaki, J., Ueno, T., ..., & Komatsu, M. (2008).
Structural basis for sorting mechanism of p62 in selective autophagy. The Journal of biological chemistry, 283(33), 22847-57. [PubMed:18524774] [WorldCat] [DOI] - ↑ 5.0 5.1
Pankiv, S., Clausen, T.H., Lamark, T., Brech, A., Bruun, J.A., Outzen, H., ..., & Johansen, T. (2007).
p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of biological chemistry, 282(33), 24131-45. [PubMed:17580304] [WorldCat] [DOI] - ↑
Jain, A., Lamark, T., Sjøttem, E., Larsen, K.B., Awuh, J.A., Øvervatn, A., ..., & Johansen, T. (2010).
p62/SQSTM1 is a target gene for transcription factor NRF2 and creates a positive feedback loop by inducing antioxidant response element-driven gene transcription. The Journal of biological chemistry, 285(29), 22576-91. [PubMed:20452972] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Komatsu, M., Kurokawa, H., Waguri, S., Taguchi, K., Kobayashi, A., Ichimura, Y., ..., & Yamamoto, M. (2010).
The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1. Nature cell biology, 12(3), 213-23. [PubMed:20173742] [WorldCat] [DOI] - ↑
Lau, A., Wang, X.J., Zhao, F., Villeneuve, N.F., Wu, T., Jiang, T., ..., & Zhang, D.D. (2010).
A noncanonical mechanism of Nrf2 activation by autophagy deficiency: direct interaction between Keap1 and p62. Molecular and cellular biology, 30(13), 3275-85. [PubMed:20421418] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Sun, D., Wu, R., Zheng, J., Li, P., & Yu, L. (2018).
Polyubiquitin chain-induced p62 phase separation drives autophagic cargo segregation. Cell research, 28(4), 405-415. [PubMed:29507397] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Ikeda, R., Noshiro, D., Morishita, H., Takada, S., Kageyama, S., Fujioka, Y., ..., & Komatsu, M. (2023).
Phosphorylation of phase-separated p62 bodies by ULK1 activates a redox-independent stress response. The EMBO journal, 42(14), e113349. [PubMed:37306101] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Kurusu, R., Fujimoto, Y., Morishita, H., Noshiro, D., Takada, S., Yamano, K., ..., & Komatsu, M. (2023).
Integrated proteomics identifies p62-dependent selective autophagy of the supramolecular vault complex. Developmental cell, 58(13), 1189-1205.e11. [PubMed:37192622] [WorldCat] [DOI] - ↑ Berkamp S, Jungbluth L, Katranidis A, Mostafavi S, Korculanin O, Lu P-H, et al. (2024).
Structural organization of p62 filaments and the cellular ultrastructure of calcium-rich p62-enwrapped lipid droplet cargo. bioRxiv. 2024.10.15.618463. - ↑
Ciuffa, R., Lamark, T., Tarafder, A.K., Guesdon, A., Rybina, S., Hagen, W.J., ..., & Sachse, C. (2015).
The selective autophagy receptor p62 forms a flexible filamentous helical scaffold. Cell reports, 11(5), 748-58. [PubMed:25921531] [WorldCat] [DOI] - ↑
Jakobi, A.J., Huber, S.T., Mortensen, S.A., Schultz, S.W., Palara, A., Kuhm, T., ..., & Sachse, C. (2020).
Structural basis of p62/SQSTM1 helical filaments and their role in cellular cargo uptake. Nature communications, 11(1), 440. [PubMed:31974402] [PMC] [WorldCat] [DOI] - ↑
Noda, N.N., Kumeta, H., Nakatogawa, H., Satoo, K., Adachi, W., Ishii, J., ..., & Inagaki, F. (2008).
Structural basis of target recognition by Atg8/LC3 during selective autophagy. Genes to cells : devoted to molecular & cellular mechanisms, 13(12), 1211-8. [PubMed:19021777] [WorldCat] [DOI] - ↑
Vargas, J.N.S., Hamasaki, M., Kawabata, T., Youle, R.J., & Yoshimori, T. (2023).
The mechanisms and roles of selective autophagy in mammals. Nature reviews. Molecular cell biology, 24(3), 167-185. [PubMed:36302887] [WorldCat] [DOI] - ↑
Yamamoto, H., Zhang, S., & Mizushima, N. (2023).
Autophagy genes in biology and disease. Nature reviews. Genetics, 24(6), 382-400. [PubMed:36635405] [PMC] [WorldCat] [DOI] - ↑
Kurusu, R., Morishita, H., & Komatsu, M. (2024).
p62 bodies: cytosolic zoning by phase separation. Journal of biochemistry, 175(2), 141-146. [PubMed:37948628] [WorldCat] [DOI] - ↑
Eapen, V.V., Swarup, S., Hoyer, M.J., Paulo, J.A., & Harper, J.W. (2021).
Quantitative proteomics reveals the selectivity of ubiquitin-binding autophagy receptors in the turnover of damaged lysosomes by lysophagy. eLife, 10. [PubMed:34585663] [PMC] [WorldCat] [DOI] - ↑
Lazarou, M., Sliter, D.A., Kane, L.A., Sarraf, S.A., Wang, C., Burman, J.L., ..., & Youle, R.J. (2015).
The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy. Nature, 524(7565), 309-314. [PubMed:26266977] [PMC] [WorldCat] [DOI] - ↑
Ravenhill, B.J., Boyle, K.B., von Muhlinen, N., Ellison, C.J., Masson, G.R., Otten, E.G., ..., & Randow, F. (2019).
The Cargo Receptor NDP52 Initiates Selective Autophagy by Recruiting the ULK Complex to Cytosol-Invading Bacteria. Molecular cell, 74(2), 320-329.e6. [PubMed:30853402] [PMC] [WorldCat] [DOI] - ↑
Shima, T., Ogura, M., Matsuda, R., Nakamura, S., Jin, N., Yoshimori, T., & Kuma, A. (2023).
The TMEM192-mKeima probe specifically assays lysophagy and reveals its initial steps. The Journal of cell biology, 222(12). [PubMed:37801070] [PMC] [WorldCat] [DOI] - ↑
Zaffagnini, G., Savova, A., Danieli, A., Romanov, J., Tremel, S., Ebner, M., ..., & Martens, S. (2018).
p62 filaments capture and present ubiquitinated cargos for autophagy. The EMBO journal, 37(5). [PubMed:29343546] [PMC] [WorldCat] [DOI] - ↑
Lim, J., Lachenmayer, M.L., Wu, S., Liu, W., Kundu, M., Wang, R., ..., & Yue, Z. (2015).
Proteotoxic stress induces phosphorylation of p62/SQSTM1 by ULK1 to regulate selective autophagic clearance of protein aggregates. PLoS genetics, 11(2), e1004987. [PubMed:25723488] [PMC] [WorldCat] [DOI] - ↑
Matsumoto, G., Wada, K., Okuno, M., Kurosawa, M., & Nukina, N. (2011).
Serine 403 phosphorylation of p62/SQSTM1 regulates selective autophagic clearance of ubiquitinated proteins. Molecular cell, 44(2), 279-89. [PubMed:22017874] [WorldCat] [DOI] - ↑ 26.0 26.1
Pilli, M., Arko-Mensah, J., Ponpuak, M., Roberts, E., Master, S., Mandell, M.A., ..., & Deretic, V. (2012).
TBK-1 promotes autophagy-mediated antimicrobial defense by controlling autophagosome maturation. Immunity, 37(2), 223-34. [PubMed:22921120] [PMC] [WorldCat] [DOI] - ↑
Turco, E., Witt, M., Abert, C., Bock-Bierbaum, T., Su, M.Y., Trapannone, R., ..., & Martens, S. (2019).
FIP200 Claw Domain Binding to p62 Promotes Autophagosome Formation at Ubiquitin Condensates. Molecular cell, 74(2), 330-346.e11. [PubMed:30853400] [PMC] [WorldCat] [DOI] - ↑
Vargas, J.N.S., Wang, C., Bunker, E., Hao, L., Maric, D., Schiavo, G., ..., & Youle, R.J. (2019).
Spatiotemporal Control of ULK1 Activation by NDP52 and TBK1 during Selective Autophagy. Molecular cell, 74(2), 347-362.e6. [PubMed:30853401] [PMC] [WorldCat] [DOI] - ↑
Agudo-Canalejo, J., Schultz, S.W., Chino, H., Migliano, S.M., Saito, C., Koyama-Honda, I., ..., & Knorr, R.L. (2021).
Wetting regulates autophagy of phase-separated compartments and the cytosol. Nature, 591(7848), 142-146. [PubMed:33473217] [WorldCat] [DOI] - ↑
Kageyama, S., Gudmundsson, S.R., Sou, Y.S., Ichimura, Y., Tamura, N., Kazuno, S., ..., & Komatsu, M. (2021).
p62/SQSTM1-droplet serves as a platform for autophagosome formation and anti-oxidative stress response. Nature communications, 12(1), 16. [PubMed:33397898] [PMC] [WorldCat] [DOI] - ↑
Yamamoto, M., Kensler, T.W., & Motohashi, H. (2018).
The KEAP1-NRF2 System: a Thiol-Based Sensor-Effector Apparatus for Maintaining Redox Homeostasis. Physiological reviews, 98(3), 1169-1203. [PubMed:29717933] [PMC] [WorldCat] [DOI] - ↑
Ichimura, Y., Waguri, S., Sou, Y.S., Kageyama, S., Hasegawa, J., Ishimura, R., ..., & Komatsu, M. (2013).
Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy. Molecular cell, 51(5), 618-31. [PubMed:24011591] [WorldCat] [DOI] - ↑
Komatsu, M., Waguri, S., Ueno, T., Iwata, J., Murata, S., Tanida, I., ..., & Chiba, T. (2005).
Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. The Journal of cell biology, 169(3), 425-34. [PubMed:15866887] [PMC] [WorldCat] [DOI] - ↑
Inami, Y., Waguri, S., Sakamoto, A., Kouno, T., Nakada, K., Hino, O., ..., & Komatsu, M. (2011).
Persistent activation of Nrf2 through p62 in hepatocellular carcinoma cells. The Journal of cell biology, 193(2), 275-84. [PubMed:21482715] [PMC] [WorldCat] [DOI] - ↑
Ni, H.M., Boggess, N., McGill, M.R., Lebofsky, M., Borude, P., Apte, U., ..., & Ding, W.X. (2012).
Liver-specific loss of Atg5 causes persistent activation of Nrf2 and protects against acetaminophen-induced liver injury. Toxicological sciences : an official journal of the Society of Toxicology, 127(2), 438-50. [PubMed:22491424] [PMC] [WorldCat] [DOI] - ↑
Takamura, A., Komatsu, M., Hara, T., Sakamoto, A., Kishi, C., Waguri, S., ..., & Mizushima, N. (2011).
Autophagy-deficient mice develop multiple liver tumors. Genes & development, 25(8), 795-800. [PubMed:21498569] [PMC] [WorldCat] [DOI] - ↑
Davidson, J.M., Chung, R.S., & Lee, A. (2022).
The converging roles of sequestosome-1/p62 in the molecular pathways of amyotrophic lateral sclerosis (ALS) and frontotemporal dementia (FTD). Neurobiology of disease, 166, 105653. [PubMed:35143965] [WorldCat] [DOI] - ↑
Faruk, M.O., Ichimura, Y., Kageyama, S., Komatsu-Hirota, S., El-Gowily, A.H., Sou, Y.S., ..., & Komatsu, M. (2021).
Phase-separated protein droplets of amyotrophic lateral sclerosis-associated p62/SQSTM1 mutants show reduced inner fluidity. The Journal of biological chemistry, 297(6), 101405. [PubMed:34774801] [PMC] [WorldCat] [DOI] - ↑
Bauer, B., Idinger, J., Schuschnig, M., Ferrari, L., & Martens, S. (2024).
Recruitment of autophagy initiator TAX1BP1 advances aggrephagy from cargo collection to sequestration. The EMBO journal, 43(23), 5910-5940. [PubMed:39448883] [PMC] [WorldCat] [DOI] - ↑
Cirulli, E.T., Lasseigne, B.N., Petrovski, S., Sapp, P.C., Dion, P.A., Leblond, C.S., ..., & Goldstein, D.B. (2015).
Exome sequencing in amyotrophic lateral sclerosis identifies risk genes and pathways. Science (New York, N.Y.), 347(6229), 1436-41. [PubMed:25700176] [PMC] [WorldCat] [DOI] - ↑
Freischmidt, A., Wieland, T., Richter, B., Ruf, W., Schaeffer, V., Müller, K., ..., & Weishaupt, J.H. (2015).
Haploinsufficiency of TBK1 causes familial ALS and fronto-temporal dementia. Nature neuroscience, 18(5), 631-6. [PubMed:25803835] [WorldCat] [DOI] - ↑
Roodman, G.D., & Windle, J.J. (2005).
Paget disease of bone. The Journal of clinical investigation, 115(2), 200-8. [PubMed:15690073] [PMC] [WorldCat] [DOI] - ↑
Alonso, N., Calero-Paniagua, I., & Del Pino-Montes, J. (2017).
Clinical and Genetic Advances in Paget's Disease of Bone: a Review. Clinical reviews in bone and mineral metabolism, 15(1), 37-48. [PubMed:28255281] [PMC] [WorldCat] [DOI] - ↑
Kurihara, N., Hiruma, Y., Yamana, K., Michou, L., Rousseau, C., Morissette, J., ..., & Roodman, G.D. (2011).
Contributions of the measles virus nucleocapsid gene and the SQSTM1/p62(P392L) mutation to Paget's disease. Cell metabolism, 13(1), 23-34. [PubMed:21195346] [PMC] [WorldCat] [DOI] - ↑
Zatloukal, K., French, S.W., Stumptner, C., Strnad, P., Harada, M., Toivola, D.M., ..., & Omary, M.B. (2007).
From Mallory to Mallory-Denk bodies: what, how and why? Experimental cell research, 313(10), 2033-49. [PubMed:17531973] [WorldCat] [DOI] - ↑
Saito, T., Ichimura, Y., Taguchi, K., Suzuki, T., Mizushima, T., Takagi, K., ..., & Komatsu, M. (2016).
p62/Sqstm1 promotes malignancy of HCV-positive hepatocellular carcinoma through Nrf2-dependent metabolic reprogramming. Nature communications, 7, 12030. [PubMed:27345495] [PMC] [WorldCat] [DOI]