「脂肪酸結合タンパク質7型」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の42版が非表示) | |||
| 1行目: | 1行目: | ||
[[Image:Balendrian-FABP7withDHA.jpg|thumb|right]] BLBPはFABPファミリーの中で7番目に脳から単離されたため、FABP7もしくはB-FABPとも呼ばれる(本稿では、最近一般的に使用されているFABP7を用いる)。 | |||
脳組織は[[wikipedia:ja:多価不飽和脂肪酸|多価不飽和脂肪酸]](PUFA)の含有率が高く、脳を構成する細胞のリン脂質膜には[[wikipedia:ja:ドコサヘキサエン酸|ドコサヘキサエン酸]](DHA)や[[wikipedia:ja:エイコサペンタエン酸|エイコサペンタエン酸]](EPA)などのPUFAが他の組織より多く含まれている。中枢神経系の細胞分化や[[シナプス]]形成の際にPUFAは必須の物質であり、脳の正常発達に不可欠である。また、PUFAの摂取不足は[[学習]]の低下や行動の異常を引き起こす。水に不溶なPUFAは、脂肪酸結合タンパク質FABPと結合して細胞内を移動し、脂質膜を構成し、[[シグナル伝達]]や[[wikipedia:ja:転写|転写]]制御を行う<ref name="ref1"><pubmed> 10854433 </pubmed></ref><ref name="ref2"><pubmed> 18323691 </pubmed></ref> 。 | |||
== 分子構造とリガンド結合能 == | == 分子構造とリガンド結合能 == | ||
タンパク質の構造は、131個の[[wikipedia:ja:アミノ酸|アミノ酸]]から構成され、[[wikipedia:ja:分子量|分子量]]は約15kDである。10個の逆平行β構造が2枚の直交するβシートを形成し、2つの短いαへリックスを持つ<ref name=" | タンパク質の構造は、131個の[[wikipedia:ja:アミノ酸|アミノ酸]]から構成され、[[wikipedia:ja:分子量|分子量]]は約15kDである。10個の逆平行β構造が2枚の直交するβシートを形成し、2つの短いαへリックスを持つ<ref name="ref1" />。ヒトのFABP7は[[wikipedia:ja:遺伝子|遺伝子]]配列において、FABP分子ファミリーの中で構造的に最も近い心臓型FABP(FABP3)と92.3%の相同性を持つ<ref name="ref3"><pubmed> 20563994 </pubmed></ref>。FABP7は、脂肪酸のなかでもDHAやEPAなどのn-3系脂肪酸と親和性が高い。なおFABP3はn-6系[[wikipedia:ja:脂肪酸|脂肪酸]]、表皮型FABP(FABP5)は飽和脂肪酸に親和性が高いとされる<ref name="ref2" />。 | ||
== 発現の制御と機能 == | == 発現の制御と機能 == | ||
FABP7遺伝子はヒトで6番染色体短腕22-23、マウスでは10番染色体に存在している (NCBI website, http://www.ncbi.nlm.nih.gov/gene/?term=FABP7)。 発達期の脳のFABP7を制御する転写因子としてNotchシグナル経路、Reelin-[[DAB1]]、[[PAX]]6、NF-1、[[POU]]ドメインタンパク質が知られている。マウスではNotchシグナル経路、ラットではPAX6が特に重要な役割を果たすと考えられている <ref name="ref3" /><ref name="ref4"><pubmed> 16237179 </pubmed></ref>。 | |||
FABPは核と細胞質の双方に発現しており、proliferator-activated receptor ([[wikipedia:ja:PPAR|PPAR]])などの[[wikipedia:ja:核内受容体|核内受容体]]を活性化することによって遺伝子を制御していると考えられている。肝臓型FABP1がPPARαとPPARγ、脂肪細胞型FABP4と表皮型FABP5がPPARγおよびPPARβに結合することが明らかにされている一方、FABP7のとの核内受容体との結合や転写調節の詳細は明らかではない<ref name="ref3" />。FABP7がDHAを輸送することにより、悪性膠芽腫ではPPARγが活性化され標的遺伝子を抑制して腫瘍の浸潤を抑制し<ref name="ref5"><pubmed> 20834042 </pubmed></ref>、トリプルネガティブ乳がん([[wikipedia:Triple-negative breast cancer|Triple-negative breast cancer ]])ではretinoid X receptorβ (RXRβ)が活性化され腫瘍の増殖を促進している可能性が示唆されている<ref name="ref6"><pubmed> 22322885 </pubmed></ref>。 | |||
== 神経系での局在と機能 == | == 神経系での局在と機能 == | ||
胎児期の[[大脳皮質]]発達過程において[[神経細胞]]の移動は[[放射状グリア細胞]] | 胎児期の[[大脳皮質]]発達過程において[[神経細胞]]の移動は[[放射状グリア細胞]]によって誘導されると考えられている。哺乳類の脳の発達期にFABP7は小脳のBergmanグリアや、脊髄や大脳皮質の放射状グリア細胞(神経幹細胞)に高い発現を示し、大脳皮質や小脳の神経細胞移動に関与していると考えられている<ref name="ref1" />。哺乳類のFABP7は神経細胞の新生が活発な胎生期の[[脳室帯]]および[[脳室下帯]]の[[神経上皮]]や成熟期[[海馬]][[歯状回]]顆粒細胞層の[[神経幹細胞]]に局在している。最近の研究では、FABP7が神経幹細胞の未分化性の維持に深く関わることが示されている<ref name="ref4" /><ref name="ref7"><pubmed> 20057506 </pubmed></ref>。これらの神経幹細胞の他に[[アストロサイト]]や[[オリゴデンドロサイト前駆細胞]](OPC)での局在が報告されている<ref name="ref8"><pubmed> 21938553 </pubmed></ref>。 | ||
FABP7は様々な神経精神疾患、特に[[統合失調症]]の病態との関連が示唆されている。統合失調症患者群において、FABP7の2番目のエクソンに存在する[[一塩基多型]](SNP) | FABP7は様々な神経精神疾患、特に[[統合失調症]]の病態との関連が示唆されている。統合失調症患者群において、FABP7の2番目のエクソンに存在する[[一塩基多型]](SNP)で有意な相関が認められ、FABP7mRNAレベルが統合失調症患者の死後脳で非患者と比較して有意に上昇していることも明らかにされている。FABP7欠損マウスでは統合失調症の[[エンドフェノタイプ]]のひとつとされる[[プレパルスインヒビション]](PPI)が障害されている。PPIの機能障害は他の神経[[精神疾患]]([[アルツハイマー病]]、[[自閉症障害]]、[[双極性障害]]など)にも見られることから、これらの疾患にもFABP7が関与していると考えられている <ref name="ref7" /><ref name="ref9"><pubmed> 18001149 </pubmed></ref>。また、FABP7は[[ダウン症]]患者の脳に過剰に発現している。末梢神経系ではFABP7の発現は低いが、神経傷害時にシュワン細胞において発現誘導が認められ、シュワン細胞と再生神経軸索の接着に関与することが知られている<ref name="ref2" />。 さらにFABP7はヒト悪性[[wikipedia:ja:膠芽腫|膠芽腫]]に発現し、FABP7の発現と生存率の間には有意の相関がある。ヒト悪性膠芽腫の浸潤と進行にFABP7は重要な役割を担っており、有効な予後マーカーになりうると考えられている<ref name="ref5" />。 | ||
== 神経系以外での局在と機能 == | == 神経系以外での局在と機能 == | ||
FABP7は[[wikipedia:ja:リンパ節|リンパ節]]など末梢性免疫臓器の[[wikipedia:ja:T細胞|T細胞]] | FABP7は[[wikipedia:ja:リンパ節|リンパ節]]など末梢性免疫臓器の[[wikipedia:ja:T細胞|T細胞]]領域特異的線維芽細胞(fibroblastic reticular cell, FRC)での局在や肝臓の[[wikipedia:ja:クッパー細胞|クッパー細胞]]での局在も報告されており、リンパ球の生存・移動や炎症反応への関与が示唆されている<ref name="ref10"><pubmed> 21042809 </pubmed></ref>。また、前述した悪性膠芽腫や[[wikipedia:ja:乳癌|乳癌]]の他にも[[wikipedia:ja:悪性黒色腫|悪性黒色腫]]<ref name="ref6" />や[[wikipedia:ja:腎癌|腎癌]]<ref name="ref11"><pubmed> 21771320 </pubmed></ref>などの種々の腫瘍での発現が知られており、腫瘍の増殖や浸潤に関わるとされている。 | ||
<br> | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
<br>(執筆者:徳田信子、大和田祐二 担当編集委員:大隅典子) | |||
2012年4月18日 (水) 18:57時点における版
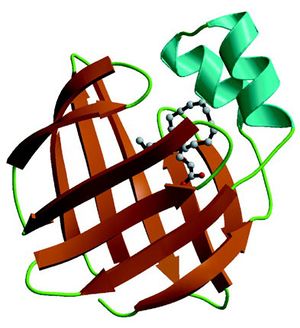
BLBPはFABPファミリーの中で7番目に脳から単離されたため、FABP7もしくはB-FABPとも呼ばれる(本稿では、最近一般的に使用されているFABP7を用いる)。
脳組織は多価不飽和脂肪酸(PUFA)の含有率が高く、脳を構成する細胞のリン脂質膜にはドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)などのPUFAが他の組織より多く含まれている。中枢神経系の細胞分化やシナプス形成の際にPUFAは必須の物質であり、脳の正常発達に不可欠である。また、PUFAの摂取不足は学習の低下や行動の異常を引き起こす。水に不溶なPUFAは、脂肪酸結合タンパク質FABPと結合して細胞内を移動し、脂質膜を構成し、シグナル伝達や転写制御を行う[1][2] 。
分子構造とリガンド結合能
タンパク質の構造は、131個のアミノ酸から構成され、分子量は約15kDである。10個の逆平行β構造が2枚の直交するβシートを形成し、2つの短いαへリックスを持つ[1]。ヒトのFABP7は遺伝子配列において、FABP分子ファミリーの中で構造的に最も近い心臓型FABP(FABP3)と92.3%の相同性を持つ[3]。FABP7は、脂肪酸のなかでもDHAやEPAなどのn-3系脂肪酸と親和性が高い。なおFABP3はn-6系脂肪酸、表皮型FABP(FABP5)は飽和脂肪酸に親和性が高いとされる[2]。
発現の制御と機能
FABP7遺伝子はヒトで6番染色体短腕22-23、マウスでは10番染色体に存在している (NCBI website, http://www.ncbi.nlm.nih.gov/gene/?term=FABP7)。 発達期の脳のFABP7を制御する転写因子としてNotchシグナル経路、Reelin-DAB1、PAX6、NF-1、POUドメインタンパク質が知られている。マウスではNotchシグナル経路、ラットではPAX6が特に重要な役割を果たすと考えられている [3][4]。
FABPは核と細胞質の双方に発現しており、proliferator-activated receptor (PPAR)などの核内受容体を活性化することによって遺伝子を制御していると考えられている。肝臓型FABP1がPPARαとPPARγ、脂肪細胞型FABP4と表皮型FABP5がPPARγおよびPPARβに結合することが明らかにされている一方、FABP7のとの核内受容体との結合や転写調節の詳細は明らかではない[3]。FABP7がDHAを輸送することにより、悪性膠芽腫ではPPARγが活性化され標的遺伝子を抑制して腫瘍の浸潤を抑制し[5]、トリプルネガティブ乳がん(Triple-negative breast cancer )ではretinoid X receptorβ (RXRβ)が活性化され腫瘍の増殖を促進している可能性が示唆されている[6]。
神経系での局在と機能
胎児期の大脳皮質発達過程において神経細胞の移動は放射状グリア細胞によって誘導されると考えられている。哺乳類の脳の発達期にFABP7は小脳のBergmanグリアや、脊髄や大脳皮質の放射状グリア細胞(神経幹細胞)に高い発現を示し、大脳皮質や小脳の神経細胞移動に関与していると考えられている[1]。哺乳類のFABP7は神経細胞の新生が活発な胎生期の脳室帯および脳室下帯の神経上皮や成熟期海馬歯状回顆粒細胞層の神経幹細胞に局在している。最近の研究では、FABP7が神経幹細胞の未分化性の維持に深く関わることが示されている[4][7]。これらの神経幹細胞の他にアストロサイトやオリゴデンドロサイト前駆細胞(OPC)での局在が報告されている[8]。
FABP7は様々な神経精神疾患、特に統合失調症の病態との関連が示唆されている。統合失調症患者群において、FABP7の2番目のエクソンに存在する一塩基多型(SNP)で有意な相関が認められ、FABP7mRNAレベルが統合失調症患者の死後脳で非患者と比較して有意に上昇していることも明らかにされている。FABP7欠損マウスでは統合失調症のエンドフェノタイプのひとつとされるプレパルスインヒビション(PPI)が障害されている。PPIの機能障害は他の神経精神疾患(アルツハイマー病、自閉症障害、双極性障害など)にも見られることから、これらの疾患にもFABP7が関与していると考えられている [7][9]。また、FABP7はダウン症患者の脳に過剰に発現している。末梢神経系ではFABP7の発現は低いが、神経傷害時にシュワン細胞において発現誘導が認められ、シュワン細胞と再生神経軸索の接着に関与することが知られている[2]。 さらにFABP7はヒト悪性膠芽腫に発現し、FABP7の発現と生存率の間には有意の相関がある。ヒト悪性膠芽腫の浸潤と進行にFABP7は重要な役割を担っており、有効な予後マーカーになりうると考えられている[5]。
神経系以外での局在と機能
FABP7はリンパ節など末梢性免疫臓器のT細胞領域特異的線維芽細胞(fibroblastic reticular cell, FRC)での局在や肝臓のクッパー細胞での局在も報告されており、リンパ球の生存・移動や炎症反応への関与が示唆されている[10]。また、前述した悪性膠芽腫や乳癌の他にも悪性黒色腫[6]や腎癌[11]などの種々の腫瘍での発現が知られており、腫瘍の増殖や浸潤に関わるとされている。
参考文献
- ↑ 1.0 1.1 1.2
Balendiran, G.K., Schnutgen, F., Scapin, G., Borchers, T., Xhong, N., Lim, K., ..., & Sacchettini, J.C. (2000).
Crystal structure and thermodynamic analysis of human brain fatty acid-binding protein. The Journal of biological chemistry, 275(35), 27045-54. [PubMed:10854433] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Owada, Y. (2008).
Fatty acid binding protein: localization and functional significance in the brain. The Tohoku journal of experimental medicine, 214(3), 213-20. [PubMed:18323691] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Liu, R.Z., Mita, R., Beaulieu, M., Gao, Z., & Godbout, R. (2010).
Fatty acid binding proteins in brain development and disease. The International journal of developmental biology, 54(8-9), 1229-39. [PubMed:20563994] [WorldCat] [DOI] - ↑ 4.0 4.1
Arai, Y., Funatsu, N., Numayama-Tsuruta, K., Nomura, T., Nakamura, S., & Osumi, N. (2005).
Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(42), 9752-61. [PubMed:16237179] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Mita, R., Beaulieu, M.J., Field, C., & Godbout, R. (2010).
Brain fatty acid-binding protein and omega-3/omega-6 fatty acids: mechanistic insight into malignant glioma cell migration. The Journal of biological chemistry, 285(47), 37005-15. [PubMed:20834042] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Liu, R.Z., Graham, K., Glubrecht, D.D., Lai, R., Mackey, J.R., & Godbout, R. (2012).
A fatty acid-binding protein 7/RXRβ pathway enhances survival and proliferation in triple-negative breast cancer. The Journal of pathology, 228(3), 310-21. [PubMed:22322885] [WorldCat] [DOI] - ↑ 7.0 7.1
Maekawa, M., Iwayama, Y., Arai, R., Nakamura, K., Ohnishi, T., Toyota, T., ..., & Yoshikawa, T. (2010).
Polymorphism screening of brain-expressed FABP7, 5 and 3 genes and association studies in autism and schizophrenia in Japanese subjects. Journal of human genetics, 55(2), 127-30. [PubMed:20057506] [WorldCat] [DOI] - ↑
Sharifi, K., Morihiro, Y., Maekawa, M., Yasumoto, Y., Hoshi, H., Adachi, Y., ..., & Owada, Y. (2011).
FABP7 expression in normal and stab-injured brain cortex and its role in astrocyte proliferation. Histochemistry and cell biology, 136(5), 501-13. [PubMed:21938553] [PMC] [WorldCat] [DOI] - ↑
Watanabe, A., Toyota, T., Owada, Y., Hayashi, T., Iwayama, Y., Matsumata, M., ..., & Yoshikawa, T. (2007).
Fabp7 maps to a quantitative trait locus for a schizophrenia endophenotype. PLoS biology, 5(11), e297. [PubMed:18001149] [PMC] [WorldCat] [DOI] - ↑
Tokuda, N., Adachi, T., Adachi, Y., Higashi, M., Sharifi, K., Tuerxun, T., ..., & Owada, Y. (2010).
Identification of FABP7 in fibroblastic reticular cells of mouse lymph nodes. Histochemistry and cell biology, 134(5), 445-52. [PubMed:21042809] [WorldCat] [DOI] - ↑
Takaoka, N., Takayama, T., Teratani, T., Sugiyama, T., Mugiya, S., & Ozono, S. (2011).
Analysis of the regulation of fatty acid binding protein 7 expression in human renal carcinoma cell lines. BMC molecular biology, 12, 31. [PubMed:21771320] [PMC] [WorldCat] [DOI]
(執筆者:徳田信子、大和田祐二 担当編集委員:大隅典子)