「視床下核」の版間の差分
Atsushinambu (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の26版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/atsushinambu 南部 篤]</font><br> | |||
''自然科学研究機構 生理学研究所''<br> | |||
DOI:<selfdoi /> 原稿受付日:2013年2月4日 原稿完成日:2019年1月31日<br> | |||
担当編集委員:[https://researchmap.jp/masahikowatanabeo 渡辺 雅彦] (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)<br> | |||
</div> | |||
羅:nucleus subthalamicus 英:subthalamic nucleus 独:subthalamische Nukleus 仏:noyau sous-thalamique 西:núcleos subtalámicos 英略語:STN | |||
同義語:ルイ体、corpus Luysi | 同義語:ルイ体、corpus Luysi | ||
{{box|text= | |||
視床下核とは、[[大脳基底核]]を構成する核のひとつである。[[大脳皮質]]から興奮性入力を、[[淡蒼球外節]]から抑制性入力を受け、淡蒼球外節・[[淡蒼球内節|内節]]、[[黒質網様部]]に興奮性投射を送る。視床下核が障害を受けると[[ヘミバリスム]]を来す。近年、[[パーキンソン病]]に対する[[脳深部刺激療法]](DBS)のターゲットとして臨床的にも注目されている。 | |||
}} | |||
==視床下核とは== | |||
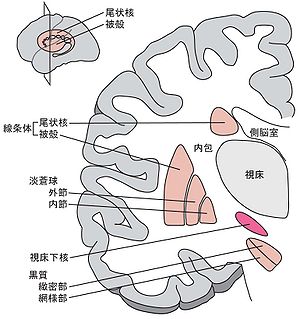
[[Image:STN Fig1.jpg|thumb|300px|'''図1.視床下核を濃い暖色で前額断で示す''']] | |||
[[Image:STN Fig2.jpg|thumb|300px|'''図2.大脳基底核を巡る神経回路'''<br>白矢印:グルタミン酸作動性興奮性投射、黒矢印:GABA作動性抑制性投射、灰色矢印:ドーパミン作動性投射]] | |||
視床下核はその名のとおり、視床の下に存在する紡錘形の小さな核(ヒトでは大粒の大豆大)であり、大脳基底核を構成する核のひとつである('''図1''')。[[wikipedia:Jules Bernard Luys|Jules Bernard Luys]]が1865年に初めて記載したことからルイ体とも呼ばれる<ref>'''J S McKenzie'''<br>The subthalamic region of Luys, Forel, and Dejerine. In: The Basal Ganglia IX, ed by Groenewegen HJ, Voorn P, Berendse HW et al. <br>''Springer, Dordrecht,'' 2009, pp. 97-107</ref>。 | |||
視床下核の障害により反対側にヘミバリスム(hemiballism)が起こることが1920年代に明らかになり、注目されても良い筈であったが、長年、大脳基底核を巡る神経回路の中で、位置づけがはっきりせず、研究もあまり進んでいなかった。しかし、1990年に[[直接路・間接路モデル]]が提唱され、さらにパーキンソン病に対する[[定位脳手術]](stereotactic surgery)のターゲットになってからは研究も進み、注目される脳部位のひとつである。 | |||
==構造== | |||
===局所解剖=== | |||
視床下核は、[[グルタミン酸]]作動性の投射ニューロンにより構成されている(現在は、興奮性であることが確立しているが、抑制性であると考えられていた時期もあった)。長い[[樹状突起]]を有し、また[[軸索]]は核内走行中に軸索側枝を出す。 | |||
===入出力=== | |||
大脳皮質からグルタミン酸作動性の興奮性入力を、淡蒼球外節から[[GABA]]作動性の抑制性入力を受け、淡蒼球外節・内節、黒質網様部にグルタミン酸作動性の興奮性投射を送る。 | |||
====直接路・間接路モデル==== | |||
以前は、視床下核は淡蒼球外節(external segment of the globus pallidus)と局所的な神経回路を構成しているだけであり、大脳基底核全体の情報処理とは無関係と考えられていた<ref>'''M R DeLong, A P Georgopoulos'''<br>Motor functions of the basal ganglia. In: Handbook of Physiology, Sect. 1, The Nervous System, vol. I I., Motor Control, Part 2, ed by Brookhart JM, Mountcastle VB, Brooks VB et al, American Physiological Society <br> ''Bethesda,'' 1981, pp. 1017-1061</ref>。 | |||
ところが1989年から1990年にかけてAlbinら<ref><pubmed>2479133</pubmed></ref>およびDeLongら<ref name=ref4><pubmed>1695404</pubmed></ref>のグループによって、直接路・間接路モデルが提案され、状況が大きく変わった('''図2''')。彼らは、大脳基底核のうち入力部として[[線条体]](striatum)を、出力部として淡蒼球内節(internal segment of the globus pallidus)と黒質網様部(substantia nigra pars reticulata)を定義し、入力部と出力部を以下の2つの経路が結ぶことを提案した。 | |||
:1. [[直接路]](direct pathway):線条体から直接、淡蒼球内節・黒質網様部に到る経路 | |||
:2. [[間接路]](indirect pathway):線条体から、淡蒼球外節、視床下核を順に経由して淡蒼球内節・黒質網様部に到る経路 | |||
直接路・間接路モデルは、それまで入り組んでいた大脳基底核の神経回路を、整理し明快にまとめたばかりでなく、後から述べるように大脳基底核疾患の病態や定位脳手術の治療メカニズムも説明できる画期的なものであった。これによって、視床下核は間接路の重要な中継核と位置づけられた。 | |||
さらに、視床下核も大脳皮質から直接、入力を受けていることが以前よりわかっていたが、最近では大脳皮質からの入力が特に重要という認識が広がり、線条体と並んで大脳基底核の入力部と考えられるようになった。それに伴い、直接路・間接路に加えて、 | |||
:3. [[ハイパー直接路]](hyperdirect pathway):大脳皮質から入力を受けた視床下核ニューロンが淡蒼球内節・黒質網様部に投射する経路 | |||
== | が提案され、広く認められるようになってきた('''図2''')。<ref name=ref5><pubmed>10899204</pubmed></ref><ref><pubmed>12067746 </pubmed></ref> | ||
[[Image:STN Fig3.jpg|thumb|300px|'''図3.視床下核の機能分化''']] | |||
====視床下核の体部位局在==== | |||
視床下核背側部は、大脳皮質[[運動野]]から[[体部位局在]]を保った入力を受けていることから、運動領域と考えられる('''図3''')<ref><pubmed>8786443</pubmed></ref><ref><pubmed>21541304</pubmed></ref>。大脳皮質[[一次運動野]]からは視床下核背側部のうち外側部に、[[補足運動野]]からは内側部に投射している。一次運動野の口腔顔面、上肢、下肢領域からは視床下核外側部において、外側から内側にかけて終止しているのに対し、補足運動野の口腔顔面、上肢、下肢領域からの投射は、内側部において内側から外側に終止している。すなわち、外側部、内側部それぞれに、互いに鏡像関係にあるような体部位再現がある('''図3''')。この運動領域の腹側には[[前頭前野]]から、その一部に[[眼球運動野]]から、最内側部には[[辺縁皮質]]から入力を受ける領域が存在する。したがって、視床下核は上下肢や体幹の運動だけではなく、[[眼球運動]]、前頭前野の機能である高次機能、[[辺縁系]]の機能である[[情動]]などにも関わっていると考えられる。 | |||
==機能== | |||
= | 視床下核から神経活動を記録してみると、20-30Hzの中程度の頻度で常に発火しており、運動領域のニューロンは、反対側の対応する体部位の随意運動に先行して、活動を変化させる<ref><pubmed>6875658</pubmed></ref>。一方、視床下核はグルタミン酸作動性の興奮性ニューロンより構成されているので、投射先である淡蒼球外節・内節ニューロンに対して興奮性入力を与え、いわば大脳基底核のdriving forceとなっている。実際、視床下核を破壊したりブロックしたりすると、淡蒼球外節・内節のニューロン活動は減少する<ref name=ref5 />。それに伴って、反対側に粗大な不随意運動であるヘミバリスムが出現する。これは、通常、ハイパー直接路や間接路が不必要な運動を抑制しているが、視床下核をブロックすると、不必要な運動を抑えられなくなり、不随意運動を来たしたと解釈できる。 | ||
==大脳基底核疾患との関連== | |||
= | 直接路・間接路モデルが広く受け入れられた理由として、大脳基底核疾患の病態が、直接路と間接路のバランスの崩れで説明できることにあった<ref name=ref4 />。パーキンソン病の際には、線条体におけるドーパミンの枯渇により、直接路ニューロンの活動性低下、間接路ニューロンの活動性亢進が想定され、それに伴って、淡蒼球内節の活動性亢進、淡蒼球外節の活動性低下、視床下核の活動性亢進が観察された<ref>'''W C Miller, M R DeLong'''<br>Altered tonic activity of neurons in the globus pallidus and subthalamic nucleus in the primate MPTP model of parkinsonism. In: The Basal Ganglia II: Structure and Function-Current Concepts, ed by Carpenter MB, Jayaraman A,<br>''Plenum, New York,'' 1986, pp. 415-427</ref>。さらに直接路・間接路モデルによると、活動性が亢進した視床下核を破壊すれば、パーキンソン病の症状が改善するはずであり、実際、動物実験で行ったところ、症状が軽減された<ref><pubmed>2402638</pubmed></ref>。これらが根拠となり、今日のような視床下核をターゲットとした定位脳手術の隆盛を見ることとなった。 | ||
実際は、手技上の問題から視床下核を凝固するのではなく、視床下核に電極を挿入し高頻度電気刺激を加える脳深部刺激療法(deep brain stimulation, DBS)を行っている訳であるが<ref name=ref12>'''AL Benabid, J Mitrofanis, S Chabardes et al.'''<br>Subthalamic nucleus stimulation for Parkinson's disease. In: Textbook of Stereotactic and Functional Neurosurgery, ed by Lozano AM, Gildenberg PL, Tasker RR,<br> ''Springer, Berlin,'' 2009, pp. 1603-1630</ref>、これが局所の神経活動を抑制しているのか、興奮させているのか、未だに議論があるところである<ref><pubmed>19081243</pubmed></ref>。さらに、当初、直接路と間接路の活動性のアンバランスを支持するデータが多かったが、その後の報告によれば、それほど明確ではなく、最近ではむしろ視床下核で観察される発振現象([[β帯域]]のニューロン発火や[[細胞外記録#局所フィールド電位記録|局所フィールド電位]])が、大脳基底核の情報伝達を阻害することにより、諸症状を引き起こしているのではないかとも考えられている<ref><pubmed>18221864</pubmed></ref>。 | |||
= | 一方、DBSの副作用として、情動異常が挙げられる<ref name=ref12 />。DBSは、視床下核の運動領域である背側部をターゲットとしているが、何らかの原因で電気刺激がより腹側部の前頭前野領域や辺縁領域にも及び('''図3''')、通常は視床下核の活動によって抑制されている情動機能が、DBSによって解放されたためではないかと考えられる。 | ||
==関連語== | |||
*[[大脳基底核]] | |||
*[[パーキンソン病]] | |||
*[[深部電気刺激]] | |||
*[[随意運動と不随意運動]] | |||
*[[運動制御]] | |||
==参考文献== | |||
<references/> | <references/> | ||
2019年2月3日 (日) 10:14時点における最新版
南部 篤
自然科学研究機構 生理学研究所
DOI:10.14931/bsd.3020 原稿受付日:2013年2月4日 原稿完成日:2019年1月31日
担当編集委員:渡辺 雅彦 (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)
羅:nucleus subthalamicus 英:subthalamic nucleus 独:subthalamische Nukleus 仏:noyau sous-thalamique 西:núcleos subtalámicos 英略語:STN
同義語:ルイ体、corpus Luysi
視床下核とは、大脳基底核を構成する核のひとつである。大脳皮質から興奮性入力を、淡蒼球外節から抑制性入力を受け、淡蒼球外節・内節、黒質網様部に興奮性投射を送る。視床下核が障害を受けるとヘミバリスムを来す。近年、パーキンソン病に対する脳深部刺激療法(DBS)のターゲットとして臨床的にも注目されている。
視床下核とは
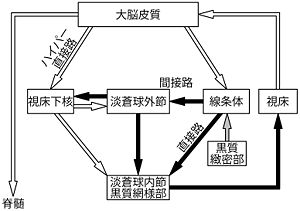
白矢印:グルタミン酸作動性興奮性投射、黒矢印:GABA作動性抑制性投射、灰色矢印:ドーパミン作動性投射
視床下核はその名のとおり、視床の下に存在する紡錘形の小さな核(ヒトでは大粒の大豆大)であり、大脳基底核を構成する核のひとつである(図1)。Jules Bernard Luysが1865年に初めて記載したことからルイ体とも呼ばれる[1]。
視床下核の障害により反対側にヘミバリスム(hemiballism)が起こることが1920年代に明らかになり、注目されても良い筈であったが、長年、大脳基底核を巡る神経回路の中で、位置づけがはっきりせず、研究もあまり進んでいなかった。しかし、1990年に直接路・間接路モデルが提唱され、さらにパーキンソン病に対する定位脳手術(stereotactic surgery)のターゲットになってからは研究も進み、注目される脳部位のひとつである。
構造
局所解剖
視床下核は、グルタミン酸作動性の投射ニューロンにより構成されている(現在は、興奮性であることが確立しているが、抑制性であると考えられていた時期もあった)。長い樹状突起を有し、また軸索は核内走行中に軸索側枝を出す。
入出力
大脳皮質からグルタミン酸作動性の興奮性入力を、淡蒼球外節からGABA作動性の抑制性入力を受け、淡蒼球外節・内節、黒質網様部にグルタミン酸作動性の興奮性投射を送る。
直接路・間接路モデル
以前は、視床下核は淡蒼球外節(external segment of the globus pallidus)と局所的な神経回路を構成しているだけであり、大脳基底核全体の情報処理とは無関係と考えられていた[2]。
ところが1989年から1990年にかけてAlbinら[3]およびDeLongら[4]のグループによって、直接路・間接路モデルが提案され、状況が大きく変わった(図2)。彼らは、大脳基底核のうち入力部として線条体(striatum)を、出力部として淡蒼球内節(internal segment of the globus pallidus)と黒質網様部(substantia nigra pars reticulata)を定義し、入力部と出力部を以下の2つの経路が結ぶことを提案した。
- 1. 直接路(direct pathway):線条体から直接、淡蒼球内節・黒質網様部に到る経路
- 2. 間接路(indirect pathway):線条体から、淡蒼球外節、視床下核を順に経由して淡蒼球内節・黒質網様部に到る経路
直接路・間接路モデルは、それまで入り組んでいた大脳基底核の神経回路を、整理し明快にまとめたばかりでなく、後から述べるように大脳基底核疾患の病態や定位脳手術の治療メカニズムも説明できる画期的なものであった。これによって、視床下核は間接路の重要な中継核と位置づけられた。
さらに、視床下核も大脳皮質から直接、入力を受けていることが以前よりわかっていたが、最近では大脳皮質からの入力が特に重要という認識が広がり、線条体と並んで大脳基底核の入力部と考えられるようになった。それに伴い、直接路・間接路に加えて、
- 3. ハイパー直接路(hyperdirect pathway):大脳皮質から入力を受けた視床下核ニューロンが淡蒼球内節・黒質網様部に投射する経路
が提案され、広く認められるようになってきた(図2)。[5][6]
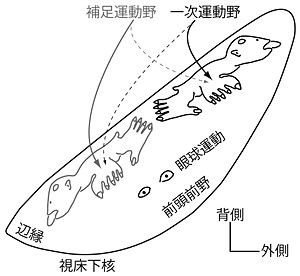
視床下核の体部位局在
視床下核背側部は、大脳皮質運動野から体部位局在を保った入力を受けていることから、運動領域と考えられる(図3)[7][8]。大脳皮質一次運動野からは視床下核背側部のうち外側部に、補足運動野からは内側部に投射している。一次運動野の口腔顔面、上肢、下肢領域からは視床下核外側部において、外側から内側にかけて終止しているのに対し、補足運動野の口腔顔面、上肢、下肢領域からの投射は、内側部において内側から外側に終止している。すなわち、外側部、内側部それぞれに、互いに鏡像関係にあるような体部位再現がある(図3)。この運動領域の腹側には前頭前野から、その一部に眼球運動野から、最内側部には辺縁皮質から入力を受ける領域が存在する。したがって、視床下核は上下肢や体幹の運動だけではなく、眼球運動、前頭前野の機能である高次機能、辺縁系の機能である情動などにも関わっていると考えられる。
機能
視床下核から神経活動を記録してみると、20-30Hzの中程度の頻度で常に発火しており、運動領域のニューロンは、反対側の対応する体部位の随意運動に先行して、活動を変化させる[9]。一方、視床下核はグルタミン酸作動性の興奮性ニューロンより構成されているので、投射先である淡蒼球外節・内節ニューロンに対して興奮性入力を与え、いわば大脳基底核のdriving forceとなっている。実際、視床下核を破壊したりブロックしたりすると、淡蒼球外節・内節のニューロン活動は減少する[5]。それに伴って、反対側に粗大な不随意運動であるヘミバリスムが出現する。これは、通常、ハイパー直接路や間接路が不必要な運動を抑制しているが、視床下核をブロックすると、不必要な運動を抑えられなくなり、不随意運動を来たしたと解釈できる。
大脳基底核疾患との関連
直接路・間接路モデルが広く受け入れられた理由として、大脳基底核疾患の病態が、直接路と間接路のバランスの崩れで説明できることにあった[4]。パーキンソン病の際には、線条体におけるドーパミンの枯渇により、直接路ニューロンの活動性低下、間接路ニューロンの活動性亢進が想定され、それに伴って、淡蒼球内節の活動性亢進、淡蒼球外節の活動性低下、視床下核の活動性亢進が観察された[10]。さらに直接路・間接路モデルによると、活動性が亢進した視床下核を破壊すれば、パーキンソン病の症状が改善するはずであり、実際、動物実験で行ったところ、症状が軽減された[11]。これらが根拠となり、今日のような視床下核をターゲットとした定位脳手術の隆盛を見ることとなった。
実際は、手技上の問題から視床下核を凝固するのではなく、視床下核に電極を挿入し高頻度電気刺激を加える脳深部刺激療法(deep brain stimulation, DBS)を行っている訳であるが[12]、これが局所の神経活動を抑制しているのか、興奮させているのか、未だに議論があるところである[13]。さらに、当初、直接路と間接路の活動性のアンバランスを支持するデータが多かったが、その後の報告によれば、それほど明確ではなく、最近ではむしろ視床下核で観察される発振現象(β帯域のニューロン発火や局所フィールド電位)が、大脳基底核の情報伝達を阻害することにより、諸症状を引き起こしているのではないかとも考えられている[14]。
一方、DBSの副作用として、情動異常が挙げられる[12]。DBSは、視床下核の運動領域である背側部をターゲットとしているが、何らかの原因で電気刺激がより腹側部の前頭前野領域や辺縁領域にも及び(図3)、通常は視床下核の活動によって抑制されている情動機能が、DBSによって解放されたためではないかと考えられる。
関連語
参考文献
- ↑ J S McKenzie
The subthalamic region of Luys, Forel, and Dejerine. In: The Basal Ganglia IX, ed by Groenewegen HJ, Voorn P, Berendse HW et al.
Springer, Dordrecht, 2009, pp. 97-107 - ↑ M R DeLong, A P Georgopoulos
Motor functions of the basal ganglia. In: Handbook of Physiology, Sect. 1, The Nervous System, vol. I I., Motor Control, Part 2, ed by Brookhart JM, Mountcastle VB, Brooks VB et al, American Physiological Society
Bethesda, 1981, pp. 1017-1061 - ↑
Albin, R.L., Young, A.B., & Penney, J.B. (1989).
The functional anatomy of basal ganglia disorders. Trends in neurosciences, 12(10), 366-75. [PubMed:2479133] [WorldCat] [DOI] - ↑ 4.0 4.1
DeLong, M.R. (1990).
Primate models of movement disorders of basal ganglia origin. Trends in neurosciences, 13(7), 281-5. [PubMed:1695404] [WorldCat] [DOI] - ↑ 5.0 5.1
Nambu, A., Tokuno, H., Hamada, I., Kita, H., Imanishi, M., Akazawa, T., ..., & Hasegawa, N. (2000).
Excitatory cortical inputs to pallidal neurons via the subthalamic nucleus in the monkey. Journal of neurophysiology, 84(1), 289-300. [PubMed:10899204] [WorldCat] [DOI] - ↑
Nambu, A., Tokuno, H., & Takada, M. (2002).
Functional significance of the cortico-subthalamo-pallidal 'hyperdirect' pathway. Neuroscience research, 43(2), 111-7. [PubMed:12067746] [WorldCat] [DOI] - ↑
Nambu, A., Takada, M., Inase, M., & Tokuno, H. (1996).
Dual somatotopical representations in the primate subthalamic nucleus: evidence for ordered but reversed body-map transformations from the primary motor cortex and the supplementary motor area. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(8), 2671-83. [PubMed:8786443] [WorldCat] - ↑
Nambu, A. (2011).
Somatotopic organization of the primate Basal Ganglia. Frontiers in neuroanatomy, 5, 26. [PubMed:21541304] [PMC] [WorldCat] [DOI] - ↑
Georgopoulos, A.P., DeLong, M.R., & Crutcher, M.D. (1983).
Relations between parameters of step-tracking movements and single cell discharge in the globus pallidus and subthalamic nucleus of the behaving monkey. The Journal of neuroscience : the official journal of the Society for Neuroscience, 3(8), 1586-98. [PubMed:6875658] [WorldCat] - ↑ W C Miller, M R DeLong
Altered tonic activity of neurons in the globus pallidus and subthalamic nucleus in the primate MPTP model of parkinsonism. In: The Basal Ganglia II: Structure and Function-Current Concepts, ed by Carpenter MB, Jayaraman A,
Plenum, New York, 1986, pp. 415-427 - ↑
Bergman, H., Wichmann, T., & DeLong, M.R. (1990).
Reversal of experimental parkinsonism by lesions of the subthalamic nucleus. Science (New York, N.Y.), 249(4975), 1436-8. [PubMed:2402638] [WorldCat] [DOI] - ↑ 12.0 12.1 AL Benabid, J Mitrofanis, S Chabardes et al.
Subthalamic nucleus stimulation for Parkinson's disease. In: Textbook of Stereotactic and Functional Neurosurgery, ed by Lozano AM, Gildenberg PL, Tasker RR,
Springer, Berlin, 2009, pp. 1603-1630 - ↑
Nambu, A. (2008).
Seven problems on the basal ganglia. Current opinion in neurobiology, 18(6), 595-604. [PubMed:19081243] [WorldCat] [DOI] - ↑
Brown, P. (2007).
Abnormal oscillatory synchronisation in the motor system leads to impaired movement. Current opinion in neurobiology, 17(6), 656-64. [PubMed:18221864] [WorldCat] [DOI]