「セラミド」の版間の差分
細 →アポトーシス |
|||
| 50行目: | 50行目: | ||
== 細胞機能 == | == 細胞機能 == | ||
=== セラミドドメイン === | === セラミドドメイン === | ||
セラミドは疎水性相互作用と水素結合による分子間の相互作用が強く、セラミドの豊富な[[膜ドメイン]]を形成することが知られている<ref name=Zhang2009><pubmed>18786504</pubmed></ref>。膜中のセラミド濃度は通常非常に低い (リン脂質の0.1-1 %)<ref name=Hannun2011><pubmed>21693702</pubmed></ref>が、スフィンゴミエリンをセラミドに代謝するスフィンゴミエリナーゼは局所的な[[セラミドドメイン]]の形成に関与すると考えられる。セラミドドメインは、様々なシグナルタンパク質のクラスター化を促進する。例えば[[デスレセプター]]として知られる[[CD95]]はセラミドのドメイン形成によってシグナルが100倍増幅することが報告されている <ref name=Grassme2003><pubmed>12934106</pubmed></ref>。 | |||
=== アポトーシス === | === アポトーシス === | ||
アポトーシスは生体の正常な発達と[[恒常性]]維持における根源的なメカニズムである。その機能破綻は[[神経変性疾患]]や[[がん]]など、様々な疾患の原因となる。セラミド豊富なドメインの関連するシグナルは、[[CD95]]、[[CD40]]、[[DR5]]、[[FcgRII]]、[[PAF受容体]]、[[CD14]]、[[黄色ブドウ球菌]]、[[淋菌]]、[[ライノウィルス]]感染などによるアポトーシスを誘導することが知られている<ref name=Bollinger2005><pubmed>16226325</pubmed></ref><ref name=Zhang2009><pubmed>18786504</pubmed></ref>。その制御機構はドメイン形成を介した受容体クラスター形成の促進に伴うシグナル伝達の制御だと考えられているが、その制御機構は複雑で未だに議論の的である<ref name=Froissart2025><pubmed>40106870</pubmed></ref><ref name=Kolesnick1999><pubmed>10366847</pubmed></ref><ref name=Obeid1993><pubmed>8456305</pubmed></ref>。例えば、セラミドの上昇はアポトーシスを誘導する<ref name=Novgorodov2005><pubmed>15722351</pubmed></ref><ref name=Obeid1993><pubmed>8456305</pubmed></ref>。一方で、その枯渇はアポトーシスの進展を抑制することもある <ref name=Bose1995><pubmed>7634330</pubmed></ref><ref name=Dbaibo2001><pubmed>11513845</pubmed></ref><ref name=Santana1996><pubmed>8706124</pubmed></ref>。セラミド合成の最初のステップである[[セリンパルミトイル基転移酵素]] ([[セリンパルミトイルトランスフェラーゼ]])を阻害する[[ISP-1]]によるセラミド合成の阻害は[[プルキンエ神経]]細胞にアポトーシスと異常な[[神経突起]]を伴う分化を誘導するが、他の脳神経細胞には影響を及ぼさない<ref name=Furuya1998><pubmed>9648886</pubmed></ref>。また、[[NGF]]枯渇によって誘導される[[交感神経系]]の細胞のアポトーシスには保護的に働くなど、細胞によっても作用や機序が異なる<ref name=Nair2000><pubmed>10713735</pubmed></ref>。このように、セラミド依存性のアポトーシスは中枢神経系の機能に重要な役割を果たしていると考えられる。 | アポトーシスは生体の正常な発達と[[恒常性]]維持における根源的なメカニズムである。その機能破綻は[[神経変性疾患]]や[[がん]]など、様々な疾患の原因となる。セラミド豊富なドメインの関連するシグナルは、[[CD95]]、[[CD40]]、[[DR5]]、[[FcgRII]]、[[PAF受容体]]、[[CD14]]、[[黄色ブドウ球菌]]、[[淋菌]]、[[ライノウィルス]]感染などによるアポトーシスを誘導することが知られている<ref name=Bollinger2005><pubmed>16226325</pubmed></ref><ref name=Zhang2009><pubmed>18786504</pubmed></ref>。その制御機構はドメイン形成を介した受容体クラスター形成の促進に伴うシグナル伝達の制御だと考えられているが、その制御機構は複雑で未だに議論の的である<ref name=Froissart2025><pubmed>40106870</pubmed></ref><ref name=Kolesnick1999><pubmed>10366847</pubmed></ref><ref name=Obeid1993><pubmed>8456305</pubmed></ref>。例えば、セラミドの上昇はアポトーシスを誘導する<ref name=Novgorodov2005><pubmed>15722351</pubmed></ref><ref name=Obeid1993><pubmed>8456305</pubmed></ref>。一方で、その枯渇はアポトーシスの進展を抑制することもある <ref name=Bose1995><pubmed>7634330</pubmed></ref><ref name=Dbaibo2001><pubmed>11513845</pubmed></ref><ref name=Santana1996><pubmed>8706124</pubmed></ref>。セラミド合成の最初のステップである[[セリンパルミトイル基転移酵素]] ([[セリンパルミトイルトランスフェラーゼ]])を阻害する[[ISP-1]]によるセラミド合成の阻害は[[プルキンエ神経]]細胞にアポトーシスと異常な[[神経突起]]を伴う分化を誘導するが、他の脳神経細胞には影響を及ぼさない<ref name=Furuya1998><pubmed>9648886</pubmed></ref>。また、[[NGF]]枯渇によって誘導される[[交感神経系]]の細胞のアポトーシスには保護的に働くなど、細胞によっても作用や機序が異なる<ref name=Nair2000><pubmed>10713735</pubmed></ref>。このように、セラミド依存性のアポトーシスは中枢神経系の機能に重要な役割を果たしていると考えられる。 | ||
2025年6月3日 (火) 22:24時点における最新版
高橋 耕太、小林 俊秀
ストラスブール大学薬学部
DOI:10.14931/bsd.11082 原稿受付日:2025年4月30日 原稿完成日:2025年5月18日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英:ceramide 独:Ceramide 仏:céramide
セラミドはスフィンゴシンと脂肪酸がアミド結合で結合した脂質の一つで、生体膜に存在する。すべてのスフィンゴ脂質の中間体であることから、その合成・代謝は生体膜の脂質組成を決める鍵分子である。また構造上の特徴から、クラスターを形成し膜ドメインを形成する。セラミドドメインの形成により膜の湾曲や膜小胞の輸送が制御され、アポトーシスなどのシグナル伝達のプラットフォームとなる。セラミド代謝の異常は様々な神経変性疾患に認められ、その病態との関連が知られている。
セラミドとは
生体膜は、グリセロリン脂質、中性脂質(コレステロール等)、スフィンゴ脂質などによって構成されている。そのなかで、スフィンゴ脂質はスフィンゴシン塩基を基本骨格にもつ脂質の総称であり、スフィンゴシン、セラミド、スフィンゴ糖脂質、スフィンゴシン1-リン酸、セラミド-1-リン酸やスフィンゴミエリンなどがある。なかでもセラミドは脳に最も多く認められる他にも、さまざまな臓器に認められる [1]。
小胞体、ミトコンドリアでde novo合成されたセラミドはゴルジ体内腔においてスフィンゴミエリンや糖鎖の付加された複雑な複合スフィンゴ糖脂質へと変化する[2]。一方で異化代謝経路も存在し、スフィンゴミエリン、スフィンゴ糖脂質の代謝によってもセラミドが生成する (図)。したがって、これら合成系と分解系の酵素群によって細胞内のセラミド量は時空間的に巧妙に制御されている。
尚、広義には皮膚のバリア機能を担うセラミドは多様な分子種が存在するが[3]、ここでは下記の構造を持つ狭義の意味でのセラミドに内容を絞って解説する。
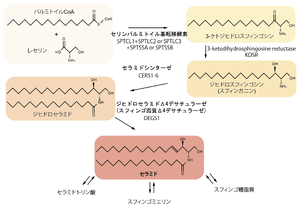
de novo合成経路に加え、セラミド-1-リン酸、スフィンゴミエリン、スフィンゴ糖脂質からの異化代謝経路も存在する。
構造
セラミドは、スフィンゴシン(sphingosine)と脂肪酸(fatty acid)からなるアミド化合物である。脂肪酸は長鎖脂肪酸C16-22、極長鎖脂肪酸C22-24が多いが、ケラチノサイトや精子細胞の分化や成熟においてはC26-36の極長鎖脂肪酸も認められる[4]。構造上、リン脂質、スフィンゴミエリン、複合スフィンゴ糖脂質と比べて極性頭部が小さい (水溶性が低い) こと、アシル基の飽和度が高い (流動性の低い、より硬い膜環境を好む) ことなどがあげられる。
生合成・代謝
セラミドはde novo合成あるいは複合スフィンゴ脂質の加水分解によって産生される (図)。腫瘍壊死因子(TNF)やFasなどによる加水分解酵素の活性化によるセラミドの産生は数分以内、一方で血清飢餓、TNF、Fas刺激後のde novo合成にかかる時間は数時間だと考えられている[5]。
De novo合成経路
セラミドは小胞体とミトコンドリアの細胞質側でパルミトイルCoAとL-セリンからスフィンガニン、ジヒドロセラミドを経て合成される。多くの他の合成酵素がひとつ、ないし二つのアイソフォームを持つのに対して、ジヒドロセラミドを合成するセラミドシンターゼ (CerS) はCerS1-6の六つのアイソフォームがあり、合成に利用するアシル基の長さと組織発現が異なっているとこから、それぞれのアシル基/組織特異性が細胞におけるセラミド種の分布の違いと機能を制御している[6][7]。例えば、CerS1はC18セラミドの合成に特異的であり、脳、筋肉のみに発現する。一方、CerS2は主にC20-26の長鎖セラミドの合成に特異的で、髄鞘形成時にオリゴデンドロサイトとシュワン細胞に最も高い発現を示す。CerS1と異なりCerS2は広く多くの組織に分布する [1]。
小胞体の細胞質側で合成されたセラミドはCERTと呼ばれる脂質輸送体によってゴルジ体へと運ばれ、内腔に移行した後、スフィンゴミエリンや複合糖脂質が合成されていく[8][9]。このセラミドのゴルジ体細胞質側から内腔への移行のメカニズムは知られていない。
異化代謝経路
セラミドはスフィンゴミエリンやスフィンゴ糖脂質の加水分解によっても産生される。
スフィンゴミエリンからセラミドへの代謝はスフィンゴミエリナーゼ (SMase) が触媒している [10]。至適pH、細胞内局在の異なるいくつかのSMaseが同定されている。
酸性スフィンゴミエリナーゼ
酸性スフィンゴミエリナーゼ (acid SMase; aSMase) はpH4.5-5で酵素活性を発揮し、リソソーム内腔でスフィンゴミエリンの代謝を制御していることが知られている [11] 。先天性脳、肝臓疾患であるNiemann-Pick病タイプAの原因遺伝子であり、酵素の欠陥により体内の様々な臓器にスフィンゴミエリンが蓄積する [12] 。酸性スフィンゴミエリナーゼは細胞外に分泌され細胞表面のスフィンゴミエリンを分解することも報告されている [13]。
中性スフィンゴミエリナーゼ
中性で活性を示す中性スフィンゴミエリナーゼ (neutral SMase; nSMase)もいくつか知られており、nSMaseI、nSMaseIIは小胞体膜、nSMaseIIIは小胞体とゴルジ体膜細胞質側に局在する。いずれもそれぞれの局在場所で局所的なセラミドのドメインを形成することで、小胞の形成、輸送、融合に関わっていると考えられる [14][15]。
代謝経路
セラミダーゼ
加水分解酵素セラミダーゼ(ceramidase; CDase)により分解され、スフィンゴシンと脂肪酸に代謝される。これらは再度セラミドシンターゼによって合成されることでも (サルベージ経路) セラミドの量は調節される。いくつかのセラミダーゼが同定されており、それらは細胞内局在と至適pHが異なる。酸性セラミダーゼはリソソーム、中性セラミダーゼはミトコンドリア、塩基性セラミダーゼはゴルジ体および小胞体に局在すると報告されている [16][17][18]。
セラミドキナーゼ
セラミドキナーゼ (CerK) によってセラミド-1-リン酸へと代謝される経路も存在する。ゴルジ体でリン酸化されたセラミド-1-リン酸は特異的な輸送タンパク質によって形質膜や核など、種々の細胞内小器官に運ばれ、シグナル伝達にも関与する [19][20]。例えば、セラミド-1-リン酸は種々の細胞種でアポトーシスに抑制的に作用することが知られている。ゆえに、CerKは細胞増殖と生存に機能すると考えられている。この他、セラミド-1-リン酸に制御されるシグナル伝達は、MEKs、ERKs、PI3K、NF-κB、mTOR、JNK、PKCaなど多数報告されている [19]。
短鎖セラミドと蛍光セラミド類似体
アシル基の短い (C2、C6) セラミドは天然のセラミドと異なり細胞膜を透過する。内在性のC2セラミドが脳や肝臓に少量存在することが知られているが、その起源や生理的な意義はよく分かっていない [21]。一方で、C2、C6短鎖セラミドを外から細胞に加えると、数時間内に内在性の長鎖セラミドの濃度が上昇し、様々なシグナルが誘導されることから、短鎖セラミドはセラミドを介したシグナル伝達の研究に用いられてきた [22][23]。
蛍光標識された短鎖(C5-6)セラミド類似体もその代謝と細胞内動態の追跡や細胞内小器官の可視化に使用されている [24]。細胞内でのセラミドの動態は用いる蛍光標識により異なり、培地に加えたニトロベンゾオキサジアゾール(NBD)標識されたN-(epsilon-7-nitrobenz-2-oxa-1,3-diazol-4-yl-aminocaproyl)-D-erythro-sphingosine (C6-NBD-Cer) は自発的にトランスゴルジネットワークに移行するが、トランスゴルジネットワークに集積するためにはトランスゴルジネットワークのコレステロールが重要な役割を果たしている [25]。 一方ボロンジピロメテン (BODIPY)標識したN-(4,4-difluoro-5,7-dimethyl-4-bora-3a,4a-diaza-s-indacene-3-pentanoyl) sphingosine (BODIPY-FL-C5-Cer) はCERT依存的に細胞質からトランスゴルジネットワークに輸送される [26]。赤外域に蛍光を持つクマリン誘導体であるCOUPY標識の蛍光セラミド類似体はエンドソーム、リソソームに局在する [27]。
細胞機能
セラミドドメイン
セラミドは疎水性相互作用と水素結合による分子間の相互作用が強く、セラミドの豊富な膜ドメインを形成することが知られている[28]。膜中のセラミド濃度は通常非常に低い (リン脂質の0.1-1 %)[29]が、スフィンゴミエリンをセラミドに代謝するスフィンゴミエリナーゼは局所的なセラミドドメインの形成に関与すると考えられる。セラミドドメインは、様々なシグナルタンパク質のクラスター化を促進する。例えばデスレセプターとして知られるCD95はセラミドのドメイン形成によってシグナルが100倍増幅することが報告されている [30]。
アポトーシス
アポトーシスは生体の正常な発達と恒常性維持における根源的なメカニズムである。その機能破綻は神経変性疾患やがんなど、様々な疾患の原因となる。セラミド豊富なドメインの関連するシグナルは、CD95、CD40、DR5、FcgRII、PAF受容体、CD14、黄色ブドウ球菌、淋菌、ライノウィルス感染などによるアポトーシスを誘導することが知られている[31][28]。その制御機構はドメイン形成を介した受容体クラスター形成の促進に伴うシグナル伝達の制御だと考えられているが、その制御機構は複雑で未だに議論の的である[32][33][34]。例えば、セラミドの上昇はアポトーシスを誘導する[35][34]。一方で、その枯渇はアポトーシスの進展を抑制することもある [36][37][38]。セラミド合成の最初のステップであるセリンパルミトイル基転移酵素 (セリンパルミトイルトランスフェラーゼ)を阻害するISP-1によるセラミド合成の阻害はプルキンエ神経細胞にアポトーシスと異常な神経突起を伴う分化を誘導するが、他の脳神経細胞には影響を及ぼさない[39]。また、NGF枯渇によって誘導される交感神経系の細胞のアポトーシスには保護的に働くなど、細胞によっても作用や機序が異なる[40]。このように、セラミド依存性のアポトーシスは中枢神経系の機能に重要な役割を果たしていると考えられる。
セラミドは異なった経路、細胞内オルガネラを介してアポトーシスを誘導する。一つはスフィンゴミエリナーゼによるスフィンゴミエリンの加水分解、もう一つはde novo合成である。中性スフィンゴミエリナーゼと酸性スフィンゴミエリナーゼは腫瘍壊死因子によって活性化されるが、それぞれ異なったメカニズムでセラミドを産生しアポトーシスを制御することが知られている[41][42]。
老化・加齢
セラミドは皮膚のバリア機能や組織修復促進の役割も持つ。加齢に伴う皮膚の線維化や組織修復能の低下は、酸性スフィンゴミエリナーゼとセラミドシンターゼの活性低下に伴うセラミドの低下によるものであると考えられる。また、セラミドはPP1やPPA2などの脱リン酸化酵素を活性化し、p21、pRbの発現を調節することで細胞の老化を制御する。このように、セラミドによる組織機能の維持や細胞老化の制御は、正常な細胞・組織恒常性を制御し、インスリン感受性、血管系の維持、免疫系の維持に関わっている [43]。
疾患との関わり
全てのスフィンゴ脂質はセラミドから合成され、セラミドに分解される。ゆえに、セラミドはスフィンゴ脂質代謝の中心的な存在である。この代謝に関連する合成・分解酵素の欠損は、リソソームへの異常なスフィンゴ糖脂質の蓄積をもたらす。特に他の臓器に比べ、脂質合成が盛んな脳が脂質異常の病態の表現型を呈する。
Farber病
セラミダーゼCDase活性の欠損はFarber病とよばれる遺伝性神経変性疾患の原因となる[44]。酸性セラミダーゼ遺伝子であるASAHの欠損により、セラミドの合成は正常であるが、複雑なスフィンゴ脂質が分解されず、リソソームに蓄積する。その結果、脳におけるセラミドの蓄積により神経機能が異常をきたす[45][46]。臨床症状は多様で、重篤な症状で乳幼児期に死亡する場合もあれば、発達障害の場合、あるいは大人になってから発症する場合もある[46]。
アルツハイマー病
セラミドはアルツハイマー病の初期段階において増加、後期に減少が認められ[30][47][48]、その増加により神経細胞やオリゴデンドロサイトの細胞死が亢進されることが知られている[49]。ゆえに、初期段階におけるセラミドの蓄積は病態進展を防ぐ標的となる可能性が考えられる。
パーキンソン病
パーキンソン病においてもレビー小体の出現に伴い、セラミド代謝の異常が認められる[50]。セラミドの代謝酵素の阻害によって、ドーパミン作動性のニューロンのα-シヌクレインの量が低下することが知られているが、これは分解酵素カテプシンDの活性がセラミドにより活性化するためだと考えられている[51]。また、セラミドを含む脂質ラフトによってα-シヌクレインのプロセシングと蓄積が制御されているとも考えられている[52]
関連項目
参考文献
- ↑ 1.0 1.1
Schiffmann, S., Birod, K., Männich, J., Eberle, M., Wegner, M.S., Wanger, R., ..., & Grösch, S. (2013).
Ceramide metabolism in mouse tissue. The international journal of biochemistry & cell biology, 45(8), 1886-94. [PubMed:23792024] [WorldCat] [DOI] - ↑
Yamaji, T., & Hanada, K. (2015).
Sphingolipid metabolism and interorganellar transport: localization of sphingolipid enzymes and lipid transfer proteins. Traffic (Copenhagen, Denmark), 16(2), 101-22. [PubMed:25382749] [WorldCat] [DOI] - ↑
Kihara, A. (2016).
Synthesis and degradation pathways, functions, and pathology of ceramides and epidermal acylceramides. Progress in lipid research, 63, 50-69. [PubMed:27107674] [WorldCat] [DOI] - ↑
Castro, B.M., Prieto, M., & Silva, L.C. (2014).
Ceramide: a simple sphingolipid with unique biophysical properties. Progress in lipid research, 54, 53-67. [PubMed:24513486] [WorldCat] [DOI] - ↑
Hannun, Y.A. (1996).
Functions of ceramide in coordinating cellular responses to stress. Science (New York, N.Y.), 274(5294), 1855-9. [PubMed:8943189] [WorldCat] [DOI] - ↑
Pewzner-Jung, Y., Ben-Dor, S., & Futerman, A.H. (2006).
When do Lasses (longevity assurance genes) become CerS (ceramide synthases)?: Insights into the regulation of ceramide synthesis. The Journal of biological chemistry, 281(35), 25001-5. [PubMed:16793762] [WorldCat] [DOI] - ↑
Riebeling, C., Allegood, J.C., Wang, E., Merrill, A.H., & Futerman, A.H. (2003).
Two mammalian longevity assurance gene (LAG1) family members, trh1 and trh4, regulate dihydroceramide synthesis using different fatty acyl-CoA donors. The Journal of biological chemistry, 278(44), 43452-9. [PubMed:12912983] [WorldCat] [DOI] - ↑
Hanada, K. (2017).
Ceramide Transport from the Endoplasmic Reticulum to the Trans Golgi Region at Organelle Membrane Contact Sites. Advances in experimental medicine and biology, 997, 69-81. [PubMed:28815522] [WorldCat] [DOI] - ↑
Hanada, K. (2018).
Lipid transfer proteins rectify inter-organelle flux and accurately deliver lipids at membrane contact sites. Journal of lipid research, 59(8), 1341-1366. [PubMed:29884707] [PMC] [WorldCat] [DOI] - ↑
Reynolds, C.P., Maurer, B.J., & Kolesnick, R.N. (2004).
Ceramide synthesis and metabolism as a target for cancer therapy. Cancer letters, 206(2), 169-80. [PubMed:15013522] [WorldCat] [DOI] - ↑
Schissel, S.L., Keesler, G.A., Schuchman, E.H., Williams, K.J., & Tabas, I. (1998).
The cellular trafficking and zinc dependence of secretory and lysosomal sphingomyelinase, two products of the acid sphingomyelinase gene. The Journal of biological chemistry, 273(29), 18250-9. [PubMed:9660788] [WorldCat] [DOI] - ↑
Otterbach, B., & Stoffel, W. (1995).
Acid sphingomyelinase-deficient mice mimic the neurovisceral form of human lysosomal storage disease (Niemann-Pick disease). Cell, 81(7), 1053-61. [PubMed:7600574] [WorldCat] [DOI] - ↑
Kornhuber, J., Rhein, C., Müller, C.P., & Mühle, C. (2015).
Secretory sphingomyelinase in health and disease. Biological chemistry, 396(6-7), 707-36. [PubMed:25803076] [WorldCat] [DOI] - ↑
Wakeham, D.E., Ybe, J.A., Brodsky, F.M., & Hwang, P.K. (2000).
Molecular structures of proteins involved in vesicle coat formation. Traffic (Copenhagen, Denmark), 1(5), 393-8. [PubMed:11208125] [WorldCat] [DOI] - ↑
Ybe, J.A., Wakeham, D.E., Brodsky, F.M., & Hwang, P.K. (2000).
Molecular structures of proteins involved in vesicle fusion. Traffic (Copenhagen, Denmark), 1(6), 474-9. [PubMed:11208133] [WorldCat] [DOI] - ↑
Bär, J., Linke, T., Ferlinz, K., Neumann, U., Schuchman, E.H., & Sandhoff, K. (2001).
Molecular analysis of acid ceramidase deficiency in patients with Farber disease. Human mutation, 17(3), 199-209. [PubMed:11241842] [WorldCat] [DOI] - ↑
El Bawab, S., Bielawska, A., & Hannun, Y.A. (1999).
Purification and characterization of a membrane-bound nonlysosomal ceramidase from rat brain. The Journal of biological chemistry, 274(39), 27948-55. [PubMed:10488143] [WorldCat] [DOI] - ↑
Mao, C., Zhou, M., & Uckun, F.M. (2001).
Crystal structure of Bruton's tyrosine kinase domain suggests a novel pathway for activation and provides insights into the molecular basis of X-linked agammaglobulinemia. The Journal of biological chemistry, 276(44), 41435-43. [PubMed:11527964] [WorldCat] [DOI] - ↑ 19.0 19.1
Gomez-Muñoz, A., Presa, N., Gomez-Larrauri, A., Rivera, I.G., Trueba, M., & Ordoñez, M. (2016).
Control of inflammatory responses by ceramide, sphingosine 1-phosphate and ceramide 1-phosphate. Progress in lipid research, 61, 51-62. [PubMed:26703189] [WorldCat] [DOI] - ↑
Simanshu, D.K., Kamlekar, R.K., Wijesinghe, D.S., Zou, X., Zhai, X., Mishra, S.K., ..., & Patel, D.J. (2013).
Non-vesicular trafficking by a ceramide-1-phosphate transfer protein regulates eicosanoids. Nature, 500(7463), 463-7. [PubMed:23863933] [PMC] [WorldCat] [DOI] - ↑
Van Overloop, H., Denizot, Y., Baes, M., & Van Veldhoven, P.P. (2007).
On the presence of C2-ceramide in mammalian tissues: possible relationship to etherphospholipids and phosphorylation by ceramide kinase. Biological chemistry, 388(3), 315-24. [PubMed:17338639] [WorldCat] [DOI] - ↑
Hannun, Y.A., & Luberto, C. (2000).
Ceramide in the eukaryotic stress response. Trends in cell biology, 10(2), 73-80. [PubMed:10652518] [WorldCat] [DOI] - ↑
Ogretmen, B., Pettus, B.J., Rossi, M.J., Wood, R., Usta, J., Szulc, Z., ..., & Hannun, Y.A. (2002).
Biochemical mechanisms of the generation of endogenous long chain ceramide in response to exogenous short chain ceramide in the A549 human lung adenocarcinoma cell line. Role for endogenous ceramide in mediating the action of exogenous ceramide. The Journal of biological chemistry, 277(15), 12960-9. [PubMed:11815611] [WorldCat] [DOI] - ↑
Lipsky, N.G., & Pagano, R.E. (1985).
A vital stain for the Golgi apparatus. Science (New York, N.Y.), 228(4700), 745-7. [PubMed:2581316] [WorldCat] [DOI] - ↑
Pagano, R.E., Sepanski, M.A., & Martin, O.C. (1989).
Molecular trapping of a fluorescent ceramide analogue at the Golgi apparatus of fixed cells: interaction with endogenous lipids provides a trans-Golgi marker for both light and electron microscopy. The Journal of cell biology, 109(5), 2067-79. [PubMed:2478562] [PMC] [WorldCat] [DOI] - ↑
Fukasawa, M., Nishijima, M., & Hanada, K. (1999).
Genetic evidence for ATP-dependent endoplasmic reticulum-to-Golgi apparatus trafficking of ceramide for sphingomyelin synthesis in Chinese hamster ovary cells. The Journal of cell biology, 144(4), 673-85. [PubMed:10037789] [PMC] [WorldCat] [DOI] - ↑
Izquierdo, E., López-Corrales, M., Abad-Montero, D., Rovira, A., Fabriàs, G., Bosch, M., ..., & Marchán, V. (2022).
Fluorescently Labeled Ceramides and 1-Deoxyceramides: Synthesis, Characterization, and Cellular Distribution Studies. The Journal of organic chemistry, 87(24), 16351-16367. [PubMed:36441972] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1
Zhang, Y., Li, X., Becker, K.A., & Gulbins, E. (2009).
Ceramide-enriched membrane domains--structure and function. Biochimica et biophysica acta, 1788(1), 178-83. [PubMed:18786504] [WorldCat] [DOI] - ↑
Hannun, Y.A., & Obeid, L.M. (2011).
Many ceramides. The Journal of biological chemistry, 286(32), 27855-62. [PubMed:21693702] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Grassmé, H., Cremesti, A., Kolesnick, R., & Gulbins, E. (2003).
Ceramide-mediated clustering is required for CD95-DISC formation. Oncogene, 22(35), 5457-70. [PubMed:12934106] [WorldCat] [DOI] - ↑
Bollinger, C.R., Teichgräber, V., & Gulbins, E. (2005).
Ceramide-enriched membrane domains. Biochimica et biophysica acta, 1746(3), 284-94. [PubMed:16226325] [WorldCat] [DOI] - ↑
Froissart, R., Pettazzoni, M., Pagan, C., Levade, T., & Vanier, M.T. (2025).
Acid sphingomyelinase deficiency: Laboratory diagnosis, genetic and epidemiologic aspects of a 50-year French cohort. Molecular genetics and metabolism, 145(1), 109081. [PubMed:40106870] [WorldCat] [DOI] - ↑
Kolesnick, R., & Hannun, Y.A. (1999).
Ceramide and apoptosis. Trends in biochemical sciences, 24(6), 224-5; author reply 227. [PubMed:10366847] [WorldCat] [DOI] - ↑ 34.0 34.1
Obeid, L.M., Linardic, C.M., Karolak, L.A., & Hannun, Y.A. (1993).
Programmed cell death induced by ceramide. Science (New York, N.Y.), 259(5102), 1769-71. [PubMed:8456305] [WorldCat] [DOI] - ↑
Novgorodov, S.A., Szulc, Z.M., Luberto, C., Jones, J.A., Bielawski, J., Bielawska, A., ..., & Obeid, L.M. (2005).
Positively charged ceramide is a potent inducer of mitochondrial permeabilization. The Journal of biological chemistry, 280(16), 16096-105. [PubMed:15722351] [WorldCat] [DOI] - ↑
Bose, R., Verheij, M., Haimovitz-Friedman, A., Scotto, K., Fuks, Z., & Kolesnick, R. (1995).
Ceramide synthase mediates daunorubicin-induced apoptosis: an alternative mechanism for generating death signals. Cell, 82(3), 405-14. [PubMed:7634330] [WorldCat] [DOI] - ↑
Dbaibo, G.S., El-Assaad, W., Krikorian, A., Liu, B., Diab, K., Idriss, N.Z., ..., & Hannun, Y.A. (2001).
Ceramide generation by two distinct pathways in tumor necrosis factor alpha-induced cell death. FEBS letters, 503(1), 7-12. [PubMed:11513845] [WorldCat] [DOI] - ↑
Santana, P., Peña, L.A., Haimovitz-Friedman, A., Martin, S., Green, D., McLoughlin, M., ..., & Kolesnick, R. (1996).
Acid sphingomyelinase-deficient human lymphoblasts and mice are defective in radiation-induced apoptosis. Cell, 86(2), 189-99. [PubMed:8706124] [WorldCat] [DOI] - ↑
Furuya, S., Mitoma, J., Makino, A., & Hirabayashi, Y. (1998).
Ceramide and its interconvertible metabolite sphingosine function as indispensable lipid factors involved in survival and dendritic differentiation of cerebellar Purkinje cells. Journal of neurochemistry, 71(1), 366-77. [PubMed:9648886] [WorldCat] [DOI] - ↑
Nair, P., Tammariello, S.P., & Estus, S. (2000).
Ceramide selectively inhibits apoptosis-associated events in NGF-deprived sympathetic neurons. Cell death and differentiation, 7(2), 207-14. [PubMed:10713735] [WorldCat] [DOI] - ↑
Cifone, M.G., Roncaioli, P., De Maria, R., Camarda, G., Santoni, A., Ruberti, G., & Testi, R. (1995).
Multiple pathways originate at the Fas/APO-1 (CD95) receptor: sequential involvement of phosphatidylcholine-specific phospholipase C and acidic sphingomyelinase in the propagation of the apoptotic signal. The EMBO journal, 14(23), 5859-68. [PubMed:8846779] [PMC] [WorldCat] [DOI] - ↑
Wiegmann, K., Schütze, S., Machleidt, T., Witte, D., & Krönke, M. (1994).
Functional dichotomy of neutral and acidic sphingomyelinases in tumor necrosis factor signaling. Cell, 78(6), 1005-15. [PubMed:7923351] [WorldCat] [DOI] - ↑
Trayssac, M., Hannun, Y.A., & Obeid, L.M. (2018).
Role of sphingolipids in senescence: implication in aging and age-related diseases. The Journal of clinical investigation, 128(7), 2702-2712. [PubMed:30108193] [PMC] [WorldCat] [DOI] - ↑
Sugita, M., Dulaney, J.T., & Moser, H.W. (1972).
Ceramidase deficiency in Farber's disease (lipogranulomatosis). Science (New York, N.Y.), 178(4065), 1100-2. [PubMed:4678225] [WorldCat] [DOI] - ↑
Ehlert, K., Frosch, M., Fehse, N., Zander, A., Roth, J., & Vormoor, J. (2007).
Farber disease: clinical presentation, pathogenesis and a new approach to treatment. Pediatric rheumatology online journal, 5, 15. [PubMed:17603888] [PMC] [WorldCat] [DOI] - ↑ 46.0 46.1
Yu, F.P.S., Amintas, S., Levade, T., & Medin, J.A. (2018).
Acid ceramidase deficiency: Farber disease and SMA-PME. Orphanet journal of rare diseases, 13(1), 121. [PubMed:30029679] [PMC] [WorldCat] [DOI] - ↑
Katsel, P., Li, C., & Haroutunian, V. (2007).
Gene expression alterations in the sphingolipid metabolism pathways during progression of dementia and Alzheimer's disease: a shift toward ceramide accumulation at the earliest recognizable stages of Alzheimer's disease? Neurochemical research, 32(4-5), 845-56. [PubMed:17342407] [WorldCat] [DOI] - ↑
Zhang, S.C., Ge, B., & Duncan, I.D. (1999).
Adult brain retains the potential to generate oligodendroglial progenitors with extensive myelination capacity. Proceedings of the National Academy of Sciences of the United States of America, 96(7), 4089-94. [PubMed:10097168] [PMC] [WorldCat] [DOI] - ↑
Jana, A., Hogan, E.L., & Pahan, K. (2009).
Ceramide and neurodegeneration: susceptibility of neurons and oligodendrocytes to cell damage and death. Journal of the neurological sciences, 278(1-2), 5-15. [PubMed:19147160] [PMC] [WorldCat] [DOI] - ↑
Rocha, E.M., Smith, G.A., Park, E., Cao, H., Graham, A.R., Brown, E., ..., & Isacson, O. (2015).
Sustained Systemic Glucocerebrosidase Inhibition Induces Brain α-Synuclein Aggregation, Microglia and Complement C1q Activation in Mice. Antioxidants & redox signaling, 23(6), 550-64. [PubMed:26094487] [PMC] [WorldCat] [DOI] - ↑
Paciotti, S., Albi, E., Parnetti, L., & Beccari, T. (2020).
Lysosomal Ceramide Metabolism Disorders: Implications in Parkinson's Disease. Journal of clinical medicine, 9(2). [PubMed:32098196] [PMC] [WorldCat] [DOI] - ↑
Fortin, D.L., Troyer, M.D., Nakamura, K., Kubo, S., Anthony, M.D., & Edwards, R.H. (2004).
Lipid rafts mediate the synaptic localization of alpha-synuclein. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(30), 6715-23. [PubMed:15282274] [PMC] [WorldCat] [DOI]