「コンドロイチン硫酸プロテオグリカン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 1行目: | 1行目: | ||
[[Image:CSunits.002.jpg|thumb|400px|'''図1''']] | [[Image:CSunits.002.jpg|thumb|400px|'''図1''']] | ||
発生過程の神経細胞は軸索を伸長させ正確な回路網を形成する。神経回路形成においてはガイダンス因子とそのレセプターの作用が正確な神経軸索路の形成をみちびくことがしられている。軸索が神経系の様々な地点で経路を選択する際にコンドロイチン硫酸プロテオグリカン(CSPG)は軸索ガイダンス因子としてやその調節因子として働くことが知られている(Ichijo, 2004<ref name=ref1><pubmed>15247486 </pubmed></ref>; Holt and Dickson, 2005<ref name=ref2><pubmed>15848796</pubmed></ref>; Carulli et al., 2005<ref name=ref3><pubmed></pubmed></ref>)。CSPGはコアタンパク質とコンドロイチン硫酸(CS)という糖鎖からなるハイブリッド分子である。CSPGの機能はCSに由来した性質と、コアタンパクに由来するものに分けて考えることができる。コアタンパクの機能は、分子間相互作用を介して細胞外マトリックスを構成する。CSPGとCSの一般的な事柄やその生化学については "Glycoforum"<ref>http://www.glycoforum.gr.jp/indexJ.html</ref>の詳しい解説が役立つ。 | |||
CSはグルクロン酸(GlcA)とNアセチルガラクトサミン(GalNAc)の二糖ユニットが繰り返した直鎖の糖鎖高分子である。他の成長因子と相互作用し、機能を調節すると従来から考えられていたことに加えて、糖鎖そのものの機能が注目されている。軸索伸長に及ぼすCSの効果はおもに抑制性であることが多く、その効果はさまざまな場面で観察されている。たとえば、網膜神経節細胞の培養下の軸索伸長や、生体に於ける軸索路形成では中脳背側正中線に於けるグリア細胞蓋板や脊髄内の軸索路形成における抑制効果がよく知られている( | |||
Snow et al., 1990<ref name=ref4><pubmed></pubmed></ref>; | |||
Snow et al., 1991<ref name=ref5><pubmed></pubmed></ref>; | |||
Brittis et al., 1992<ref name=ref6><pubmed>1738848</pubmed></ref>; | |||
Brittis et al., 1994<ref name=ref7><pubmed>8052616</pubmed></ref>; | |||
Hoffman-Kim et al., 1998<ref name=ref8><pubmed>9671675</pubmed></ref>; | |||
Chung et al., 2000<ref name=ref9><pubmed></pubmed></ref>; | |||
Yick et al., 2000<ref name=ref10><pubmed>10790883</pubmed></ref>; | |||
Ichijo and Kawabata, 2001<ref name=ref11><pubmed>11717364</pubmed></ref>; | |||
Moon et al., 2001<ref name=ref12><pubmed></pubmed></ref>; | |||
Becker and Becker, 2002<ref name=ref13><pubmed></pubmed></ref>; | |||
Walz et al., 2002<ref name=ref14><pubmed></pubmed></ref>; | |||
Masuda et al., 2004<ref name=ref15><pubmed></pubmed></ref>)。さらに中枢神経系が損傷したときにCSが軸索再伸長(軸索路再生)を抑制することが知られている;グリア瘢痕からCSを取り除くことで治療効果が期待されるので、CSが医薬研究開発のひとつの焦点となっている (Bradbury et al., 2002<ref name=ref16><pubmed></pubmed></ref>; | |||
Morgenstern et al., 2002<ref name=ref17><pubmed></pubmed></ref>; | |||
Busch and Silver, 2007<ref name=ref18><pubmed>17223033</pubmed></ref>; | |||
Cafferty et al., 2008<ref name=ref19><pubmed>18634577</pubmed></ref>)。 | |||
他方、CSは抑制性の効果ばかりではなく、異なる神経細胞にたいして多様な効果を示すことが報告されている。たとえば、CSは培養下の海馬神経細胞の神経突起伸長を促進し(Challacombe and Elam, 1997<ref name=ref20><pubmed>9000441</pubmed></ref>; | |||
Clement et al., 1998<ref name=ref21><pubmed></pubmed></ref>; | |||
他方、CSは抑制性の効果ばかりではなく、異なる神経細胞にたいして多様な効果を示すことが報告されている。たとえば、CSは培養下の海馬神経細胞の神経突起伸長を促進し(Challacombe and Elam, 1997; Clement et al., 1998; Clement et al. 1999; Faissner et al., 1994; Fernaud-Espinosa et al., 1994; Nadanaka et al., 1998)、ラットの網膜神経節細胞に対して標的由来栄養因子として機能することも報告されている(Huxlin et al., 1995)。マウスの一次視覚野における神経回路の可塑性におよぼすCSの効果が示されている(Lander et al., 1997; Pizzorusso et al., 2002; Pizzorusso et al., 2006; Carulli et al., 2010)。これらのことはCSPGまたはCSは一つの分子エンティティーではあるが、その中には異なった機能特異性を有する多様な分子が含まれていることを示唆している。 | Clement et al. 1999<ref name=ref22><pubmed></pubmed></ref>; | ||
Faissner et al., 1994<ref name=ref23><pubmed>7519189</pubmed></ref>; | |||
Fernaud-Espinosa et al., 1994<ref name=ref24><pubmed>7962187</pubmed></ref>; | |||
Nadanaka et al., 1998<ref name=ref25><pubmed>9837960</pubmed></ref>)、ラットの網膜神経節細胞に対して標的由来栄養因子として機能することも報告されている(Huxlin et al., 1995<ref name=ref26><pubmed></pubmed></ref>)。マウスの一次視覚野における神経回路の可塑性におよぼすCSの効果が示されている(Lander et al., 1997<ref name=ref27><pubmed>9412498</pubmed></ref>; | |||
Pizzorusso et al., 2002<ref name=ref28><pubmed>12424383</pubmed></ref>; | |||
Pizzorusso et al., 2006<ref name=ref29><pubmed>16709670</pubmed></ref>; | |||
Carulli et al., 2010<ref name=ref30><pubmed></pubmed></ref>)。これらのことはCSPGまたはCSは一つの分子エンティティーではあるが、その中には異なった機能特異性を有する多様な分子が含まれていることを示唆している。 | |||
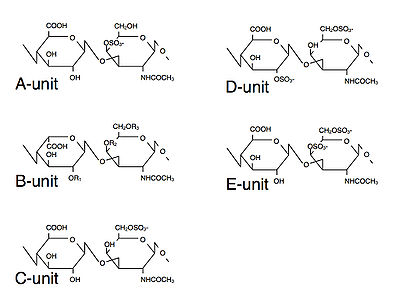
このような多様な機能はCSが構造多様性を示すこと関係があるかもしれない。CSの二糖ユニット(GlcA-GalNAc)の上の様々な位置に硫酸基の負荷が行われる結果、多様なユニットが形成されることが知られている。それらはアルファベットを冠してO-, A-, B-, C-, D-, E-unitなどと呼ばれ、これらのユニットが組み合わされてCS鎖の構造多様性が生み出される[O-unit (GlcA-GalNAc), A-unit (GlcA-GalNAc4S), C-unit (GlcA-GalNAc6S), D-unit (GlcA2S-GalNAc6S), E-unit (GlcA-GalNAc4S6S)]。イズロン酸(IdoA:GlcAのC5位のエピマー)とGalNAcの二糖が作るユニットをB-unitと呼ぶ[B-unit (IdoA-GalNAc)]。(図1) | このような多様な機能はCSが構造多様性を示すこと関係があるかもしれない。CSの二糖ユニット(GlcA-GalNAc)の上の様々な位置に硫酸基の負荷が行われる結果、多様なユニットが形成されることが知られている。それらはアルファベットを冠してO-, A-, B-, C-, D-, E-unitなどと呼ばれ、これらのユニットが組み合わされてCS鎖の構造多様性が生み出される[O-unit (GlcA-GalNAc), A-unit (GlcA-GalNAc4S), C-unit (GlcA-GalNAc6S), D-unit (GlcA2S-GalNAc6S), E-unit (GlcA-GalNAc4S6S)]。イズロン酸(IdoA:GlcAのC5位のエピマー)とGalNAcの二糖が作るユニットをB-unitと呼ぶ[B-unit (IdoA-GalNAc)]。(図1) | ||
| 14行目: | 36行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | |||
(執筆者:一條裕之 担当編集委員:大隅典子) | (執筆者:一條裕之 担当編集委員:大隅典子) | ||
2012年6月7日 (木) 11:32時点における版
発生過程の神経細胞は軸索を伸長させ正確な回路網を形成する。神経回路形成においてはガイダンス因子とそのレセプターの作用が正確な神経軸索路の形成をみちびくことがしられている。軸索が神経系の様々な地点で経路を選択する際にコンドロイチン硫酸プロテオグリカン(CSPG)は軸索ガイダンス因子としてやその調節因子として働くことが知られている(Ichijo, 2004[1]; Holt and Dickson, 2005[2]; Carulli et al., 2005[3])。CSPGはコアタンパク質とコンドロイチン硫酸(CS)という糖鎖からなるハイブリッド分子である。CSPGの機能はCSに由来した性質と、コアタンパクに由来するものに分けて考えることができる。コアタンパクの機能は、分子間相互作用を介して細胞外マトリックスを構成する。CSPGとCSの一般的な事柄やその生化学については "Glycoforum"[4]の詳しい解説が役立つ。
CSはグルクロン酸(GlcA)とNアセチルガラクトサミン(GalNAc)の二糖ユニットが繰り返した直鎖の糖鎖高分子である。他の成長因子と相互作用し、機能を調節すると従来から考えられていたことに加えて、糖鎖そのものの機能が注目されている。軸索伸長に及ぼすCSの効果はおもに抑制性であることが多く、その効果はさまざまな場面で観察されている。たとえば、網膜神経節細胞の培養下の軸索伸長や、生体に於ける軸索路形成では中脳背側正中線に於けるグリア細胞蓋板や脊髄内の軸索路形成における抑制効果がよく知られている( Snow et al., 1990[5]; Snow et al., 1991[6]; Brittis et al., 1992[7]; Brittis et al., 1994[8]; Hoffman-Kim et al., 1998[9]; Chung et al., 2000[10]; Yick et al., 2000[11]; Ichijo and Kawabata, 2001[12]; Moon et al., 2001[13]; Becker and Becker, 2002[14]; Walz et al., 2002[15]; Masuda et al., 2004[16])。さらに中枢神経系が損傷したときにCSが軸索再伸長(軸索路再生)を抑制することが知られている;グリア瘢痕からCSを取り除くことで治療効果が期待されるので、CSが医薬研究開発のひとつの焦点となっている (Bradbury et al., 2002[17]; Morgenstern et al., 2002[18]; Busch and Silver, 2007[19]; Cafferty et al., 2008[20])。
他方、CSは抑制性の効果ばかりではなく、異なる神経細胞にたいして多様な効果を示すことが報告されている。たとえば、CSは培養下の海馬神経細胞の神経突起伸長を促進し(Challacombe and Elam, 1997[21]; Clement et al., 1998[22]; Clement et al. 1999[23]; Faissner et al., 1994[24]; Fernaud-Espinosa et al., 1994[25]; Nadanaka et al., 1998[26])、ラットの網膜神経節細胞に対して標的由来栄養因子として機能することも報告されている(Huxlin et al., 1995[27])。マウスの一次視覚野における神経回路の可塑性におよぼすCSの効果が示されている(Lander et al., 1997[28]; Pizzorusso et al., 2002[29]; Pizzorusso et al., 2006[30]; Carulli et al., 2010[31])。これらのことはCSPGまたはCSは一つの分子エンティティーではあるが、その中には異なった機能特異性を有する多様な分子が含まれていることを示唆している。
このような多様な機能はCSが構造多様性を示すこと関係があるかもしれない。CSの二糖ユニット(GlcA-GalNAc)の上の様々な位置に硫酸基の負荷が行われる結果、多様なユニットが形成されることが知られている。それらはアルファベットを冠してO-, A-, B-, C-, D-, E-unitなどと呼ばれ、これらのユニットが組み合わされてCS鎖の構造多様性が生み出される[O-unit (GlcA-GalNAc), A-unit (GlcA-GalNAc4S), C-unit (GlcA-GalNAc6S), D-unit (GlcA2S-GalNAc6S), E-unit (GlcA-GalNAc4S6S)]。イズロン酸(IdoA:GlcAのC5位のエピマー)とGalNAcの二糖が作るユニットをB-unitと呼ぶ[B-unit (IdoA-GalNAc)]。(図1)
CSのユニット組成の違いが神経突起の伸長や、大脳皮質の層形成に異なった効果を有することが報告されているが、どの様なレベルの構造多様性がどの様に神経細胞の振る舞いに影響を与えているかという機構については不明の点が多い。近年の研究は細胞が特定のCSの構造を識別していることを示唆している(Clement et al., 1998; Nadanaka et al., 1998; Oohira et al., 2000; Ueoka et al., 2000; Gilbert et al., 2005; Properzi et al., 2005)。CS結合タンパク質が8糖(4 units)や10糖(5 units)の長さにわたる特定のユニット配列を特異的に認識することが報告されており、従来に想定されていたようなCS鎖全体の長さや負の荷電量が非特異的に影響を与えているのではないと考えられるようになった(Blanchard et al., 2007; Deepa et al., 2007a; Deepa et al., 2007b; Pothacharoen et al., 2007; Numakura et al., 2010)。これらの報告は細胞表面のCSの構造多様性を認識する受容体の探索という分野を導くこととなった。近年報告されたtransmembrane protein tyrosine phosphatase (PTPσ)とcontactin-1はCS特異的な受容体の候補分子として注目を集めている(Mikami et al., 2009; Shen et al., 2009; Coles et al., 2011)。
参考文献
- ↑
Ichijo, H. (2004).
Proteoglycans as cues for axonal guidance in formation of retinotectal or retinocollicular projections. Molecular neurobiology, 30(1), 23-33. [PubMed:15247486] [WorldCat] [DOI] - ↑
Holt, C.E., & Dickson, B.J. (2005).
Sugar codes for axons? Neuron, 46(2), 169-72. [PubMed:15848796] [PMC] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑ http://www.glycoforum.gr.jp/indexJ.html
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑
Brittis, P.A., Canning, D.R., & Silver, J. (1992).
Chondroitin sulfate as a regulator of neuronal patterning in the retina. Science (New York, N.Y.), 255(5045), 733-6. [PubMed:1738848] [WorldCat] [DOI] - ↑
Brittis, P.A., & Silver, J. (1994).
Exogenous glycosaminoglycans induce complete inversion of retinal ganglion cell bodies and their axons within the retinal neuroepithelium. Proceedings of the National Academy of Sciences of the United States of America, 91(16), 7539-42. [PubMed:8052616] [PMC] [WorldCat] [DOI] - ↑
Hoffman-Kim, D., Lander, A.D., & Jhaveri, S. (1998).
Patterns of chondroitin sulfate immunoreactivity in the developing tectum reflect regional differences in glycosaminoglycan biosynthesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(15), 5881-90. [PubMed:9671675] [PMC] [WorldCat] - ↑ Resource not found in PubMed.
- ↑
Yick, L.W., Wu, W., So, K.F., Yip, H.K., & Shum, D.K. (2000).
Chondroitinase ABC promotes axonal regeneration of Clarke's neurons after spinal cord injury. Neuroreport, 11(5), 1063-7. [PubMed:10790883] [WorldCat] [DOI] - ↑
Ichijo, H., & Kawabata, I. (2001).
Roles of the telencephalic cells and their chondroitin sulfate proteoglycans in delimiting an anterior border of the retinal pathway. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(23), 9304-14. [PubMed:11717364] [PMC] [WorldCat] - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑
Busch, S.A., & Silver, J. (2007).
The role of extracellular matrix in CNS regeneration. Current opinion in neurobiology, 17(1), 120-7. [PubMed:17223033] [WorldCat] [DOI] - ↑
Cafferty, P., & Auld, V.J. (2007).
No pun intended: future directions in invertebrate glial cell migration studies. Neuron glia biology, 3(1), 45-54. [PubMed:18634577] [WorldCat] [DOI] - ↑
Challacombe, J.F., & Elam, J.S. (1997).
Chondroitin 4-sulfate stimulates regeneration of goldfish retinal axons. Experimental neurology, 143(1), 10-7. [PubMed:9000441] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑
Faissner, A., Clement, A., Lochter, A., Streit, A., Mandl, C., & Schachner, M. (1994).
Isolation of a neural chondroitin sulfate proteoglycan with neurite outgrowth promoting properties. The Journal of cell biology, 126(3), 783-99. [PubMed:7519189] [PMC] [WorldCat] [DOI] - ↑
Fernaud-Espinosa, I., Nieto-Sampedro, M., & Bovolenta, P. (1994).
Differential effects of glycosaminoglycans on neurite outgrowth from hippocampal and thalamic neurones. Journal of cell science, 107 ( Pt 6), 1437-48. [PubMed:7962187] [WorldCat] - ↑
Nadanaka, S., Kitagawa, H., & Sugahara, K. (1998).
Demonstration of the immature glycosaminoglycan tetrasaccharide sequence GlcAbeta1-3Galbeta1-3Galbeta1-4Xyl on recombinant soluble human alpha-thrombomodulin. An oligosaccharide structure on a "part-time" proteoglycan. The Journal of biological chemistry, 273(50), 33728-34. [PubMed:9837960] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑
Lander, C., Zhang, H., & Hockfield, S. (1998).
Neurons produce a neuronal cell surface-associated chondroitin sulfate proteoglycan. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(1), 174-83. [PubMed:9412498] [WorldCat] - ↑
Pizzorusso, T., Medini, P., Berardi, N., Chierzi, S., Fawcett, J.W., & Maffei, L. (2002).
Reactivation of ocular dominance plasticity in the adult visual cortex. Science (New York, N.Y.), 298(5596), 1248-51. [PubMed:12424383] [WorldCat] [DOI] - ↑
Pizzorusso, T., Medini, P., Landi, S., Baldini, S., Berardi, N., & Maffei, L. (2006).
Structural and functional recovery from early monocular deprivation in adult rats. Proceedings of the National Academy of Sciences of the United States of America, 103(22), 8517-22. [PubMed:16709670] [PMC] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
(執筆者:一條裕之 担当編集委員:大隅典子)