リソソーム
リソソーム(リソゾーム、ライソソーム、ライソゾーム、lysosome)は真核生物の細胞小器官の一つである。リソソームの内腔はpH5前後に酸性化されており、種々の加水分解酵素を含む。リソソームは細胞内外成分の分解機能を担い、分解基質はエンドサイトーシス、オートファジーなどの経路によってリソソームに輸送される。リソソームの機能異常は遺伝性疾患のリソソーム病を引き起こす。植物や酵母などでは液胞(vacuole)がリソソームに相当する細胞小器官であると考えられている。
リソソームは1955年にド・デューブ(Christian de Duve)によって細胞分画法・生化学的手法を用いて発見された[1]。ド・デューブはラット肝臓へのインスリンの作用を解析する過程で、肝細胞内の加水分解酵素を含む顆粒が膜に包まれていることを偶然発見し、それらの顆粒をギリシア語の”lyso”(分解する)+”soma”(小体)を語源としてlysosomeと名付けた。さらに電子顕微鏡を用いてリソソームが実際に細胞小器官であることを1956年に報告した[2]。ド・デューブは「細胞の構造と機能に関する諸発見」によってクラウデ(Albert Claude)、パラーデ(George E. Palade)と共に1974年にノーベル医学生理学賞を受賞した。
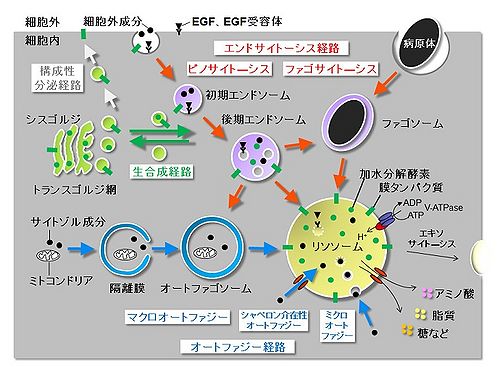
リソソームは細胞内外成分の分解機能を担い、エンドサイトーシス経路(ピノサイト―シス、ファゴサイトーシス)やオートファジー経路(マクロ、シャペロン介在性、ミクロ)から輸送されてきた基質を分解する。細胞外成分、EGF・EGF受容体、病原体などはエンドサイトーシス経路でリソソームへ輸送される。サイトゾル成分や細胞内小器官などはオートファジー経路でリソソームへ輸送される。リソソーム膜上にはV-ATPaseが存在し、内腔を酸性化する。リソソーム内には各種加水分解酵素が存在し、基質をアミノ酸、脂質、糖などにまで分解する。リソソームはエキソサイト―シスされることもある。リソソーム構成タンパク質の多くは、トランスゴルジ網から生合成経路を通り、後期エンドソームに運ばれた後、リソソームに到達する。膜タンパク質の一部は、構成性分泌経路で細胞膜に出た後、エンドサイトーシス経路でリソソームに到達する。
種類と構造
リソソームは6~10 nmの一重の生体膜に囲まれた直径0.1~1.2 μmの細胞小器官である。リソソームは極めて動的な存在であることから、様々な名称で分類されてきた。一次リソソーム(primary lysosome)は分解基質を含まないリソソームを指し、内部が均一な高電子密度顆粒である。エンドソーム、ファゴソーム、オートファゴソームと融合し分解基質を含んだ一次リソソームは二次リソソーム(secondary lysosome)と呼ばれる。二次リソソームの大きさや形態は多様性に富んでおり、内部に基質由来の粒子、層板状構造を認めることが多い。二次リソソームはさらに基質の輸送経路に従ってファゴリソソーム(phagolysosome)、オートリソソーム(autolysosome)などとも呼ばれるが、両者は相互排他的ではないため明確に区別できない。またリソソームの生合成過程で出現する未成熟なリソソームはリソソーム前駆体(protolysosome)と呼ばれ、トランスゴルジ網から一次リソソームが新規合成される際や、二次リソソームからのリサイクルによって一次リソソームが再合成される際などに認められる[3]。未分解基質を多量に蓄積したリソソームは残余小体(residual body)と呼ばれ、老齢個体の肝細胞、心筋細胞、神経細胞などで認める。残余小体は「消耗性色素」「リポフスチン顆粒」とも呼ばれ、しばしば自家蛍光を発する。
構成タンパク質
リソソームを構成するタンパク質は、加水分解酵素などの可溶性タンパク質と、液胞型プロトンポンプなどの膜タンパク質に大別される。これらは特有の局在化機構によってリソソームへ輸送される。
可溶性タンパク質
リソソーム内腔には生体高分子(タンパク質、脂質、糖質など)を構成単位(アミノ酸、リン脂質、糖、核酸など)にまで分解できる約60種類の加水分解酵素が存在する。プロテアーゼ(protease)、グリコシダーゼ(glycosidase)、リパーゼ(lipase)、ホスファターゼ(phosphatase)、ヌクレアーゼ(nuclease)、ホスホリパーゼ(phospholipase)、スルファターゼ(sulfatase)などがあり、多くは酸性域に至適水素イオン指数|pH]]を持つため、酸性加水分解酵素(acid hydrolase)と総称される。これらはA-B + H2O → A-H + B-OHという加水分解反応によって基質を分解する。
リソソームに局在するプロテアーゼは20種類以上あり、それらはカテプシン(Cathepsin)と名付けられ、A-Zまで存在する。リソソームにはカテプシン以外の名称のプロテアーゼも存在する(Legumain、Napsin、TPP1など)。これらのプロテアーゼは活性中心のアミノ酸残基の違いから、システインプロテアーゼ(カテプシンB、C/J/DPP1、F、H/I、K/O2、L、O、S、V/L2/U、W、X/P/Z/Y、Legumain)、アスパラギン酸プロテアーゼ(カテプシンD、E、Napsin)、セリンプロテアーゼ(カテプシンA、G、TPP1)に分類される。
カテプシンの多くは不活性型の前駆体として合成され、酸性環境下でプロセシングされて活性型となる。例えばカテプシンDは、不活性型のプレプロ酵素として小胞体で翻訳された後、小胞体内腔でシグナルペプチドを除去され、ゴルジ体内腔で糖鎖付加を受けてプロ酵素(52 kDa)となる。その後、生合成経路で後期エンドソームに達すると、N末端のプロペプチドが切離され、活性型の一本鎖ポリペプチド中間体(48 kDa)となる。最終的にリソソームに達すると、カテプシンBあるいはLによって軽鎖(14 kDa)と重鎖(32 kDa)の2本鎖に切断され、軽鎖と重鎖がジスルフィド結合で繋げられて成熟体となる。
膜タンパク質
リソソーム膜タンパク質は100種類以上存在し、多くは内腔側に向け高度に糖鎖修飾されている。それらの糖鎖修飾は、加水分解酵素の作用から逃れるために重要であると考えられている。主要なリソソーム膜タンパク質としては、LAMP-1、LAMP-2、LIMP-2などがあり、これらは全リソソーム膜タンパク質量の50%以上を占める[4]。LAMP-2はリソソーム病のダノン病(Danon disease)の原因遺伝子として知られている。
リソソーム膜には液胞型プロトンポンプ(V型/液胞型ATPアーゼ、vacuolar type H+-ATPase、V-ATPase)や塩化物イオンチャネル(chloride channel)が存在し、リソソーム内腔にそれぞれ水素イオン、塩化物イオンを輸送することで、内腔を低いpHに維持している。V-ATPaseは多数のサブユニットから構成される超分子複合体であり、ATPを加水分解する親水性の触媒頭部(V1)と、水素イオンを輸送する膜内在性部分(V0)から構成される。ATPの加水分解反応と共役した回転触媒機構によって水素イオンをリソソーム内に輸送する。V-ATPaseは進化的、構造的にミトコンドリアに局在するwikipedia:F-ATPaseに類似している。
リソソーム膜には最終分解産物([[wikipedia:JA:アミノ酸、ジペプチド、トリペプチド、糖、核酸、無機イオン、ビタミン、コレステロール、リン脂質など)を細胞質に送り出す様々なトランスポーターが存在しており、分解産物の再利用に重要である[5]。これらのトランスポーターの多くは水素イオンの濃度勾配を利用した二次性能動輸送によって基質を共輸送すると考えられている。例えば最初に同定されたリソソーム膜トランスポーターであるCystinosinは、アミノ酸のシスチンを水素イオンとともにリソソーム外へ共輸送するアミノ酸トランスポーターである。Cystinosinはリソソーム病のシスチノーシス(Cystinosis)の原因遺伝子として同定されている。
局在化機構
リソソーム可溶性タンパク質の多くは、生合成経路およびエンドサイトーシス経路を介してリソソームに輸送される(図)。粗面小胞体で合成された加水分解酵素などの可溶性タンパク質は、シスゴルジ体で糖鎖部分にマンノース6―リン酸(mannose 6-phosphate: M6P)の付加を受け、トランスゴルジ網でマンノース6-リン酸受容体(mannose 6-phosphate receptor)と結合し、クラスリン/AP小胞に取り込まれる。その後、クラスリン被覆は脱重合し、被覆を失った小胞は後期エンドソームと融合する。後期エンドソームに入ったリソソーム酵素は、酸性環境下におかれることでM6P受容体から解離し、マンノース残基のリン酸基が除去され、リソソームへ輸送される。被覆タンパク質とM6P受容体はトランスゴルジ網に回収され再利用される。なおM6P非依存的な局在化機構も存在する[4]。
リソソーム可溶性タンパク質への特異的なM6Pの付加は、ゴルジ体に局在するN-アセチルグルコサミン(GlcNAc)-1-リン酸転移酵素(N-acetylglucosamine-1-phosphate transferase)およびGlcNAc-1-リン酸ジエステルα-GlcNAc転移酵素(N-acetylglucosamine-1-phosphodiester-α-N-acetylglucosaminidase)が担っている。多くのリソソーム酵素は前者に特異的に認識されるアミノ酸配列を持ち、この酵素が欠損すると様々なリソソーム酵素がリソソームに輸送されず、リソソーム病のムコ脂質症Ⅱ型(I細胞病、I-cell disease)を引き起こす。
リソソーム膜タンパク質の局在化機構の詳細は十分に明らかにされていないが、細胞質領域に輸送シグナル(チロシンモチーフ、ジロイシンモチーフなど)を持つものはトランスゴルジ網でクラスリン/AP小胞に取り込まれ、後期エンドソームを経てリソソームに運ばれると考えられている[4]。またLAMP-1などの膜タンパク質の一部は構成性分泌経路(constitutive secretory pathway)を介してもリソソームに運ばれる。この場合は、ゴルジ体を出たあと細胞膜表面に運ばれ、エンドサイトーシス経路でリソソームに到達すると考えられている[4]。
生合成機構
リソソームの生合成機構については、4つのモデルが提唱されている[4]。①成熟モデル:初期エンドソームが、後期エンドソーム、リソソームへと成熟する。②小胞輸送モデル:初期エンドソーム、後期エンドソーム、リソソームはそれぞれ独立しており、それらの間の輸送は小胞を介する。③Kiss-and-runモデル:後期エンドソームとリソソームが一時的な融合(kiss)と解離(run)を繰り返す過程で、内容物や膜成分を分配し、リソソームへと成熟する(成熟モデルの変形型)。④直接融合モデル:後期エンドソームとリソソームが直接融合しハイブリッドオルガネラを形成した後、両者が再形成される。
これらのモデルのうちいずれが正しいかについてはまだ決着がついていないが、共焦点顕微鏡を用いた生細胞タイムラプス観察の結果では、Kiss-and-runおよび直接融合が主な生合成機構であるとの報告がある[6]。また長時間の飢餓条件下では、マクロオートファジーによって形成されたオートリソソームからもリサイクルによってリソソームが再合成される[3]。この場合の再合成はmTORC1複合体の再活性化に依存しており、オートリソソームから伸長したチューブ様構造体から小胞(リソソーム前駆体)が出芽し、それらがリソソームに成熟する。
リソソーム生合成のマスター遺伝子としては、転写因子TFEBが同定されている[7]。リソソーム構成タンパク質の多くはプロモーター領域に共通の配列モチーフを持っており、それらの配列にTFEBが結合して遺伝子発現を誘導することで、リソソーム生合成が促進される。TFEBは通常はリソソーム膜上に局在しているが、飢餓やリソソームストレス条件下では核に移行し、遺伝子発現を誘導すると考えられている。
分解基質の輸送経路
リソソームで分解される基質は、主にエンドサイトーシス、オートファジーの2つの経路でリソソームに運ばれる(図)。
エンドサイトーシス経路
エンドサイトーシスの飲作用(ピノサイト―シス、pinocytosis)は細胞外成分や細胞膜成分を取り込み、初期エンドソーム、後期エンドソームを経由してリソソームへ輸送する。エンドサイトーシスの食作用(ファゴサイトーシス、phagocytosis)は細胞外病原体、異物、アポトーシス細胞などをファゴソーム(phagosome)に取り込み、リソソームへ輸送し、ファゴリソソームを形成する。
オートファジー経路
マクロオートファジー(macroautophagy)は、細胞質成分(サイトゾル、細胞小器官、細胞内病原体など)をオートファゴソーム(autophagosome)と呼ばれる二重膜で囲い込み、リソソームへ輸送する経路である。この過程では、まず隔離膜(isolation membrane/phagophore)が細胞質成分を取り囲み、最終的に隔離膜の端が閉じてオートファゴソーム(autophagosome)が形成される。リソソームと融合すると、オートファゴソームの内膜と細胞質成分は分解され、一重膜のオートリソソームとなる。これらの分解は原則として非選択的(バルク分解)であるが、選択的オートファジーも存在し、選択的基質として可溶性タンパク質(p62など)、ミトコンドリア(mitophagy)、ペルオキシソーム(pexophagy)、細胞内病原体(xenophagy)、凝集体(aggrephagy)、リボソーム(ribophagy)などが報告されている。
シャペロン介在性オートファジー(chaperon-mediated autophagy)は、可溶性サイトゾルタンパク質がリソソーム膜を直接透過して内腔へ輸送される経路であり、哺乳類細胞で報告されている。この経路では、KFEQRモチーフを持つ基質タンパク質(GAPDHなど)が細胞質に局在するシャペロン(Hsc70など)によって特異的に認識され、LAMP-2A(LAMP-2のスプライシングバリアントの一つ)を介してリソソーム内腔へ輸送される。
ミクロオートファジー(microautophagy)は、リソソーム(酵母では液胞)の膜が内側に陥入して分離することで細胞質成分をリソソーム内腔へ輸送する経路である。酵母以外の生物種ではあまり報告されていないが、哺乳類細胞では後期エンドソームの多胞体(multivesicular body)との類似点が指摘されている。
機能
リソソームの主な機能は、生体高分子の分解と再利用である。エンドサイトーシスの飲作用(ピノサイト―シス)による細胞外成分や細胞膜成分の分解は、代謝回転、栄養供給などに重要である。上皮増殖因子(EGF)やその受容体(EGFR)などの分解は、シグナル伝達を遮断するうえで重要である。エンドサイトーシスの食作用(ファゴサイトーシス)による病原体、異物、アポトーシス細胞などの分解は、生体防御、抗原提示、自己免疫疾患抑制などに重要である。マクロオートファジーによるサイトゾル成分や細胞小器官の分解は、細胞内の代謝回転、品質管理、飢餓時の栄養供給、抗原提示などに重要である。
リソソームは細胞内の分解装置としてだけでなく、他にも様々な機能を有している。リソソームのエキソサイト―シスは、損傷した細胞膜の修復、細胞外マトリックスの分解、骨融解などに関与する。またリソソーム膜の透過性亢進と細胞死との関連も報告されている。
リソソームは細胞内の栄養状態(アミノ酸など)を感知する場としても重要である。mTORC1複合体は細胞内のアミノ酸濃度を感知して、細胞成長・代謝・タンパク質合成などの様々な細胞機能を制御する重要なシグナル因子であるが、その活性化はリソソーム膜上で起こる[8]。mTORC1複合体は低栄養条件下では不活性型として細胞質に存在するが、細胞内のアミノ酸濃度が上昇すると、リソソーム膜上の活性型Rag複合体(GTP型RagA/B、GDP型RagC/D)と結合することでリソソームへ移行し、活性化される。Rag複合体はRagulatorと呼ばれるリソソーム膜タンパク質を含む複合体(p14、MP1、p18)を介してリソソーム膜上に恒常的に局在している[8]。
さらに細胞内のアミノ酸濃度を感知するセンサータンパク質の多くもリソソーム膜上に局在する。最近、ロイシルtRNA合成酵素(leucyl-tRNA synthetase)が細胞内のロイシン濃度を感知してリソソームに移行し、Rag複合体を活性化することが報告された[9]。ロイシルtRNA合成酵素は、細胞内ロイシン濃度が上昇するとRag複合体と結合し、細胞質からリソソーム膜上へ移行する。さらにRagDのGTPase活性化タンパク質(GAP)として機能することでRag複合体を活性型に変換し、mTORC1複合体をリソソームへ移行させると考えられている。ロイシルtRNA合成酵素は酵母でも保存されており、液胞膜上でのロイシン依存的なTOR活性化に必要である[10]。一方、リソソーム内腔のアミノ酸が液胞型プロトンポンプの構造変化を介してRag複合体やmTOR複合体の活性を制御するという報告もあり[11]、リソソーム自体が積極的に細胞機能を制御している可能性も示唆されている。
リソソーム病
リソソーム病(ライソゾーム病、リソゾーム病、リソソーム蓄積症、lysosomal disease、lysosomal storage disease/disorder)は、リソソーム酵素の欠損や輸送障害によって発症する遺伝性疾患である。1963年にden Hersによってリソソーム病の概念が確立された[12]。リソソーム酵素が欠損すると、リソソーム内に未分解の基質が大量に蓄積する。現在までに約60種類のリソソーム病が知られており、多くは劣性遺伝形式である。罹病率は出生5000-8000人あたり1人である。我が国では「ライソゾーム病」という名称で国の特定疾患(難病)に指定されている。リソソーム病の症状は欠損酵素の種類によって異なるが、肝脾腫、骨変形、中枢神経障害(精神運動発達遅滞、痙攣など)、眼障害、腎障害、心不全などの様々な症状を呈する。治療法として一部の疾患で酵素補充療法(Enzyme replacement therapy)、造血幹細胞移植などが行われている。
リソソーム病は欠損酵素の種類、蓄積物質の種類、リソソームタンパク質の種類など様々なカテゴリーで分類されている。リソソームタンパク質の種類に基づいた分類[13]を表に示す。
リソソーム関連オルガネラ
リソソーム関連オルガネラ(Lysosome-related organelle)は、リソソームの性質の一部を保持しながらも、細胞特異的に特殊な機能を担うようになったオルガネラである[14]。リソソーム関連オルガネラの機能は主に生理活性物質の貯蓄、活性化、分泌である。制御性分泌(regulated secretion)を担うリソソーム関連オルガネラは分泌型リソソーム(secretory lysosome)とも呼ばれる。チェディアック・東症候群(Chédiak-Higashi syndrome)やヘルマンスキー・パドラック症候群(Hermansky-Pudlak syndrome)などの疾患では、リソソームだけでなくリソソーム関連オルガネラの一部も機能障害を来たすことが報告されている[14]。以下、代表的なリソソーム関連オルガネラの例を挙げる。
メラノソーム
メラノソームはメラノサイト、虹彩色素上皮細胞、網膜色素上皮細胞に存在する。内腔はpH5前後に酸性化されており、加水分解酵素やLAMP-1/2などを有する[14]。メラノソームにはメラニン色素が蓄積されており、エキソサイト―シスによって細胞外に放出される。放出された色素は皮膚ではケラチノサイトに取り込まれる。
溶菌性顆粒
溶菌性顆粒(Lytic granule)は細胞傷害性T細胞、NK細胞に存在する。内腔はpH5.1-5.4に酸性化されており、加水分解酵素やLAMP-1/2などを有する。溶菌性顆粒はパーフォリンやグランザイムなどを含んでおり、標的細胞(ウィルス感染細胞や腫瘍細胞など)に放出することでそれらを破壊する。溶菌性顆粒に含まれるカテプシンCは、グランザイム前駆体のプロセッシングと活性化に必要である。
血小板密顆粒
血小板密顆粒(Platelet-dense granule、delta granule)は血小板、巨核球に存在する。内腔はpH6前後に酸性化されており、LAMP-2などを有する。血小板密顆粒はカルシウム、セロトニン、ADP、ATP、ピロリン酸などを含んでおり、それらの分泌は血液凝固反応に重要である。
MHCクラスIIコンパートメント
MHCクラスIIコンパートメント(MHC class II compartment、class II vesicles)はプロフェッショナル抗原提示細胞(マクロファージ、樹状細胞、Bリンパ球など)に存在する。リソソームと類似するが、MHCクラスII分子などの抗原提示に関わるタンパク質を多量に含む点や、形態的に内部小胞を多数認める点などが異なる。主にエンドサイトーシスで輸送されてくる外来性抗原物質由来の抗原プロセッシング、抗原ペプチドの産生に重要である。
アズール顆粒
アズール顆粒(Azurophilic granule、primary granule)は好中球に存在し、加水分解酵素、LAMP-3などを有する。ミエロペルオキシダーゼやディフェンシンなどの殺菌性物質を含んでおり、ファゴソームと融合したり、細胞外へ放出されたりすることで、病原体を殺菌する。アズール顆粒に含まれるカテプシンGは細胞外基質の分解、サイトカインの活性化に関与する。
好塩基球顆粒
好塩基球顆粒(Basophil granule)は好塩基球に存在し、加水分解酵素、LAMP-1/2などを有する。好塩基球顆粒にはヒスタミン、セロトニンなどが存在し、それらは免疫グロブリンEの細胞膜への結合に伴って細胞外へ分泌され、免疫応答を惹起する。
ラメラ体
ラメラ体(層板小体、Lamellar body)はⅡ型肺胞上皮細胞に存在する。ラメラ体は大きさが1-2 umあり、分泌顆粒では最大のものの一つである。内腔はpH5.5前後に酸性化されており、加水分解酵素やLAMP-1などを有する。ラメラ体はサーファクタントを含んでおり、それらの肺胞腔への分泌は肺胞の表面張力減少、肺胞拡張に必要である。ラメラ体に含まれるカテプシンHなどの加水分解酵素はサーファクタント前駆体のプロセッシングに関与する。
刷子縁
刷子縁(Ruffled border)は破骨細胞の骨吸収に特化した細胞膜の一部を指す。破骨細胞は明帯(sealing zone)を介して骨表面に接し、刷子縁と骨表面とで囲まれた骨吸収窩(resorptive pit)を形成する。刷子縁には液胞型プロトンポンプや塩化物イオンチャネルが局在している。また骨吸収に必要な酵素群(カテプシンKや酸性フォスファターゼなど)は、破骨細胞内のリソソームが刷子縁にエキソサイト―シスされることで吸収窩に供給されている。したがって、刷子縁および吸収窩はリソソームと類似した性質を持っていると考えられている。破骨細胞に高発現するカテプシンKは濃化異骨症(Pycnodysostosis)の原因遺伝子として同定されている。
リソソーム阻害剤
生細胞でリソソーム機能を阻害する主な方法としては、リソソームのpHを上昇させて加水分解酵素の活性を抑制したり、加水分解酵素阻害剤を投与して直接活性を抑制したりする方法がある。以下に主なリソソーム阻害剤を挙げる。
リソソーム親和性アミン
ド・デューブはリソソームに選択的に取り込まれ薬効を発揮する薬剤のコンセプトを1974年に考案し、その性質をlysosomotropism、その性質を持つ薬剤をlysosomotropic agentと名付けた[15]。これらの薬剤の多くはリソソーム(酸性コンパートメント)内に到達するとプロトン化され電荷を帯びるため、膜透過性が低下し、リソソーム内に蓄積する。リソソーム内の薬剤濃度は細胞外の約100-1000倍に達するため、しばしば浸透圧膨張によってリソソームの空胞化(vacuolation)を引き起こす。塩化アンモニウム(ammonium chloride、NH4Cl)、クロロキン(chloroquine)、メチルアミン(methylamine、CH3NH2)などの弱塩基アミンは、リソソームのpHを上昇させ、リソソーム機能を抑制する。
液胞型プロトンポンプ阻害剤
バフィロマイシンA1(Bafilomycin A1)、コンカナマイシンA(Concanamycin A)は液胞型プロトンポンプを特異的に阻害する。いずれもマクロライド系抗生物質で構造が類似しているが、後者のほうがより強力で特異性が高いとされている。
プロテアーゼ阻害剤
システインプロテアーゼ阻害剤としてはE64d(不可逆的阻害)、Pepstatin A(可逆的阻害)などがある。システイン・セリン・スレオニンプロテアーゼ阻害剤としてはLeupeptin(可逆的阻害)などがある。
参考文献
- ↑
DE DUVE, C., PRESSMAN, B.C., GIANETTO, R., WATTIAUX, R., & APPELMANS, F. (1955).
Tissue fractionation studies. 6. Intracellular distribution patterns of enzymes in rat-liver tissue. The Biochemical journal, 60(4), 604-17. [PubMed:13249955] [PMC] [WorldCat] [DOI] - ↑
NOVIKOFF, A.B., BEAUFAY, H., & DE DUVE, C. (1956).
Electron microscopy of lysosomerich fractions from rat liver. The Journal of biophysical and biochemical cytology, 2(4 Suppl), 179-84. [PubMed:13357540] [PMC] [WorldCat] - ↑ 3.0 3.1
Yu, L., McPhee, C.K., Zheng, L., Mardones, G.A., Rong, Y., Peng, J., ..., & Lenardo, M.J. (2010).
Termination of autophagy and reformation of lysosomes regulated by mTOR. Nature, 465(7300), 942-6. [PubMed:20526321] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4
Saftig, P., & Klumperman, J. (2009).
Lysosome biogenesis and lysosomal membrane proteins: trafficking meets function. Nature reviews. Molecular cell biology, 10(9), 623-35. [PubMed:19672277] [WorldCat] [DOI] - ↑
Ruivo, R., Anne, C., Sagné, C., & Gasnier, B. (2009).
Molecular and cellular basis of lysosomal transmembrane protein dysfunction. Biochimica et biophysica acta, 1793(4), 636-49. [PubMed:19146888] [WorldCat] [DOI] - ↑
Bright, N.A., Gratian, M.J., & Luzio, J.P. (2005).
Endocytic delivery to lysosomes mediated by concurrent fusion and kissing events in living cells. Current biology : CB, 15(4), 360-5. [PubMed:15723798] [WorldCat] [DOI] - ↑
Sardiello, M., Palmieri, M., di Ronza, A., Medina, D.L., Valenza, M., Gennarino, V.A., ..., & Ballabio, A. (2009).
A gene network regulating lysosomal biogenesis and function. Science (New York, N.Y.), 325(5939), 473-7. [PubMed:19556463] [WorldCat] [DOI] - ↑ 8.0 8.1
Sancak, Y., Bar-Peled, L., Zoncu, R., Markhard, A.L., Nada, S., & Sabatini, D.M. (2010).
Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids. Cell, 141(2), 290-303. [PubMed:20381137] [PMC] [WorldCat] [DOI] - ↑
Han, J.M., Jeong, S.J., Park, M.C., Kim, G., Kwon, N.H., Kim, H.K., ..., & Kim, S. (2012).
Leucyl-tRNA synthetase is an intracellular leucine sensor for the mTORC1-signaling pathway. Cell, 149(2), 410-24. [PubMed:22424946] [WorldCat] [DOI] - ↑
Segev, N., & Hay, N. (2012).
Hijacking leucyl-tRNA synthetase for amino acid-dependent regulation of TORC1. Molecular cell, 46(1), 4-6. [PubMed:22500735] [PMC] [WorldCat] [DOI] - ↑
Zoncu, R., Bar-Peled, L., Efeyan, A., Wang, S., Sancak, Y., & Sabatini, D.M. (2011).
mTORC1 senses lysosomal amino acids through an inside-out mechanism that requires the vacuolar H(+)-ATPase. Science (New York, N.Y.), 334(6056), 678-83. [PubMed:22053050] [PMC] [WorldCat] [DOI] - ↑
HERS, H.G. (1965).
INBORN LYSOSOMAL DISEASES. Gastroenterology, 48, 625-33. [PubMed:14280390] [WorldCat] - ↑ 13.0 13.1
Wilcox, W.R. (2004).
Lysosomal storage disorders: the need for better pediatric recognition and comprehensive care. The Journal of pediatrics, 144(5 Suppl), S3-14. [PubMed:15126978] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Dell'Angelica, E.C., Mullins, C., Caplan, S., & Bonifacino, J.S. (2000).
Lysosome-related organelles. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(10), 1265-78. [PubMed:10877819] [WorldCat] [DOI] - ↑
de Duve, C., de Barsy, T., Poole, B., Trouet, A., Tulkens, P., & Van Hoof, F. (1974).
Commentary. Lysosomotropic agents. Biochemical pharmacology, 23(18), 2495-531. [PubMed:4606365] [WorldCat] [DOI]
(執筆者:森下英晃、水島昇 担当編集者:大隅典子)