「抗精神病薬」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の39版が非表示) | |||
| 1行目: | 1行目: | ||
英: antipsychotics, neuroleptics | |||
抗精神病薬は、[[向精神薬]] (psychotropic drugs)の一種で抗精神病作用、すなわち[[幻覚]]、[[妄想]]、[[作為体験]]などの精神病症状に対して効果を有する薬物の総称である。主に[[統合失調症]]や[[双極性障害]]などの[[精神疾患]]の治療を目的として用いられる。[[神経遮断薬]] (neuroleptics)や[[強力精神安定剤]] (major tranquilizer)とも呼ばれる。 | |||
== 歴史 == | == 歴史 == | ||
抗精神病薬の歴史は、1950年に中枢作用の強い抗[[ヒスタミン]](histamine)薬として開発された[[クロルプロマジン]](chlorpromazine)に端を発する。当初は外科医のLaboritが、強化[[ | 抗精神病薬の歴史は、1950年に中枢作用の強い抗[[ヒスタミン]](histamine)薬として開発された[[クロルプロマジン]](chlorpromazine)に端を発する。当初は外科医のLaboritが、強化[[wikipedia:JA:麻酔|麻酔]](人工冬眠)に用いて外科手術後のショックを予防する目的で使用した。その後、1952年に精神科医のDelayとDenikerが、統合失調症や[[躁病]]患者に投与したところ、覚醒状態で抗幻覚・妄想作用と鎮静作用を示すことを報告した。1958年にベルギーのJanssenは、[[ブチロフェノン]](butyrophenone)系抗精神病薬の[[ハロペリドール]](haloperidol)を開発した。1963年には[[wikipedia:JA:アルビド・カールソン|Carlsson]]とLindqvistが、これらの薬物が脳内[[ドーパミン]](dopamine)の代謝産物を増加させることを報告し、統合失調症の「[[ドーパミン仮説]]」(ドーパミン神経の過剰興奮が統合失調症の病因)の糸口を作った。その後[[ベンズアミド]](benzamide)系、[[イミノジベンジル]](iminodibenzyl)系などの第1世代(定型または従来型)抗精神病薬 (First-Generation Antipsychotics)が数多く開発され上市された。 第1世代抗精神病薬の開発コンセプトは、抗精神病薬の臨床用量(または血漿中濃度)が、[[ドーパミン|ドーパミン D<sub>2</sub>受容体]]遮断作用と正の相関を示すため、D<sub>2</sub>受容体の遮断作用が抗精神病効果の発現に本質的に重要であるというものであった。 | ||
しかし第1世代抗精神病薬は、①[[アカシジア]] (akathisia)や遅発性[[ジスキネジア]] (tardive dyskinesia; TD)などの急性および慢性の[[錐体外路系]]副作用 (extrapyramidal side effects)を高率に生じさせたり、②乳汁分泌や性機能障害を生じる可能性のある高[[プロラクチン]](prolactin)血症を起こしたり、③[[陰性症状]](意欲低下、感情の平板化、社会的引きこもりなど)や認知機能障害(記憶力低下、注意力低下、遂行機能障害など)に対して無効あるいは増悪させたりするなどの宿命的問題点があった <ref name="ref1">'''Miyamoto S, Merrill DB, Lieberman JA, Fleischhacker WW, Marder SR''': <br>Antipsychotic Drugs, In PSYCHIATRY (Third edition) <br>'''Tasman A, Kay J, Lieberman JA, First MB, Maj M''' eds<br>pp. 2161-2201<br>John Wiley & Sons, Ltd (Chichester):2008</ref>。 | |||
1958年に合成された第2世代(非定型または新規)抗精神病薬(Second-Generation Antipsychotics)の原型である[[クロザピン]](clozapine)は、第1世代抗精神病薬の欠点をかなり克服したが、約1%の頻度で[[wikipedia:JA:無顆粒球症|無顆粒球症]]という致死的副作用が発現したため、本邦を含む多くの国で開発が中断された。しかし、クロザピンの薬理作用の研究が進むにつれて、抗D<sub>2</sub>受容体作用に比べて相対的に強い[[セロトニン]](serotonin) [[セロトニン#5-HT2受容体|5-HT<sub>2A</sub>受容体]]遮断作用が注目されるようになった。Janssenは、5-HT<sub>2A</sub>受容体遮断作用を有する[[ピパンペロン]](pipamperone)が、陰性症状に比較的有効で錐体外路症状の発現が少ない事実に気づき、1984年にセロトニンドーパミン遮断薬 (Serotonin Dopamine Antagonist; SDA)の原型といえる[[リスペリドン]](risperidone)の開発を導いた。 | |||
さらに無顆粒球症を伴わず、クロザピン類似の薬理学的プロフィールを持つ抗精神病薬の開発が進み、1982年に[[オランザピン]](olanzapine)、1985年に[[クエチアピン]](quetiapine)が合成された。本邦でも1987年にSDAとして[[ペロスピロン]](perospirone)が開発された。 | |||
クロザピンは、1988年に米国のKaneらによって治療抵抗性統合失調症に対するクロルプロマジンとの[[wikipedia:JA:二重盲検比較試験|二重盲検比較試験]]で優位性が証明されたのを受け、1990年米国で承認された。現在厳密な副作用モニタリングのもと、世界100ヶ国以上の国々で上市されている。 | |||
本邦では2006年にD<sub>2</sub>受容体[[部分作動薬]]の[[アリピプラゾール]](aripiprazole)が、2008年に[[ブロナンセリン]](blonanserin)、2009年にクロザピン、2011年にリスペリドンの主要活性代謝産物である[[パリペリドン]](paliperidone)が上市され、2012年4月現在8種類の第2世代抗精神病薬が統合失調症の薬物治療の中心となっている。特に、アリピプラゾールをはじめとするD<sub>2</sub>受容体部分作動薬は、第1世代抗精神病薬や第2世代抗精神病薬とは異なる機序でドーパミン伝達の安定化作用を有しているため、第3世代抗精神病薬 (Third-Generation Antipsychotics)と位置付ける研究者もいる。 | |||
== 対象疾患 == | == 対象疾患 == | ||
抗精神病薬は、統合失調症、[[統合失調感情障害]]、短期(急性一過性)精神病性障害や[[妄想性障害]] | 抗精神病薬は、統合失調症、[[統合失調感情障害]]、短期(急性一過性)精神病性障害や[[妄想性障害]]といった統合失調症圏の精神病性障害を主な対象疾患とするが、双極性障害(躁うつ病)や[[認知症]]の問題行動(暴力や興奮など)にも有用である。さらに基礎疾患によらず、幻覚妄想状態や[[精神運動興奮]]を呈する場合は、保険適応外で使用されることが多い。また、強度の不安や焦燥感、重度のうつ状態や不眠、[[せん妄]]、悪心・嘔吐、吃逆に対する対処薬として利用される場合がある。 | ||
== 種類 == | == 種類 == | ||
| 36行目: | 25行目: | ||
=== 第1世代 === | === 第1世代 === | ||
[[フェノチアジン]](Phenothiazine)誘導体として、クロルプロマジン、[[フルフェナジン]](fluphenazine)、[[レボメプロマジン]] (levomepromazine)、[[ペルフェナジン]](perphenazine)、[[プロペリシアジン]](propericiazine)などが挙げられる。[[ブチロフェノン]]誘導体として、[[ブロムペリドール]](bromperidol)、ハロペリドール、[[ピパンペロン]]、[[チミペロン]](timiperone)などが含まれる。[[ベンズアミド]]誘導体として、[[ネモナプリド]](nemonapride)、[[スルピリド]](sulpiride)、[[スルトプリド]](sultopride)などがある。[[イミノジベンジル]]誘導体として、[[カルピプラミン]](carpipramine)、[[クロカプラミン]](clocapramine)、[[モサプラミン]](mosapramine)、[[ジフェニルブチルピペリジン]](diphenylbutylpiperidine)誘導体として[[ピモジド]](pimozide)、[[インドール]](indole)誘導体として[[オキシペルチン]](oxypertine)がある。[[チエピン]](thiepin)誘導体として[[ゾテピン]] | [[Image:第1世代抗精神病薬の構造式.jpg|thumb|right|300px|'''図1 代表的な第1世代抗精神病薬の化学構造式''']] | ||
[[フェノチアジン]](Phenothiazine)誘導体として、クロルプロマジン、[[フルフェナジン]](fluphenazine)、[[レボメプロマジン]] (levomepromazine)、[[ペルフェナジン]](perphenazine)、[[プロペリシアジン]](propericiazine)などが挙げられる。[[ブチロフェノン]]誘導体として、[[ブロムペリドール]](bromperidol)、ハロペリドール、[[ピパンペロン]]、[[チミペロン]](timiperone)などが含まれる。[[ベンズアミド]]誘導体として、[[ネモナプリド]](nemonapride)、[[スルピリド]](sulpiride)、[[スルトプリド]](sultopride)などがある。[[イミノジベンジル]]誘導体として、[[カルピプラミン]](carpipramine)、[[クロカプラミン]](clocapramine)、[[モサプラミン]](mosapramine)、[[ジフェニルブチルピペリジン]](diphenylbutylpiperidine)誘導体として[[ピモジド]](pimozide)、[[インドール]](indole)誘導体として[[オキシペルチン]](oxypertine)がある。[[チエピン]](thiepin)誘導体として[[ゾテピン]](zotepine)があるが、欧米では第2世代抗精神病薬に分類されることが多い。(図1) | |||
=== 第2世代 === | === 第2世代 === | ||
[[Image:第2世代抗精神病薬の構造式.jpg|thumb|right|300px|'''図2 代表的な第2,3世代抗精神病薬の化学構造式''']] | |||
SDAとしてリスペリドン、ペロスピロン、[[パリペリドン]]、[[ルラシドン]](lurasidone)(本邦臨床試験中)、[[ジプラシドン]](ziprasidone)(本邦臨床試験中)、[[アセナピン]](asenapine)(本邦臨床試験中)がある。多元受容体標的化抗精神病薬 (multi-acting receptor-targeted antipsychotics; MARTA)としてクロザピン、オランザピン、クエチアピンがあるが、欧米ではMARTAの呼称は一般的ではない。[[ブロナンセリン]]はD<sub>2</sub>受容体の親和性が5-HT<sub>2A</sub>受容体の親和性よりも強い第2世代抗精神病薬であるため、dopamine serotonin antagonist (DSA)と呼ぶ研究者もいる。なお、本邦では未承認の[[アミスルプリド]](amisulpride)は、D<sub>2</sub>受容体よりもD<sub>3</sub>受容体に選択性が高いベンズアミド誘導体であり第2世代抗精神病薬に分類される(図2)。 | |||
=== 第3世代 === | === 第3世代 === | ||
アリピプラゾールが現在上市されており、[[dopamine system stabilizer]] (DSS)とも称される。D<sub>2</sub>受容体と[[セロトニン#5-HT1受容体|5-HT<sub>1A</sub>受容体]]部分作動作用などを有するOPC-34712と、D<sub>2</sub>とD<sub>3</sub>受容体の遮断作用と部分作動作用を有する[[カリプラジン]](cariprazine)は、2012年4月現在臨床試験中である。 | |||
|- | |||
== 作用機序 == | == 作用機序 == | ||
| 135行目: | 43行目: | ||
=== 共通の作用機序 === | === 共通の作用機序 === | ||
ドーパミン神経系は、[[中脳辺縁系]]、[[中脳皮質系]]、[[黒質線条体系]]、[[下垂体漏斗系]]の4つの回路がある。ドーパミン受容体はD<sub>1</sub>からD<sub>5</sub>まで5種類のsubtypeが存在し、脳内分布も異なる。また存在する場所によっては、[[シナプス前部位受容体]]([[自己受容体]])や[[シナプス後部位受容体]]に分けられる。幻覚や妄想などの精神病症状は、中脳辺縁系においてドーパミン神経の過活動が生じて[[神経終末]]からのドーパミン放出が増加し、シナプス後部のD<sub>2</sub>受容体が過剰に刺激されて生じると推定されている。現在使用可能なすべての抗精神病薬は、程度の差はあるがシナプス後部位D<sub>2</sub>受容体に対して遮断作用を有し、中脳辺縁系のドーパミンの過剰な伝達を阻害して精神病症状を緩和すると推定されている<ref name="ref2"><pubmed> 15289815 </pubmed></ref>。 | ドーパミン神経系は、[[中脳辺縁系]]、[[中脳皮質系]]、[[黒質線条体系]]、[[下垂体漏斗系]]の4つの回路がある。ドーパミン受容体はD<sub>1</sub>からD<sub>5</sub>まで5種類のsubtypeが存在し、脳内分布も異なる。また存在する場所によっては、[[シナプス前部位受容体]]([[自己受容体]])や[[シナプス後部位受容体]]に分けられる。幻覚や妄想などの精神病症状は、中脳辺縁系においてドーパミン神経の過活動が生じて[[神経終末]]からのドーパミン放出が増加し、シナプス後部のD<sub>2</sub>受容体が過剰に刺激されて生じると推定されている。現在使用可能なすべての抗精神病薬は、程度の差はあるがシナプス後部位D<sub>2</sub>受容体に対して遮断作用を有し、中脳辺縁系のドーパミンの過剰な伝達を阻害して精神病症状を緩和すると推定されている<ref name="ref2"><pubmed> 15289815 </pubmed></ref>。 | ||
前述したように''in vitro''では、抗精神病薬の臨床用量とD<sub>2</sub>受容体阻害能は正の相関を示すが、D<sub>2</sub>受容体阻害作用が強ければ強いほど抗精神病効果が高まるわけではない。抗精神病薬の用量を上げてD<sub>2</sub>受容体の阻害がある一定のレベルを超えると、臨床効果は頭打ちとなり、錐体外路症状や過鎮静などの副作用の発現頻度が増加する。 | 前述したように''in vitro''では、抗精神病薬の臨床用量とD<sub>2</sub>受容体阻害能は正の相関を示すが、D<sub>2</sub>受容体阻害作用が強ければ強いほど抗精神病効果が高まるわけではない。抗精神病薬の用量を上げてD<sub>2</sub>受容体の阻害がある一定のレベルを超えると、臨床効果は頭打ちとなり、錐体外路症状や過鎮静などの副作用の発現頻度が増加する。 | ||
抗精神病薬がヒト脳内のD<sub>2</sub>受容体とどのような結合状態にあるかに関して、1990年代後半から[[Positron Emission Tomography]] (PET)や[[Single Photon Emission Computed Tomography]] (SPECT)を用いた脳画像研究が盛んに行われ、患者の脳内 (''in vivo'')での挙動が視覚的に把握できるようになり、新しい知見が得られた。すなわち、抗精神病薬投与による抗精神病効果の出現には、65~70% 以上の[[線条体]]でのD<sub>2</sub>受容体の占拠率が必要であるが、80%以上占拠すると錐体外路症状の頻度が有意に増加する。したがって、治療効果を最大にして錐体外路症状を最小限にするための至適な線条体D<sub>2</sub> 受容体の占拠率は、65~80%であることが判明した。 | 抗精神病薬がヒト脳内のD<sub>2</sub>受容体とどのような結合状態にあるかに関して、1990年代後半から[[Positron Emission Tomography]] (PET)や[[Single Photon Emission Computed Tomography]] (SPECT)を用いた脳画像研究が盛んに行われ、患者の脳内 (''in vivo'')での挙動が視覚的に把握できるようになり、新しい知見が得られた。すなわち、抗精神病薬投与による抗精神病効果の出現には、65~70% 以上の[[線条体]]でのD<sub>2</sub>受容体の占拠率が必要であるが、80%以上占拠すると錐体外路症状の頻度が有意に増加する。したがって、治療効果を最大にして錐体外路症状を最小限にするための至適な線条体D<sub>2</sub> 受容体の占拠率は、65~80%であることが判明した。 | ||
しかし、多数のPETやSPECT研究結果を分析したStoneら <ref><pubmed> 18303092 </pubmed></ref>の[[ | しかし、多数のPETやSPECT研究結果を分析したStoneら <ref><pubmed> 18303092 </pubmed></ref>の[[wikipedia:JA:メタ解析|メタ解析]]では、線条体のD<sub>2</sub>受容体阻害は治療効果よりも錐体外路症状の発現に関与し、抗精神病効果に関係するのは[[側頭葉皮質]]のD<sub>2</sub>受容体であると主張している。しかし、側頭葉皮質以外のD<sub>2</sub>受容体も抗精神病効果に関与する可能性は十分あり、今後真の標的部位を探求する脳画像研究が必要である。 | ||
=== 第2世代抗精神病薬の薬理学的特徴 === | === 第2世代抗精神病薬の薬理学的特徴 === | ||
ほとんどの第2世代抗精神病薬は、有効治療用量内では錐体外路症状や高プロラクチン血症の発現頻度が少ない。この第2世代抗精神病薬のメリットは、薬理学的に第1世代抗精神病薬とはいくつか異なった作用機序に由来する。ただし、D<sub>2</sub>受容体阻害作用を除いて、すべての第2世代抗精神病薬に共通する薬理学的作用機序はいまだ明らかでない。 Meltzerら<ref><pubmed> 2571717 </pubmed></ref>は1989年に、第2世代抗精神病薬の「非定型性 (atypicality)」すなわち錐体外路症状を惹起しない用量範囲内で抗精神病効果を示すという特性に対して最も重要なのは、D<sub>2</sub>受容体遮断作用に比べて5-HT<sub>2A</sub>受容体遮断作用が相対的に強いことであると主張し、「セロトニン-ドーパミン仮説」を提唱した。[[縫線核]]を起始核とする[[セロトニン神経]]は、[[中脳黒質]]から線条体に投射するドーパミン神経に対して抑制的に作用しており、ドーパミン神経上の5-HT<sub>2A</sub>受容体を遮断することで、ドーパミン神経の抑制が解除(脱抑制)されてドーパミンの放出を促進し、抗精神病薬によるD<sub>2</sub>受容体遮断を一部緩和して錐体外路症状を軽減すると考えられている。 | |||
またD<sub>2</sub>受容体遮断作用に5-HT<sub>2A</sub> | またD<sub>2</sub>受容体遮断作用に5-HT<sub>2A</sub>受容体遮断作用が加わると、前頭前野や[[海馬]]でドーパミンの放出が亢進して、陰性症状や認知機能障害に対して効果を発揮すると推定されている。 | ||
次に多くの第2世代抗精神病薬は、第1世代抗精神病薬よりもD<sub>2</sub>受容体遮断作用が弱いという特徴がある。抗精神病薬のD<sub>2</sub>受容体に対する親和性の強さは、内因性のドーパミンと比較して強い場合には固い結合 (tight binding)、弱い場合には緩い結合 (loose binding)と呼ばれる。また抗精神病薬とD<sub>2</sub>受容体との結合-解離の時間経過に関して、PETやSPECTによる研究および血漿中プロラクチン値の変動などにより、1日1回投与でも24時間以上D<sub>2</sub>受容体の阻害が持続する抗精神病薬と、24時間以内にD<sub>2</sub>受容体の占拠率が速やかに低下するか、D<sub>2</sub>受容体から速やかに解離する薬物に分類される。 | 次に多くの第2世代抗精神病薬は、第1世代抗精神病薬よりもD<sub>2</sub>受容体遮断作用が弱いという特徴がある。抗精神病薬のD<sub>2</sub>受容体に対する親和性の強さは、内因性のドーパミンと比較して強い場合には固い結合 (tight binding)、弱い場合には緩い結合 (loose binding)と呼ばれる。また抗精神病薬とD<sub>2</sub>受容体との結合-解離の時間経過に関して、PETやSPECTによる研究および血漿中プロラクチン値の変動などにより、1日1回投与でも24時間以上D<sub>2</sub>受容体の阻害が持続する抗精神病薬と、24時間以内にD<sub>2</sub>受容体の占拠率が速やかに低下するか、D<sub>2</sub>受容体から速やかに解離する薬物に分類される。 | ||
KapurとSeemanら <ref><pubmed> 11229973 </pubmed></ref>は、抗精神病薬がいかに速くD<sub>2</sub>受容体に結合するかよりも、D<sub>2</sub>受容体からいかに速く解離するか(k<sub>off</sub> | KapurとSeemanら <ref><pubmed> 11229973 </pubmed></ref>は、抗精神病薬がいかに速くD<sub>2</sub>受容体に結合するかよりも、D<sub>2</sub>受容体からいかに速く解離するか(k<sub>off</sub>で示す)が、第2世代抗精神病薬の“非定型性”に重要であるとする「急速解離 (fast dissociation)仮説」を提唱した。すなわちすべての抗精神病薬は、D<sub>2</sub>受容体からの解離の速度にかかわらず、その占拠率に応じて持続性の ドーパミン伝達を抑制する。しかし、D<sub>2</sub>受容体から素早く解離できる薬剤は、ストレスなどによるドーパミンの一過性の過剰放出に反応して速やかに置換することで、ドーパミン伝達をより生理的に近い状態に保持できると考えた。Loose bindingは、内因性のドーパミンよりD<sub>2</sub>受容体に対する親和性が弱いクロザピン、クエチアピン、オランザピンで錐体外路症状が少ない理由の一つとなり、fast dissociationはクロザピン、クエチアピン、ペロスピロンによる錐体外路症状や高プロラクチン血症の発現頻度が少ない機序を説明可能である。しかしリスペリドンは、内因性のドーパミンより強く結合し、1日1回投与でも24時間以上D<sub>2</sub>受容体の阻害が持続する抗精神病薬であり、彼らの理論に当てはまらない。同様に、第2世代抗精神病薬のブロナンセリンやオランザピンは遅いk<sub>off</sub>を示す。したがって「セロトニン-ドーパミン仮説」や「急速解離仮説」は、多くの第2世代抗精神病薬の作用機序を説明できるのは事実であるが、すべての第2世代抗精神病薬に共通した機序ではない点に留意する必要がある <ref name="ref2"><pubmed> 15289815 </pubmed></ref>。 | ||
第2世代抗精神病薬の中には5-HT<sub>2C</sub>、[[セロトニン#5-HT6受容体|5-HT<sub>6</sub>]]、[[セロトニン#5-HT7受容体|5-HT<sub>7</sub>]]受容体遮断作用や[[セロトニン#5-HT1受容体|5-HT<sub>1A</sub>]]受容体部分作動作用を有する薬剤がある。5-HT<sub>1A</sub>受容体は、縫線核ではシナプス前の[[細胞体]]に自己受容体として存在し、5-HT ニューロンの発火率を抑制する。また辺縁系や大脳皮質ではシナプス後に存在し、発火率を抑制している。クロザピン、ペロスピロン、クエチアピンおよびジプラシドンは、5-HT<sub>1A</sub>受容体部分作動作用を有しており、D<sub>2</sub>と5-HT<sub>2A</sub>受容体間の相互作用と5-HT<sub>1A</sub>受容体の機能的活性化を介して、前頭葉皮質のドーパミン遊離を促進することで、陰性症状や認知機能障害、不安・抑うつ症状に対する効果が期待できる可能性がある。 | |||
=== ドーパミン部分作動薬の作用機序 === | === ドーパミン部分作動薬の作用機序 === | ||
アリピプラゾールは、D<sub>2</sub> 受容体の部分作動薬でありD<sub>2</sub> に高い親和性を示すが、その固有活性は内因性のドーパミンよりも低い。この特性によりシナプス間隙のドーパミン量に応じて、[[遮断薬]](antagonist)あるいは[[作動薬]](agonist)として作用が変化する。例えばドーパミンが過剰な状態では、シナプス前のドーパミン自己受容体に作動薬として働き、ドーパミンの合成と放出を抑制する。またシナプス後D<sub>2</sub>受容体には遮断薬として働いて、抗精神病効果を発揮すると推定されている。一方、ドーパミン伝達が低下した状態では、アリピプラゾールは機能的に本来の作動薬として作用し、ドーパミン機能を調節することで、D<sub>2</sub> | アリピプラゾールは、D<sub>2</sub> 受容体の部分作動薬でありD<sub>2</sub> に高い親和性を示すが、その固有活性は内因性のドーパミンよりも低い。この特性によりシナプス間隙のドーパミン量に応じて、[[遮断薬]](antagonist)あるいは[[作動薬]](agonist)として作用が変化する。例えばドーパミンが過剰な状態では、シナプス前のドーパミン自己受容体に作動薬として働き、ドーパミンの合成と放出を抑制する。またシナプス後D<sub>2</sub>受容体には遮断薬として働いて、抗精神病効果を発揮すると推定されている。一方、ドーパミン伝達が低下した状態では、アリピプラゾールは機能的に本来の作動薬として作用し、ドーパミン機能を調節することで、D<sub>2</sub>受容体の完全遮断薬である第1世代抗精神病薬がもたらすようなドーパミン神経伝達の低下状態が持続することを防ぐことが可能となる。なお、アリピプラゾールは5-HT<sub>1A</sub>受容体部分作動作用も有しているが、臨床効果にどれほど寄与するかは不明である。 | ||
== 有効性 == | == 有効性 == | ||
| 163行目: | 71行目: | ||
=== 陽性症状と陰性症状 === | === 陽性症状と陰性症状 === | ||
第2世代抗精神病薬と第1世代抗精神病薬の有効性を比較した150本の無作為化二重盲検比較試験のメタ解析 <ref name="ref3"><pubmed> 19058842 </pubmed></ref>では、4種類の第2世代抗精神病薬 (アミスルピリド(amisulpiride)、クロザピン、オランザピン、リスペリドン) が、[[陽性症状]]に対して第1世代抗精神病薬よりも有意に高いeffect size (-0.13〜-0.36)を示したが、他の第2世代抗精神病薬 (アリピプラゾール、クエチアピン、セルチンドール(sertindole)、ジプラシドン、ゾテピン)は、第1世代抗精神病薬と有意差がみられなかった。陰性症状に対しても、上記の4種類の第2世代抗精神病薬が、第1世代抗精神病薬よりも有意に高いeffect size (-0.13〜-0.32)を示したが、他の第2世代抗精神病薬は、第1世代抗精神病薬と有意差を認めなかった。ただし、一次性の陰性症状に対する有効性は、低用量のアミスルピリドを除いて明らかではなく、第2世代抗精神病薬の一部は、抑うつ症状に対する改善効果や低い錐体外路症状発現率を介して、二次性の陰性症状に効果を発揮している可能性がある<ref name="ref1" />。 | |||
抗精神病薬の短期間の有効性 (efficacy)を検証する臨床試験は、厳密に統制された条件下で実施するため、その結果が日常臨床にすぐに還元できるとは限らない。そこで、対象患者や併用薬などの制限を緩和し、実際の臨床現場の実情を反映した総合的な治療効果(有用性:effectiveness)を示す評価指標を用いたより長期のアウトカム(effectiveness)試験が、デザインされ実施されてきた。その代表的な試験は、米国政府主導で実施された[[ | 抗精神病薬の短期間の有効性 (efficacy)を検証する臨床試験は、厳密に統制された条件下で実施するため、その結果が日常臨床にすぐに還元できるとは限らない。そこで、対象患者や併用薬などの制限を緩和し、実際の臨床現場の実情を反映した総合的な治療効果(有用性:effectiveness)を示す評価指標を用いたより長期のアウトカム(effectiveness)試験が、デザインされ実施されてきた。その代表的な試験は、米国政府主導で実施された[[wikipedia:Clinical Antipsychotic Trials of Intervention Effectiveness|Clinical Antipsychotic Trials of Intervention Effectiveness]] (CATIE)である <ref><pubmed> 16172203 </pubmed></ref>。CATIEは1,493名の慢性期統合失調症患者を対象とした3相から成る18か月間の多施設二重盲検比較試験で、主要評価項目は「あらゆる理由による治療中断」である。第I相では、第2世代抗精神病薬4剤 (オランザピン、クエチアピン、リスペリドン、ジプラシドン)と第1世代抗精神病薬のペルフェナジンが比較され、オランザピンが最も低い治療中断率(64%)を示したが、その他の第2世代抗精神病薬は陽性症状や陰性症状に対してペルフェナジンと有意な違いを示さなかった。 | ||
498名の初回エピソード統合失調症患者を対象とした[[ | 498名の初回エピソード統合失調症患者を対象とした[[wikipedia:European First-Episode Schizophrenia Trial|European First-Episode Schizophrenia Trial]] (EUFEST)は、1年間の多施設オープン無作為化試験であり、アミスルプリド、オランザピン、クエチアピンおよびジプラシドンのeffectivenessが、低用量のハロペリドールと比較された <ref><pubmed> 18374841 </pubmed></ref>。この試験の主要評価項目も「あらゆる理由による治療中断」であった。治療中断率はアミスルプリド 40%、オランザピン 33%、クエチアピン 53%、ジプラシドン 45%、 ハロペリドール 72%であり、第2世代抗精神病薬はハロペリドールより有意に治療中断率が低かった。しかし、陽性症状や陰性症状に関しては、薬剤群間で有意な差はみられなかった。したがって、CATIE とEUFEST 試験の結果からは、第2世代抗精神病薬が第1世代抗精神病薬より陽性症状や陰性症状に関して明らかに優っているわけではなく、薬剤間の違いも大きくないことが判明した。 | ||
=== 認知機能障害に対する効果 === | === 認知機能障害に対する効果 === | ||
統合失調症の認知機能障害は、患者の社会的・職業的機能に影響するため疾患の中核的障害と考えられ、重要な治療標的となっている。現在までの知見で、第2世代抗精神病薬は第1世代抗精神病薬より認知機能改善効果が若干大きい可能性がある。例えばWoodwardら <ref><pubmed> 15784157 </pubmed></ref>は、第2世代抗精神病薬と第1世代抗精神病薬を比較した14本の無作為化比較試験をメタ解析し、第2世代抗精神病薬4剤 (クロザピン、オランザピン、リスペリドン、クエチアピン)の[[global cognitive index]]のeffect sizeは0.24で、第1世代抗精神病薬より改善効果が若干優れ、項目別では学習と処理速度が有意であった。また認知機能改善プロフィールは薬剤ごとに異なる可能性を示唆した。 | |||
=== 抑うつ症状に対する効果 === | === 抑うつ症状に対する効果 === | ||
第2世代抗精神病薬の抗うつ効果に関して、placeboと比較した無作為化対照試験では、アミスルプリド、アリピプラゾール、オランザピン、クエチアピン、リスペリドン、ジプラシドンは、有意な抗うつ効果を有する可能性が示唆されている <ref><pubmed> 15812601 </pubmed></ref>。また、第2世代抗精神病薬と第1世代抗精神病薬の有効性を比較したメタ解析 <ref name="ref3" />では、アミスルプリド、アリピプラゾール、クロザピン、オランザピンおよびクエチアピンは、抑うつ症状に関しては第1世代抗精神病薬より有意に優れた有効性を示した。しかし、これらの第2世代抗精神病薬薬剤間での優劣は不明である。 | |||
=== 再発予防効果 === | === 再発予防効果 === | ||
Leuchtら <ref name="ref3" /> | Leuchtら <ref name="ref3" />は、第1世代抗精神病薬と第2世代抗精神病薬を比較した14本の長期投与試験についてメタ解析を実施し再発率を検討した。その結果、オランザピン、リスペリドンおよびセルチンドールは、第1世代抗精神病薬よりも有意に再発予防効果が優れていた。この理由として、有効性が高いためかadherenceが向上したためか、あるいはその両者によるかは不明である。 | ||
== 副作用 == | == 副作用 == | ||
抗精神病薬は中枢性、末梢性に多様な副作用を示すが、その出現頻度や程度は薬物ごとに異なり用量も影響する。副作用はD<sub>2</sub> 受容体、[[ | 抗精神病薬は中枢性、末梢性に多様な副作用を示すが、その出現頻度や程度は薬物ごとに異なり用量も影響する。副作用はD<sub>2</sub> 受容体、[[ムスカリン性acetylcholine (Ach)受容体]]、[[adrenaline (α<sub>1</sub>)受容体]]、[[ヒスタミン (H<sub>1</sub>)受容体]]が、抗精神病薬で遮断された結果生じるものが多い <ref name="ref1" />。多くの副作用は投与早期に出現し、長期投与で耐性を生じやすいが、持続的使用の後出現するものもある。軽微な副作用は、抗精神病薬の減量や薬物の変更、副作用止めの薬物の追加などで対応可能な場合が多い。しかし、頻度は低いが[[wikipedia:JA:悪性症候群|悪性症候群]]など重篤な副作用もある。一般的に第2世代抗精神病薬は、第1世代抗精神病薬と比較して、錐体外路症状、過鎮静、抗コリン性副作用の発現頻度は低いが、体重増加や[[wikipedia:JA:高血糖|高血糖]]など代謝性の副作用に注意が必要である。 | ||
=== 錐体外路症状 === | === 錐体外路症状 === | ||
| 191行目: | 99行目: | ||
=== 悪性症候群 === | === 悪性症候群 === | ||
抗精神病薬の投与開始や増量時、あるいは抗Parkinson薬や抗不安薬の減量・中止時に、脱水や身体的衰弱などが重なった場合に生じやすい。症状は高熱、錐体外路症状(筋固縮、振戦、無動など)、[[自律神経症状]]([[wikipedia:JA:発汗|発汗]]、[[wikipedia:JA:頻脈|頻脈]]、[[wikipedia:JA:血圧|血圧]]変動など)、意識障害などが出現し、[[wikipedia:JA:CPK|CPK]]、血中・尿中[[wikipedia:JA:myoglobin|myoglobin]]の上昇などがみられ、重篤な場合は[[wikipedia:JA:腎不全|腎不全]]を合併し、死に至ることもある。[[wikipedia:JA:横紋筋融解症|横紋筋融解症]]を合併する時もある。 | |||
=== 自律神経症状 === | === 自律神経症状 === | ||
抗コリン性の副作用として頻度の高い症状は、[[ | 抗コリン性の副作用として頻度の高い症状は、[[wikipedia:JA:口渇|口渇]]、[[wikipedia:JA:便秘|便秘]]、[[wikipedia:JA:麻痺性イレウス|麻痺性イレウス]]、排尿困難([[wikipedia:JA:尿閉|尿閉]])、かすみ目、[[wikipedia:JA:鼻閉|鼻閉]]、[[wikipedia:JA:頻脈|頻脈]]、血圧上昇、[[wikipedia:JA:眼圧|眼圧]]上昇([[wikipedia:JA:緑内障|緑内障]]の悪化) であり、低力価薬や併用した抗コリン薬で生じやすい。いずれも不快な症状でadherence低下につながりやすい。 抗α<sub>1</sub>性副作用としては、[[wikipedia:JA:低血圧|低血圧]](特に[[wikipedia:JA:起立性低血圧|起立性低血圧]])とそれに伴う[[wikipedia:JA:ふらつき|ふらつき]]、[[wikipedia:JA:めまい|めまい]]、[[wikipedia:JA:立ちくらみ|立ちくらみ]]、[[wikipedia:JA:倦怠感|倦怠感]]がある。稀に持続性勃起症が生じる。また心・循環器系副作用として、[[wikipedia:JA:心電図|心電図]]異常(特に[[wikipedia:JA:QTc延長|QTc延長]])と致死性[[wikipedia:JA:不整脈|不整脈]] (torsade de pointes)が生じる可能性がある。 | ||
=== 代謝内分泌系症状 === | === 代謝内分泌系症状 === | ||
代謝系副作用として、食欲亢進、体重増加、高血糖(耐糖能異常)、[[wikipedia:JA:高脂血症|高脂血症]]、[[wikipedia:JA:II型糖尿病|II型糖尿病]]が問題となる。食欲増加には、H<sub>1</sub>受容体や5-HT<sub>2C</sub>受容体の遮断作用の関与が推定されている。清涼飲料水の多飲や過食後、著しい高血糖から[[wikipedia:JA:糖尿病性ケトアシドーシス|糖尿病性ケトアシドーシス]](ketoacidosis)や[[wikipedia:JA:糖尿病性昏睡|糖尿病性昏睡]]など重篤な副作用が生じることがある。第2世代抗精神病薬の中では、クロザピンやオランザピンが代謝系副作用の頻度が高い。 内分泌系副作用としては高プロラクチン血症が代表的であり、それに起因する乳汁分泌、無月経、女性化乳房、性欲減退、勃起障害や射精障害などの性機能障害がある。下垂体のD<sub>2</sub>受容体の遮断作用に基づくとされ、リスペリドンやパリペリドンを除く第2世代抗精神病薬は、通常の用量下では高プロラクチン血症を来たしにくい。 抗精神病薬を長期服用している患者には、病的な多飲水を原因とする[[低Na血症]]を認める場合がある。[[抗利尿ホルモン]]不適合分泌症候群が生じていることもあり、さらに低Na血症が進行すると、水中毒に至り意識障害やけいれんに至る。 | |||
=== その他の副作用 === | === その他の副作用 === | ||
抗精神病薬の投与初期や大量投与では、抗α<sub>1</sub>作用や抗H<sub>1</sub>作用により、日中の眠気や過鎮静が生じることがある。また薬剤性肝障害や薬疹などのアレルギー反応はフェノチアジン系薬物で多い。その他、けいれん、顆粒球減少症、色素沈着、[[ | 抗精神病薬の投与初期や大量投与では、抗α<sub>1</sub>作用や抗H<sub>1</sub>作用により、日中の眠気や過鎮静が生じることがある。また薬剤性肝障害や薬疹などのアレルギー反応はフェノチアジン系薬物で多い。その他、けいれん、顆粒球減少症、色素沈着、[[wikipedia:JA:光線過敏症|光線過敏症]]などの副作用がみられることがある。 | ||
== 参考文献 == | |||
<references /> | |||
(執筆者:宮本聖也 担当編集委員:加藤忠史) | |||
2012年4月17日 (火) 00:43時点における版
英: antipsychotics, neuroleptics
抗精神病薬は、向精神薬 (psychotropic drugs)の一種で抗精神病作用、すなわち幻覚、妄想、作為体験などの精神病症状に対して効果を有する薬物の総称である。主に統合失調症や双極性障害などの精神疾患の治療を目的として用いられる。神経遮断薬 (neuroleptics)や強力精神安定剤 (major tranquilizer)とも呼ばれる。
歴史
抗精神病薬の歴史は、1950年に中枢作用の強い抗ヒスタミン(histamine)薬として開発されたクロルプロマジン(chlorpromazine)に端を発する。当初は外科医のLaboritが、強化麻酔(人工冬眠)に用いて外科手術後のショックを予防する目的で使用した。その後、1952年に精神科医のDelayとDenikerが、統合失調症や躁病患者に投与したところ、覚醒状態で抗幻覚・妄想作用と鎮静作用を示すことを報告した。1958年にベルギーのJanssenは、ブチロフェノン(butyrophenone)系抗精神病薬のハロペリドール(haloperidol)を開発した。1963年にはCarlssonとLindqvistが、これらの薬物が脳内ドーパミン(dopamine)の代謝産物を増加させることを報告し、統合失調症の「ドーパミン仮説」(ドーパミン神経の過剰興奮が統合失調症の病因)の糸口を作った。その後ベンズアミド(benzamide)系、イミノジベンジル(iminodibenzyl)系などの第1世代(定型または従来型)抗精神病薬 (First-Generation Antipsychotics)が数多く開発され上市された。 第1世代抗精神病薬の開発コンセプトは、抗精神病薬の臨床用量(または血漿中濃度)が、ドーパミン D2受容体遮断作用と正の相関を示すため、D2受容体の遮断作用が抗精神病効果の発現に本質的に重要であるというものであった。
しかし第1世代抗精神病薬は、①アカシジア (akathisia)や遅発性ジスキネジア (tardive dyskinesia; TD)などの急性および慢性の錐体外路系副作用 (extrapyramidal side effects)を高率に生じさせたり、②乳汁分泌や性機能障害を生じる可能性のある高プロラクチン(prolactin)血症を起こしたり、③陰性症状(意欲低下、感情の平板化、社会的引きこもりなど)や認知機能障害(記憶力低下、注意力低下、遂行機能障害など)に対して無効あるいは増悪させたりするなどの宿命的問題点があった [1]。
1958年に合成された第2世代(非定型または新規)抗精神病薬(Second-Generation Antipsychotics)の原型であるクロザピン(clozapine)は、第1世代抗精神病薬の欠点をかなり克服したが、約1%の頻度で無顆粒球症という致死的副作用が発現したため、本邦を含む多くの国で開発が中断された。しかし、クロザピンの薬理作用の研究が進むにつれて、抗D2受容体作用に比べて相対的に強いセロトニン(serotonin) 5-HT2A受容体遮断作用が注目されるようになった。Janssenは、5-HT2A受容体遮断作用を有するピパンペロン(pipamperone)が、陰性症状に比較的有効で錐体外路症状の発現が少ない事実に気づき、1984年にセロトニンドーパミン遮断薬 (Serotonin Dopamine Antagonist; SDA)の原型といえるリスペリドン(risperidone)の開発を導いた。
さらに無顆粒球症を伴わず、クロザピン類似の薬理学的プロフィールを持つ抗精神病薬の開発が進み、1982年にオランザピン(olanzapine)、1985年にクエチアピン(quetiapine)が合成された。本邦でも1987年にSDAとしてペロスピロン(perospirone)が開発された。
クロザピンは、1988年に米国のKaneらによって治療抵抗性統合失調症に対するクロルプロマジンとの二重盲検比較試験で優位性が証明されたのを受け、1990年米国で承認された。現在厳密な副作用モニタリングのもと、世界100ヶ国以上の国々で上市されている。
本邦では2006年にD2受容体部分作動薬のアリピプラゾール(aripiprazole)が、2008年にブロナンセリン(blonanserin)、2009年にクロザピン、2011年にリスペリドンの主要活性代謝産物であるパリペリドン(paliperidone)が上市され、2012年4月現在8種類の第2世代抗精神病薬が統合失調症の薬物治療の中心となっている。特に、アリピプラゾールをはじめとするD2受容体部分作動薬は、第1世代抗精神病薬や第2世代抗精神病薬とは異なる機序でドーパミン伝達の安定化作用を有しているため、第3世代抗精神病薬 (Third-Generation Antipsychotics)と位置付ける研究者もいる。
対象疾患
抗精神病薬は、統合失調症、統合失調感情障害、短期(急性一過性)精神病性障害や妄想性障害といった統合失調症圏の精神病性障害を主な対象疾患とするが、双極性障害(躁うつ病)や認知症の問題行動(暴力や興奮など)にも有用である。さらに基礎疾患によらず、幻覚妄想状態や精神運動興奮を呈する場合は、保険適応外で使用されることが多い。また、強度の不安や焦燥感、重度のうつ状態や不眠、せん妄、悪心・嘔吐、吃逆に対する対処薬として利用される場合がある。
種類
第1世代
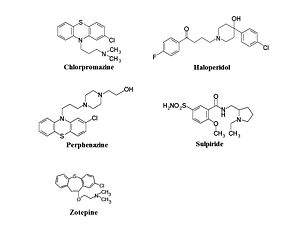
フェノチアジン(Phenothiazine)誘導体として、クロルプロマジン、フルフェナジン(fluphenazine)、レボメプロマジン (levomepromazine)、ペルフェナジン(perphenazine)、プロペリシアジン(propericiazine)などが挙げられる。ブチロフェノン誘導体として、ブロムペリドール(bromperidol)、ハロペリドール、ピパンペロン、チミペロン(timiperone)などが含まれる。ベンズアミド誘導体として、ネモナプリド(nemonapride)、スルピリド(sulpiride)、スルトプリド(sultopride)などがある。イミノジベンジル誘導体として、カルピプラミン(carpipramine)、クロカプラミン(clocapramine)、モサプラミン(mosapramine)、ジフェニルブチルピペリジン(diphenylbutylpiperidine)誘導体としてピモジド(pimozide)、インドール(indole)誘導体としてオキシペルチン(oxypertine)がある。チエピン(thiepin)誘導体としてゾテピン(zotepine)があるが、欧米では第2世代抗精神病薬に分類されることが多い。(図1)
第2世代
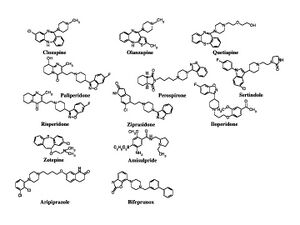
SDAとしてリスペリドン、ペロスピロン、パリペリドン、ルラシドン(lurasidone)(本邦臨床試験中)、ジプラシドン(ziprasidone)(本邦臨床試験中)、アセナピン(asenapine)(本邦臨床試験中)がある。多元受容体標的化抗精神病薬 (multi-acting receptor-targeted antipsychotics; MARTA)としてクロザピン、オランザピン、クエチアピンがあるが、欧米ではMARTAの呼称は一般的ではない。ブロナンセリンはD2受容体の親和性が5-HT2A受容体の親和性よりも強い第2世代抗精神病薬であるため、dopamine serotonin antagonist (DSA)と呼ぶ研究者もいる。なお、本邦では未承認のアミスルプリド(amisulpride)は、D2受容体よりもD3受容体に選択性が高いベンズアミド誘導体であり第2世代抗精神病薬に分類される(図2)。
第3世代
アリピプラゾールが現在上市されており、dopamine system stabilizer (DSS)とも称される。D2受容体と5-HT1A受容体部分作動作用などを有するOPC-34712と、D2とD3受容体の遮断作用と部分作動作用を有するカリプラジン(cariprazine)は、2012年4月現在臨床試験中である。
作用機序
共通の作用機序
ドーパミン神経系は、中脳辺縁系、中脳皮質系、黒質線条体系、下垂体漏斗系の4つの回路がある。ドーパミン受容体はD1からD5まで5種類のsubtypeが存在し、脳内分布も異なる。また存在する場所によっては、シナプス前部位受容体(自己受容体)やシナプス後部位受容体に分けられる。幻覚や妄想などの精神病症状は、中脳辺縁系においてドーパミン神経の過活動が生じて神経終末からのドーパミン放出が増加し、シナプス後部のD2受容体が過剰に刺激されて生じると推定されている。現在使用可能なすべての抗精神病薬は、程度の差はあるがシナプス後部位D2受容体に対して遮断作用を有し、中脳辺縁系のドーパミンの過剰な伝達を阻害して精神病症状を緩和すると推定されている[2]。
前述したようにin vitroでは、抗精神病薬の臨床用量とD2受容体阻害能は正の相関を示すが、D2受容体阻害作用が強ければ強いほど抗精神病効果が高まるわけではない。抗精神病薬の用量を上げてD2受容体の阻害がある一定のレベルを超えると、臨床効果は頭打ちとなり、錐体外路症状や過鎮静などの副作用の発現頻度が増加する。
抗精神病薬がヒト脳内のD2受容体とどのような結合状態にあるかに関して、1990年代後半からPositron Emission Tomography (PET)やSingle Photon Emission Computed Tomography (SPECT)を用いた脳画像研究が盛んに行われ、患者の脳内 (in vivo)での挙動が視覚的に把握できるようになり、新しい知見が得られた。すなわち、抗精神病薬投与による抗精神病効果の出現には、65~70% 以上の線条体でのD2受容体の占拠率が必要であるが、80%以上占拠すると錐体外路症状の頻度が有意に増加する。したがって、治療効果を最大にして錐体外路症状を最小限にするための至適な線条体D2 受容体の占拠率は、65~80%であることが判明した。
しかし、多数のPETやSPECT研究結果を分析したStoneら [3]のメタ解析では、線条体のD2受容体阻害は治療効果よりも錐体外路症状の発現に関与し、抗精神病効果に関係するのは側頭葉皮質のD2受容体であると主張している。しかし、側頭葉皮質以外のD2受容体も抗精神病効果に関与する可能性は十分あり、今後真の標的部位を探求する脳画像研究が必要である。
第2世代抗精神病薬の薬理学的特徴
ほとんどの第2世代抗精神病薬は、有効治療用量内では錐体外路症状や高プロラクチン血症の発現頻度が少ない。この第2世代抗精神病薬のメリットは、薬理学的に第1世代抗精神病薬とはいくつか異なった作用機序に由来する。ただし、D2受容体阻害作用を除いて、すべての第2世代抗精神病薬に共通する薬理学的作用機序はいまだ明らかでない。 Meltzerら[4]は1989年に、第2世代抗精神病薬の「非定型性 (atypicality)」すなわち錐体外路症状を惹起しない用量範囲内で抗精神病効果を示すという特性に対して最も重要なのは、D2受容体遮断作用に比べて5-HT2A受容体遮断作用が相対的に強いことであると主張し、「セロトニン-ドーパミン仮説」を提唱した。縫線核を起始核とするセロトニン神経は、中脳黒質から線条体に投射するドーパミン神経に対して抑制的に作用しており、ドーパミン神経上の5-HT2A受容体を遮断することで、ドーパミン神経の抑制が解除(脱抑制)されてドーパミンの放出を促進し、抗精神病薬によるD2受容体遮断を一部緩和して錐体外路症状を軽減すると考えられている。
またD2受容体遮断作用に5-HT2A受容体遮断作用が加わると、前頭前野や海馬でドーパミンの放出が亢進して、陰性症状や認知機能障害に対して効果を発揮すると推定されている。
次に多くの第2世代抗精神病薬は、第1世代抗精神病薬よりもD2受容体遮断作用が弱いという特徴がある。抗精神病薬のD2受容体に対する親和性の強さは、内因性のドーパミンと比較して強い場合には固い結合 (tight binding)、弱い場合には緩い結合 (loose binding)と呼ばれる。また抗精神病薬とD2受容体との結合-解離の時間経過に関して、PETやSPECTによる研究および血漿中プロラクチン値の変動などにより、1日1回投与でも24時間以上D2受容体の阻害が持続する抗精神病薬と、24時間以内にD2受容体の占拠率が速やかに低下するか、D2受容体から速やかに解離する薬物に分類される。
KapurとSeemanら [5]は、抗精神病薬がいかに速くD2受容体に結合するかよりも、D2受容体からいかに速く解離するか(koffで示す)が、第2世代抗精神病薬の“非定型性”に重要であるとする「急速解離 (fast dissociation)仮説」を提唱した。すなわちすべての抗精神病薬は、D2受容体からの解離の速度にかかわらず、その占拠率に応じて持続性の ドーパミン伝達を抑制する。しかし、D2受容体から素早く解離できる薬剤は、ストレスなどによるドーパミンの一過性の過剰放出に反応して速やかに置換することで、ドーパミン伝達をより生理的に近い状態に保持できると考えた。Loose bindingは、内因性のドーパミンよりD2受容体に対する親和性が弱いクロザピン、クエチアピン、オランザピンで錐体外路症状が少ない理由の一つとなり、fast dissociationはクロザピン、クエチアピン、ペロスピロンによる錐体外路症状や高プロラクチン血症の発現頻度が少ない機序を説明可能である。しかしリスペリドンは、内因性のドーパミンより強く結合し、1日1回投与でも24時間以上D2受容体の阻害が持続する抗精神病薬であり、彼らの理論に当てはまらない。同様に、第2世代抗精神病薬のブロナンセリンやオランザピンは遅いkoffを示す。したがって「セロトニン-ドーパミン仮説」や「急速解離仮説」は、多くの第2世代抗精神病薬の作用機序を説明できるのは事実であるが、すべての第2世代抗精神病薬に共通した機序ではない点に留意する必要がある [2]。
第2世代抗精神病薬の中には5-HT2C、5-HT6、5-HT7受容体遮断作用や5-HT1A受容体部分作動作用を有する薬剤がある。5-HT1A受容体は、縫線核ではシナプス前の細胞体に自己受容体として存在し、5-HT ニューロンの発火率を抑制する。また辺縁系や大脳皮質ではシナプス後に存在し、発火率を抑制している。クロザピン、ペロスピロン、クエチアピンおよびジプラシドンは、5-HT1A受容体部分作動作用を有しており、D2と5-HT2A受容体間の相互作用と5-HT1A受容体の機能的活性化を介して、前頭葉皮質のドーパミン遊離を促進することで、陰性症状や認知機能障害、不安・抑うつ症状に対する効果が期待できる可能性がある。
ドーパミン部分作動薬の作用機序
アリピプラゾールは、D2 受容体の部分作動薬でありD2 に高い親和性を示すが、その固有活性は内因性のドーパミンよりも低い。この特性によりシナプス間隙のドーパミン量に応じて、遮断薬(antagonist)あるいは作動薬(agonist)として作用が変化する。例えばドーパミンが過剰な状態では、シナプス前のドーパミン自己受容体に作動薬として働き、ドーパミンの合成と放出を抑制する。またシナプス後D2受容体には遮断薬として働いて、抗精神病効果を発揮すると推定されている。一方、ドーパミン伝達が低下した状態では、アリピプラゾールは機能的に本来の作動薬として作用し、ドーパミン機能を調節することで、D2受容体の完全遮断薬である第1世代抗精神病薬がもたらすようなドーパミン神経伝達の低下状態が持続することを防ぐことが可能となる。なお、アリピプラゾールは5-HT1A受容体部分作動作用も有しているが、臨床効果にどれほど寄与するかは不明である。
有効性
陽性症状と陰性症状
第2世代抗精神病薬と第1世代抗精神病薬の有効性を比較した150本の無作為化二重盲検比較試験のメタ解析 [6]では、4種類の第2世代抗精神病薬 (アミスルピリド(amisulpiride)、クロザピン、オランザピン、リスペリドン) が、陽性症状に対して第1世代抗精神病薬よりも有意に高いeffect size (-0.13〜-0.36)を示したが、他の第2世代抗精神病薬 (アリピプラゾール、クエチアピン、セルチンドール(sertindole)、ジプラシドン、ゾテピン)は、第1世代抗精神病薬と有意差がみられなかった。陰性症状に対しても、上記の4種類の第2世代抗精神病薬が、第1世代抗精神病薬よりも有意に高いeffect size (-0.13〜-0.32)を示したが、他の第2世代抗精神病薬は、第1世代抗精神病薬と有意差を認めなかった。ただし、一次性の陰性症状に対する有効性は、低用量のアミスルピリドを除いて明らかではなく、第2世代抗精神病薬の一部は、抑うつ症状に対する改善効果や低い錐体外路症状発現率を介して、二次性の陰性症状に効果を発揮している可能性がある[1]。
抗精神病薬の短期間の有効性 (efficacy)を検証する臨床試験は、厳密に統制された条件下で実施するため、その結果が日常臨床にすぐに還元できるとは限らない。そこで、対象患者や併用薬などの制限を緩和し、実際の臨床現場の実情を反映した総合的な治療効果(有用性:effectiveness)を示す評価指標を用いたより長期のアウトカム(effectiveness)試験が、デザインされ実施されてきた。その代表的な試験は、米国政府主導で実施されたClinical Antipsychotic Trials of Intervention Effectiveness (CATIE)である [7]。CATIEは1,493名の慢性期統合失調症患者を対象とした3相から成る18か月間の多施設二重盲検比較試験で、主要評価項目は「あらゆる理由による治療中断」である。第I相では、第2世代抗精神病薬4剤 (オランザピン、クエチアピン、リスペリドン、ジプラシドン)と第1世代抗精神病薬のペルフェナジンが比較され、オランザピンが最も低い治療中断率(64%)を示したが、その他の第2世代抗精神病薬は陽性症状や陰性症状に対してペルフェナジンと有意な違いを示さなかった。
498名の初回エピソード統合失調症患者を対象としたEuropean First-Episode Schizophrenia Trial (EUFEST)は、1年間の多施設オープン無作為化試験であり、アミスルプリド、オランザピン、クエチアピンおよびジプラシドンのeffectivenessが、低用量のハロペリドールと比較された [8]。この試験の主要評価項目も「あらゆる理由による治療中断」であった。治療中断率はアミスルプリド 40%、オランザピン 33%、クエチアピン 53%、ジプラシドン 45%、 ハロペリドール 72%であり、第2世代抗精神病薬はハロペリドールより有意に治療中断率が低かった。しかし、陽性症状や陰性症状に関しては、薬剤群間で有意な差はみられなかった。したがって、CATIE とEUFEST 試験の結果からは、第2世代抗精神病薬が第1世代抗精神病薬より陽性症状や陰性症状に関して明らかに優っているわけではなく、薬剤間の違いも大きくないことが判明した。
認知機能障害に対する効果
統合失調症の認知機能障害は、患者の社会的・職業的機能に影響するため疾患の中核的障害と考えられ、重要な治療標的となっている。現在までの知見で、第2世代抗精神病薬は第1世代抗精神病薬より認知機能改善効果が若干大きい可能性がある。例えばWoodwardら [9]は、第2世代抗精神病薬と第1世代抗精神病薬を比較した14本の無作為化比較試験をメタ解析し、第2世代抗精神病薬4剤 (クロザピン、オランザピン、リスペリドン、クエチアピン)のglobal cognitive indexのeffect sizeは0.24で、第1世代抗精神病薬より改善効果が若干優れ、項目別では学習と処理速度が有意であった。また認知機能改善プロフィールは薬剤ごとに異なる可能性を示唆した。
抑うつ症状に対する効果
第2世代抗精神病薬の抗うつ効果に関して、placeboと比較した無作為化対照試験では、アミスルプリド、アリピプラゾール、オランザピン、クエチアピン、リスペリドン、ジプラシドンは、有意な抗うつ効果を有する可能性が示唆されている [10]。また、第2世代抗精神病薬と第1世代抗精神病薬の有効性を比較したメタ解析 [6]では、アミスルプリド、アリピプラゾール、クロザピン、オランザピンおよびクエチアピンは、抑うつ症状に関しては第1世代抗精神病薬より有意に優れた有効性を示した。しかし、これらの第2世代抗精神病薬薬剤間での優劣は不明である。
再発予防効果
Leuchtら [6]は、第1世代抗精神病薬と第2世代抗精神病薬を比較した14本の長期投与試験についてメタ解析を実施し再発率を検討した。その結果、オランザピン、リスペリドンおよびセルチンドールは、第1世代抗精神病薬よりも有意に再発予防効果が優れていた。この理由として、有効性が高いためかadherenceが向上したためか、あるいはその両者によるかは不明である。
副作用
抗精神病薬は中枢性、末梢性に多様な副作用を示すが、その出現頻度や程度は薬物ごとに異なり用量も影響する。副作用はD2 受容体、ムスカリン性acetylcholine (Ach)受容体、[[adrenaline (α1)受容体]]、[[ヒスタミン (H1)受容体]]が、抗精神病薬で遮断された結果生じるものが多い [1]。多くの副作用は投与早期に出現し、長期投与で耐性を生じやすいが、持続的使用の後出現するものもある。軽微な副作用は、抗精神病薬の減量や薬物の変更、副作用止めの薬物の追加などで対応可能な場合が多い。しかし、頻度は低いが悪性症候群など重篤な副作用もある。一般的に第2世代抗精神病薬は、第1世代抗精神病薬と比較して、錐体外路症状、過鎮静、抗コリン性副作用の発現頻度は低いが、体重増加や高血糖など代謝性の副作用に注意が必要である。
錐体外路症状
抗精神病薬が黒質線条体系のD2受容体を遮断した結果、脳内のドーパミンとAchのバランスが崩れて出現する。ハロペリドールなど高力価薬で多く、低力価薬や第2世代抗精神病薬では少ない。投与開始後早期に現れる急性の錐体外路症状と、長期投与で出現する遅発性の錐体外路症状がある。 急性の錐体外路症状として、急性ジストニア (dystonia)、parkinsonism、アカシジアがある。急性ジストニアは、眼球上転、舌・頚部・体幹のねじれや突っ張りが特徴的である。Parkinsonismは、筋固縮、振戦、無動 (akinesia)を3徴候とし、仮面様顔貌、小刻み歩行や流涎もみられる。アカシジア(静座不能症)は、「じっとしていられない、足がムズムズする」などの異常な感覚を自覚し、不眠、不安、焦燥感を伴うことが多く、精神症状との鑑別が重要である。 遅発性の錐体外路症状は、D2受容体の過感受性によるとされるTDが代表的である。口唇や舌をモグモグ動かすような口周囲の不随意運動がほとんどである。抗コリン薬はTDを悪化させるので注意が必要である。
悪性症候群
抗精神病薬の投与開始や増量時、あるいは抗Parkinson薬や抗不安薬の減量・中止時に、脱水や身体的衰弱などが重なった場合に生じやすい。症状は高熱、錐体外路症状(筋固縮、振戦、無動など)、自律神経症状(発汗、頻脈、血圧変動など)、意識障害などが出現し、CPK、血中・尿中myoglobinの上昇などがみられ、重篤な場合は腎不全を合併し、死に至ることもある。横紋筋融解症を合併する時もある。
自律神経症状
抗コリン性の副作用として頻度の高い症状は、口渇、便秘、麻痺性イレウス、排尿困難(尿閉)、かすみ目、鼻閉、頻脈、血圧上昇、眼圧上昇(緑内障の悪化) であり、低力価薬や併用した抗コリン薬で生じやすい。いずれも不快な症状でadherence低下につながりやすい。 抗α1性副作用としては、低血圧(特に起立性低血圧)とそれに伴うふらつき、めまい、立ちくらみ、倦怠感がある。稀に持続性勃起症が生じる。また心・循環器系副作用として、心電図異常(特にQTc延長)と致死性不整脈 (torsade de pointes)が生じる可能性がある。
代謝内分泌系症状
代謝系副作用として、食欲亢進、体重増加、高血糖(耐糖能異常)、高脂血症、II型糖尿病が問題となる。食欲増加には、H1受容体や5-HT2C受容体の遮断作用の関与が推定されている。清涼飲料水の多飲や過食後、著しい高血糖から糖尿病性ケトアシドーシス(ketoacidosis)や糖尿病性昏睡など重篤な副作用が生じることがある。第2世代抗精神病薬の中では、クロザピンやオランザピンが代謝系副作用の頻度が高い。 内分泌系副作用としては高プロラクチン血症が代表的であり、それに起因する乳汁分泌、無月経、女性化乳房、性欲減退、勃起障害や射精障害などの性機能障害がある。下垂体のD2受容体の遮断作用に基づくとされ、リスペリドンやパリペリドンを除く第2世代抗精神病薬は、通常の用量下では高プロラクチン血症を来たしにくい。 抗精神病薬を長期服用している患者には、病的な多飲水を原因とする低Na血症を認める場合がある。抗利尿ホルモン不適合分泌症候群が生じていることもあり、さらに低Na血症が進行すると、水中毒に至り意識障害やけいれんに至る。
その他の副作用
抗精神病薬の投与初期や大量投与では、抗α1作用や抗H1作用により、日中の眠気や過鎮静が生じることがある。また薬剤性肝障害や薬疹などのアレルギー反応はフェノチアジン系薬物で多い。その他、けいれん、顆粒球減少症、色素沈着、光線過敏症などの副作用がみられることがある。
参考文献
- ↑ 1.0 1.1 1.2 Miyamoto S, Merrill DB, Lieberman JA, Fleischhacker WW, Marder SR:
Antipsychotic Drugs, In PSYCHIATRY (Third edition)
Tasman A, Kay J, Lieberman JA, First MB, Maj M eds
pp. 2161-2201
John Wiley & Sons, Ltd (Chichester):2008 - ↑ 2.0 2.1
Miyamoto, S., Duncan, G.E., Marx, C.E., & Lieberman, J.A. (2005).
Treatments for schizophrenia: a critical review of pharmacology and mechanisms of action of antipsychotic drugs. Molecular psychiatry, 10(1), 79-104. [PubMed:15289815] [WorldCat] [DOI] - ↑
Stone, J.M., Davis, J.M., Leucht, S., & Pilowsky, L.S. (2009).
Cortical dopamine D2/D3 receptors are a common site of action for antipsychotic drugs--an original patient data meta-analysis of the SPECT and PET in vivo receptor imaging literature. Schizophrenia bulletin, 35(4), 789-97. [PubMed:18303092] [PMC] [WorldCat] [DOI] - ↑
Meltzer, H.Y., Matsubara, S., & Lee, J.C. (1989).
Classification of typical and atypical antipsychotic drugs on the basis of dopamine D-1, D-2 and serotonin2 pKi values. The Journal of pharmacology and experimental therapeutics, 251(1), 238-46. [PubMed:2571717] [WorldCat] - ↑
Kapur, S., & Seeman, P. (2001).
Does fast dissociation from the dopamine d(2) receptor explain the action of atypical antipsychotics?: A new hypothesis. The American journal of psychiatry, 158(3), 360-9. [PubMed:11229973] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Leucht, S., Corves, C., Arbter, D., Engel, R.R., Li, C., & Davis, J.M. (2009).
Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet (London, England), 373(9657), 31-41. [PubMed:19058842] [WorldCat] [DOI] - ↑
Lieberman, J.A., Stroup, T.S., McEvoy, J.P., Swartz, M.S., Rosenheck, R.A., Perkins, D.O., ..., & Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) Investigators (2005).
Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. The New England journal of medicine, 353(12), 1209-23. [PubMed:16172203] [WorldCat] [DOI] - ↑
Kahn, R.S., Fleischhacker, W.W., Boter, H., Davidson, M., Vergouwe, Y., Keet, I.P., ..., & EUFEST study group (2008).
Effectiveness of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder: an open randomised clinical trial. Lancet (London, England), 371(9618), 1085-97. [PubMed:18374841] [WorldCat] [DOI] - ↑
Woodward, N.D., Purdon, S.E., Meltzer, H.Y., & Zald, D.H. (2005).
A meta-analysis of neuropsychological change to clozapine, olanzapine, quetiapine, and risperidone in schizophrenia. The international journal of neuropsychopharmacology, 8(3), 457-72. [PubMed:15784157] [WorldCat] [DOI] - ↑
Möller, H.J. (2005).
Antidepressive effects of traditional and second generation antipsychotics: a review of the clinical data. European archives of psychiatry and clinical neuroscience, 255(2), 83-93. [PubMed:15812601] [WorldCat] [DOI]
(執筆者:宮本聖也 担当編集委員:加藤忠史)