GABA
江藤 圭
University of North Carolina at Chapel Hill, Department of Pharmacology
石橋 仁
北里大学医療衛生学部生理学研究室
鍋倉 淳一
自然科学研究機構生理学研究所
DOI:10.14931/bsd.3097 原稿受付日:2012年12月25日 原稿完成日:2014年3月13日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:γ-aminobutyric acid 独:γ-Aminobuttersäure 仏:acide γ-aminobutyrique
| γ-Aminobutyric acid | |
|---|---|
| |
| |
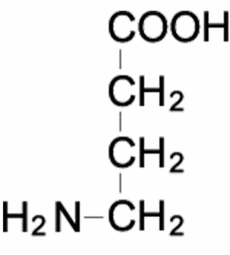
4-aminobutanoic acid | |
| Identifiers | |
| 56-12-2 | |
| ChEBI | |
| ChEMBL | ChEMBL96 |
| ChemSpider | 116 |
| DrugBank | {{{value}}} |
| |
| 1067 | |
| Jmol-3D images | Image |
| KEGG | D00058 |
| MeSH | gamma-Aminobutyric+Acid |
| PubChem | 119 |
| |
| UNII | 2ACZ6IPC6I |
| Properties | |
| Molar mass | 103.12 g/mol |
| Appearance | white microcrystalline powder |
| Density | 1.11 g/mL |
| Melting point | 203.7 °C (398.7 °F; 476.8 K) |
| Boiling point | |
| soluble | |
| Acidity (pKa) | 4.23 (carboxyl), 10.43 (amino)[1] |
| 危険性 | |
| Main hazards | Irritant, Harmful |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
同義語:γ-アミノ酪酸
GABAとは
γ-アミノ酪酸 (γ-aminobutyric acid, GABA)は、イモなどの植物に含まれるアミノ酸として古くから知られていたが、1950年代になって、林髞らにより脳にGABAを注入すると抑制作用を示すことが明らかにされ[2]、1966年には大塚正徳らが、ザリガニの神経筋接合部においてGABAが刺激に応じて放出されることを証明し、GABAの抑制性伝達物質としての同定に寄与した[3]。その後、1967年にKrnjevicとSchwartzがGABAが抑制性神経伝達物質であると証明し[4]、今日では、哺乳動物の中枢神経系において、GABAが抑制性伝達物質であることは広く認識されている。もちろん、GABAは中枢神経系以外にも、さまざまな非神経組織に存在して、その組織特有の生理機能を有していると考えられている。
生合成
脳内では主に、グルタミン酸デカルボキシラーゼ(glutamic acid decarboxylase; GAD)による脱炭酸によって、グルタミン酸から産生される[5]。このGADには、 分子量が 65300と66600の2つのアイソフォーム(GAD65とGAD67)が知られており、どちらも同一の抑制性神経細胞に存在するが、GAD67が細胞質全体に存在するのに対してGAD65は神経終末部に豊富に存在することから[6]、GAD65が抑制性シナプス伝達を担うGABA合成に関与すると考えられている[7]。
GABAの合成に関しては、TCAサイクルのα-ケトグルタル酸からグルタミン酸を経由してGABAが合成される経路がある[8]。また、神経終末部では、細胞外からグルタミン酸輸送体により、グルタミン酸が取り込まれてGAD65によりGABAが合成される。GABAの分解過程では、GABAはGABAアミノ基転移酵素によりコハク酸セミアルデヒドとなり、その後酸化されてコハク酸となりTCAサイクルに入る。
神経終末部でGAD65により新たに作られたGABAは、小胞型抑制性アミノ酸トランスポーター(VIAAT、VGATとも呼ばれる)によりシナプス小胞内へ充填され、神経終末部から放出される[9] [10]。
-
図.GABAの合成・代謝経路
機能
GABAは、GABAA受容体、GABAB受容体、GABAC受容体の3種の受容体に作用することによってその生理機能を発揮する[11]。GABAAとGABAB受容体は中枢神経系に広く分布し、GABAC受容体は成熟脊椎動物ではほぼ網膜のみに限局して分布する。
GABAAとGABAC受容体を介した機能
GABAAとGABAC受容体はイオンチャネル型受容体で、塩化物イオン (Cl-イオン)を主に透過させる。GABAA受容体はαサブユニット、βサブユニット、γサブユニット、δサブユニット、εサブユニットなどによって構成される五量体であるが、脳部位によってサブユニットの発現が異なっている。また、構成サブユニットの違いにより薬物に対する感受性も異なる。GABAC受容体は ρサブユニットで形成される五量体であり、GABAA受容体を抑制するビククリンに感受性がないなど、GABAA受容体とは薬物感受性がかなり異なっている[11]。GABAA受容体はゲフィリンという足場タンパク質によりシナプス部位に維持される[12]。
GABAAおよびGABAC受容体を介した抑制効果は、神経細胞内の塩化物イオン濃度により変化する。通常、成熟期の神経細胞内塩化物イオン濃度は低く保たれており、塩化物イオンの平衡電位は静止電位よりも過分極側にあるため、GABAA受容体およびGABAC受容体の応答は過分極性である。しかし、発達期においてGABAは脱分極作用(興奮性作用)を示すことがある。これは、細胞内から塩化物イオンを排出する役割を担うトランスポーターの機能や発現が、成熟期の神経細胞と異なるためである[13] [14]。
GABAB受容体を介した機能
GABAB受容体は、GABAB1およびGABAB2サブユニットからなる代謝型受容体で、GABAはGABAB1受容体に結合し、GABAB2受容体はGi/oタンパク質を活性化する。GABAB受容体の生理機能としては、K+チャネルの活性化、Ca2+チャネルの抑制、アデニル酸シクラーゼの抑制などの作用がある[15]。
関連項目
参考文献
- ↑ Dawson, R.M.C., et al.
Data for Biochemical Research
Oxford, Clarendon Press, 1959. - ↑
HAYASHI, T. (1958).
Inhibition and excitation due to gamma-aminobutyric acid in the central nervous system. Nature, 182(4642), 1076-7. [PubMed:13590228] [WorldCat] [DOI] - ↑
Otsuka, M., Iversen, L.L., Hall, Z.W., & Kravitz, E.A. (1966).
Release of gamma-aminobutyric acid from inhibitory nerves of lobster. Proceedings of the National Academy of Sciences of the United States of America, 56(4), 1110-5. [PubMed:5230136] [PMC] [WorldCat] [DOI] - ↑
Krnjević, K., & Schwartz, S. (1967).
The action of gamma-aminobutyric acid on cortical neurones. Experimental brain research, 3(4), 320-36. [PubMed:6031164] [WorldCat] [DOI] - ↑
Erlander, M.G., Tillakaratne, N.J., Feldblum, S., Patel, N., & Tobin, A.J. (1991).
Two genes encode distinct glutamate decarboxylases. Neuron, 7(1), 91-100. [PubMed:2069816] [WorldCat] [DOI] - ↑
Esclapez, M., Tillakaratne, N.J., Kaufman, D.L., Tobin, A.J., & Houser, C.R. (1994).
Comparative localization of two forms of glutamic acid decarboxylase and their mRNAs in rat brain supports the concept of functional differences between the forms. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(3 Pt 2), 1834-55. [PubMed:8126575] [WorldCat] - ↑
Soghomonian, J.J., & Martin, D.L. (1998).
Two isoforms of glutamate decarboxylase: why? Trends in pharmacological sciences, 19(12), 500-5. [PubMed:9871412] [WorldCat] [DOI] - ↑
Waagepetersen, H.S., Sonnewald, U., Larsson, O.M., & Schousboe, A. (1999).
Synthesis of vesicular GABA from glutamine involves TCA cycle metabolism in neocortical neurons. Journal of neuroscience research, 57(3), 342-9. [PubMed:10412025] [WorldCat] - ↑
McIntire, S.L., Reimer, R.J., Schuske, K., Edwards, R.H., & Jorgensen, E.M. (1997).
Identification and characterization of the vesicular GABA transporter. Nature, 389(6653), 870-6. [PubMed:9349821] [WorldCat] [DOI] - ↑
Sagné, C., El Mestikawy, S., Isambert, M.F., Hamon, M., Henry, J.P., Giros, B., & Gasnier, B. (1997).
Cloning of a functional vesicular GABA and glycine transporter by screening of genome databases. FEBS letters, 417(2), 177-83. [PubMed:9395291] [WorldCat] [DOI] - ↑ 11.0 11.1
Bormann, J. (2000).
The 'ABC' of GABA receptors. Trends in pharmacological sciences, 21(1), 16-9. [PubMed:10637650] [WorldCat] [DOI] - ↑
Tyagarajan, S.K., & Fritschy, J.M. (2014).
Gephyrin: a master regulator of neuronal function? Nature reviews. Neuroscience, 15(3), 141-56. [PubMed:24552784] [WorldCat] [DOI] - ↑
Ganguly, K., Schinder, A.F., Wong, S.T., & Poo, M. (2001).
GABA itself promotes the developmental switch of neuronal GABAergic responses from excitation to inhibition. Cell, 105(4), 521-32. [PubMed:11371348] [WorldCat] [DOI] - ↑
Shibata, S., Kakazu, Y., Okabe, A., Fukuda, A., & Nabekura, J. (2004).
Experience-dependent changes in intracellular Cl- regulation in developing auditory neurons. Neuroscience research, 48(2), 211-20. [PubMed:14741396] [WorldCat] [DOI] - ↑
Xu, C., Zhang, W., Rondard, P., Pin, J.P., & Liu, J. (2014).
Complex GABAB receptor complexes: how to generate multiple functionally distinct units from a single receptor. Frontiers in pharmacology, 5, 12. [PubMed:24575041] [PMC] [WorldCat] [DOI]