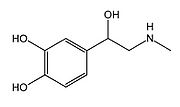
英:adrenaline, epinephrine 独:Adrenalin, Epinephrin 仏:adrénaline, épinéphrine 略称:Ad, EP
| |
|---|---|
| |
| Systematic (IUPAC) name | |
| (R)-4-(1-hydroxy- 2-(methylamino)ethyl)benzene-1,2-diol | |
| Clinical data | |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a603002 |
| Pregnancy cat. | A (AU) C (US) |
| Legal status | Prescription Only (S4) (AU) POM (UK) ℞-only (US) |
| Routes | IV, IM, endotracheal, IC |
| Pharmacokinetic data | |
| Bioavailability | Nil (oral) |
| Metabolism | adrenergic synapse (MAO and COMT) |
| Half-life | 2 minutes |
| Excretion | Urine |
| Identifiers | |
| CAS number | 51-43-4 |
| ATC code | A01AD01 B02BC09 (WHO) C01CA24 (WHO) R01AA14 (WHO) R03AA01 (WHO) S01EA01 (WHO) |
| PubChem | CID 5816 |
| IUPHAR ligand | 509 |
| DrugBank | DB00668 |
| ChemSpider | 5611 |
| UNII | YKH834O4BH |
| KEGG | D00095 |
| ChEBI | CHEBI:28918 |
| ChEMBL | CHEMBL679 |
| Chemical data | |
| Formula | C9H13NO3 |
| Mol. mass | 183.204 g/mol |
| SMILES | eMolecules & PubChem |
| |
| | |
同義語:エピネフリン
アドレナリンはモノアミンの一種、またカテコールアミンの一種である。生体内において、神経伝達物質またはホルモンとして働く。生体内ではチロシンから合成される。受容体はアドレナリン受容体と呼ばれるファミリーであり、Gタンパク質共役7回膜貫通型である。中枢神経系では、後脳髄質(延髄でしょうか?)にアドレナリン作動性神経細胞が存在し、そこからほぼ脳全域に投射している。
発見と用語
1893年、George Oliver(イギリス)は副腎(Adrenal gland)に薬理学的に劇的な効果を持つ物質が含まれることを発見した[1]。1897年、John Abel(アメリカ)は副腎から粗抽出物を調製、これをエピネフリンと呼んだが[2]、これには生理活性がなかった[3]。その後、1901年、高峰譲吉と上中啓三は副腎から生理活性物質を精製した[4]。これをParke, Davis & CoはAdrenalineという名前で販売した[3]。
現在、アドレナリンとエピネフリンという呼称については、国により使用頻度が異なる。歴史的にはアドレナリンの方が正しい呼称と考えられ、欧州ではアドレナリンの方が一般的である。しかし、米国の、特に医学分野では、John Abelの影響の名残でエピネフリンの方が一般的である。日本では2006年の第十五改正日本薬局方よりアドレナリンが一般名称となった。
構造
カテコール基と二級アミノ基をもつ、カテコールアミン神経伝達物質の一種。また、ドーパミン、セロトニン、ヒスタミンなどとともにモノアミン系神経伝達物質のグループを形成する。
合成
脳の一部の神経細胞、および副腎髄質中にあるクロム親和性細胞において合成される(図2)。他に、も合成されている(「他に、」の後に何か単語が入る?)。生合成に関わる酵素は以下の通り。
- チロシン水酸化酵素 (tyrosine hydroxylase, TH):EC 1.14.16.2。チロシンよりL-DOPA (L-3,4-dihydroxyphenylalanine)を合成する[5] [6] [7]。反応には、テトラヒドロビオプテリン (tetrahydrobiopterin), O2, Fe2+が必要。カテコールアミン合成において、律速段階の酵素であると考えられている。その活性制御は、主にタンパク質の量と、リン酸化による。全てのカテコールアミン産生細胞に存在する。補因子であるテトラヒドロビオプテリンはGTPより合成される。律速酵素はGTPシクロヒドラーゼI (GTP cyclohydrolase I)である[8]。
- 芳香族アミノ酸脱炭酸酵素 (aromatic L-amino acid decarboxylase, AADC):EC 4.1.1.28。L-DOPAよりドーパミンを合成する。他に、この酵素は5-ヒドロキシトリプトファン (5-hydroxytryptophan)からセロトニン(5-hydroxytryptamine, 5-HT)を合成する反応も触媒する。ピリドキサールリン酸 (pyridoxal phosphate)が必要。全てのカテコールアミン産生細胞に存在する[9]。
- ドーパミンβ水酸化酵素 (dopamine β-hydroxylase, DBH):EC 1.14.2.1。ドーパミンよりノルアドレナリンを合成する。アスコルビン酸、O2、Cu2+が必要。ノルアドレナリン、アドレナリン産生細胞のシナプス小胞の中に存在し、シナプス小胞に取り込まれたドーパミンをノルアドレナリンに変換する[10]。
- フェニルエタノールアミン-N-メチル基転移酵素 (phenylethanolamine N-methyltransferase, PNMT):EC 2.1.1.28。ノルアドレナリンのアミノ基にメチル基を付加し、アドレナリンを生合成する。メチル基のドナーとしてチロシンS-アデノシルメチオニン (S-adenosylmethione)が必要。ヒトでは一つの遺伝子があり(Gene ID 5409)、転写産物は副腎髄質に多く、心臓、および脳幹にも存在する[11]。PNMTは細胞質に局在するが、顆粒内にもあるとの説もある[12]。そのため、アドレナリンの生合成が、細胞質で起きるのか、ノルアドレナリンが合成された顆粒内で起きるのかについては、まだはっきりと分かっていない。
放出、再取り込み
アドレナリンの前駆体であるドーパミンは小胞型モノアミントランスポーター(vesicular monoamine transporter, vMAT)によりシナプス小胞内に輸送される。vMAT1は主に副腎のクロム親和性細胞、vMAT2は神経細胞で発現している。vMATはH+との交換輸送によりモノアミンを小胞内に蓄積させる[13]。 アドレナリンの放出は他の神経伝達物質と同様に、神経活動依存的、カルシウム依存的なシナプス小胞のエキソサイトーシスによる。 アドレナリンの再取り込みの機構はまだよく理解されていない。アドレナリン特異的なトランスポーターは、ほ乳類では報告されていない。
代謝分解
アドレナリンの代謝分解には次の二つの酵素が重要である。
- モノアミン酸化酵素(monoamine oxidase, MAO):MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在しに存在し、細胞内のアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる[14]。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる[14]。(ノルアドレナリンをアドレナリンに修正)
- カテコール-O-メチル基転移酵素(catechol-O-methyltransferase, COMT):これはカテコール基のメタ位水酸基にメチル基を転移させる。腎臓や肝臓に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている[15]。
脳においてアドレナリンの多くは、ノルアドレナリンと同様、MAO、アルデヒド還元酵素、およびCOMTにより3-メトキシ-4-ヒドロキシフェニルグリコール (3-methoxy-4-hydroxyphenylglycol, MHPG)へ代謝され、さらに3-メトキシ-4-ヒドロキシマンデル酸 (3-methoxy-4-hydroxymandelic acid) (またはバニリルマンデル酸, vanillylmandelic acid, VMA)となって尿中に排出される[16]。MHPGの硫酸化物も尿中に排出される[16]。
主たる投射系と機能
中枢神経系 中枢神経系におけるアドレナリン作動性の神経細胞は、主に次の二つの部位にある。
- C1:髄質の腹外側にありノルアドレナリン作動性神経細胞核A1に近接する。
- C2:髄質の背側にありノルアドレナリン作動性神経細胞核A2に近接する。C1、C2共に視床下部に上行性投射をし、循環器系や内分泌系の調節を行う。
末梢神経系 末梢神経系の節後神経細胞は、ノルアドレナリンと共にアドレナリン作動性でもある。脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、ノルアドレナリン性の出力を内臓器官に与える。その結果、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。
受容体
アドレナリンはノルアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる。より細かくは、α1A-α1D、α2A-α2C、β1-β3、から構成されている。いずれも三量体Gタンパク質共役型受容体である。α1はGq、α2はGi、β1-β3はGsと共役している。
末梢神経系において、アドレナリンは、低濃度ではβ1およびβ2アドレナリン受容体に作用し、高濃度ではα1を介した作用が主となる。(ノルアドレナリンはα1およびβ1アドレナリン受容体のアゴニストとして作用する。)
| 受容体 | アゴニスト選択性 | 主な作用 | 細胞内シグナル | アゴニスト | アンタゴニスト |
|---|---|---|---|---|---|
| α1: A, B, D† |
ノルアドレナリン > アドレナリン >> イソプレナリン | 平滑筋収縮 | Gq: ホスホリパーゼC (PLC) 活性化によりイノシトール3リン酸とジアシルグリセロール、細胞内カルシウムの上昇 |
(α1アゴニスト) |
|
| α2: A, B, C |
アドレナリン ≥ ノルアドレナリン >> イソプレナリン | 自己受容体活性化による神経伝達物質放出減少 心筋弛緩、血小板活性化 |
Gi: アデニル酸シクラーゼ抑制, cAMP減少 |
(α2アゴニスト) |
|
| β1 | イソプレナリン > アドレナリン = ノルアドレナリン | 心筋収縮 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 |
(β1アゴニスト) |
|
| β2 | イソプレナリン > アドレナリン >> ノルアドレナリン | 平滑筋弛緩 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 (Giと共役することもある) |
(β2アゴニスト) |
|
| β3 | イソプレナリン = ノルアドレナリン > アドレナリン | 脂肪代謝亢進、膀胱排尿筋弛緩 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 |
表 アドレナリン性受容体 Wikipedia項目Adrenergic Receptorから翻訳、修正の上転載。 †α1C受容体と呼ばれる物は、存在しない。
関連項目
参考文献
- ↑ G Oliver, EA Schäfer
On the physiological action of extract of the suprarenal capsules
J. Physiol. Lond.:1894;16;i-iv - ↑ JJ Abel
On epinephrin, the active constituent of the suprarenal capsule and its compounds
Proc. Am. Phys. Soc.: 1898; 34; 35 - ↑ 3.0 3.1
Aronson, J.K. (2000).
"Where name and image meet"--the argument for "adrenaline". BMJ (Clinical research ed.), 320(7233), 506-9. [PubMed:10678871] [PMC] [WorldCat] [DOI] - ↑ J Takamine
The isolation of the active principle of the suprarenal gland
J. Physiol. Lond.:1901;27;30P-39P - ↑
Dunkley, P.R., Bobrovskaya, L., Graham, M.E., von Nagy-Felsobuki, E.I., & Dickson, P.W. (2004).
Tyrosine hydroxylase phosphorylation: regulation and consequences. Journal of neurochemistry, 91(5), 1025-43. [PubMed:15569247] [WorldCat] [DOI] - ↑
Daubner, S.C., Le, T., & Wang, S. (2011).
Tyrosine hydroxylase and regulation of dopamine synthesis. Archives of biochemistry and biophysics, 508(1), 1-12. [PubMed:21176768] [PMC] [WorldCat] [DOI] - ↑
Nagatsu, T. (1989).
The human tyrosine hydroxylase gene. Cellular and molecular neurobiology, 9(3), 313-21. [PubMed:2575455] [WorldCat] [DOI] - ↑
Thöny, B., Auerbach, G., & Blau, N. (2000).
Tetrahydrobiopterin biosynthesis, regeneration and functions. The Biochemical journal, 347 Pt 1, 1-16. [PubMed:10727395] [PMC] [WorldCat] - ↑
Berry, M.D., Juorio, A.V., Li, X.M., & Boulton, A.A. (1996).
Aromatic L-amino acid decarboxylase: a neglected and misunderstood enzyme. Neurochemical research, 21(9), 1075-87. [PubMed:8897471] [WorldCat] [DOI] - ↑
Rush, R.A., & Geffen, L.B. (1980).
Dopamine beta-hydroxylase in health and disease. Critical reviews in clinical laboratory sciences, 12(3), 241-77. [PubMed:6998654] [WorldCat] [DOI] - ↑
Ziegler, M.G., Bao, X., Kennedy, B.P., Joyner, A., & Enns, R. (2002).
Location, development, control, and function of extraadrenal phenylethanolamine N-methyltransferase. Annals of the New York Academy of Sciences, 971, 76-82. [PubMed:12438093] [WorldCat] [DOI] - ↑
Nagatsu, I., & Kondo, Y. (1974).
Immunoelectronmicroscopic localization of phenylethanolamine-n-methyltransferase in the bovine adrenal medulla. Histochemistry, 42(4), 351-8. [PubMed:4615087] [WorldCat] [DOI] - ↑
Erickson, J.D., & Varoqui, H. (2000).
Molecular analysis of vesicular amine transporter function and targeting to secretory organelles. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(15), 2450-8. [PubMed:11099462] [WorldCat] [DOI] - ↑ 14.0 14.1
Youdim, M.B., Edmondson, D., & Tipton, K.F. (2006).
The therapeutic potential of monoamine oxidase inhibitors. Nature reviews. Neuroscience, 7(4), 295-309. [PubMed:16552415] [WorldCat] [DOI] - ↑
Chen, J., Song, J., Yuan, P., Tian, Q., Ji, Y., Ren-Patterson, R., ..., & Weinberger, D.R. (2011).
Orientation and cellular distribution of membrane-bound catechol-O-methyltransferase in cortical neurons: implications for drug development. The Journal of biological chemistry, 286(40), 34752-60. [PubMed:21846718] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 D E Golan, A H Tashjian Jr, E J Armstrong, A W Armstrong
Principles of Pharmacology, Second Edition
Wolters Kluwer Health (Philadelphia):2002
(執筆者:徳岡宏文、一瀬宏 担当編集者:尾藤晴彦)