ニューレグリン
| Neuregulin family | |||||||||
|---|---|---|---|---|---|---|---|---|---|
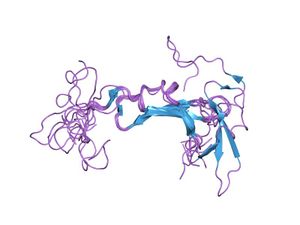 Nrg1の上皮成長因子ホモロジードメインの構造.[1] | |||||||||
| Identifiers | |||||||||
| Symbol | Neuregulin | ||||||||
| Pfam | PF02158 | ||||||||
| InterPro | IPR002154 | ||||||||
| SCOP | 1hrf | ||||||||
| SUPERFAMILY | 1hrf | ||||||||
| |||||||||
英:Neuregulin、英略語:NRG
ニューレグリンとは 上皮成長因子(Epidermal Growth Factor;EGF)様の活性ドメインを有する蛋白質で、細胞の増殖、成長、分化に影響を発揮する。
サブタイプ
最初に見つけられた分子、ニューレグリン1(NRG1)は、その歴史的経緯の違いから、neu differentiation factor (NDF), heregulin (Her), glia growth factor (GGF), ARIA (acetylcholine receptor inducing activity)などの別称を有する。 現在、NRGファミリーはNRG1-4に加えて、Tomoregulin-2 (TEFF2)やChondroitin sulfate proteoglycan 5 (CSPG5)も同様の活性型EGF様ドメインを持つことから、それぞれNRG5, NRG6とも呼ばれる。
分布
(細胞内分布はどうか、産生細胞は何か、どの組織に多いか判っておりましたら御記述下さい)
Allen Brain Atlas
構造
通常、膜結合型の大きな前駆体分子として合成され、細胞膜表面にアンカーされている。神経伝達や細胞損傷、細胞ストレスなどの刺激に反応して、細胞はADAMなどの膜結合型メタロプロテアーゼが活性化し、NRG前駆体の細胞外ドメインを切断(シェデイング)して、その活性ドメインを放出する。多くの場合、このシェデイングが活性発揮の律速となっている。 その活性中心部は、約50-60アミノ酸からなる構造を呈し、6つのシステインが3つのジスルフィド結合し、2つのベータシート構造を形成している。
機能
受容体
これらのNRG分子は、上皮成長因子受容体ファミリー分子(ErbB1-4)に、おのおの異なる親和性で結合する。ErbB1-4は共通した構造をもち、細胞外領域(リガンド結合部、2量体結合部)、細胞膜貫通領域、細胞内領域(チロシンキナーゼ酵素部)からなる。細胞外領域にリガンドが結合すると、受容体の酵素部が活性化するとともに、相互アフィニテイーが上がり、2量体を形成しやすくなる。通常、2量体を形成すると、相手側のErbB分子の細胞内領域をリン酸化する。表1にあるようにErbB分子は、多くの組み合わせで2量体を形成するが、ホモ2量体でない限り、リガンド結合ErbB分子とシグナル伝達ErbB分子は、異なるかもしれないことに注意しなくてはならない。
| 受容体 | 結合リガンド |
2量体形成 パートナー |
主要細胞内 シグナル分子 |
その他 結合分子 |
|---|---|---|---|---|
|
ErbB1 (Her1) |
EGF TGFα HB-EGF Amphiregulin Betacellulin Epiregulin |
ErbB1 ErbB2 ErbB4 |
PLCγ Cb1 (Grb2・PI3K) Shc SHP-1 Src |
Abl Doc-R STAT3 |
|
ErbB2 (Her2) (NeU) |
No ligand |
ErbB1 ErbB3 ErbB4 |
Cbl1 (Grb2・PI3K) Shc |
TNS4 CXCR4 |
|
ErbB3 (Her3) |
NRG1 NRG2 NRG6 Betacellulin |
ErbB1 ErbB2 ErbB4 |
Shc (Grb2・PI3K) ??? |
PA2G4 PIK3R1 RGS4 |
|
ErbB4 (Her4) |
HB-EGF Betacellulin NRG1 NRG2 NRG3 NRG4 NRG5 |
ErbB1 ErbB2 ErbB3 ErbB4 |
(Grb2・PI3K)
??? |
STAT5A PSD-95 ICD DLG4 YAP1 TACE secretase |
細胞内シグナル伝達系
ErbBのシグナル伝達経路には、Grb2/Ras/Raf/MAPK(マイトジェン活性化プロテインキナーゼ)経路、 PI3K(フォスフォイノシトール3キナーゼ)/Akt経路、PLCγ(フォフォライペ-スCガンマ)/IP3経路の3つが存在する。このシグナル伝達の結果、神経系の細胞は増殖、分化、生存などの方向にむかう。 Grb2/Ras/Raf/MAPK経路は、ErbB1, ErbB2活性化から派生することが多く、主に細胞分化や増殖 に関与する。ErbB4活性化後には、主にPI3K/Akt経路が働き、細胞成長や抗アポトーシスを引き起こす。また、これらErbB 受容体はPLCγ/IP3経路も活性化し、Cキナーゼや細胞内カルシウムを動員し、細胞運動や細胞増殖に関与する。
特にErbB4分子は、神経細胞のなかで多くはPSD-95と結合し後シナプス部位に蓄積している。PSD-95分子を介してNMDA型グルタミン酸受容体とシグナル分子複合体を形成し、ErbB4シグナルは直接的にNMDA型グルタミン酸受容体の活動を調節しているとされている。NRG もしくは 電気刺激は、γ-セクレターゼによる ErbB4の細胞内ドメインの切断を促進し、核内に移行し分化や細胞死の誘導をする。切断されたErbB4の細胞内ドメインは、TAB2、N-CoRとの複合体を形成し、遺伝子の転写を調節する能力を発揮する。
生理活性
ErbB3とErbB2はおもにオリゴデンドロサイトに発現していて、その前駆細胞の増殖と分化に関与していることが知られている。オリゴデンドロサイトやシュワン細胞、そのミエリン形成の研究から、細胞間接着分子のように、神経細胞の形質膜上に存在する非可溶性のNRGが、グリア細胞膜上のErbB3と相互作用をしている可能性も示唆されている。
ErbB4分子は、おもに小脳プルキンエ細胞をふくむGABA神経細胞に多量に発現しているとともに、視床下部アストロサイトや錐体細胞にも発現が確認される。
(生理活性について、サブタイプごとにシナプス可塑性や病気などとの関わりについてもう少し付け加えて頂けると幸甚です.また、ノックアウトなどの知見もございましたら、よろしく御願い致します)
参考文献
- ↑ Nagata K; Kohda D; Hatanaka H; et al. (1994). "Solution structure of the epidermal growth factor-like domain of heregulin-alpha, a ligand for p180erbB-4". EMBO J. 13 (15): 3517–23. PMC 395255. PMID 8062828.
{{cite journal}}: Unknown parameter|author-separator=ignored (help); Unknown parameter|month=ignored (help)
- Mei, L., and Xiong, W.C. (2008) Neuregulin 1 in neural development, synaptic plasticity and schizophrenia. Nat Rev Neurosci 9, 437-452.
- Bublil, E.M., and Yarden, Y. (2007) The EGF receptor family: spearheading a merger of signaling and therapeutics. Curr Opin Cell Biol 19, 124-134.
- Higashiyama, S., Iwabuki, H., Morimoto, C., Hieda, M., Inoue, H., and Matsushita, N. (2008). Membrane-anchored growth factors, the epidermal growth factor family: beyond receptor ligands. Cancer Sci 99, 214-220.
(執筆者:那波宏之、編集委員:林 康紀)