「ニューロン新生」の版間の差分
細編集の要約なし |
細 (→機能) |
||
| (2人の利用者による、間の27版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">金子 順、[http://researchmap.jp/hisatsune 久恒 辰博]</font><br> | |||
''東京大学 新領域創成科学研究科''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年5月31日 原稿完成日:2012年6月15日<br> | |||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | |||
</div> | |||
英:neurogenesis 独:Neurogenese 仏:neurogenèse | |||
同義語:神経新生 | |||
{{box|text= | |||
ニューロン新生とは[[神経幹細胞]]と呼ばれる[[ニューロン]]の素となる細胞がニューロンへ分化する事である。19世紀後半、[[wikipedia:ja:サンティアゴ・ラモン・イ・カハール|ラモ二・カハール]]によりニューロンが発見されて以来、長らくニューロン新生は胎生期から幼年期において生じ、成体期では生じないと考えられていた。しかし、成体脳においても、[[記憶]]にかかわる[[海馬]]体の[[歯状回]]部位において、個体の生涯を通じて新しくニューロンが生み出されていることが明らかになった。これにより、ニューロンは決して再生しないという定説は覆った。成体脳におけるニューロン新生が明らかになり、ニューロン新生を制御する機構や、新生ニューロンの機能に関する研究が精力的に行われている。ニューロン新生の研究は記憶や[[学習]]、疾患、[[ストレス]]との関わりなど、解決すべき課題が多く存在している。現在、海馬新生ニューロンの機能についての研究が進み、記憶形成や[[抗うつ作用]]を担っていることを示すデータが数多く得られてきた。また疾患[[モデル動物]]を用いた研究により、病態との関連も調べられている。これらのニューロン新生に関する研究成果は、[[記憶障害]]や[[精神疾患]]に対する応用が期待されている。 | |||
}} | |||
== 歴史的背景== | == 歴史的背景== | ||
1960年代から、アルトマンらによるトリチウム化チミジン(<sup>3</sup>H-thymidine)を使用した[[wikipedia:ja:哺乳動物|哺乳動物]]([[マウス]]や[[wikipedia:ja:ラット|ラット]]など)の研究で、成体脳でもニューロンが生み出されていることが報告された<ref name=ref1><pubmed>13860749</pubmed></ref> <ref name=ref2><pubmed>13512326</pubmed></ref>。また1980年代に入ると、ノッテボームらは[[wikipedia:ja:カナリア|カナリア]]を用いた実験により、新たに生み出されたニューロンが古いニューロンと入れ替わる事を示し、このニューロン置き換えが、新しく歌を覚えるという学習と関係している事を明らかにした<ref name=ref3><pubmed>3913361</pubmed></ref>。一方、ヒトの脳でニューロンが新生しているとは長らく認知されることがなかった。しかし、1998年[[wikipedia:ja:スウェーデン|スウェーデン]]の[[wikipedia:ja:ヨーテボリ|エーテボリ]]にある[[wikipedia:Sahlgrenska University Hospital|サールグレンスカ大学病院]]のエリクソンと[[wikipedia:Salk Institute for Biological Studies|米国ソーク生物学研究所]]の[[wikipedia:Fred Gage|ゲージ]]らは、[[抗がん剤]]([[wikipedia:ja:ブロモデオキシウリジン|ブロモデオキシウリジン]])を服用したがん患者の協力を得て、その患者が死亡した後に、脳組織標本を詳しく調べることにより、大人の脳の中でも、少なくとも、海馬の歯状回で、ニューロンが新生していることを見出した<ref name=ref4><pubmed>9809557</pubmed></ref>。 | |||
エリクソンとゲージらの研究に触発され、大型の[[wikipedia:ja:サル|サル]]([[wikipedia:ja:マカクザル|マカクザル]])でも、成体海馬でニューロン新生が起こっていることが立証された。これらの研究により哺乳類の脳において、成体の海馬でニューロン新生が起こっていることが確実に立証された<ref name=ref5><pubmed> 15788705 </pubmed></ref> <ref name=ref6>'''ケンペルマン, G. & ゲージ, F. H.'''<br>大人でも脳細胞は新生する<br>''日経サイエンス'', 1999年8月号 36-42.</ref>。また、海馬歯状回でのニューロン新生に加え、他の脳部位におけるニューロン新生に関しても、非常に精力的な研究が進められている。[[動物モデル]]を用いた研究では、[[におい]]感覚を伝達する嗅球において、[[GABA]]陽性の[[介在性ニューロン]]が新生していることが立証されている<ref name=ref7><pubmed>12704391</pubmed></ref>。また、[[前頭連合野]]においてもニューロン新生があるとする報告もある<ref name=ref8><pubmed>10521353</pubmed></ref>。しかし、ヒトにおいては、動物と同じメカニズムでは、嗅球のニューロン新生が起こっていないことがわかっており<ref name=ref9><pubmed>21964341</pubmed></ref>、今後の更なる研究が待たれている。また、ヒトの大脳新皮質のニューロン新生については、1960年代の水爆実験で放出された大気中<sup>14</sup>Cをトレーサーとして使用した研究により、大脳新皮質のニューロン新生は、仮に起こっていたとしてもその数は非常に限定的であるとするデータも得られている<ref name=ref10><pubmed>16901981</pubmed></ref>。 | |||
こうした新生ニューロンは[[神経幹細胞]] | こうした新生ニューロンは[[神経幹細胞]]と呼ばれる細胞がニューロンに分化する事で生じる。神経幹細胞は、分裂して同じ細胞を作る機能(自己増殖能)と、[[分化]]してニューロンや、[[アストロサイト]]、[[オリゴデンドロサイト]]などを作る機能(多分化能)をあわせ持つ細胞である。この神経幹細胞が、成体脳においても、海馬歯状回など、ニューロン新生が起きている部位には存在しており、新生ニューロンを供給している。本項目では、海馬歯状回のニューロン新生を中心に説明を行う。 | ||
== 細胞メカニズム == | == 細胞メカニズム == | ||
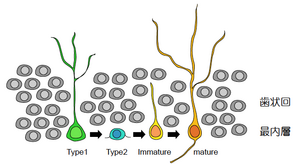
成体海馬新生ニューロンの起源に関し、神経幹細胞の[[ | [[image:図1.海馬におけるニューロン新生.png|thumb|300px|'''図1.海馬におけるニューロン新生'''<br>成体海馬において神経幹細胞からニューロンが分化する。Type1 cellからType2 cellへの分化の進行と共に放射状の突起が消失する。その後、軸索を伸ばし、ニューロンへと成熟する。]] | ||
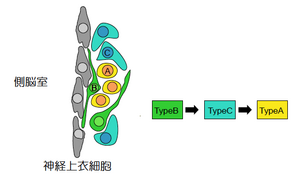
[[image:図2.側脳室下帯におけるニューロン新生.png|thumb|300px|'''図2.側脳室下帯におけるニューロン新生'''<br>神経幹細胞であるTypeB cellは分裂、増殖を繰り返し、TypeC cellを産生する。TypeA cellへとさらに分化が進むと、RMS内を通過して嗅球へと移動する。]] | |||
成体海馬新生ニューロンの起源に関し、神経幹細胞の[[GFP]]標識や核酸アナログ(ブロモデオキシウリジン)を用いて分裂細胞を標識する実験が行われ、歯状回の最内層に存在する神経幹細胞より新生ニューロンが生まれていることが判明した<ref name=ref11><pubmed>7684771</pubmed></ref>。成体の海馬では、幹細胞としての性質を強く保有するtype-1細胞から、ニューロンとしての性質を部分的に持ち分裂を繰り返すtype-2細胞が分化する。この終末分化からおよそ4週間を経て、新生ニューロンは[[顆粒細胞]]として成長し、海馬回路網に機能的に組み込まれる<ref name=ref12><pubmed>14561863</pubmed></ref>(図1参照)。終末分化から4~8週を経た若い過渡期にある新生ニューロンのことを、狭義には、新生ニューロンと呼ぶこともある。多くの遺伝子組み換えマウスを用いた研究において、この時期の新生ニューロンを特異的に消滅させる実験が実施されている<ref name=ref13><pubmed>22016545</pubmed></ref>。 | |||
一方、[[嗅球]]のニューロン新生は[[側脳室]]下層に存在する神経幹細胞であるType B Cellが分裂と分化を行い、分裂の早い一過性増殖細胞(Type C Cell)を経た後、[[神経芽細胞]](Type A Cell)へと分化し、[[吻側移行経路]](Rostral Migratory Stream)(RMS)を通って嗅球に移動し、ニューロンへと成熟する<ref name=ref14><pubmed>11283751</pubmed></ref>(図2参照)。嗅球のニューロン新生を阻害したマウスでは、[[性行動]]や[[養育行動の神経回路|母性行動]]など先天的な[[嗅覚]]依存的な行動に影響を与えることが示されている<ref name=ref15><pubmed>21536899</pubmed></ref>。 | |||
== | ==機能== | ||
海馬新生ニューロンは、歯状回の顆粒細胞として機能する。しかし、その機能は周囲にある成熟した顆粒細胞とは大きく異なり、むしろ発達期に存在する幼若タイプのニューロンに近く、発火しやすく神経[[可塑性]]に富む<ref name=ref16><pubmed>15107864</pubmed></ref> <ref name=ref17><pubmed>15056704</pubmed></ref>。一般に顆粒細胞は[[嗅内野]]皮質からの投射([[貫通線維]])を受け神経情報を受容し、[[苔状線維]]を[[CA3]]領域に伸ばし、CA3[[錐体細胞]]との間に[[シナプス]]結合を形成する。新生ニューロンは、[[NMDA型グルタミン酸受容体]]を介した神経可塑性に富んでおり<ref name=ref16 />、加えて顆粒細胞にしては珍しくGABA神経による強い興奮抑制がない<ref name=ref18><pubmed>22282476</pubmed></ref>。そのため、歯状回部位における神経信号のゲート機構を担っていることが推測されている。 | |||
また歯状回部位は、空間記憶における[[パターン分離]]を司っているが<ref name=ref19><pubmed>17556551</pubmed></ref>、この作用は主に新生ニューロンにより司られていることが判ってきた<ref name=ref20><pubmed>19590004</pubmed></ref> <ref name=ref21><pubmed>21460835</pubmed></ref> <ref name=ref22><pubmed>22365813</pubmed></ref>。加えて、新生ニューロンには、記憶をアップデートする機能や<ref name=ref23><pubmed>19914173</pubmed></ref>、過去の記憶を整理し[[ストレス応答]]を緩和する働きがあることもわかってきた<ref name=ref24><pubmed>12907793</pubmed></ref> <ref name=ref25><pubmed>21814201</pubmed></ref>。成体脳で新生ニューロンが存在しているのは極めて限られた部位であるが、新生ニューロンは周辺ニューロンとは極めて異なる機能特性を持っており、この特殊なニューロンが海馬回路に機能的に組み込まれることによって、記憶の[[記憶|形成]]・[[記憶|維持]]・[[記憶消去|消去]]や、さらには[[感情]]のコントロールへと至る様々な脳機能に対して、中核的な働きを示しているのである<ref name=ref23 /> <ref name=ref24 /> <ref name=ref25 />。海馬体からの出力は、[[海馬采]]を経て[[脳弓]]へと至る経路と、嗅内野皮質を経て大脳[[新皮質]]の各領域と連結する経路がある<ref name=ref26><pubmed>18270514</pubmed></ref>。 | |||
== 病的変化 == | == 病的変化 == | ||
===加齢変化=== | ===加齢変化=== | ||
海馬新生ニューロンの数は加齢に伴い、減少することが知られている<ref name= | |||
海馬新生ニューロンの数は加齢に伴い、減少することが知られている<ref name=ref5 />。加齢により、神経幹細胞の数は比較的保持されるが、新生ニューロンへの分化とその生存が極めて低下することが分かってきた<ref name=ref27><pubmed>19201065</pubmed></ref>。ごく最近、加齢に伴う新生ニューロン数の低下に脳内の[[wikipedia:ja:炎症反応|炎症反応]]が寄与していることが明らかになってきた<ref name=ref28><pubmed>21886162</pubmed></ref>。 | |||
===疾病下での変化=== | ===疾病下での変化=== | ||
[[認知症]] | |||
[[認知症]]や精神疾患においても、新生ニューロンの数やはたらきが低下している<ref name=ref5 /> <ref name=ref29><pubmed>21395858</pubmed></ref>。[[アルツハイマー病]]モデルマウスを用いてこれまでに多くの研究が実施され、[[老人斑]]の蓄積に応じて新生ニューロンの数が減少し、そのはたらきも低下している<ref name=ref30><pubmed>22192775</pubmed></ref>。アルツハイマー病のリスク遺伝子として[[ApoE4]]があるが、ApoE4を遺伝子導入したマウスでは、海馬のGABA回路のはたらきが低下し、新生ニューロン数も減少することがわかった<ref name=ref31><pubmed>19951691</pubmed></ref>。このマウスにGABA回路のはたらきを高める[[フェノバルビタール]]を投与すると新生ニューロン数の減少が抑えられることも明らかにされた<ref name=ref31 />。また、[[家族性アルツハイマー病]]の原因遺伝子である[[アミロイド前駆体タンパク質]]を導入したマウスでは、海馬GABA回路のアンバランスがおこり、新生ニューロンのはたらきが低下することが認められている<ref name=ref32><pubmed>19951690</pubmed></ref>。このように、アルツハイマー病モデルマウスにおいて、海馬新生ニューロンのはたらきを低下させる仕組みもわかってきた。 | |||
== 調節 == | == 調節 == | ||
成体海馬において、新生ニューロンの数を増加させるための諸条件について、特に小動物を用いて非常に精力的に研究が展開されている。[[運動]]や[[学習行動]]など、[[wikipedia:ja:生活習慣|生活習慣]]の改善により新生ニューロン数が増加する点が注目されている。また、各種の[[神経伝達物質]][[受容体]]に対する薬剤も同様の作用を持つことから、海馬回路の活動が直接的あるいは間接的にニューロン新生の過程にはたらきかけていることが推測される。事実、海馬回路の活動が高まると新生ニューロンの数が増加することが知られている。この一つの仕組みとして、海馬回路から放出されたGABAによりニューロン前駆細胞が刺激され、ニューロン分化が促進することが明らかになり、GABA回路のはたらきを高める薬剤(フェノバルビタール)を投与することで海馬の新生ニューロンの数が増加することも見出された<ref name=ref33><pubmed>16157276</pubmed></ref>。 | |||
== 終わりに == | == 終わりに == | ||
以上述べてきたように、1990年代から精力的に続けられている研究によって、成体脳のニューロン新生、特に海馬歯状回に起こっているニューロン新生の動態について、その起源や分化過程、そしてニューロンとなった後の機能について、多くのことが明らかとなってきた。そして、ニューロン新生の程度が、多くの病態において顕著に低下していることが、動物研究により明らかになるにつれて、アルツハイマー病をはじめとした神経変性疾患の脳内において、なぜニューロン新生が抑えられているのか、そしてこのニューロン新生の抑制はどのようにすれば解除できるのかについて、現在、研究が進展しつつある。 | |||
== 関連語 == | == 関連語 == | ||
| 43行目: | 64行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2020年1月9日 (木) 19:35時点における最新版
金子 順、久恒 辰博
東京大学 新領域創成科学研究科
DOI:10.14931/bsd.1798 原稿受付日:2012年5月31日 原稿完成日:2012年6月15日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英:neurogenesis 独:Neurogenese 仏:neurogenèse
同義語:神経新生
ニューロン新生とは神経幹細胞と呼ばれるニューロンの素となる細胞がニューロンへ分化する事である。19世紀後半、ラモ二・カハールによりニューロンが発見されて以来、長らくニューロン新生は胎生期から幼年期において生じ、成体期では生じないと考えられていた。しかし、成体脳においても、記憶にかかわる海馬体の歯状回部位において、個体の生涯を通じて新しくニューロンが生み出されていることが明らかになった。これにより、ニューロンは決して再生しないという定説は覆った。成体脳におけるニューロン新生が明らかになり、ニューロン新生を制御する機構や、新生ニューロンの機能に関する研究が精力的に行われている。ニューロン新生の研究は記憶や学習、疾患、ストレスとの関わりなど、解決すべき課題が多く存在している。現在、海馬新生ニューロンの機能についての研究が進み、記憶形成や抗うつ作用を担っていることを示すデータが数多く得られてきた。また疾患モデル動物を用いた研究により、病態との関連も調べられている。これらのニューロン新生に関する研究成果は、記憶障害や精神疾患に対する応用が期待されている。
歴史的背景
1960年代から、アルトマンらによるトリチウム化チミジン(3H-thymidine)を使用した哺乳動物(マウスやラットなど)の研究で、成体脳でもニューロンが生み出されていることが報告された[1] [2]。また1980年代に入ると、ノッテボームらはカナリアを用いた実験により、新たに生み出されたニューロンが古いニューロンと入れ替わる事を示し、このニューロン置き換えが、新しく歌を覚えるという学習と関係している事を明らかにした[3]。一方、ヒトの脳でニューロンが新生しているとは長らく認知されることがなかった。しかし、1998年スウェーデンのエーテボリにあるサールグレンスカ大学病院のエリクソンと米国ソーク生物学研究所のゲージらは、抗がん剤(ブロモデオキシウリジン)を服用したがん患者の協力を得て、その患者が死亡した後に、脳組織標本を詳しく調べることにより、大人の脳の中でも、少なくとも、海馬の歯状回で、ニューロンが新生していることを見出した[4]。
エリクソンとゲージらの研究に触発され、大型のサル(マカクザル)でも、成体海馬でニューロン新生が起こっていることが立証された。これらの研究により哺乳類の脳において、成体の海馬でニューロン新生が起こっていることが確実に立証された[5] [6]。また、海馬歯状回でのニューロン新生に加え、他の脳部位におけるニューロン新生に関しても、非常に精力的な研究が進められている。動物モデルを用いた研究では、におい感覚を伝達する嗅球において、GABA陽性の介在性ニューロンが新生していることが立証されている[7]。また、前頭連合野においてもニューロン新生があるとする報告もある[8]。しかし、ヒトにおいては、動物と同じメカニズムでは、嗅球のニューロン新生が起こっていないことがわかっており[9]、今後の更なる研究が待たれている。また、ヒトの大脳新皮質のニューロン新生については、1960年代の水爆実験で放出された大気中14Cをトレーサーとして使用した研究により、大脳新皮質のニューロン新生は、仮に起こっていたとしてもその数は非常に限定的であるとするデータも得られている[10]。
こうした新生ニューロンは神経幹細胞と呼ばれる細胞がニューロンに分化する事で生じる。神経幹細胞は、分裂して同じ細胞を作る機能(自己増殖能)と、分化してニューロンや、アストロサイト、オリゴデンドロサイトなどを作る機能(多分化能)をあわせ持つ細胞である。この神経幹細胞が、成体脳においても、海馬歯状回など、ニューロン新生が起きている部位には存在しており、新生ニューロンを供給している。本項目では、海馬歯状回のニューロン新生を中心に説明を行う。
細胞メカニズム
成体海馬新生ニューロンの起源に関し、神経幹細胞のGFP標識や核酸アナログ(ブロモデオキシウリジン)を用いて分裂細胞を標識する実験が行われ、歯状回の最内層に存在する神経幹細胞より新生ニューロンが生まれていることが判明した[11]。成体の海馬では、幹細胞としての性質を強く保有するtype-1細胞から、ニューロンとしての性質を部分的に持ち分裂を繰り返すtype-2細胞が分化する。この終末分化からおよそ4週間を経て、新生ニューロンは顆粒細胞として成長し、海馬回路網に機能的に組み込まれる[12](図1参照)。終末分化から4~8週を経た若い過渡期にある新生ニューロンのことを、狭義には、新生ニューロンと呼ぶこともある。多くの遺伝子組み換えマウスを用いた研究において、この時期の新生ニューロンを特異的に消滅させる実験が実施されている[13]。
一方、嗅球のニューロン新生は側脳室下層に存在する神経幹細胞であるType B Cellが分裂と分化を行い、分裂の早い一過性増殖細胞(Type C Cell)を経た後、神経芽細胞(Type A Cell)へと分化し、吻側移行経路(Rostral Migratory Stream)(RMS)を通って嗅球に移動し、ニューロンへと成熟する[14](図2参照)。嗅球のニューロン新生を阻害したマウスでは、性行動や母性行動など先天的な嗅覚依存的な行動に影響を与えることが示されている[15]。
機能
海馬新生ニューロンは、歯状回の顆粒細胞として機能する。しかし、その機能は周囲にある成熟した顆粒細胞とは大きく異なり、むしろ発達期に存在する幼若タイプのニューロンに近く、発火しやすく神経可塑性に富む[16] [17]。一般に顆粒細胞は嗅内野皮質からの投射(貫通線維)を受け神経情報を受容し、苔状線維をCA3領域に伸ばし、CA3錐体細胞との間にシナプス結合を形成する。新生ニューロンは、NMDA型グルタミン酸受容体を介した神経可塑性に富んでおり[16]、加えて顆粒細胞にしては珍しくGABA神経による強い興奮抑制がない[18]。そのため、歯状回部位における神経信号のゲート機構を担っていることが推測されている。
また歯状回部位は、空間記憶におけるパターン分離を司っているが[19]、この作用は主に新生ニューロンにより司られていることが判ってきた[20] [21] [22]。加えて、新生ニューロンには、記憶をアップデートする機能や[23]、過去の記憶を整理しストレス応答を緩和する働きがあることもわかってきた[24] [25]。成体脳で新生ニューロンが存在しているのは極めて限られた部位であるが、新生ニューロンは周辺ニューロンとは極めて異なる機能特性を持っており、この特殊なニューロンが海馬回路に機能的に組み込まれることによって、記憶の形成・維持・消去や、さらには感情のコントロールへと至る様々な脳機能に対して、中核的な働きを示しているのである[23] [24] [25]。海馬体からの出力は、海馬采を経て脳弓へと至る経路と、嗅内野皮質を経て大脳新皮質の各領域と連結する経路がある[26]。
病的変化
加齢変化
海馬新生ニューロンの数は加齢に伴い、減少することが知られている[5]。加齢により、神経幹細胞の数は比較的保持されるが、新生ニューロンへの分化とその生存が極めて低下することが分かってきた[27]。ごく最近、加齢に伴う新生ニューロン数の低下に脳内の炎症反応が寄与していることが明らかになってきた[28]。
疾病下での変化
認知症や精神疾患においても、新生ニューロンの数やはたらきが低下している[5] [29]。アルツハイマー病モデルマウスを用いてこれまでに多くの研究が実施され、老人斑の蓄積に応じて新生ニューロンの数が減少し、そのはたらきも低下している[30]。アルツハイマー病のリスク遺伝子としてApoE4があるが、ApoE4を遺伝子導入したマウスでは、海馬のGABA回路のはたらきが低下し、新生ニューロン数も減少することがわかった[31]。このマウスにGABA回路のはたらきを高めるフェノバルビタールを投与すると新生ニューロン数の減少が抑えられることも明らかにされた[31]。また、家族性アルツハイマー病の原因遺伝子であるアミロイド前駆体タンパク質を導入したマウスでは、海馬GABA回路のアンバランスがおこり、新生ニューロンのはたらきが低下することが認められている[32]。このように、アルツハイマー病モデルマウスにおいて、海馬新生ニューロンのはたらきを低下させる仕組みもわかってきた。
調節
成体海馬において、新生ニューロンの数を増加させるための諸条件について、特に小動物を用いて非常に精力的に研究が展開されている。運動や学習行動など、生活習慣の改善により新生ニューロン数が増加する点が注目されている。また、各種の神経伝達物質受容体に対する薬剤も同様の作用を持つことから、海馬回路の活動が直接的あるいは間接的にニューロン新生の過程にはたらきかけていることが推測される。事実、海馬回路の活動が高まると新生ニューロンの数が増加することが知られている。この一つの仕組みとして、海馬回路から放出されたGABAによりニューロン前駆細胞が刺激され、ニューロン分化が促進することが明らかになり、GABA回路のはたらきを高める薬剤(フェノバルビタール)を投与することで海馬の新生ニューロンの数が増加することも見出された[33]。
終わりに
以上述べてきたように、1990年代から精力的に続けられている研究によって、成体脳のニューロン新生、特に海馬歯状回に起こっているニューロン新生の動態について、その起源や分化過程、そしてニューロンとなった後の機能について、多くのことが明らかとなってきた。そして、ニューロン新生の程度が、多くの病態において顕著に低下していることが、動物研究により明らかになるにつれて、アルツハイマー病をはじめとした神経変性疾患の脳内において、なぜニューロン新生が抑えられているのか、そしてこのニューロン新生の抑制はどのようにすれば解除できるのかについて、現在、研究が進展しつつある。
関連語
参考文献
- ↑
ALTMAN, J. (1962).
Autoradiographic study of degenerative and regenerative proliferation of neuroglia cells with tritiated thymidine. Experimental neurology, 5, 302-18. [PubMed:13860749] [WorldCat] [DOI] - ↑
MESSIER, B., LEBLOND, C.P., & SMART, I. (1958).
Presence of DNA synthesis and mitosis in the brain of young adult mice. Experimental cell research, 14(1), 224-6. [PubMed:13512326] [WorldCat] [DOI] - ↑
Nottebohm, F. (1985).
Neuronal replacement in adulthood. Annals of the New York Academy of Sciences, 457, 143-61. [PubMed:3913361] [WorldCat] [DOI] - ↑
Eriksson, P.S., Perfilieva, E., Björk-Eriksson, T., Alborn, A.M., Nordborg, C., Peterson, D.A., & Gage, F.H. (1998).
Neurogenesis in the adult human hippocampus. Nature medicine, 4(11), 1313-7. [PubMed:9809557] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Abrous, D.N., Koehl, M., & Le Moal, M. (2005).
Adult neurogenesis: from precursors to network and physiology. Physiological reviews, 85(2), 523-69. [PubMed:15788705] [WorldCat] [DOI] - ↑ ケンペルマン, G. & ゲージ, F. H.
大人でも脳細胞は新生する
日経サイエンス, 1999年8月号 36-42. - ↑
Carleton, A., Petreanu, L.T., Lansford, R., Alvarez-Buylla, A., & Lledo, P.M. (2003).
Becoming a new neuron in the adult olfactory bulb. Nature neuroscience, 6(5), 507-18. [PubMed:12704391] [WorldCat] [DOI] - ↑
Gould, E., Reeves, A.J., Graziano, M.S., & Gross, C.G. (1999).
Neurogenesis in the neocortex of adult primates. Science (New York, N.Y.), 286(5439), 548-52. [PubMed:10521353] [WorldCat] [DOI] - ↑
Sanai, N., Nguyen, T., Ihrie, R.A., Mirzadeh, Z., Tsai, H.H., Wong, M., ..., & Alvarez-Buylla, A. (2011).
Corridors of migrating neurons in the human brain and their decline during infancy. Nature, 478(7369), 382-6. [PubMed:21964341] [PMC] [WorldCat] [DOI] - ↑
Bhardwaj, R.D., Curtis, M.A., Spalding, K.L., Buchholz, B.A., Fink, D., Björk-Eriksson, T., ..., & Frisén, J. (2006).
Neocortical neurogenesis in humans is restricted to development. Proceedings of the National Academy of Sciences of the United States of America, 103(33), 12564-8. [PubMed:16901981] [PMC] [WorldCat] [DOI] - ↑
Seki, T., & Arai, Y. (1993).
Highly polysialylated neural cell adhesion molecule (NCAM-H) is expressed by newly generated granule cells in the dentate gyrus of the adult rat. The Journal of neuroscience : the official journal of the Society for Neuroscience, 13(6), 2351-8. [PubMed:7684771] [WorldCat] - ↑
Fukuda, S., Kato, F., Tozuka, Y., Yamaguchi, M., Miyamoto, Y., & Hisatsune, T. (2003).
Two distinct subpopulations of nestin-positive cells in adult mouse dentate gyrus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(28), 9357-66. [PubMed:14561863] [PMC] [WorldCat] - ↑
Arruda-Carvalho, M., Sakaguchi, M., Akers, K.G., Josselyn, S.A., & Frankland, P.W. (2011).
Posttraining ablation of adult-generated neurons degrades previously acquired memories. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(42), 15113-27. [PubMed:22016545] [PMC] [WorldCat] [DOI] - ↑
Alvarez-Buylla, A., García-Verdugo, J.M., & Tramontin, A.D. (2001).
A unified hypothesis on the lineage of neural stem cells. Nature reviews. Neuroscience, 2(4), 287-93. [PubMed:11283751] [WorldCat] [DOI] - ↑
Sakamoto, M., Imayoshi, I., Ohtsuka, T., Yamaguchi, M., Mori, K., & Kageyama, R. (2011).
Continuous neurogenesis in the adult forebrain is required for innate olfactory responses. Proceedings of the National Academy of Sciences of the United States of America, 108(20), 8479-84. [PubMed:21536899] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Schmidt-Hieber, C., Jonas, P., & Bischofberger, J. (2004).
Enhanced synaptic plasticity in newly generated granule cells of the adult hippocampus. Nature, 429(6988), 184-7. [PubMed:15107864] [WorldCat] [DOI] - ↑
Overstreet, L.S., Hentges, S.T., Bumaschny, V.F., de Souza, F.S., Smart, J.L., Santangelo, A.M., ..., & Rubinstein, M. (2004).
A transgenic marker for newly born granule cells in dentate gyrus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(13), 3251-9. [PubMed:15056704] [PMC] [WorldCat] [DOI] - ↑
Marín-Burgin, A., Mongiat, L.A., Pardi, M.B., & Schinder, A.F. (2012).
Unique processing during a period of high excitation/inhibition balance in adult-born neurons. Science (New York, N.Y.), 335(6073), 1238-42. [PubMed:22282476] [PMC] [WorldCat] [DOI] - ↑
McHugh, T.J., Jones, M.W., Quinn, J.J., Balthasar, N., Coppari, R., Elmquist, J.K., ..., & Tonegawa, S. (2007).
Dentate gyrus NMDA receptors mediate rapid pattern separation in the hippocampal network. Science (New York, N.Y.), 317(5834), 94-9. [PubMed:17556551] [WorldCat] [DOI] - ↑
Clelland, C.D., Choi, M., Romberg, C., Clemenson, G.D., Fragniere, A., Tyers, P., ..., & Bussey, T.J. (2009).
A functional role for adult hippocampal neurogenesis in spatial pattern separation. Science (New York, N.Y.), 325(5937), 210-3. [PubMed:19590004] [PMC] [WorldCat] [DOI] - ↑
Sahay, A., Scobie, K.N., Hill, A.S., O'Carroll, C.M., Kheirbek, M.A., Burghardt, N.S., ..., & Hen, R. (2011).
Increasing adult hippocampal neurogenesis is sufficient to improve pattern separation. Nature, 472(7344), 466-70. [PubMed:21460835] [PMC] [WorldCat] [DOI] - ↑
Nakashiba, T., Cushman, J.D., Pelkey, K.A., Renaudineau, S., Buhl, D.L., McHugh, T.J., ..., & Tonegawa, S. (2012).
Young dentate granule cells mediate pattern separation, whereas old granule cells facilitate pattern completion. Cell, 149(1), 188-201. [PubMed:22365813] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Kitamura, T., Saitoh, Y., Takashima, N., Murayama, A., Niibori, Y., Ageta, H., ..., & Inokuchi, K. (2009).
Adult neurogenesis modulates the hippocampus-dependent period of associative fear memory. Cell, 139(4), 814-27. [PubMed:19914173] [WorldCat] [DOI] - ↑ 24.0 24.1
Santarelli, L., Saxe, M., Gross, C., Surget, A., Battaglia, F., Dulawa, S., ..., & Hen, R. (2003).
Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants. Science (New York, N.Y.), 301(5634), 805-9. [PubMed:12907793] [WorldCat] [DOI] - ↑ 25.0 25.1
Snyder, J.S., Soumier, A., Brewer, M., Pickel, J., & Cameron, H.A. (2011).
Adult hippocampal neurogenesis buffers stress responses and depressive behaviour. Nature, 476(7361), 458-61. [PubMed:21814201] [PMC] [WorldCat] [DOI] - ↑
Bird, C.M., & Burgess, N. (2008).
The hippocampus and memory: insights from spatial processing. Nature reviews. Neuroscience, 9(3), 182-94. [PubMed:18270514] [WorldCat] [DOI] - ↑
Aizawa, K., Ageyama, N., Terao, K., & Hisatsune, T. (2011).
Primate-specific alterations in neural stem/progenitor cells in the aged hippocampus. Neurobiology of aging, 32(1), 140-50. [PubMed:19201065] [WorldCat] [DOI] - ↑
Villeda, S.A., Luo, J., Mosher, K.I., Zou, B., Britschgi, M., Bieri, G., ..., & Wyss-Coray, T. (2011).
The ageing systemic milieu negatively regulates neurogenesis and cognitive function. Nature, 477(7362), 90-4. [PubMed:21886162] [PMC] [WorldCat] [DOI] - ↑
Winner, B., Kohl, Z., & Gage, F.H. (2011).
Neurodegenerative disease and adult neurogenesis. The European journal of neuroscience, 33(6), 1139-51. [PubMed:21395858] [WorldCat] [DOI] - ↑
Mu, Y., & Gage, F.H. (2011).
Adult hippocampal neurogenesis and its role in Alzheimer's disease. Molecular neurodegeneration, 6, 85. [PubMed:22192775] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1
Li, G., Bien-Ly, N., Andrews-Zwilling, Y., Xu, Q., Bernardo, A., Ring, K., ..., & Huang, Y. (2009).
GABAergic interneuron dysfunction impairs hippocampal neurogenesis in adult apolipoprotein E4 knockin mice. Cell stem cell, 5(6), 634-45. [PubMed:19951691] [PMC] [WorldCat] [DOI] - ↑
Sun, B., Halabisky, B., Zhou, Y., Palop, J.J., Yu, G., Mucke, L., & Gan, L. (2009).
Imbalance between GABAergic and Glutamatergic Transmission Impairs Adult Neurogenesis in an Animal Model of Alzheimer's Disease. Cell stem cell, 5(6), 624-33. [PubMed:19951690] [PMC] [WorldCat] [DOI] - ↑
Tozuka, Y., Fukuda, S., Namba, T., Seki, T., & Hisatsune, T. (2005).
GABAergic excitation promotes neuronal differentiation in adult hippocampal progenitor cells. Neuron, 47(6), 803-15. [PubMed:16157276] [WorldCat] [DOI]