「パッチクランプ法」の版間の差分
(ページの作成:「<div align="right"> <font size="+1">[http://researchmap.jp/kennyfutai 二井 健介]</font><br> ''マサチューセッツ州立大学 メディカルスクール''<b...」) |
細編集の要約なし |
||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[http://researchmap.jp/kennyfutai 二井 健介]</font><br> | <font size="+1">[http://researchmap.jp/kennyfutai 二井 健介]、[http://profiles.umassmed.edu/profiles/ProfileDetails.aspx?Person=3324 渡辺卓也]</font><br> | ||
''マサチューセッツ州立大学 メディカルスクール''<br> | ''マサチューセッツ州立大学 メディカルスクール''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2013年6月4日 原稿完成日:2013年6月xx日<br> | DOI [[XXXX]]/XXXX 原稿受付日:2013年6月4日 原稿完成日:2013年6月xx日<br> | ||
| 8行目: | 8行目: | ||
{{box|text= パッチクランプ法は、イオンチャネルを介したイオンの挙動(電流)を記録することで、細胞膜上の単一または複数のイオンチャネルの活動を直接的に測定する方法である。 | {{box|text= パッチクランプ法は、イオンチャネルを介したイオンの挙動(電流)を記録することで、細胞膜上の単一または複数のイオンチャネルの活動を直接的に測定する方法である。 | ||
培養細胞や急性単離標本、組織標本(スライス切片)、さらに''in vivo''の系において適用可能であり、主に神経、心筋、平滑筋、感覚器細胞などを対象とした研究に用いられている。 | |||
パッチクランプ法は電位固定法を基に、Erwin NeherとBert Sakmannによって開発された<ref name=ref1><pubmed>1083489</pubmed></ref>。彼らはこの方法により筋線維における単一アセチルコリン電流を直接的に検出し、イオン通過路としてのチャネルの存在を初めて証明した。その後、ギガシール法の確立とパッチクランプ法を応用した様々な方法の追加開発により、多くの細胞系に用いられるようになった。この技法を発明し、発展させたことにより、1991年にErwin NeherとBert Sakmannはノーベル生理学・医学賞を受賞した。}} | |||
== 基本的技術 == | == 基本的技術 == | ||
先端が開口しているガラス微小ピペットを電極として用いる。電極先端の経は1μmほどであり、この大きさは[[細胞膜]]上の[[イオンチャネル]]が数個入る程度である。さらに、熱加工により先端表面は滑らかであり、細胞膜と高抵抗で密着する。電極内部は、実験目的に応じて選択された内液によって満たされる(例えば、セルアタッチ法では、内液とバス液のイオン組成は同じである)。また、薬物を添加したり、イオン組成を変えたりして、異なる環境下のイオンチャネルの挙動を解析することも可能である。内液と接触している塩化銀の金属線は、専用アンプへ電流を伝える。電極は細胞に接触し、吸引により内部に軽い陰圧をかけることで、細胞膜とピペット先端との隙間が非常に小さくなる。この隙間の絶縁性は非常に高いため、電極内部とバス液の間の電気抵抗は非常に高くなる。この電気抵抗は1ギガオーム以上になるため、このピペットと細胞膜の密着をギガシールと呼ぶ。このギガシールにより、漏れ電流が非常に小さくなり、イオンチャネルの開閉による小さな電流を測定することが可能となる。 | |||
== 種々の方法 == | == 種々の方法 == | ||
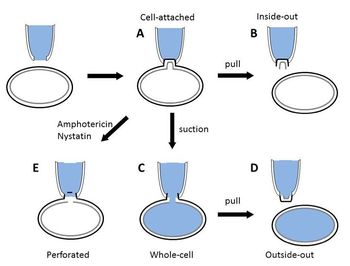
[[image:パッチクランプ.jpg|thumb|350px|'''図.パッチクランプ法の様々な方法''']] | |||
研究目的によって以下のパッチクランプ法が使い分けられる(図)。セルアタッチ法とインサイド-アウト法、アウトサイド-アウト法は、電極で取り囲んだ領域のイオンチャネルの挙動を記録するために用いられる(単一チャネル記録法)。ホールセル法とパーフォレイテッド法は単一チャネル電流ではなく、細胞膜全体の電気現象を記録することができる(全細胞電流記録法)。 | |||
== セルアタッチ法 == | === セルアタッチ法 === | ||
電極を細胞膜上に密着させたまま記録する方法である。この方法は細胞内液と電極内液が混ざらないため、細胞内環境を変化させることなく、単一イオンチャネル電流や神経細胞の発火頻度を記録することができる。リガンド依存性イオンチャネルや代謝型受容体に調節されるチャネルに関する研究では、細胞膜の外部表面に神経伝達物質や薬物が接触できるように、それらを電極内液に含ませて使用する。 | |||
== インサイド-アウト法 == | === インサイド-アウト法 === | ||
セルアタッチ法の状態からギガシールした電極を引き上げると、細胞からパッチ膜が切り離され、細胞膜の内側がバス液中に露出した状態がインサイドーアウト法である。これをインサイドーアウト法と呼ぶ。この方法ではイオンチャネルの細胞膜内側の条件を調節することが可能であり、細胞内リガンドによって影響されるイオンチャネルの解析に有用である。 | |||
== ホールセル法(コンベンショナル ホールセル法) == | === ホールセル法(コンベンショナル ホールセル法) === | ||
セルアタッチ法から電極の陰圧をさらに強くすることでパッチ膜を破って穴を開け、電極内と細胞内が繋がる状態がホールセル法である。ホールセル法では、全細胞膜の複数のイオンチャネルを介した電流を記録することが可能である。ホールセル法は、電極を刺入して電流を記録する方法と比較して、ギガシールの結果によりリーク電流が非常に少なく安定して記録することができる。しかし、穴を通して細胞内の可溶性成分が電極内液側へ漏出することにより細胞内から失われるという欠点がある。 | |||
== アウトサイド-アウト法 == | === アウトサイド-アウト法 === | ||
ホールセル法の状態から電極をゆっくりと細胞から引き離し、細胞膜の小胞を形成させ、細胞から切り取る。これにより細胞膜の外側が電極の外側を向くようになる。細胞外液組成を調節して記録することができるため、神経伝達物質のような細胞膜の外側に作用するような物質の研究に用いられる。 | |||
== パーフォレイテッド法(穿孔パッチ法) == | === パーフォレイテッド法(穿孔パッチ法) === | ||
コンベンショナル ホールセル法の代替法であり、HornとMartyによって開発された<ref name=ref2><pubmed>2459299</pubmed></ref> | コンベンショナル ホールセル法の代替法であり、HornとMartyによって開発された<ref name=ref2><pubmed>2459299</pubmed></ref>。ギガシールを形成後、陰圧によって膜を破るのではなく、パッチ電極内液に含まれたナイスタチン、アンフォテリシンBやグラミシジンのような抗生物質によって細胞膜に小さな穴をあける方法である。これらの抗生物質が、ほとんどの細胞膜に一価イオンや10Å以下の径を持つ分子を通過させる孔をあけることを利用している。そのため、膜を破らずに全細胞膜での電流を記録することができる。また、細胞の内容成分の漏出を軽減し、細胞内環境を保持することが可能となる。しかし、いくつかの欠点がある。まず、ホールセル法と比較して、シリーズ抵抗が高くなり、電気的解像能が低下する。また、抗生物質による細胞膜の穿孔には時間がかかる(10-30分間)。さらに、抗生物質により形成された孔によって電極先端の膜は弱くなっているため、その膜が破れて、コンベンショナル ホールセル法に移行する危険性がある。 | ||
== ルーズパッチ法 == | === ルーズパッチ法 === | ||
非侵襲的に細胞から記録を行うため、ギガシールよりも緩いシールを形成して記録を行う方法をルーズパッチ法と呼ぶ。シールが緩いので、記録後に電極を細胞膜から取り去っても細胞膜は無傷であり、細胞膜を壊すことなく、同じ細胞の異なる場所で繰り返し記録することが可能である。しかし、電極と細胞膜間の抵抗が低いため、電流が漏れやすいという欠点がある。この漏れ電流は、細胞の異なる場所での記録と比較することで補正することができる。 | |||
=== ブラインドパッチ法 === | |||
顕微鏡下で観察できない組織深部にある細胞から記録を行うために、オシロスコープ上で電極抵抗の変化を観察しながら、細胞に電極を接触させ、記録を行う方法をブラインドパッチ法と呼ぶ。視覚的に標的細胞を選別しないため、無作為的に細胞から記録することができる。しかし、様々な種類の細胞が存在する場所では、どの種類の細胞から記録したのかわからないため、電極内液に標識物質等を添加し、記録後に細胞を同定する必要がある。 | |||
=== オートパッチクランプ法 === | |||
(i)ブラインドパッチ法をロボットに応用させたin vivoでのパッチクランプ法が開発されている<ref><pubmed>22561988</pubmed></ref>。(ii)複数のパッチ穴のあるプレートやチップ上の培養細胞でのパッチクランプ法が開発されている<ref><pubmed>12854998</pubmed></ref> <ref><pubmed>19149491</pubmed></ref>。プレートやチップを用いたパッチクランプ法は、短時間に大量のデータを取得することが可能であり、薬物のスクリーニングに有用である。 | |||
=== 神経細胞におけるdendriticパッチクランプ法 === | |||
神経細胞の細胞体と樹状突起間ではチャネルの分布や特性が違うため、電流電位応答が異なる。樹状突起での微細な電流電位応答を記録するため、細胞体ではなく、樹状突起に電極を当てて記録するdendritic パッチクランプ法がある<ref><pubmed>17406407</pubmed></ref>。 | |||
== 参考文献 == | == 参考文献 == | ||
2013年6月13日 (木) 15:47時点における版
二井 健介、渡辺卓也
マサチューセッツ州立大学 メディカルスクール
DOI XXXX/XXXX 原稿受付日:2013年6月4日 原稿完成日:2013年6月xx日
担当編集委員:林 康紀(独立行政法人理化学研究所)
パッチクランプ法は、イオンチャネルを介したイオンの挙動(電流)を記録することで、細胞膜上の単一または複数のイオンチャネルの活動を直接的に測定する方法である。
培養細胞や急性単離標本、組織標本(スライス切片)、さらにin vivoの系において適用可能であり、主に神経、心筋、平滑筋、感覚器細胞などを対象とした研究に用いられている。
パッチクランプ法は電位固定法を基に、Erwin NeherとBert Sakmannによって開発された[1]。彼らはこの方法により筋線維における単一アセチルコリン電流を直接的に検出し、イオン通過路としてのチャネルの存在を初めて証明した。その後、ギガシール法の確立とパッチクランプ法を応用した様々な方法の追加開発により、多くの細胞系に用いられるようになった。この技法を発明し、発展させたことにより、1991年にErwin NeherとBert Sakmannはノーベル生理学・医学賞を受賞した。
基本的技術
先端が開口しているガラス微小ピペットを電極として用いる。電極先端の経は1μmほどであり、この大きさは細胞膜上のイオンチャネルが数個入る程度である。さらに、熱加工により先端表面は滑らかであり、細胞膜と高抵抗で密着する。電極内部は、実験目的に応じて選択された内液によって満たされる(例えば、セルアタッチ法では、内液とバス液のイオン組成は同じである)。また、薬物を添加したり、イオン組成を変えたりして、異なる環境下のイオンチャネルの挙動を解析することも可能である。内液と接触している塩化銀の金属線は、専用アンプへ電流を伝える。電極は細胞に接触し、吸引により内部に軽い陰圧をかけることで、細胞膜とピペット先端との隙間が非常に小さくなる。この隙間の絶縁性は非常に高いため、電極内部とバス液の間の電気抵抗は非常に高くなる。この電気抵抗は1ギガオーム以上になるため、このピペットと細胞膜の密着をギガシールと呼ぶ。このギガシールにより、漏れ電流が非常に小さくなり、イオンチャネルの開閉による小さな電流を測定することが可能となる。
種々の方法
研究目的によって以下のパッチクランプ法が使い分けられる(図)。セルアタッチ法とインサイド-アウト法、アウトサイド-アウト法は、電極で取り囲んだ領域のイオンチャネルの挙動を記録するために用いられる(単一チャネル記録法)。ホールセル法とパーフォレイテッド法は単一チャネル電流ではなく、細胞膜全体の電気現象を記録することができる(全細胞電流記録法)。
セルアタッチ法
電極を細胞膜上に密着させたまま記録する方法である。この方法は細胞内液と電極内液が混ざらないため、細胞内環境を変化させることなく、単一イオンチャネル電流や神経細胞の発火頻度を記録することができる。リガンド依存性イオンチャネルや代謝型受容体に調節されるチャネルに関する研究では、細胞膜の外部表面に神経伝達物質や薬物が接触できるように、それらを電極内液に含ませて使用する。
インサイド-アウト法
セルアタッチ法の状態からギガシールした電極を引き上げると、細胞からパッチ膜が切り離され、細胞膜の内側がバス液中に露出した状態がインサイドーアウト法である。これをインサイドーアウト法と呼ぶ。この方法ではイオンチャネルの細胞膜内側の条件を調節することが可能であり、細胞内リガンドによって影響されるイオンチャネルの解析に有用である。
ホールセル法(コンベンショナル ホールセル法)
セルアタッチ法から電極の陰圧をさらに強くすることでパッチ膜を破って穴を開け、電極内と細胞内が繋がる状態がホールセル法である。ホールセル法では、全細胞膜の複数のイオンチャネルを介した電流を記録することが可能である。ホールセル法は、電極を刺入して電流を記録する方法と比較して、ギガシールの結果によりリーク電流が非常に少なく安定して記録することができる。しかし、穴を通して細胞内の可溶性成分が電極内液側へ漏出することにより細胞内から失われるという欠点がある。
アウトサイド-アウト法
ホールセル法の状態から電極をゆっくりと細胞から引き離し、細胞膜の小胞を形成させ、細胞から切り取る。これにより細胞膜の外側が電極の外側を向くようになる。細胞外液組成を調節して記録することができるため、神経伝達物質のような細胞膜の外側に作用するような物質の研究に用いられる。
パーフォレイテッド法(穿孔パッチ法)
コンベンショナル ホールセル法の代替法であり、HornとMartyによって開発された[2]。ギガシールを形成後、陰圧によって膜を破るのではなく、パッチ電極内液に含まれたナイスタチン、アンフォテリシンBやグラミシジンのような抗生物質によって細胞膜に小さな穴をあける方法である。これらの抗生物質が、ほとんどの細胞膜に一価イオンや10Å以下の径を持つ分子を通過させる孔をあけることを利用している。そのため、膜を破らずに全細胞膜での電流を記録することができる。また、細胞の内容成分の漏出を軽減し、細胞内環境を保持することが可能となる。しかし、いくつかの欠点がある。まず、ホールセル法と比較して、シリーズ抵抗が高くなり、電気的解像能が低下する。また、抗生物質による細胞膜の穿孔には時間がかかる(10-30分間)。さらに、抗生物質により形成された孔によって電極先端の膜は弱くなっているため、その膜が破れて、コンベンショナル ホールセル法に移行する危険性がある。
ルーズパッチ法
非侵襲的に細胞から記録を行うため、ギガシールよりも緩いシールを形成して記録を行う方法をルーズパッチ法と呼ぶ。シールが緩いので、記録後に電極を細胞膜から取り去っても細胞膜は無傷であり、細胞膜を壊すことなく、同じ細胞の異なる場所で繰り返し記録することが可能である。しかし、電極と細胞膜間の抵抗が低いため、電流が漏れやすいという欠点がある。この漏れ電流は、細胞の異なる場所での記録と比較することで補正することができる。
ブラインドパッチ法
顕微鏡下で観察できない組織深部にある細胞から記録を行うために、オシロスコープ上で電極抵抗の変化を観察しながら、細胞に電極を接触させ、記録を行う方法をブラインドパッチ法と呼ぶ。視覚的に標的細胞を選別しないため、無作為的に細胞から記録することができる。しかし、様々な種類の細胞が存在する場所では、どの種類の細胞から記録したのかわからないため、電極内液に標識物質等を添加し、記録後に細胞を同定する必要がある。
オートパッチクランプ法
(i)ブラインドパッチ法をロボットに応用させたin vivoでのパッチクランプ法が開発されている[3]。(ii)複数のパッチ穴のあるプレートやチップ上の培養細胞でのパッチクランプ法が開発されている[4] [5]。プレートやチップを用いたパッチクランプ法は、短時間に大量のデータを取得することが可能であり、薬物のスクリーニングに有用である。
神経細胞におけるdendriticパッチクランプ法
神経細胞の細胞体と樹状突起間ではチャネルの分布や特性が違うため、電流電位応答が異なる。樹状突起での微細な電流電位応答を記録するため、細胞体ではなく、樹状突起に電極を当てて記録するdendritic パッチクランプ法がある[6]。
参考文献
- ↑
Neher, E., & Sakmann, B. (1976).
Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature, 260(5554), 799-802. [PubMed:1083489] [WorldCat] [DOI] - ↑
Horn, R., & Marty, A. (1988).
Muscarinic activation of ionic currents measured by a new whole-cell recording method. The Journal of general physiology, 92(2), 145-59. [PubMed:2459299] [PMC] [WorldCat] [DOI] - ↑
Kodandaramaiah, S.B., Franzesi, G.T., Chow, B.Y., Boyden, E.S., & Forest, C.R. (2012).
Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nature methods, 9(6), 585-7. [PubMed:22561988] [PMC] [WorldCat] [DOI] - ↑
Schroeder, K., Neagle, B., Trezise, D.J., & Worley, J. (2003).
Ionworks HT: a new high-throughput electrophysiology measurement platform. Journal of biomolecular screening, 8(1), 50-64. [PubMed:12854998] [WorldCat] [DOI] - ↑
Korsgaard, M.P., Strøbaek, D., & Christophersen, P. (2009).
Automated planar electrode electrophysiology in drug discovery: examples of the use of QPatch in basic characterization and high content screening on Na(v), K(Ca)2.3, and K(v)11.1 channels. Combinatorial chemistry & high throughput screening, 12(1), 51-63. [PubMed:19149491] [WorldCat] [DOI] - ↑
Davie, J.T., Kole, M.H., Letzkus, J.J., Rancz, E.A., Spruston, N., Stuart, G.J., & Häusser, M. (2006).
Dendritic patch-clamp recording. Nature protocols, 1(3), 1235-47. [PubMed:17406407] [WorldCat] [DOI]
3.岡田泰伸
新パッチクランプ実験技術法
吉岡書店 (2001) ISBN 4-8427-0296-6
4.Tritsch D. Chesnoy-Marchais D. Feltz A.(translation supervised by Mikoshiba K.)
ニューロンの生理学
京都大学学術出版会 ISBN 978-4-87698-773-3