「前障」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の13版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">安島 綾子、[https://researchmap.jp/yoshihiroyoshihara/ 吉原 良浩]</font><br> | <font size="+1">安島 綾子、[https://researchmap.jp/yoshihiroyoshihara/ 吉原 良浩]</font><br> | ||
''理化学研究所 脳神経科学研究センター システム分子行動学研究チーム''<br> | ''理化学研究所 脳神経科学研究センター システム分子行動学研究チーム''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2019年3月29日 原稿完成日:2019年4月5日<br> | ||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/keijitanaka 田中 啓治](独立行政法人理化学研究所 脳神経科学研究センター)<br> | ||
</div> | </div> | ||
羅:claustrum 英:claustrum 独:Claustrum 仏:claustrum | 羅:claustrum 英:claustrum 独:Claustrum 仏:claustrum | ||
{{box|text= | {{box|text= 前障は哺乳類に特徴的な脳の一領域。大脳皮質(島皮質)の内側、線条体の外側に位置し、前後方向・背腹方向に伸展した薄い灰白質である。前障はほとんどすべての大脳皮質及び扁桃体基底外側部と双方向性の結合をもつ。この特徴的な神経結合様式や電気生理学的実験の結果などをもとにして、これまでに多くの研究者が前障の機能についての考察を行い、多種感覚情報の統合、サリエンシーの検出、注意の割り当て、意識のオン/オフなど、高次脳機能における前障の関与についての仮説が提唱されている。}} | ||
== 解剖 == | == 解剖 == | ||
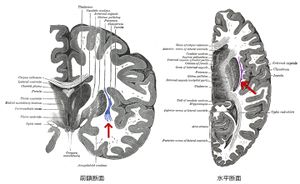
[[ファイル:Ajima Fig 1.jpg|サムネイル|右|'''図1. ヒト前障(赤矢印)'''<br>Wikipediaより]] | [[ファイル:Ajima Fig 1.jpg|サムネイル|右|'''図1. ヒト前障(赤矢印)'''<br>Wikipediaより]] | ||
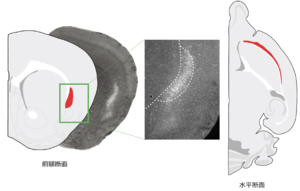
[[ファイル:Ajima Fig 2.png|サムネイル|'''図2. マウス前障(赤)'''<br>写真は前障のグルタミン酸作働性ニューロン のマーカーラテキシンの免疫染色像]] | [[ファイル:Ajima Fig 2.png|サムネイル|'''図2. マウス前障(赤)'''<br>写真は前障のグルタミン酸作働性ニューロン のマーカーラテキシンの免疫染色像]] | ||
[[霊長類]] | [[霊長類]]では、前障は[[大脳皮質]]([[島皮質]])と[[線条体]]の間の[[白質]]の中に位置する、前後方向・背腹方向に伸展した薄いシート状の[[灰白質]]である('''図1''')、[[げっ歯類]]では前障と島皮質の間に白質はなく、前障は島皮質の内側に接する('''図2''')。 | ||
=== 細胞構築 === | === 細胞構築 === | ||
[[ヒト]][[脳切片]]の[[ゴルジ染色]]により、前障にはおもに3種類のニューロンの存在が確認されている。そのうち大部分(85-90%)は大型の[[細胞体]] | [[ヒト]][[脳切片]]の[[ゴルジ染色]]により、前障にはおもに3種類のニューロンの存在が確認されている。そのうち大部分(85-90%)は大型の[[細胞体]]と[[有棘樹状突起]](spiny dendrite)を有しており、前障への入力を受け、前障からの出力を担う[[興奮性ニューロン]]であると考えられている。残りのニューロンは[[無棘樹状突起]](aspiny dendrite)を有し、細胞体の大きさから2種類に分類され、[[抑制性ニューロン]]であると考えられている<ref><pubmed> 7091711</pubmed></ref>。 | ||
マウス[[脳スライス標本]]における電気生理学実験によって、前障ニューロンは電気生理学的特性の異なる2種類の興奮性ニューロンと3種類の抑制性ニューロンに分類されている。これら2種類の興奮性ニューロンは、大脳皮質への[[軸索]] | マウス[[脳スライス標本]]における電気生理学実験によって、前障ニューロンは電気生理学的特性の異なる2種類の興奮性ニューロンと3種類の抑制性ニューロンに分類されている。これら2種類の興奮性ニューロンは、大脳皮質への[[軸索]]投射パターンが異なっており、機能的な差異を持つと考えらえる<ref><pubmed> 30109490 </pubmed></ref>。 | ||
=== 入力・出力 === | === 入力・出力 === | ||
[[ラット]]、[[ネコ]]、[[サル]]等での古典的トレーサー実験により、前障は大脳皮質のほとんどすべての領野および[[扁桃体]][[基底外側部]]と双方向性な神経結合を有すると報告されている<ref><pubmed> 26801010 </pubmed></ref><ref name=eGariepy><pubmed> 12412139 </pubmed></ref><ref name=Smythies2014 >'''Smythies JR, Edelstein LR and Ramachandran VS ed.'''<br>The claustrum-structural, functional and clinical neuroscience.<br>''Academic Press:'' 2014</ref><ref><pubmed> 15643691 </pubmed></ref>。ネコ大脳皮質視覚野あるいは聴覚野と前障との神経結合様式を解析した実験で、前障の異なる亜領域がそれぞれ視覚野あるいは聴覚野と双方向結合を持つことが報告された<ref><pubmed>6169810</pubmed></ref><ref name=Beneyto><pubmed>11397538</pubmed></ref>。これらの亜領域は、それぞれ視覚前障 (visual claustrum)、聴覚前障(auditory claustrum)と呼ばれる。また、サルにおいて、皮質間結合が強い二つの領野(例えば[[運動前野]]と[[前頭連合野]]など)は前障内の共通のサブ領域に投射するが、皮質間結合が弱い二つの領野は異なるサブ領域に投射することが示されている<ref name=eGariepy /><ref><pubmed>6800568</pubmed></ref><ref><pubmed>2846794</pubmed></ref>。また、大脳皮質からの直接入力は、前障内興奮性ニューロンとともに抑制性ニューロンにも送られ、大脳皮質から前障への[[フィードフォワード抑制機構]]が存在することが報告されている<ref name=Kim2016><PubMed>26791208</pubmed></ref>。 | |||
最近、[[トランスジェニックマウス]]や[[ウイルスベクター]]技術を駆使した前障ニューロンの神経回路遺伝学的解析が盛んに行われつつある<ref name=Zingg2018><pubmed> 30252130 </pubmed></ref><ref name=Narikiyo2018>'''Narikiyo K, Mizuguchi R, Ajima A, Mitsui S, Shiozaki M, Hamanaka H, Johansen JP, Mori K and Yoshihara Y'''<br>The claustrum coordinates cortical slow-wave activity.<br>bioRxiv: 2018, doi: https://doi.org/10.1101/286773</ref><ref name= Jackson2018><pubmed> 30122374 </pubmed></ref><ref name=Atlan2018><pubmed> 30122531 </pubmed></ref>。その結果は、上述の神経回路トレーサーを用いた古典的神経解剖学の知見とほとんど一致しており、前障が広範な大脳皮質領域および扁桃体基底外側部と双方性神経結合を有することが確認された<ref name=Zingg2018 /><ref name=Narikiyo2018 /><ref name=Wang2017></ref><ref name=Altan2017><pubmed>26973027 </pubmed></ref>。また、改変型[[狂犬病ウイルス]]を用いた単一シナプス逆行性トレーシング実験により、[[縫線核]]の[[セロトニン]]作働性ニューロン、[[大脳基底核]]の[[アセチルコリン]]作働性ニューロン、[[視床]][[内背側核]]の[[グルタミン酸]]作働性ニューロンなどから、前障へのシナプス入力の存在が明らかとなった<ref name=Zingg2018 /><ref name=Narikiyo2018 /><ref name=Atlan2018 />。 | |||
最近、[[トランスジェニックマウス]]や[[ウイルスベクター]]技術を駆使した前障ニューロンの神経回路遺伝学的解析が盛んに行われつつある<ref name=Zingg2018><pubmed> 30252130 </pubmed></ref><ref name=Narikiyo2018>'''Narikiyo K, Mizuguchi R, Ajima A, Mitsui S, Shiozaki M, Hamanaka H, Johansen JP, Mori K and Yoshihara Y'''<br>The claustrum coordinates cortical slow-wave activity.<br>bioRxiv: 2018, doi: https://doi.org/10.1101/286773</ref><ref name= Jackson2018><pubmed> 30122374 </pubmed></ref><ref name=Atlan2018><pubmed> 30122531 </pubmed></ref> | |||
=== 内部回路 === | === 内部回路 === | ||
前障内部の神経回路については、前障—皮質間の神経結合様式に比較して、研究が非常に少なく、ほとんど分かっていない。[[マウス]]脳スライス標本における前障内の2つの近傍ニューロンからの同時記録実験により、抑制性ニューロン同士及び興奮性ニューロン-抑制性ニューロン間の結合に比較して、前障内における興奮性ニューロン同士の結合は非常に少ないことが示されている。また、抑制性ニューロン同士の結合は、[[電気シナプス]]と[[化学シナプス]]の両方が存在すると報告されている<ref name=Kim2016></ref>。 | |||
=== 分子マーカー === | === 分子マーカー === | ||
前障だけに特異的に発現する分子はこれまでに発見されていない。しかしながら、マウスでは、[[Gnb4]] (guanine nucleotide-binding protein subunit β-4)、[[Gng2]] (guanine nucleotide-binding protein subunit γ-2)、[[Ntng2]]([[ネトリンG2]])、[[Nr4a2]] (nuclear receptor 4a2)、[[ラテキシン]]などが、前障ニューロンに高発現しており、隣接する皮質領域と前障を区別する分子マーカーとして利用されている('''図2''')<ref name=Narikiyo2018 /><ref name=Wang2017><pubmed>27223051</pubmed></ref><ref><pubmed>16203099</pubmed></ref><ref><pubmed> 24904319 </pubmed></ref>。また最近、前障ニューロンにDNA組換え酵素[[Cre]]を発現する遺伝子改変マウスが報告されている<ref name=Narikiyo2018></ref><ref name=Atlan2018 ></ref><ref name=Wang2017></ref> 。 | |||
== 機能 == | == 機能 == | ||
[[多種感覚情報統合|多種感覚情報の統合]] (multimodal sensory integration)、[[ | [[多種感覚情報統合|多種感覚情報の統合]] (multimodal sensory integration)、[[サリエンシー]]の検出 (saliency detection)、[[注意]]の割り当て (attentional load allocation)、[[意識]]の中枢 (neural correlates of consciousness)など、高次脳機能における前障の関与についての仮説が提唱されている<ref name=Smythies2014 /><ref><pubmed> 16147522 </pubmed></ref><ref><pubmed> 26116988 </pubmed></ref><ref><pubmed> 29118217 </pubmed></ref>。 | ||
=== 前障ニューロンの活動 === | === 前障ニューロンの活動 === | ||
前障ニューロンは、一般に低い自発発火頻度を持つことが、単一細胞記録で示されている<ref name=Narikiyo2018></ref><ref><pubmed> 13332440 </pubmed></ref>。また、睡眠中<ref name=Narikiyo2018></ref><ref><pubmed> 26601158 </pubmed></ref><ref><pubmed> 28347885 </pubmed></ref>における活動が覚醒時よりも高いことが、[[c-fos]]発現解析や単一細胞記録で報告されている。 | |||
サルとネコの実験において、前障には視覚刺激または聴覚刺激に反応するニューロンがあること報告されている<ref name=Olson><pubmed> 7442793 </pubmed></ref><ref name=Sherk><pubmed> 7209525 </pubmed></ref><ref name=Remedios2010><pubmed> 20881109 </pubmed></ref><ref name=Remedios2014><pubmed> 24772069 </pubmed></ref>。これらの反応の刺激特徴(傾きや音の高さなど)に対する選択性は低く<ref name=Olson /><ref name=Sherk /><ref><pubmed> 3948949 </pubmed></ref>、刺激開始時に限局している<ref name=Remedios2010></ref><ref name=Remedios2014></ref> 。これらのことは、前障ニューロンは詳細な感覚情報ではなく、個々の刺激のタイミングの情報を伝えていることを示唆している。 | |||
=== 前障ニューロンが大脳皮質に及ぼす影響 === | === 前障ニューロンが大脳皮質に及ぼす影響 === | ||
1980年頃から前障の電気刺激や傷害に伴う大脳皮質ニューロンの活動変化を解析する研究がなされてきたが<ref><pubmed> 7104694 </pubmed></ref><ref><pubmed> 6489496 </pubmed></ref><ref><pubmed> 3257060 </pubmed></ref><ref><pubmed> 26186439 </pubmed></ref> | 1980年頃から前障の電気刺激や傷害に伴う大脳皮質ニューロンの活動変化を解析する研究がなされてきたが<ref><pubmed> 7104694 </pubmed></ref><ref><pubmed> 6489496 </pubmed></ref><ref><pubmed> 3257060 </pubmed></ref><ref><pubmed> 26186439 </pubmed></ref>、薄く不規則な形のシート状構造をとる前障のニューロンを選択的に興奮あるいは抑制させることは困難であり、前障の機能についての統一的見解は得られていなかった。しかしながら近年の、ウイルスベクター・[[光遺伝学]]・[[化学遺伝学]]などの神経回路遺伝学技術の革新により、光刺激や薬物投与で前障ニューロン特異的に活動操作をすることが可能となり、ようやくその機能の一端が明らかになりつつある。 | ||
マウス前障ニューロンに[[チャネルロドプシン|光駆動性陽イオンチャネル]]([[チャネルロドプシン]])を発現させ、光刺激によって前障ニューロンを興奮させると、大脳皮質内の多くの抑制性ニューロン(特に[[ニューロペプチドY]] ([[NPY]])陽性ニューロンと[[パルブアルブミン]] (PV)陽性ニューロン)において[[活動電位]]が発生する<ref name=Narikiyo2018></ref><ref name= Jackson2018></ref>。しかし、大脳皮質の[[錐体細胞]]では、興奮性[[後シナプス電位]](excitatory postsynaptic potential: EPSP)が誘導されるものの、活動電位は発生しない<ref name= Jackson2018></ref>。ところが、NPY陽性抑制性ニューロンの活動を阻害しておくと、前障の光遺伝学的刺激により活動電位が発生する<ref name= Jackson2018></ref>。これらのことから前障ニューロンは、大脳皮質内抑制性ニューロン(特にNPY陽性ニューロン)の興奮を介して、錐体細胞に[[フィードフォワード抑制]]をかけると考えられる。 | |||
ヒトの[[てんかん]]発作の治療の一環で、前障に高頻度電気刺激を与えると、それまでの行動が一時停止し、意識喪失状態になる。電気刺激を止めたところ、何事もなかったかのように元の動作を続けたと報告されている<ref><pubmed> 24967698 </pubmed></ref>。マウス及びヒトにおける以上の知見により、前障が意識のオン/オフに関与している可能性が示唆されている。 | |||
その他に、前障ニューロンの神経回路遺伝学的な抑制操作によって、[[恐怖文脈条件づけ]]学習(contextual fear conditioning)における長期の記憶が低下すること <ref><pubmed> 28077707 </pubmed></ref>、[[5選択連続反応時間課題]](5-choice serial reaction time task)におけるトップダウン注意の低下が起こること、無関連な妨害音を無視できなくなって[[二肢強制選択タスク]](two-alternative forced choice task)や[[養育行動]]([[新生児回収行動テスト]]:pup retrieval test)の成功率が低下することが報告されており<ref name=Atlan2018></ref>、前障が[[記憶]]・注意の割り当て・多感覚情報の統合など、さまざまな高次機能に関わる可能性が示されている。 | |||
その他に、前障ニューロンの神経回路遺伝学的な抑制操作によって、[[恐怖文脈条件づけ]]学習(contextual fear conditioning)における長期の記憶が低下すること <ref><pubmed> 28077707 </pubmed></ref> | |||
== 関連項目 == | == 関連項目 == | ||
| 63行目: | 57行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2019年4月8日 (月) 12:11時点における最新版
安島 綾子、吉原 良浩
理化学研究所 脳神経科学研究センター システム分子行動学研究チーム
DOI:10.14931/bsd.7940 原稿受付日:2019年3月29日 原稿完成日:2019年4月5日
担当編集委員:田中 啓治(独立行政法人理化学研究所 脳神経科学研究センター)
羅:claustrum 英:claustrum 独:Claustrum 仏:claustrum
前障は哺乳類に特徴的な脳の一領域。大脳皮質(島皮質)の内側、線条体の外側に位置し、前後方向・背腹方向に伸展した薄い灰白質である。前障はほとんどすべての大脳皮質及び扁桃体基底外側部と双方向性の結合をもつ。この特徴的な神経結合様式や電気生理学的実験の結果などをもとにして、これまでに多くの研究者が前障の機能についての考察を行い、多種感覚情報の統合、サリエンシーの検出、注意の割り当て、意識のオン/オフなど、高次脳機能における前障の関与についての仮説が提唱されている。
解剖
霊長類では、前障は大脳皮質(島皮質)と線条体の間の白質の中に位置する、前後方向・背腹方向に伸展した薄いシート状の灰白質である(図1)、げっ歯類では前障と島皮質の間に白質はなく、前障は島皮質の内側に接する(図2)。
細胞構築
ヒト脳切片のゴルジ染色により、前障にはおもに3種類のニューロンの存在が確認されている。そのうち大部分(85-90%)は大型の細胞体と有棘樹状突起(spiny dendrite)を有しており、前障への入力を受け、前障からの出力を担う興奮性ニューロンであると考えられている。残りのニューロンは無棘樹状突起(aspiny dendrite)を有し、細胞体の大きさから2種類に分類され、抑制性ニューロンであると考えられている[1]。
マウス脳スライス標本における電気生理学実験によって、前障ニューロンは電気生理学的特性の異なる2種類の興奮性ニューロンと3種類の抑制性ニューロンに分類されている。これら2種類の興奮性ニューロンは、大脳皮質への軸索投射パターンが異なっており、機能的な差異を持つと考えらえる[2]。
入力・出力
ラット、ネコ、サル等での古典的トレーサー実験により、前障は大脳皮質のほとんどすべての領野および扁桃体基底外側部と双方向性な神経結合を有すると報告されている[3][4][5][6]。ネコ大脳皮質視覚野あるいは聴覚野と前障との神経結合様式を解析した実験で、前障の異なる亜領域がそれぞれ視覚野あるいは聴覚野と双方向結合を持つことが報告された[7][8]。これらの亜領域は、それぞれ視覚前障 (visual claustrum)、聴覚前障(auditory claustrum)と呼ばれる。また、サルにおいて、皮質間結合が強い二つの領野(例えば運動前野と前頭連合野など)は前障内の共通のサブ領域に投射するが、皮質間結合が弱い二つの領野は異なるサブ領域に投射することが示されている[4][9][10]。また、大脳皮質からの直接入力は、前障内興奮性ニューロンとともに抑制性ニューロンにも送られ、大脳皮質から前障へのフィードフォワード抑制機構が存在することが報告されている[11]。
最近、トランスジェニックマウスやウイルスベクター技術を駆使した前障ニューロンの神経回路遺伝学的解析が盛んに行われつつある[12][13][14][15]。その結果は、上述の神経回路トレーサーを用いた古典的神経解剖学の知見とほとんど一致しており、前障が広範な大脳皮質領域および扁桃体基底外側部と双方性神経結合を有することが確認された[12][13][16][17]。また、改変型狂犬病ウイルスを用いた単一シナプス逆行性トレーシング実験により、縫線核のセロトニン作働性ニューロン、大脳基底核のアセチルコリン作働性ニューロン、視床内背側核のグルタミン酸作働性ニューロンなどから、前障へのシナプス入力の存在が明らかとなった[12][13][15]。
内部回路
前障内部の神経回路については、前障—皮質間の神経結合様式に比較して、研究が非常に少なく、ほとんど分かっていない。マウス脳スライス標本における前障内の2つの近傍ニューロンからの同時記録実験により、抑制性ニューロン同士及び興奮性ニューロン-抑制性ニューロン間の結合に比較して、前障内における興奮性ニューロン同士の結合は非常に少ないことが示されている。また、抑制性ニューロン同士の結合は、電気シナプスと化学シナプスの両方が存在すると報告されている[11]。
分子マーカー
前障だけに特異的に発現する分子はこれまでに発見されていない。しかしながら、マウスでは、Gnb4 (guanine nucleotide-binding protein subunit β-4)、Gng2 (guanine nucleotide-binding protein subunit γ-2)、Ntng2(ネトリンG2)、Nr4a2 (nuclear receptor 4a2)、ラテキシンなどが、前障ニューロンに高発現しており、隣接する皮質領域と前障を区別する分子マーカーとして利用されている(図2)[13][16][18][19]。また最近、前障ニューロンにDNA組換え酵素Creを発現する遺伝子改変マウスが報告されている[13][15][16] 。
機能
多種感覚情報の統合 (multimodal sensory integration)、サリエンシーの検出 (saliency detection)、注意の割り当て (attentional load allocation)、意識の中枢 (neural correlates of consciousness)など、高次脳機能における前障の関与についての仮説が提唱されている[5][20][21][22]。
前障ニューロンの活動
前障ニューロンは、一般に低い自発発火頻度を持つことが、単一細胞記録で示されている[13][23]。また、睡眠中[13][24][25]における活動が覚醒時よりも高いことが、c-fos発現解析や単一細胞記録で報告されている。
サルとネコの実験において、前障には視覚刺激または聴覚刺激に反応するニューロンがあること報告されている[26][27][28][29]。これらの反応の刺激特徴(傾きや音の高さなど)に対する選択性は低く[26][27][30]、刺激開始時に限局している[28][29] 。これらのことは、前障ニューロンは詳細な感覚情報ではなく、個々の刺激のタイミングの情報を伝えていることを示唆している。
前障ニューロンが大脳皮質に及ぼす影響
1980年頃から前障の電気刺激や傷害に伴う大脳皮質ニューロンの活動変化を解析する研究がなされてきたが[31][32][33][34]、薄く不規則な形のシート状構造をとる前障のニューロンを選択的に興奮あるいは抑制させることは困難であり、前障の機能についての統一的見解は得られていなかった。しかしながら近年の、ウイルスベクター・光遺伝学・化学遺伝学などの神経回路遺伝学技術の革新により、光刺激や薬物投与で前障ニューロン特異的に活動操作をすることが可能となり、ようやくその機能の一端が明らかになりつつある。
マウス前障ニューロンに光駆動性陽イオンチャネル(チャネルロドプシン)を発現させ、光刺激によって前障ニューロンを興奮させると、大脳皮質内の多くの抑制性ニューロン(特にニューロペプチドY (NPY)陽性ニューロンとパルブアルブミン (PV)陽性ニューロン)において活動電位が発生する[13][14]。しかし、大脳皮質の錐体細胞では、興奮性後シナプス電位(excitatory postsynaptic potential: EPSP)が誘導されるものの、活動電位は発生しない[14]。ところが、NPY陽性抑制性ニューロンの活動を阻害しておくと、前障の光遺伝学的刺激により活動電位が発生する[14]。これらのことから前障ニューロンは、大脳皮質内抑制性ニューロン(特にNPY陽性ニューロン)の興奮を介して、錐体細胞にフィードフォワード抑制をかけると考えられる。
ヒトのてんかん発作の治療の一環で、前障に高頻度電気刺激を与えると、それまでの行動が一時停止し、意識喪失状態になる。電気刺激を止めたところ、何事もなかったかのように元の動作を続けたと報告されている[35]。マウス及びヒトにおける以上の知見により、前障が意識のオン/オフに関与している可能性が示唆されている。
その他に、前障ニューロンの神経回路遺伝学的な抑制操作によって、恐怖文脈条件づけ学習(contextual fear conditioning)における長期の記憶が低下すること [36]、5選択連続反応時間課題(5-choice serial reaction time task)におけるトップダウン注意の低下が起こること、無関連な妨害音を無視できなくなって二肢強制選択タスク(two-alternative forced choice task)や養育行動(新生児回収行動テスト:pup retrieval test)の成功率が低下することが報告されており[15]、前障が記憶・注意の割り当て・多感覚情報の統合など、さまざまな高次機能に関わる可能性が示されている。
関連項目
参考文献
- ↑
Braak, H., & Braak, E. (1982).
Neuronal types in the claustrum of man. Anatomy and embryology, 163(4), 447-60. [PubMed:7091711] [WorldCat] [DOI] - ↑
White, M.G., & Mathur, B.N. (2018).
Claustrum circuit components for top-down input processing and cortical broadcast. Brain structure & function, 223(9), 3945-3958. [PubMed:30109490] [PMC] [WorldCat] [DOI] - ↑
White, M.G., Cody, P.A., Bubser, M., Wang, H.D., Deutch, A.Y., & Mathur, B.N. (2017).
Cortical hierarchy governs rat claustrocortical circuit organization. The Journal of comparative neurology, 525(6), 1347-1362. [PubMed:26801010] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Tanné-Gariépy, J., Boussaoud, D., & Rouiller, E.M. (2002).
Projections of the claustrum to the primary motor, premotor, and prefrontal cortices in the macaque monkey. The Journal of comparative neurology, 454(2), 140-57. [PubMed:12412139] [WorldCat] [DOI] - ↑ 5.0 5.1 Smythies JR, Edelstein LR and Ramachandran VS ed.
The claustrum-structural, functional and clinical neuroscience.
Academic Press: 2014 - ↑
Edelstein, L.R., & Denaro, F.J. (2004).
The claustrum: a historical review of its anatomy, physiology, cytochemistry and functional significance. Cellular and molecular biology (Noisy-le-Grand, France), 50(6), 675-702. [PubMed:15643691] [WorldCat] - ↑
LeVay, S., & Sherk, H. (1981).
The visual claustrum of the cat. I. Structure and connections. The Journal of neuroscience : the official journal of the Society for Neuroscience, 1(9), 956-80. [PubMed:6169810] [WorldCat] - ↑
Beneyto, M., & Prieto, J.J. (2001).
Connections of the auditory cortex with the claustrum and the endopiriform nucleus in the cat. Brain research bulletin, 54(5), 485-98. [PubMed:11397538] [WorldCat] [DOI] - ↑
Pearson, R.C., Brodal, P., Gatter, K.C., & Powell, T.P. (1982).
The organization of the connections between the cortex and the claustrum in the monkey. Brain research, 234(2), 435-41. [PubMed:6800568] [WorldCat] [DOI] - ↑
Selemon, L.D., & Goldman-Rakic, P.S. (1988).
Common cortical and subcortical targets of the dorsolateral prefrontal and posterior parietal cortices in the rhesus monkey: evidence for a distributed neural network subserving spatially guided behavior. The Journal of neuroscience : the official journal of the Society for Neuroscience, 8(11), 4049-68. [PubMed:2846794] [WorldCat] - ↑ 11.0 11.1
Kim, J., Matney, C.J., Roth, R.H., & Brown, S.P. (2016).
Synaptic Organization of the Neuronal Circuits of the Claustrum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 36(3), 773-84. [PubMed:26791208] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Zingg, B., Dong, H.W., Tao, H.W., & Zhang, L.I. (2018).
Input-output organization of the mouse claustrum. The Journal of comparative neurology, 526(15), 2428-2443. [PubMed:30252130] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3 13.4 13.5 13.6 13.7 Narikiyo K, Mizuguchi R, Ajima A, Mitsui S, Shiozaki M, Hamanaka H, Johansen JP, Mori K and Yoshihara Y
The claustrum coordinates cortical slow-wave activity.
bioRxiv: 2018, doi: https://doi.org/10.1101/286773 - ↑ 14.0 14.1 14.2 14.3
Jackson, J., Karnani, M.M., Zemelman, B.V., Burdakov, D., & Lee, A.K. (2018).
Inhibitory Control of Prefrontal Cortex by the Claustrum. Neuron, 99(5), 1029-1039.e4. [PubMed:30122374] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2 15.3
Atlan, G., Terem, A., Peretz-Rivlin, N., Sehrawat, K., Gonzales, B.J., Pozner, G., ..., & Citri, A. (2018).
The Claustrum Supports Resilience to Distraction. Current biology : CB, 28(17), 2752-2762.e7. [PubMed:30122531] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Wang, Q., Ng, L., Harris, J.A., Feng, D., Li, Y., Royall, J.J., ..., & Zeng, H. (2017).
Organization of the connections between claustrum and cortex in the mouse. The Journal of comparative neurology, 525(6), 1317-1346. [PubMed:27223051] [PMC] [WorldCat] [DOI] - ↑
Atlan, G., Terem, A., Peretz-Rivlin, N., Groysman, M., & Citri, A. (2017).
Mapping synaptic cortico-claustral connectivity in the mouse. The Journal of comparative neurology, 525(6), 1381-1402. [PubMed:26973027] [WorldCat] [DOI] - ↑
Miyashita, T., Nishimura-Akiyoshi, S., Itohara, S., & Rockland, K.S. (2005).
Strong expression of NETRIN-G2 in the monkey claustrum. Neuroscience, 136(2), 487-96. [PubMed:16203099] [WorldCat] [DOI] - ↑
Watakabe, A., Ohsawa, S., Ichinohe, N., Rockland, K.S., & Yamamori, T. (2014).
Characterization of claustral neurons by comparative gene expression profiling and dye-injection analyses. Frontiers in systems neuroscience, 8, 98. [PubMed:24904319] [PMC] [WorldCat] [DOI] - ↑
Crick, F.C., & Koch, C. (2005).
What is the function of the claustrum? Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 360(1458), 1271-9. [PubMed:16147522] [PMC] [WorldCat] [DOI] - ↑
Goll, Y., Atlan, G., & Citri, A. (2015).
Attention: the claustrum. Trends in neurosciences, 38(8), 486-95. [PubMed:26116988] [WorldCat] [DOI] - ↑
Brown, S.P., Mathur, B.N., Olsen, S.R., Luppi, P.H., Bickford, M.E., & Citri, A. (2017).
New Breakthroughs in Understanding the Role of Functional Interactions between the Neocortex and the Claustrum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 37(45), 10877-10881. [PubMed:29118217] [PMC] [WorldCat] [DOI] - ↑
SEGUNDO, J.P., & MACHNE, X. (1956).
Unitary responses to afferent volleys in lenticular nucleus and claustrum. Journal of neurophysiology, 19(4), 325-39. [PubMed:13332440] [WorldCat] [DOI] - ↑
Renouard, L., Billwiller, F., Ogawa, K., Clément, O., Camargo, N., Abdelkarim, M., ..., & Luppi, P.H. (2015).
The supramammillary nucleus and the claustrum activate the cortex during REM sleep. Science advances, 1(3), e1400177. [PubMed:26601158] [PMC] [WorldCat] [DOI] - ↑
Luppi, P.H., Billwiller, F., & Fort, P. (2017).
Selective activation of a few limbic structures during paradoxical (REM) sleep by the claustrum and the supramammillary nucleus: evidence and function. Current opinion in neurobiology, 44, 59-64. [PubMed:28347885] [WorldCat] [DOI] - ↑ 26.0 26.1
Olson, C.R., & Graybiel, A.M. (1980).
Sensory maps in the claustrum of the cat. Nature, 288(5790), 479-81. [PubMed:7442793] [WorldCat] [DOI] - ↑ 27.0 27.1
Sherk, H., & LeVay, S. (1981).
Visual claustrum: topography and receptive field properties in the cat. Science (New York, N.Y.), 212(4490), 87-9. [PubMed:7209525] [WorldCat] [DOI] - ↑ 28.0 28.1
Remedios, R., Logothetis, N.K., & Kayser, C. (2010).
Unimodal responses prevail within the multisensory claustrum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(39), 12902-7. [PubMed:20881109] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Remedios, R., Logothetis, N.K., & Kayser, C. (2014).
A role of the claustrum in auditory scene analysis by reflecting sensory change. Frontiers in systems neuroscience, 8, 44. [PubMed:24772069] [PMC] [WorldCat] [DOI] - ↑
Clarey, J.C., & Irvine, D.R. (1986).
Auditory response properties of neurons in the claustrum and putamen of the cat. Experimental brain research, 61(2), 432-7. [PubMed:3948949] [WorldCat] [DOI] - ↑
Tsumoto, T., & Suda, K. (1982).
Effects of stimulation of the dorsocaudal claustrum on activities of striate cortex neurons in the cat. Brain research, 240(2), 345-9. [PubMed:7104694] [WorldCat] [DOI] - ↑
Salerno, M.T., Cortimiglia, R., Crescimanno, G., Amato, G., & Infantellina, F. (1984).
Effects of claustrum stimulation on spontaneous bioelectrical activity of motor cortex neurons in the cat. Experimental neurology, 86(2), 227-39. [PubMed:6489496] [WorldCat] [DOI] - ↑
Moryś, J., Słoniewski, P., & Narkiewicz, O. (1988).
Somatosensory evoked potentials following lesions of the claustrum. Acta physiologica Polonica, 39(5-6), 475-83. [PubMed:3257060] [WorldCat] - ↑
Chau, A., Salazar, A.M., Krueger, F., Cristofori, I., & Grafman, J. (2015).
The effect of claustrum lesions on human consciousness and recovery of function. Consciousness and cognition, 36, 256-64. [PubMed:26186439] [WorldCat] [DOI] - ↑
Koubeissi, M.Z., Bartolomei, F., Beltagy, A., & Picard, F. (2014).
Electrical stimulation of a small brain area reversibly disrupts consciousness. Epilepsy & behavior : E&B, 37, 32-5. [PubMed:24967698] [WorldCat] [DOI] - ↑
Kitanishi, T., & Matsuo, N. (2017).
Organization of the Claustrum-to-Entorhinal Cortical Connection in Mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 37(2), 269-280. [PubMed:28077707] [PMC] [WorldCat] [DOI]