「小胞モノアミントランスポーター」の版間の差分
細編集の要約なし |
細 (→精神刺激薬とVMAT) |
||
| (4人の利用者による、間の59版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">榊原 泰史、[http://researchmap.jp/read0092822 曽良 一郎]</font><br> | |||
''東北大学 大学院医学系研究科 医科学専攻''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年4月26日 原稿完成日:2012年6月6日<br> | |||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | |||
</div> | |||
{{PBB|geneid=6570}} | |||
{{PBB|geneid=6571}} | |||
英:Vesicular Monoamine Transporter 英略語:VMAT | |||
同義語:小胞型モノアミントランスポーター | |||
{{box|text= | |||
小胞モノアミントランスポーターは、4種類ある[[小胞]][[神経伝達物質]]輸送体タンパク質(トランスポーター)のうちの1つであり、[[モノアミン]]神経終末にある[[シナプス]]小胞や、[[副腎]]の[[クロム親和性細胞]]の[[有芯小胞]]に存在する。合成されたモノアミンを、[[開口放出]]に備えて小胞内に輸送、貯蔵する。VMATは依存性薬物([[精神刺激薬]])の分子標的であり、[[薬物依存]]のメカニズムの中でも特に[[神経細胞]]毒性を研究する上で注目される。 | |||
}} | |||
==サブタイプ== | ==サブタイプ== | ||
[[wikipedia:JA:|哺乳類]]では、''Slc18a1''遺伝子にコードされるVMAT1と、''Slc18a2''遺伝子にコードされるVMAT2の、2種類のサブタイプが存在する。これらVMAT1とVMAT2は、[[小胞アセチルコリントランスポーター]](VAChT)とともにSLC(solute carrier)トランスポータースーパーファミリーの1つ、SLC18ファミリーを形成している<ref><pubmed>16762425</pubmed></ref>。 | |||
==分布== | |||
[http://mouse.brain-map.org/experiment/show/76098391 VMAT1]は、主に[[副腎髄質]]の[[クロム親和性細胞]]や腸管の[[腸クロム親和性細胞]]など、さまざまな[[神経内分泌細胞]]の有芯小胞の膜上に存在する。一方で、[http://mouse.brain-map.org/experiment/show/968 VMAT2]は、主に[[中枢神経系]]や[[交感神経系]]のモノアミン作動性神経終末にある[[シナプス小胞]]の膜上に存在するが、VMAT1と同様に副腎髄質のクロム親和性細胞の有芯小胞にも存在する。 | |||
==構造と機能== | |||
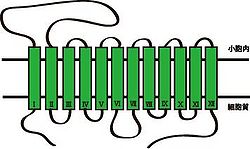
[[Image:VMAT二次構造その2.jpg|thumb|250px|'''図1.VMATの二次構造'''<br>文献<ref><pubmed>12827358</pubmed></ref>から改変]] | |||
上述したように、VMAT1とVMAT2は別々の遺伝子によりコードされているが、両者の配列相同性および構造は極めて類似している。[[細胞膜]][[モノアミントランスポーター]]と同じく、12個の膜貫通ドメイン(TMD1~12)をもつ[[wikipedia:ja:膜タンパク質|膜タンパク質]]で、アミノ末端(N末端)とカルボキシ末端(C末端)は細胞質側に位置する(図1参照)。1番目と2番目の膜貫通ドメイン(TMD1~2)の間には、小胞内に面するループ構造をもつ。膜貫通領域の予測法であるハイドロパシーモデルでは、このループ構造に数個の[[wikipedia:ja:グリコシル化|グリコシル化]]部位が存在すると予測されている<ref><pubmed>20135628</pubmed></ref>。 | |||
===モノアミン貯蔵の仕組み=== | |||
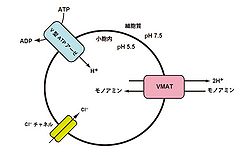
[[Image:モノアミン貯蔵の仕組み.jpg|thumb|250px|'''図2.VMATによる小胞内へのモノアミン取り込み機構'''<br>文献<ref name=ref1 />から改変]] | |||
== | VMATは、小胞内外のH<sup>+</sup>の[[電気化学的勾配]]を駆動力としてモノアミンを小胞内に輸送し、開口放出に備えて貯蔵している。小胞内へのモノアミン貯蔵は、[[神経活動]]に依存した開口放出に備えるだけでなく、モノアミンの合成と分解を調節する上でも必要である。VMAT1とVMAT2の場合、1分子のモノアミンを取り込むために、2分子のH<sup>+</sup>が必要となる。H<sup>+</sup>は[[wikipedia:V-ATPase|V型ATPアーゼ]]の[[wikipedia:ja:ATP|ATP]]加水分解によって産生され、小胞内に移動される。これにより膜内外でpHの勾配が生じるため、VMATはH<sup>+</sup>とモノアミンを[[対向輸送]]することで小胞内にモノアミンを取り込んでいる(図2参照)<ref name=ref1><pubmed>19259829</pubmed></ref>。また、[[wikipedia:ClC3|ClC3]]や[[wikipedia:ClC7|ClC7]]などのCl<sup>-</sup>チャネルを通ってCl<sup>-</sup>イオンが小胞内に出入りすることで、膜内外における電荷のバランスが維持される。これにより小胞膜上のV型ATPアーゼとVMATは個別に働くことができ、効率のよいモノアミンの貯蔵が可能となる。V型ATPアーゼ、あるいはCl<sup>-</sup>チャネルが阻害されると、小胞内のpHが酸性に維持されず、モノアミンを小胞内に貯蔵できなくなる<ref><pubmed>12122145</pubmed></ref><ref><pubmed>11864736</pubmed></ref>。 | ||
[[Image: | ===VMAT2の神経保護作用=== | ||
モノアミンの合成と小胞への輸送は従来、それぞれ独立した過程と考えられていたが、輸送の効率化のため、これらは一連の過程として行われるとする説がある。例えば、シナプス小胞膜上のVMAT2は、[[ドーパミン]]合成酵素である[[チロシン水酸化酵素]]や[[芳香族アミノ酸脱炭酸酵素]]、[[wikipedia:ja:シャペロン|シャペロン]]タンパク質である[[熱ショック蛋白質|Hsc70]]と複合体を形成しており、合成されたドーパミンを素早く効率的に小胞内に取り込んでいる、というモデルが提示されている<ref><pubmed>21797260</pubmed></ref>。 | |||
こうしたメカニズムは神経保護作用の点で重要であり、合成されたモノアミンの細胞質への拡散を最小限に抑え、モノアミンの酸化やそれに伴う[[神経細胞毒性]]発現を抑制すると考えられる。細胞質にモノアミンが過剰に存在すると、それらは酸化され[[wikipedia:ja:キノン|キノン]]やジヒドロキシ化合物に変化する。これら酸化物が産生する[[wikipedia:ja:活性酸素|活性酸素]]が原因となり、[[神経変性]]が誘導される。こうした神経細胞毒性発現は、[[精神刺激薬]]である[[メタンフェタミン]]においても見られ、VMAT2ヘテロ欠損マウスではメタンフェタミンによる神経細胞毒性の増強が示されており、またMPTPなどの外因性神経毒性物質を小胞内に閉じ込めることにより、活性酸素による神経変性に対して抑制作用をもつことも分かっている<ref name=ref1 /><ref><pubmed>17664021</pubmed></ref>。 | |||
==精神刺激薬とVMAT== | |||
[[Image:依存性薬物とVMAT.jpg|thumb|250px|'''図3.モノアミントランスポーターに対する精神刺激薬の作用'''<br>文献<ref name=ref2 />から改変]] | |||
精神刺激薬である[[コカイン]]、[[メチルフェニデート]]、メタンフェタミンや[[アンフェタミン]]は、モノアミントランスポーターを標的分子としている(表参照)。コカインやメチルフェニデートが細胞膜モノアミントランスポーターの阻害により薬理効果を生じる一方、メタンフェタミンやアンフェタミンはシナプス小胞膜上のVMAT2にも作用する(図3参照)<ref name=ref2><pubmed>17825265</pubmed></ref>。VMAT2ヘテロ欠損マウスでは、コカインではなく、アンフェタミン投与による行動感作の形成、条件付け場所嗜好性がほとんど見られないことから、アンフェタミンの報酬効果がVMAT2に依存することが示唆されている<ref><pubmed>9275230</pubmed></ref><ref><pubmed>17377774</pubmed></ref><ref><pubmed>11099463</pubmed></ref><ref><pubmed>21118356</pubmed></ref>。 | |||
ドーパミン神経終末において、アンフェタミンやメタンフェタミンは、VMAT2によるシナプス小胞内への取り込みを阻害するだけでなく、貯蔵されているドーパミンを細胞質へ放出させることにより、小胞内のドーパミン量を減少させるとともに、細胞質のドーパミン量を増加させる。また、これらの薬剤を投与すると、細胞質に局在するVMAT2を含むシナプス小胞が細胞質外に移動し、細胞質でのドーパミン取り込みが減少する<ref name=ref3><pubmed>14612158</pubmed></ref>。メタンフェタミンを投与した[[wikipedia:ja:ラット|ラット]]脳画分を用いた実験では、粗シナプトソーム画分、及び細胞質画分でVMAT2のタンパク質量が減少することが示されている<ref name=ref4><pubmed>16594636</pubmed></ref>。一方で、コカインやメチルフェニデートも、VMAT2を含むシナプス小胞の細胞内局在を変化させる。これらの薬剤を投与すると、シナプス膜近傍に局在するシナプス小胞が細胞質へと移動し、細胞質でのド-パミン取り込みを増加させるので、細胞質のドーパミン量は減少する<ref name=ref3 />。コカインを投与したラット脳画分を用いた実験では、VMAT2のタンパク質量が[[シナプス]]膜画分では減少し、細胞質画分では上昇することが示されている<ref name=ref4 />。コカインやメタンフェタミン投与による、VMAT2を含むシナプス小胞の局在変化については、ドーパミン受容体の1つ、ドーパミン[[D2受容体|D<sub>2</sub>受容体]]の関与が指摘されている。 | |||
上述の精神刺激薬以外に、VMATに作用する薬剤としてよく知られているものに、[[レセルピン]]と[[テトラベナジン]]がある。いずれもVMAT阻害作用を有しており、レセルピンはVMATのモノアミン認識部位に結合し、モノアミンの小胞内への輸送を阻害する。一方で、テトラベナジンは、レセルピンの作用部位とは異なる部位に結合して阻害作用を発揮すると考えられている<ref><pubmed>17233532</pubmed></ref>。 | |||
{| class="wikitable" style="text-align:center" | |||
|+ '''表.各種薬剤の標的トランスポーター分子''' | |||
|- | |||
| | |||
| 薬剤の標的分子 | |||
|- | |||
| コカイン | |||
| rowspan="2" | 細胞膜モノアミントランスポーター | |||
|- | |||
| メチルフェニデート | |||
|- | |||
| アンフェタミン | |||
| rowspan="2" | 細胞膜モノアミントランスポーター<br>'''小胞モノアミントランスポーター(VMAT2)''' | |||
|- | |||
| メタンフェタミン | |||
|- | |||
| レセルピン | |||
| rowspan="2" | '''小胞モノアミントランスポーター(VMAT2)''' | |||
|- | |||
| テトラベナジン | |||
|- | |||
|} | |||
==関連項目== | ==関連項目== | ||
*[[ | *[[モノアミン系]](Wikipedia日本語版の[[wikipedia:ja:モノアミン神経伝達物質|モノアミン神経伝達物質]]の項目) | ||
*[[ドーパミントランスポーター]] | *[[ドーパミントランスポーター]] | ||
*[[セロトニントランスポーター]] | *[[セロトニントランスポーター]] | ||
*[[ノルエピネフリントランスポーター]] | *[[ノルエピネフリントランスポーター]] | ||
*[[薬物依存]] | *[[小胞アセチルコリントランスポーター]] | ||
*[[小胞グルタミン酸トランスポーター]] | |||
*[[小胞GABAトランスポーター]] | |||
*[[薬物依存]](Wikipedia日本語版の[[wikipedia:ja:薬物依存症|薬物依存症]]の項目) | |||
*[[精神刺激薬]] | |||
*[[覚醒剤]](Wikipedia日本語版の[[wikipedia:ja:覚醒剤|覚醒剤]]の項目) | |||
*[[麻薬]](Wikipedia日本語版の[[wikipedia:ja:麻薬|麻薬]]の項目) | |||
==参考文献== | ==参考文献== | ||
<references /> | |||
2015年4月20日 (月) 15:20時点における最新版
榊原 泰史、曽良 一郎
東北大学 大学院医学系研究科 医科学専攻
DOI:10.14931/bsd.1090 原稿受付日:2012年4月26日 原稿完成日:2012年6月6日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
| Solute carrier family 18 (vesicular monoamine), member 2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | SLC18A2; SVAT; SVMT; VAT2; VMAT2 | ||||||||||||
| External IDs | OMIM: 193001 MGI: 106677 HomoloGene: 2298 GeneCards: SLC18A2 Gene | ||||||||||||
| |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 6571 | 214084 | |||||||||||
| Ensembl | ENSG00000165646 | ENSMUSG00000025094 | |||||||||||
| UniProt | Q05940 | Q8BRU6 | |||||||||||
| RefSeq (mRNA) | NM_003054.4 | NM_172523.3 | |||||||||||
| RefSeq (protein) | NP_003045.2 | NP_766111.1 | |||||||||||
| Location (UCSC) |
Chr 10: 119 – 119.04 Mb |
Chr 19: 59.34 – 59.37 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
英:Vesicular Monoamine Transporter 英略語:VMAT
同義語:小胞型モノアミントランスポーター
小胞モノアミントランスポーターは、4種類ある小胞神経伝達物質輸送体タンパク質(トランスポーター)のうちの1つであり、モノアミン神経終末にあるシナプス小胞や、副腎のクロム親和性細胞の有芯小胞に存在する。合成されたモノアミンを、開口放出に備えて小胞内に輸送、貯蔵する。VMATは依存性薬物(精神刺激薬)の分子標的であり、薬物依存のメカニズムの中でも特に神経細胞毒性を研究する上で注目される。
サブタイプ
哺乳類では、Slc18a1遺伝子にコードされるVMAT1と、Slc18a2遺伝子にコードされるVMAT2の、2種類のサブタイプが存在する。これらVMAT1とVMAT2は、小胞アセチルコリントランスポーター(VAChT)とともにSLC(solute carrier)トランスポータースーパーファミリーの1つ、SLC18ファミリーを形成している[1]。
分布
VMAT1は、主に副腎髄質のクロム親和性細胞や腸管の腸クロム親和性細胞など、さまざまな神経内分泌細胞の有芯小胞の膜上に存在する。一方で、VMAT2は、主に中枢神経系や交感神経系のモノアミン作動性神経終末にあるシナプス小胞の膜上に存在するが、VMAT1と同様に副腎髄質のクロム親和性細胞の有芯小胞にも存在する。
構造と機能
上述したように、VMAT1とVMAT2は別々の遺伝子によりコードされているが、両者の配列相同性および構造は極めて類似している。細胞膜モノアミントランスポーターと同じく、12個の膜貫通ドメイン(TMD1~12)をもつ膜タンパク質で、アミノ末端(N末端)とカルボキシ末端(C末端)は細胞質側に位置する(図1参照)。1番目と2番目の膜貫通ドメイン(TMD1~2)の間には、小胞内に面するループ構造をもつ。膜貫通領域の予測法であるハイドロパシーモデルでは、このループ構造に数個のグリコシル化部位が存在すると予測されている[3]。
モノアミン貯蔵の仕組み
VMATは、小胞内外のH+の電気化学的勾配を駆動力としてモノアミンを小胞内に輸送し、開口放出に備えて貯蔵している。小胞内へのモノアミン貯蔵は、神経活動に依存した開口放出に備えるだけでなく、モノアミンの合成と分解を調節する上でも必要である。VMAT1とVMAT2の場合、1分子のモノアミンを取り込むために、2分子のH+が必要となる。H+はV型ATPアーゼのATP加水分解によって産生され、小胞内に移動される。これにより膜内外でpHの勾配が生じるため、VMATはH+とモノアミンを対向輸送することで小胞内にモノアミンを取り込んでいる(図2参照)[4]。また、ClC3やClC7などのCl-チャネルを通ってCl-イオンが小胞内に出入りすることで、膜内外における電荷のバランスが維持される。これにより小胞膜上のV型ATPアーゼとVMATは個別に働くことができ、効率のよいモノアミンの貯蔵が可能となる。V型ATPアーゼ、あるいはCl-チャネルが阻害されると、小胞内のpHが酸性に維持されず、モノアミンを小胞内に貯蔵できなくなる[5][6]。
VMAT2の神経保護作用
モノアミンの合成と小胞への輸送は従来、それぞれ独立した過程と考えられていたが、輸送の効率化のため、これらは一連の過程として行われるとする説がある。例えば、シナプス小胞膜上のVMAT2は、ドーパミン合成酵素であるチロシン水酸化酵素や芳香族アミノ酸脱炭酸酵素、シャペロンタンパク質であるHsc70と複合体を形成しており、合成されたドーパミンを素早く効率的に小胞内に取り込んでいる、というモデルが提示されている[7]。
こうしたメカニズムは神経保護作用の点で重要であり、合成されたモノアミンの細胞質への拡散を最小限に抑え、モノアミンの酸化やそれに伴う神経細胞毒性発現を抑制すると考えられる。細胞質にモノアミンが過剰に存在すると、それらは酸化されキノンやジヒドロキシ化合物に変化する。これら酸化物が産生する活性酸素が原因となり、神経変性が誘導される。こうした神経細胞毒性発現は、精神刺激薬であるメタンフェタミンにおいても見られ、VMAT2ヘテロ欠損マウスではメタンフェタミンによる神経細胞毒性の増強が示されており、またMPTPなどの外因性神経毒性物質を小胞内に閉じ込めることにより、活性酸素による神経変性に対して抑制作用をもつことも分かっている[4][8]。
精神刺激薬とVMAT
精神刺激薬であるコカイン、メチルフェニデート、メタンフェタミンやアンフェタミンは、モノアミントランスポーターを標的分子としている(表参照)。コカインやメチルフェニデートが細胞膜モノアミントランスポーターの阻害により薬理効果を生じる一方、メタンフェタミンやアンフェタミンはシナプス小胞膜上のVMAT2にも作用する(図3参照)[9]。VMAT2ヘテロ欠損マウスでは、コカインではなく、アンフェタミン投与による行動感作の形成、条件付け場所嗜好性がほとんど見られないことから、アンフェタミンの報酬効果がVMAT2に依存することが示唆されている[10][11][12][13]。
ドーパミン神経終末において、アンフェタミンやメタンフェタミンは、VMAT2によるシナプス小胞内への取り込みを阻害するだけでなく、貯蔵されているドーパミンを細胞質へ放出させることにより、小胞内のドーパミン量を減少させるとともに、細胞質のドーパミン量を増加させる。また、これらの薬剤を投与すると、細胞質に局在するVMAT2を含むシナプス小胞が細胞質外に移動し、細胞質でのドーパミン取り込みが減少する[14]。メタンフェタミンを投与したラット脳画分を用いた実験では、粗シナプトソーム画分、及び細胞質画分でVMAT2のタンパク質量が減少することが示されている[15]。一方で、コカインやメチルフェニデートも、VMAT2を含むシナプス小胞の細胞内局在を変化させる。これらの薬剤を投与すると、シナプス膜近傍に局在するシナプス小胞が細胞質へと移動し、細胞質でのド-パミン取り込みを増加させるので、細胞質のドーパミン量は減少する[14]。コカインを投与したラット脳画分を用いた実験では、VMAT2のタンパク質量がシナプス膜画分では減少し、細胞質画分では上昇することが示されている[15]。コカインやメタンフェタミン投与による、VMAT2を含むシナプス小胞の局在変化については、ドーパミン受容体の1つ、ドーパミンD2受容体の関与が指摘されている。
上述の精神刺激薬以外に、VMATに作用する薬剤としてよく知られているものに、レセルピンとテトラベナジンがある。いずれもVMAT阻害作用を有しており、レセルピンはVMATのモノアミン認識部位に結合し、モノアミンの小胞内への輸送を阻害する。一方で、テトラベナジンは、レセルピンの作用部位とは異なる部位に結合して阻害作用を発揮すると考えられている[16]。
| 薬剤の標的分子 | |
| コカイン | 細胞膜モノアミントランスポーター |
| メチルフェニデート | |
| アンフェタミン | 細胞膜モノアミントランスポーター 小胞モノアミントランスポーター(VMAT2) |
| メタンフェタミン | |
| レセルピン | 小胞モノアミントランスポーター(VMAT2) |
| テトラベナジン |
関連項目
- モノアミン系(Wikipedia日本語版のモノアミン神経伝達物質の項目)
- ドーパミントランスポーター
- セロトニントランスポーター
- ノルエピネフリントランスポーター
- 小胞アセチルコリントランスポーター
- 小胞グルタミン酸トランスポーター
- 小胞GABAトランスポーター
- 薬物依存(Wikipedia日本語版の薬物依存症の項目)
- 精神刺激薬
- 覚醒剤(Wikipedia日本語版の覚醒剤の項目)
- 麻薬(Wikipedia日本語版の麻薬の項目)
参考文献
- ↑
Gether, U., Andersen, P.H., Larsson, O.M., & Schousboe, A. (2006).
Neurotransmitter transporters: molecular function of important drug targets. Trends in pharmacological sciences, 27(7), 375-83. [PubMed:16762425] [WorldCat] [DOI] - ↑
Eiden, L.E., Schäfer, M.K., Weihe, E., & Schütz, B. (2004).
The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine. Pflugers Archiv : European journal of physiology, 447(5), 636-40. [PubMed:12827358] [WorldCat] [DOI] - ↑
Wimalasena, K. (2011).
Vesicular monoamine transporters: structure-function, pharmacology, and medicinal chemistry. Medicinal research reviews, 31(4), 483-519. [PubMed:20135628] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Guillot, T.S., & Miller, G.W. (2009).
Protective actions of the vesicular monoamine transporter 2 (VMAT2) in monoaminergic neurons. Molecular neurobiology, 39(2), 149-70. [PubMed:19259829] [WorldCat] [DOI] - ↑
Pothos, E.N., Mosharov, E., Liu, K.P., Setlik, W., Haburcak, M., Baldini, G., ..., & Sulzer, D. (2002).
Stimulation-dependent regulation of the pH, volume and quantal size of bovine and rodent secretory vesicles. The Journal of physiology, 542(Pt 2), 453-76. [PubMed:12122145] [PMC] [WorldCat] [DOI] - ↑
Pothos, E.N. (2002).
Regulation of dopamine quantal size in midbrain and hippocampal neurons. Behavioural brain research, 130(1-2), 203-7. [PubMed:11864736] [WorldCat] [DOI] - ↑
Sager, J.J., & Torres, G.E. (2011).
Proteins interacting with monoamine transporters: current state and future challenges. Biochemistry, 50(34), 7295-310. [PubMed:21797260] [WorldCat] [DOI] - ↑
Yamamoto, H., Kamegaya, E., Hagino, Y., Imai, K., Fujikawa, A., Tamura, K., ..., & Sora, I. (2007).
Genetic deletion of vesicular monoamine transporter-2 (VMAT2) reduces dopamine transporter activity in mesencephalic neurons in primary culture. Neurochemistry international, 51(2-4), 237-44. [PubMed:17664021] [WorldCat] [DOI] - ↑ 9.0 9.1
Howell, L.L., & Kimmel, H.L. (2008).
Monoamine transporters and psychostimulant addiction. Biochemical pharmacology, 75(1), 196-217. [PubMed:17825265] [WorldCat] [DOI] - ↑
Takahashi, N., Miner, L.L., Sora, I., Ujike, H., Revay, R.S., Kostic, V., ..., & Uhl, G.R. (1997).
VMAT2 knockout mice: heterozygotes display reduced amphetamine-conditioned reward, enhanced amphetamine locomotion, and enhanced MPTP toxicity. Proceedings of the National Academy of Sciences of the United States of America, 94(18), 9938-43. [PubMed:9275230] [PMC] [WorldCat] [DOI] - ↑
Fukushima, S., Shen, H., Hata, H., Ohara, A., Ohmi, K., Ikeda, K., ..., & Sora, I. (2007).
Methamphetamine-induced locomotor activity and sensitization in dopamine transporter and vesicular monoamine transporter 2 double mutant mice. Psychopharmacology, 193(1), 55-62. [PubMed:17377774] [WorldCat] [DOI] - ↑
Uhl, G.R., Li, S., Takahashi, N., Itokawa, K., Lin, Z., Hazama, M., & Sora, I. (2000).
The VMAT2 gene in mice and humans: amphetamine responses, locomotion, cardiac arrhythmias, aging, and vulnerability to dopaminergic toxins. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(15), 2459-65. [PubMed:11099463] [WorldCat] [DOI] - ↑
Tammimäki, A., & Männistö, P.T. (2011).
Effect of genetic modifications in the synaptic dopamine clearance systems on addiction-like behaviour in mice. Basic & clinical pharmacology & toxicology, 108(1), 2-8. [PubMed:21118356] [WorldCat] [DOI] - ↑ 14.0 14.1
Fleckenstein, A.E., & Hanson, G.R. (2003).
Impact of psychostimulants on vesicular monoamine transporter function. European journal of pharmacology, 479(1-3), 283-9. [PubMed:14612158] [WorldCat] [DOI] - ↑ 15.0 15.1
Riddle, E.L., Fleckenstein, A.E., & Hanson, G.R. (2005).
Role of monoamine transporters in mediating psychostimulant effects. The AAPS journal, 7(4), E847-51. [PubMed:16594636] [PMC] [WorldCat] [DOI] - ↑
Zheng, G., Dwoskin, L.P., & Crooks, P.A. (2006).
Vesicular monoamine transporter 2: role as a novel target for drug development. The AAPS journal, 8(4), E682-92. [PubMed:17233532] [PMC] [WorldCat] [DOI]