性行動の神経回路
岡 良隆
東京大学大学院理学系研究科 生物科学専攻
DOI:10.14931/bsd.7121 原稿受付日:2016年5月17日 原稿完成日:201X年X月XX日
担当編集委員:宮川 剛(藤田保健衛生大学)
英:neural circuit for sexual behavior
一般に動物は、繁殖期になると、日長や温度などの外界の環境に依存して生殖腺(性腺)を発達させると共に、非繁殖期には示さない、求愛行動をはじめとする生殖に関係した一連の性行動を行うようになる。この時、生殖腺の発達は、脳の情報処理システムが外界の環境の情報を適切に処理し、それを主に視床下部のニューロンに伝え、さらにその情報を脳下垂体という脳と内分泌系のインターフェースに伝えて、脳下垂体ホルモンを放出させ、末梢の生殖腺を刺激することにより起きる。一方、視床下部のニューロンは、繁殖期特有の性行動の賦活化にも極めて重要なはたらきをしている。この時に重要なこととして、生殖腺の発達と性行動が、タイミング良く進むように協調的に調節される必要がある。さらに、いずれの現象においても、雌雄でそれらがうまく足並みを揃えて調節されることが生殖の成功に繋がり、種が保存される。このようなしくみは、神経系と内分泌系の協調的な調節機能により実現されている。
研究の歴史
「性行動」と「生殖行動」は似ているが、後者が生殖の行為そのものを指すことが多いのに対して、前者は生殖に関わる一連のすべての行動パターンの連鎖を指す、より広義の用語として用いられることが多い。本項では、より広義の用語である「性行動」について解説する。性行動を引き起こす中枢神経系のしくみを科学的な研究の対象として考えるきっかけを作ったのは、1973年にノーベル医学生理学賞を受賞したフォン・フリッシュ(K. von Frisch)、ローレンツ(K. Lorenz)、ティンバーゲン(N. Tinbergen)の3人の功績によるところが大きい。
生得的行動(本能行動とも言う)を触発する最適刺激が,あるときには弱い反応しか起こさないことやまったく効果を与えないことがある。このように、外的刺激の変化によらず行動の閾値が変わったりする場合、それは動物の「内的要因」の強さの変化に起因すると考えられる。逆に、内的要因が強まると、解発刺激がなくても行動が解発されるような応答の閾値の極端な低下が見られることもある。これらのことから,ティンバーゲンは行動の自発性の原因となる内的要因が「行動の動機づけ」を決定する、と考えた。ティンバーゲンは、生まれつき動物に備わっているような生得的反応の内的・外的な要因について詳細に解析していたが、ホルモンの役割については特に注目していた。そして、ホルモンは中枢神経系に作用し、本能的活動と特に関係深い感覚神経系の興奮性を高めるように作用するのではないか、と考えた。性行動は生得的行動の中でも、例えば、ティンバーゲンのトゲウオの性行動の解析のように、上記の行動学者達が好んで研究例として取り上げたものである。
このような動物行動学者のノーベル賞受賞に触発され、特に、こうした動物行動学が初期に盛んであったドイツを中心として、生得的行動の神経機構に対する実証可能な作業仮説をたてて、それを神経生物学的な手法で解析しようとする、神経行動学(ニューロエソロジーNeuroethology)という学問分野が、ヨーロッパから始まり、次第に世界的に研究分野として広まっていった。
一方、ホルモンの機能を研究する内分泌学者の一部にも、動物が繁殖期に見せる性行動がホルモンによる調節を受けることに興味を寄せていた。例えば、カエルにおいては次のような一連の研究がなされている。カエルは産卵期になると生息地から水辺の繁殖地へと移動し、つがいを形成するが、このとき、オスはメイティングコール(mating call, MC)とよばれる鳴き声を発し、メスをひきつける。メイティングコールに対する性ステロイド(生殖腺でコレステロールから合成される性ホルモン)の影響に関しては、脳内への性ステロイドの局所投与や生殖腺除去実験などの多数の研究が見られる。これらの実験から、性ホルモンの影響を受けて性行動を促進する脳部位としては脳の視索前野や視床下部が重要な脳部位である事がわかってきた。
性ステロイドは、生殖腺で作られ、いわゆる二次性徴を促し生殖そのものを可能にするという生物学的作用をもつが、同じ性ステロイドが性行動を同時に促進的に調節することにより、生殖と性行動を同時に調節するという、理にかなった調節が可能となっている。このような性行動の研究において、ホルモンと神経系の関係が様々な角度から解析された好例としては、雌ラットが交尾時に示すロードシス行動(メスがオスのマウンティングをやりやすくするように背中を反らせる行動)がある。さらに、2000年以降、社会行動の神経機構の研究が盛んになると同時に、光遺伝学やDREADDを用いた化学遺伝学などの手法の開発が進み、性行動も含めた雌雄のマウスそれぞれに特異的な社会行動の神経機構についての研究もDulacらにより推進されている。
性ステロイドホルモンと性行動
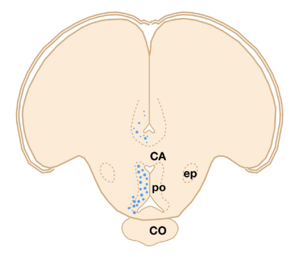
文献[3]より改変。CA:前交連、PO&POPv:視索前野、CO:視交差、ep:脚間核。トリチウム標識したエストラジオール17βを結合した脳内のニューロンを丸印で示す。
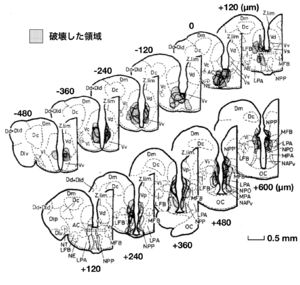
局所破壊された脳部位をシェードで示す。終脳腹側野前交連上核(Vs)と終脳腹側野腹側部(pVv)の後方部、および視索前野脳室周囲部(NPP)の局所的脳破壊により、オスの性行動が有意に阻害された。
文献[4]より改変
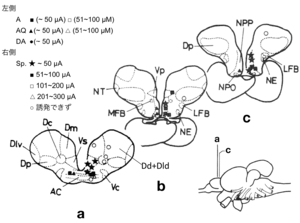
放精行動が生じた部位電気刺激の閾値をプロットしてある。★が最も有効な部位であり、それらは終脳腹側野前交連上核(Vs)および視索前野脳室周囲部(NPP)に局在していた。
文献[5]より改変
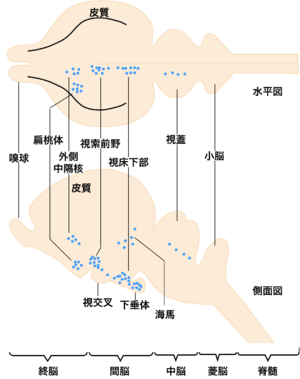
1970年代に、性ステロイドホルモンを用いたオートラジオグラフィーの研究から、性ステロイドを取り込む脳内ニューロンの分布について、哺乳類、両生類、魚類等を用いて研究が行なわれた。その結果、動物によらず、視索前野、外側中隔野、扁桃体、視床下部、海馬、中脳灰白質等の脳部位に性ステロイドを感受するニューロンが分布していることがわかった(図1)。
興味深いことに、これらの脳部位の多くは、メスラットのロードシス行動などに深く関与することが多くの研究から明らかになっている。たとえば、視床下部腹内側核や中脳灰白質は、それらの脳部位を破壊すると性行動が阻害され、電気刺激すると性行動が誘起される[6]。したがって、性ステロイドがこれらの脳部位のニューロンに直接結合することによって、それらのニューロンの活動状態(興奮性)に影響を与え、それが性行動を制御する神経回路を賦活化してロードシス行動が起こることが考えられる。
一方、キンギョなどの魚類の脳においてもエストロゲンなどの性ステロイドを取り込むニューロンの分布が調べられたが(図2)[3]、多くのステロイド取り込み細胞の見られた終脳腹側野Vsとよばれる部位や視索前野は、脳の局所破壊を行うことによってオスキンギョの性行動が阻害され(図3)[4]、電気刺激することによって雌雄のヒメマスの性行動が促進される(図4)ような脳部位[7]と極めて似かよった部位であった。
メスの性ステロイドであるエストロゲンが中枢神経系に及ぼす影響については、従来多数の報告がある。エストロゲンは標的ニューロンの受容体に結合した後、核移行して標的遺伝子の転写活性を調節することによりゆっくりと効果を及ぼす遺伝子レベルの調節が主であると考えられていた。しかしながら、Gタンパク質共役型の膜レセプターを介する速いノンゲノミック作用も知られている[5]。ロードシスなどの性行動に対する脳内性ステロイド感受性ニューロンの性行動への関与に関しても、まずは性ステロイドの遺伝子レベルの調節か非遺伝子レベルの調節かをまず厳密に区別し、この作用機構について分子・細胞生物学的観点から今一度見直す必要がある。性行動に関与する脳部位や、性ステロイドの性行動に対する影響などの研究は1970年代から1980年代にかけて比較的盛んに行われていたが、その後研究の大きな進展がないままになっていた。ところが、最近、光遺伝学の技術の発展により、上述の視床下部腹内側核ニューロンにおいて、エストロゲン受容体を発現する少数ニューロンの活性化により、オスマウスのマウンティング様の行動が起きるが、それらの刺激を強くしていくと攻撃行動に転じていく、と言う興味ある研究結果が報告されている[8](ただし、この場合、エストロジェン受容体発現ニューロンはニューロンのマーカーとして用いられているだけで、これらのオスの行動にエストロジェンが関わっているのかはよくわかっていない)。このように、遺伝学的技術をイメージングや電気生理学的・形態学的手法と組み合わせる事により、古くから興味を持たれていた問題に対して新たなアプローチが可能となり、性行動の神経回路に対する理解が飛躍的に進むことが期待される。
このように性行動が性ステロイドホルモンの影響を受ける事は、生殖腺の発達と性行動が協調的にタイミング良く調節されるのに、理にかなったしくみであると考えられる。この良い例として、ほ乳類において生殖の中枢制御に中心的なはたらきをするキスペプチンニューロンが、同時に雌マウスの性行動も制御している(RP3Vとよばれる部位に局在するキスペプチンニューロンは、正中隆起に投射するGnRHニューロンに入力してパルス状のGnRH放出を引き起こす事で、生殖腺の発達調節をすることが知られているが、一方で、そのニューロンがメスのオス選択、ひいてはロードシス行動に必須であることを実験的に示した)、と言う研究成果が報告されている[9]。
ペプチドホルモンと性行動~GnRHを例として~
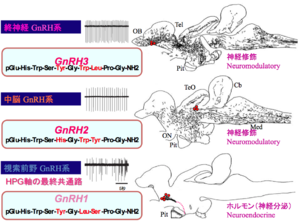
文献[10]より改変
脳内の代表的なペプチドホルモンとして、視床下部ニューロンで産生され、脳底の正中隆起とよばれる部位の脳下垂体門脈血中に放出され、脳下垂体前葉に運ばれて脳下垂体ホルモン放出を促進・抑制する、いわゆる向下垂体ホルモン(hypophysiotropic hormone)とよばれる一群のホルモンがある。
ここで解説する生殖腺刺激ホルモン放出ホルモン(gonadotropin-releasing hormone, GnRH)は、生殖を中枢制御する働きをもつ視床下部ホルモンとして、1977年ノーベル生理学・医学賞を受賞したギルマンとシャリーにより発見された代表的な視床下部ホルモンである。近年免疫組織化学およびin situ hybridization(ISH)を用いた形態学的な研究がなされ、脊椎動物脳内では、形態的・機能的に異なる以下の3つのGnRH神経系が存在している(GnRHには3つのパラログ遺伝子、gnrh1, gnrh2, gnrh3が存在しており、それぞれのパラログが異なるニューロン群に発現し、異なる機能を果たす)という基本的コンセンサスが得られている(図5)[10]。
- 視索前野GnRH1(POA-GnRH)神経系 ;視索前野の細胞体から軸索を正中隆起に投射して、下垂体門脈系を介して下垂体からの性腺刺激ホルモン放出を促進する(ただし、真骨魚においては直接下垂体前葉に投射)。遺伝子パラログgnrh1を発現。
- 中脳GnRH2(Midbrain GnRH)神経系;中脳被蓋に細胞体をもち、脳内に広く軸索投射して主に神経修飾作用をもつ(正中隆起には投射しない)。遺伝子パラログgnrh2を発現。
- 終神経GnRH3(Terminal nerve-GnRH; TN-GnRH)神経系;終脳と嗅球の境界部に細胞塊を形成し、軸索を脳全体に広く投射しており、主に神経修飾作用をもつ(正中隆起には投射しない)。遺伝子パラログgnrh3を発現。
この中で、性行動の神経回路と最も深い関わりを持つのが3)の終神経GnRH3ニューロンである。Okaらは図5に示すドワーフグーラミーやGFPトランスジェニックメダカを用いてこれらのニューロンの形態学的・電気生理学的特徴の解析を行うと同時に、これらのニューロンの細胞塊を破壊した熱帯魚の行動学的解析を行い、これらのニューロンが作るGnRH3ペプチドが、脳内に極めて広く張り巡らされた軸索から放出されて引き起こされる神経修飾作用が、熱帯魚の性行動レパートリーの一つである巣作り行動などの行動の動機付けを調節している、と言う説を提唱している[11][12]。最近、遺伝子改変メダカを用いた行動学的実験や電気生理学的実験を組み合わせた研究により、この作業仮説を支持するような実験結果が得られ、今後のさらなる研究が期待されている[13]。GnRH2とGnRH3は視床下部外GnRH系とも呼ばれるが、それらの機能については、文献を参照のこと。
関連項目
参考文献
- ↑ 岡良隆
環境に適応した行動を発言させる脊椎動物神経系・内分泌系のしくみ
岡・蟻川編 「行動とコミュニケーション」
シリーズ21世紀の動物科学 1998: 東京. p. 197-226. 2 - ↑ J.I. Morrell and D.W. Pfaff
American Zoologist, 18, 447-460. 1978 - ↑ 3.0 3.1
Kim, Y.S., Stumpf, W.E., & Sar, M. (1978).
Topography of estrogen target cells in the forebrain of goldfish, Carassius auratus. The Journal of comparative neurology, 182(4), 611-20. [PubMed:721971] [WorldCat] [DOI] - ↑ 4.0 4.1
Koyama, Y., Satou, M., Oka, Y., & Ueda, K. (1984).
Involvement of the telencephalic hemispheres and the preoptic area in sexual behavior of the male goldfish, Carassius auratus: a brain-lesion study. Behavioral and neural biology, 40(1), 70-86. [PubMed:6610412] [WorldCat] [DOI] - ↑ 5.0 5.1
Satou, M., Oka, Y., Kusunoki, M., Matsushima, T., Kato, M., Fujita, I., & Ueda, K. (1984).
Telencephalic and preoptic areas integrate sexual behavior in hime salmon (landlocked red salmon, Oncorhynchus nerka): results of electrical brain stimulation experiments. Physiology & behavior, 33(3), 441-7. [PubMed:6393162] [WorldCat] [DOI] - ↑ D.W. Pfaff
Estrogens and Brain Function.
New York, Heidelberg, Berlin: 1980, Springer-Verlag. 281 - ↑
Koyama, Y., Satou, M., Oka, Y., & Ueda, K. (1984).
Involvement of the telencephalic hemispheres and the preoptic area in sexual behavior of the male goldfish, Carassius auratus: a brain-lesion study. Behavioral and neural biology, 40(1), 70-86. [PubMed:6610412] [WorldCat] [DOI] - ↑
Lee, H., Kim, D.W., Remedios, R., Anthony, T.E., Chang, A., Madisen, L., ..., & Anderson, D.J. (2014).
Scalable control of mounting and attack by Esr1+ neurons in the ventromedial hypothalamus. Nature, 509(7502), 627-32. [PubMed:24739975] [PMC] [WorldCat] [DOI] - ↑
Hellier, V., Brock, O., Candlish, M., Desroziers, E., Aoki, M., Mayer, C., ..., & Bakker, J. (2018).
Female sexual behavior in mice is controlled by kisspeptin neurons. Nature communications, 9(1), 400. [PubMed:29374161] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Yamamoto, N., Oka, Y., Amano, M., Aida, K., Hasegawa, Y., & Kawashima, S. (1995).
Multiple gonadotropin-releasing hormone (GnRH)-immunoreactive systems in the brain of the dwarf gourami, Colisa lalia: immunohistochemistry and radioimmunoassay. The Journal of comparative neurology, 355(3), 354-68. [PubMed:7636018] [WorldCat] [DOI] - ↑
Yamamoto, N., Oka, Y., & Kawashima, S. (1997).
Lesions of gonadotropin-releasing hormone-immunoreactive terminal nerve cells: effects on the reproductive behavior of male dwarf gouramis. Neuroendocrinology, 65(6), 403-12. [PubMed:9208402] [WorldCat] [DOI] - ↑
Karigo, T., & Oka, Y. (2013).
Neurobiological study of fish brains gives insights into the nature of gonadotropin-releasing hormone 1-3 neurons. Frontiers in endocrinology, 4, 177. [PubMed:24312079] [PMC] [WorldCat] [DOI] - ↑
Okuyama, T., Yokoi, S., Abe, H., Isoe, Y., Suehiro, Y., Imada, H., ..., & Takeuchi, H. (2014).
A neural mechanism underlying mating preferences for familiar individuals in medaka fish. Science (New York, N.Y.), 343(6166), 91-4. [PubMed:24385628] [WorldCat] [DOI]