「抑制性シナプス」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 1行目: | 1行目: | ||
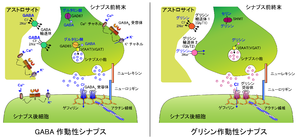
[[image:抑制性シナプス1.png|thumb|300px|'''図1.シナプス前抑制とシナプス後抑制''']] | [[image:抑制性シナプス1.png|thumb|300px|'''図1.シナプス前抑制とシナプス後抑制''']] | ||
脳機能は[[興奮性シナプス|興奮性]]及び抑制性シナプスにおける化学的[[神経伝達]]のバランスにより制御されている。抑制性シナプスには、抑制性シナプス前ニューロンが抑制性入力を受ける対象となる標的細胞と直接シナプス結合し、この標的細胞の興奮性を制御している場合と、[[興奮性ニューロン]][[軸索終末]]部にシナプス結合し、この軸索での興奮性神経伝達のみを選択的に制御する場合とがあり、両者は各々シナプス後抑制(postsynaptic inhibition)、シナプス前抑制(presynaptic inhibition)と呼ばれている(図1)。各抑制様式にはそれぞれ異なる機能的意義を有するが、本稿では特に一般的に抑制性シナプスと認知されているシナプス後抑制を念頭に解説する。 | |||
== 基本構造 == | == 基本構造 == | ||
抑制性シナプスにおいては、抑制性[[神経伝達物質]]が[[小胞]]放出され、[[シナプス後膜]]に存在する[[wikipedia:ja:陰イオン|陰イオン]]透過性の[[イオンチャネル]]を活性化する。この結果、細胞外に最も高濃度で存在する陰イオンは[[wikipedia:ja:クロールイオン|クロールイオン]]であるため主にクロールイオンの透過性が亢進することになる。クロールイオンチャネルとしては、[[GABAA受容体|GABA<sub>A</sub>受容体]]及び[[グリシン受容体]]が存在しこれらは各々複数のサブタイプを持っている。中枢神経系のニューロンは抑制性及び興奮性の両方の入力を受けており、両者のバランスによってニューロンの興奮性の制御が行われている。 | |||
== | == 機能 == | ||
[[wikipedia:ja:哺乳類|哺乳類]]においては通常の細胞内外のクロールイオン濃度は総陰イオン濃度の約70%及び1%程度で濃度としては約150mM 及び数mM付近にあるため、その[[平衡電位]]は-70~-80 mV付近となり、通常の神経細胞の静止膜電位よりも若干深い。GABA及びグリシン受容体の活性化により、これらのチャネルのコンダクタンスが上昇すると、[[膜電位]]が[[静止電位]]付近の場合には低い電位勾配のため大量のクロールイオンの移動(流入)は起こらず膜電位に与える影響も少ない。しかし、興奮性シナプスが活性化され膜電位に[[脱分極]]が生じている状況においてはクロールイオンの電位勾配に従い比較的大量のクロールイオンの細胞内への流入が起こり、膜電位は静止電位付近へ引き戻される。この結果、興奮性入力により生じた脱分極幅の縮小が生じ、活動電位発生の確率を下げる。 | |||
== 病態時及び幼若期の抑制性シナプスの機能 == | == 病態時及び幼若期の抑制性シナプスの機能 == | ||
| 15行目: | 15行目: | ||
[[image:抑制性シナプス2.png|thumb|300px|'''図2.細胞内塩素イオン濃度の発達性変化に伴う、抑制性神経伝達物質の機能的な変化''']] | [[image:抑制性シナプス2.png|thumb|300px|'''図2.細胞内塩素イオン濃度の発達性変化に伴う、抑制性神経伝達物質の機能的な変化''']] | ||
細胞内のクロールイオン濃度の調節に寄与しているのは主に、[[ナトリウム-カリウム-クロール共輸送体]]([[NKCC]])及び[[カリウム-クロール共輸送体]]([[KCC]])で、これらは細胞内へのクロールイオンの取り込み及び細胞外へのクロールイオンの排出を担っており、両者のバランスで神経細胞内のクロールイオンの濃度が決定されている<ref name=ref1><pubmed>16022677</pubmed></ref>。これらの輸送体タンパク質により前述の如く通常の状態では、細胞内クロールイオン濃度は比較的低い状態に保たれており、この事により[[GABA]](及び[[glycine]])作動性のクロールコンダクタンスの上昇が膜電位の過分極作用をもたらす。ところが神経損傷等の病態時には、これらのバランスが崩れることが知られており、例えば[[軸索切断]]や[[過酸化水素水]]暴露等を行った神経細胞は[[KCC2]]のダウンレギュレーションとそれに伴うクロールイオン平衡電位の上昇が生じることが知られており、結果的にGABA受容体活性化に伴う脱分極が生じる事が知られている<ref name=ref2><pubmed>12040048</pubmed></ref> <ref name=ref3><pubmed>17301172</pubmed></ref>。また、正常時においても幼若期にはクロライドホメオスタシスの脆弱性が有り、細胞内クロールイオン濃度が相対的に高い事、またこれに伴いGABA作動性入力に対して神経細胞が脱分極を来す事などが知られている<ref name=ref4><pubmed>10191302</pubmed></ref>(図2)。 | |||
== 関連項目 == | |||
*[[抑制性アミノ酸]] | |||
*[[GABA受容体]] | |||
*[[グリシン受容体]] | |||
== 参考文献 == | == 参考文献 == | ||
2012年12月21日 (金) 11:25時点における版
脳機能は興奮性及び抑制性シナプスにおける化学的神経伝達のバランスにより制御されている。抑制性シナプスには、抑制性シナプス前ニューロンが抑制性入力を受ける対象となる標的細胞と直接シナプス結合し、この標的細胞の興奮性を制御している場合と、興奮性ニューロン軸索終末部にシナプス結合し、この軸索での興奮性神経伝達のみを選択的に制御する場合とがあり、両者は各々シナプス後抑制(postsynaptic inhibition)、シナプス前抑制(presynaptic inhibition)と呼ばれている(図1)。各抑制様式にはそれぞれ異なる機能的意義を有するが、本稿では特に一般的に抑制性シナプスと認知されているシナプス後抑制を念頭に解説する。
基本構造
抑制性シナプスにおいては、抑制性神経伝達物質が小胞放出され、シナプス後膜に存在する陰イオン透過性のイオンチャネルを活性化する。この結果、細胞外に最も高濃度で存在する陰イオンはクロールイオンであるため主にクロールイオンの透過性が亢進することになる。クロールイオンチャネルとしては、GABAA受容体及びグリシン受容体が存在しこれらは各々複数のサブタイプを持っている。中枢神経系のニューロンは抑制性及び興奮性の両方の入力を受けており、両者のバランスによってニューロンの興奮性の制御が行われている。
機能
哺乳類においては通常の細胞内外のクロールイオン濃度は総陰イオン濃度の約70%及び1%程度で濃度としては約150mM 及び数mM付近にあるため、その平衡電位は-70~-80 mV付近となり、通常の神経細胞の静止膜電位よりも若干深い。GABA及びグリシン受容体の活性化により、これらのチャネルのコンダクタンスが上昇すると、膜電位が静止電位付近の場合には低い電位勾配のため大量のクロールイオンの移動(流入)は起こらず膜電位に与える影響も少ない。しかし、興奮性シナプスが活性化され膜電位に脱分極が生じている状況においてはクロールイオンの電位勾配に従い比較的大量のクロールイオンの細胞内への流入が起こり、膜電位は静止電位付近へ引き戻される。この結果、興奮性入力により生じた脱分極幅の縮小が生じ、活動電位発生の確率を下げる。
病態時及び幼若期の抑制性シナプスの機能
細胞内のクロールイオン濃度の調節に寄与しているのは主に、ナトリウム-カリウム-クロール共輸送体(NKCC)及びカリウム-クロール共輸送体(KCC)で、これらは細胞内へのクロールイオンの取り込み及び細胞外へのクロールイオンの排出を担っており、両者のバランスで神経細胞内のクロールイオンの濃度が決定されている[1]。これらの輸送体タンパク質により前述の如く通常の状態では、細胞内クロールイオン濃度は比較的低い状態に保たれており、この事によりGABA(及びglycine)作動性のクロールコンダクタンスの上昇が膜電位の過分極作用をもたらす。ところが神経損傷等の病態時には、これらのバランスが崩れることが知られており、例えば軸索切断や過酸化水素水暴露等を行った神経細胞はKCC2のダウンレギュレーションとそれに伴うクロールイオン平衡電位の上昇が生じることが知られており、結果的にGABA受容体活性化に伴う脱分極が生じる事が知られている[2] [3]。また、正常時においても幼若期にはクロライドホメオスタシスの脆弱性が有り、細胞内クロールイオン濃度が相対的に高い事、またこれに伴いGABA作動性入力に対して神経細胞が脱分極を来す事などが知られている[4](図2)。
関連項目
参考文献
- ↑
Price, T.J., Cervero, F., & de Koninck, Y. (2005).
Role of cation-chloride-cotransporters (CCC) in pain and hyperalgesia. Current topics in medicinal chemistry, 5(6), 547-55. [PubMed:16022677] [PMC] [WorldCat] [DOI] - ↑
Nabekura, J., Ueno, T., Okabe, A., Furuta, A., Iwaki, T., Shimizu-Okabe, C., ..., & Akaike, N. (2002).
Reduction of KCC2 expression and GABAA receptor-mediated excitation after in vivo axonal injury. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(11), 4412-7. [PubMed:12040048] [PMC] [WorldCat] [DOI] - ↑
Wake, H., Watanabe, M., Moorhouse, A.J., Kanematsu, T., Horibe, S., Matsukawa, N., ..., & Nabekura, J. (2007).
Early changes in KCC2 phosphorylation in response to neuronal stress result in functional downregulation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(7), 1642-50. [PubMed:17301172] [PMC] [WorldCat] [DOI] - ↑
Kakazu, Y., Akaike, N., Komiyama, S., & Nabekura, J. (1999).
Regulation of intracellular chloride by cotransporters in developing lateral superior olive neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(8), 2843-51. [PubMed:10191302] [PMC] [WorldCat]
(執筆者:加藤剛、鍋島淳一 担当編集委員:柚崎通介)