「放出可能プール」の版間の差分
Shinyakawaguchi (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| 1行目: | 1行目: | ||
英:releasable pool | 英:releasable pool | ||
放出可能プール(releasable pool)とは、生理学的には、神経軸索終末において[[神経伝達物質]]が充填された細胞内膜小胞([[シナプス小胞]])のうち、[[活動電位]]発生に伴う細胞内Ca<Sup>2+</Sup>濃度上昇に応じて迅速(ms程度)に細胞膜へ融合([[エキソサイトーシス]])して[[神経伝達物質]]を[[開口放出]]できる準備が整った状態にある群を意味する<ref>'''石渡信一、桂 勲、桐野豊、三宅成樹 編''' <br> 生物物理学 ハンドブック<br> ''朝倉書店'':2007 </ref>。実際には研究者の用いる実験標本の違い、放出可能プールを推定するために使用する強度の神経終末刺激の方法の違い(神経刺激、終末の脱分極、Caアンケイジング等)、伝達物質放出の記録法(電気生理学的、光学的手法)、解析法の違いによって研究者ごとに放出可能プールの定義は異なっているのが現状で、統一的見解はない。また、生理学的な概念であるため、実体がどのようなものか(形質膜に張り付いた小胞すべてがそうなのか)もよくわかっていない。生化学的には、シナプス小胞は、活動電位が発生しても放出されない貯蔵プールにある状態から、軸索終末の[[アクティブゾーン]]の細胞膜近傍にドッキングし、その後Ca<Sup>2+</Sup>依存的な開口放出に至るための準備過程(プライミング)を経る。このプライミングを終えた状態が、放出可能プールであると考えられている。ただ、生理学的な概念との対応はわかっていない。多くのタンパク質が担う放出可能プールの制御メカニズムは、連発刺激時にシナプス伝達効率が変化する短期[[シナプス可塑性]]の重要な要素となると考えられている<ref><pubmed> 11826273 </pubmed></ref>。 | |||
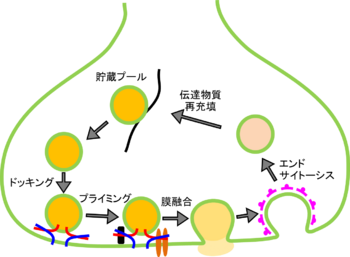
==貯蔵プール== | ==貯蔵プール== | ||
[[Image:Vesicle.png|thumb|right|350px|'''図.シナプス小胞の開口放出とリサイクリング''']] | |||
軸索終末の多くのシナプス小胞は、貯蔵プールと呼ばれる状態で、活動電位が発生してもただちに開口放出されない。 | |||
==ドッキング== | |||
シナプス小胞膜上のVAMP2とシナプス前膜に存在する[[syntaxin1]]および[[SNAP-25]]が結合して[[SNARE複合体]]を形成することにより、シナプス小胞がシナプス前膜のアクティブゾーン近傍に結合する。VAMPとsyntaxin1およびSNAP-25は、4本のαへリックスからなるコイルドコイル構造を形成して強固に結合し、ジッパーのような構造で小胞膜をシナプス前膜に近づけると考えられている。ドッキングの分子メカニズムの詳細は不明であるが、ドッキングに関与する分子を阻害すると、1放出部位レベルではシナプス小胞がドッキングできないのでall-or-noneにシナプス伝達が阻害される。 | |||
==プライミング== | ==プライミング== | ||
ドッキングされたシナプス小胞は、その後さらにCa<Sup>2+</Sup>上昇に応じて即時に膜融合に至るためのプライミング過程を経て、放出可能プールとなると考えられている。このプライミング過程は、Munc-13、Rimなどのタンパク質が関わっていると考えられているが、プライミングの分子実体はよくわかっていない。プライミング関連タンパク質の機能修飾はシナプス伝達の不全や、反復刺激に対する短期シナプス可塑性の変化につながるようである。 | |||
==膜融合== | ==膜融合== | ||
活動電位の発生によりアクティブゾーンのCa<Sup>2+</Sup>チャネルが開いてCa<Sup>2+</Sup>が流入する。Ca<Sup>2+</Sup>チャネルはアクティブゾーンでクラスターを形成しており、その近傍では局所的に数十μM程度のCa<Sup>2+</Sup>濃度に達する。これにより、シナプスタグミン等のCa<Sup>2+</Sup>センサータンパク質が構造変化を起こすことにより、即時に(Ca<Sup>2+</Sup>流入から0.2 ms程度)[[エキソサイトーシス]]が起こり、伝達物質はシナプス間隙へ放出されると考えられている。 | |||
==小胞のリサイクリング== | ==小胞のリサイクリング== | ||
エキソサイトーシスされた小胞膜は、[[クラスリン]]が結合して重合することにより作り出すΩ型の被覆ピットとなり、そのくびれ部を[[ダイナミン]]がGTP依存的にくびり切ることによりシナプス前膜から[[エンドサイトーシス]]されて細胞内に回収される。その後、小胞からクラスリンが解離して小胞内が酸性化し、再度神経伝達物質が充填されて貯蔵プールへ移行する。ただし、リサイクリングがクラスリン依存性経路を介してゆっくりおこるのか、kiss-and-runのような早いリサイクリングをとるのかわかっていない。 | |||
==関連項目== | ==関連項目== | ||
*[[SNAP-25]] | *[[SNAP-25]] | ||
*[[SNARE複合体]] | *[[SNARE複合体]] | ||
| 47行目: | 51行目: | ||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
(執筆者:川口真也、坂場武史 担当編集委員:柚崎通介) | |||
2012年9月14日 (金) 10:21時点における版
英:releasable pool
放出可能プール(releasable pool)とは、生理学的には、神経軸索終末において神経伝達物質が充填された細胞内膜小胞(シナプス小胞)のうち、活動電位発生に伴う細胞内Ca2+濃度上昇に応じて迅速(ms程度)に細胞膜へ融合(エキソサイトーシス)して神経伝達物質を開口放出できる準備が整った状態にある群を意味する[1]。実際には研究者の用いる実験標本の違い、放出可能プールを推定するために使用する強度の神経終末刺激の方法の違い(神経刺激、終末の脱分極、Caアンケイジング等)、伝達物質放出の記録法(電気生理学的、光学的手法)、解析法の違いによって研究者ごとに放出可能プールの定義は異なっているのが現状で、統一的見解はない。また、生理学的な概念であるため、実体がどのようなものか(形質膜に張り付いた小胞すべてがそうなのか)もよくわかっていない。生化学的には、シナプス小胞は、活動電位が発生しても放出されない貯蔵プールにある状態から、軸索終末のアクティブゾーンの細胞膜近傍にドッキングし、その後Ca2+依存的な開口放出に至るための準備過程(プライミング)を経る。このプライミングを終えた状態が、放出可能プールであると考えられている。ただ、生理学的な概念との対応はわかっていない。多くのタンパク質が担う放出可能プールの制御メカニズムは、連発刺激時にシナプス伝達効率が変化する短期シナプス可塑性の重要な要素となると考えられている[2]。
貯蔵プール
軸索終末の多くのシナプス小胞は、貯蔵プールと呼ばれる状態で、活動電位が発生してもただちに開口放出されない。
ドッキング
シナプス小胞膜上のVAMP2とシナプス前膜に存在するsyntaxin1およびSNAP-25が結合してSNARE複合体を形成することにより、シナプス小胞がシナプス前膜のアクティブゾーン近傍に結合する。VAMPとsyntaxin1およびSNAP-25は、4本のαへリックスからなるコイルドコイル構造を形成して強固に結合し、ジッパーのような構造で小胞膜をシナプス前膜に近づけると考えられている。ドッキングの分子メカニズムの詳細は不明であるが、ドッキングに関与する分子を阻害すると、1放出部位レベルではシナプス小胞がドッキングできないのでall-or-noneにシナプス伝達が阻害される。
プライミング
ドッキングされたシナプス小胞は、その後さらにCa2+上昇に応じて即時に膜融合に至るためのプライミング過程を経て、放出可能プールとなると考えられている。このプライミング過程は、Munc-13、Rimなどのタンパク質が関わっていると考えられているが、プライミングの分子実体はよくわかっていない。プライミング関連タンパク質の機能修飾はシナプス伝達の不全や、反復刺激に対する短期シナプス可塑性の変化につながるようである。
膜融合
活動電位の発生によりアクティブゾーンのCa2+チャネルが開いてCa2+が流入する。Ca2+チャネルはアクティブゾーンでクラスターを形成しており、その近傍では局所的に数十μM程度のCa2+濃度に達する。これにより、シナプスタグミン等のCa2+センサータンパク質が構造変化を起こすことにより、即時に(Ca2+流入から0.2 ms程度)エキソサイトーシスが起こり、伝達物質はシナプス間隙へ放出されると考えられている。
小胞のリサイクリング
エキソサイトーシスされた小胞膜は、クラスリンが結合して重合することにより作り出すΩ型の被覆ピットとなり、そのくびれ部をダイナミンがGTP依存的にくびり切ることによりシナプス前膜からエンドサイトーシスされて細胞内に回収される。その後、小胞からクラスリンが解離して小胞内が酸性化し、再度神経伝達物質が充填されて貯蔵プールへ移行する。ただし、リサイクリングがクラスリン依存性経路を介してゆっくりおこるのか、kiss-and-runのような早いリサイクリングをとるのかわかっていない。
関連項目
- SNAP-25
- SNARE複合体
- アクティブゾーン
- エクソサイトーシス
- エンドサイトーシス
- カルシウム
- カルシウムチャネル
- カルシウムドメイン
- ケージド試薬
- シナプシン
- シナプス
- シナプス可塑性
- シナプス小胞
- シナプス前終末
- シナプトタグミン
- シナプトブレビン
- シンタキシン
- ダイナミン
- 神経伝達物質
- 分泌小胞
- 膜融合
- 量子仮説
参考文献
- ↑ 石渡信一、桂 勲、桐野豊、三宅成樹 編
生物物理学 ハンドブック
朝倉書店:2007 - ↑
Zucker, R.S., & Regehr, W.G. (2002).
Short-term synaptic plasticity. Annual review of physiology, 64, 355-405. [PubMed:11826273] [WorldCat] [DOI]
(執筆者:川口真也、坂場武史 担当編集委員:柚崎通介)