「筋萎縮性側索硬化症」の版間の差分
細 (→治療) |
Makotourushitani (トーク | 投稿記録) 細編集の要約なし |
||
| (同じ利用者による、間の3版が非表示) | |||
| 3行目: | 3行目: | ||
''名古屋大学 環境医学研究所 病態神経科学''<br> | ''名古屋大学 環境医学研究所 病態神経科学''<br> | ||
DOI:<selfdoi /> 原稿受付日:2015年12月18日 原稿完成日:2016年2月2日<br> | DOI:<selfdoi /> 原稿受付日:2015年12月18日 原稿完成日:2016年2月2日<br> | ||
担当編集委員:[http://researchmap.jp/read0141446 漆谷 真] | 担当編集委員:[http://researchmap.jp/read0141446 漆谷 真](滋賀医科大学 医学部 神経内科)<br> | ||
</div> | </div> | ||
| 326行目: | 326行目: | ||
| Established | | Established | ||
|- | |- | ||
| | | Lebel B | ||
| Probable | | Probable | ||
|- | |- | ||
| 406行目: | 406行目: | ||
| [[ALS5]]||15q15-21||[[スパタクシン]] ([[Spatacsin]], [[SPG11]])||AR | | [[ALS5]]||15q15-21||[[スパタクシン]] ([[Spatacsin]], [[SPG11]])||AR | ||
|- | |- | ||
| [[ALS6]]||16q11.2||[[Fused in | | [[ALS6]]||16q11.2||[[Fused in salcoma/translocated in liposarcoma]] ([[FUS]]/[[TLS]])||AD | ||
|- | |- | ||
| [[ALS7]]||20p13||||AD | | [[ALS7]]||20p13||||AD | ||
2017年1月9日 (月) 20:02時点における版
渡邊 征爾、山中 宏二
名古屋大学 環境医学研究所 病態神経科学
DOI:10.14931/bsd.6587 原稿受付日:2015年12月18日 原稿完成日:2016年2月2日
担当編集委員:漆谷 真(滋賀医科大学 医学部 神経内科)
英:amyotrophic lateral sclerosis, 英略称: ALS 独:Amyotrophy Lateralsklerose 仏:sclérose latérale amyotrophique
同義語:ルー・ゲーリッグ病 (Lou Gehrig's disease)
筋萎縮性側索硬化症は、大脳皮質運動野および脳幹、脊髄の運動神経の細胞死による、全身の骨格筋の筋力低下、筋萎縮を主症状とする進行性の神経変性疾患である。ALSの90%以上は、非遺伝性に発症するが、約5−10%は遺伝性に発症する。遺伝性ALSの原因遺伝子は約20種類が同定されている。運動神経細胞死の根本的原因は不明であり、有効といえる治療法は確立されていない。最近、非遺伝性を含むALSの病巣に異常蓄積するTDP-43タンパク質が同定された。これらの病因タンパク質や遺伝子を手がかりとして病態の解明に向けて研究が進展している。
歴史
筋萎縮性側索硬化症(ALS)はフランスの神経内科医、病理学者であるジャン=マルタン・シャルコー (Jean-Martin Charcot) (1825-1893)と同僚の Alex Joffroyにより、独立した疾患として初めて記述された[1]。さらに、アメリカ大リーグの野球選手ルー・ゲーリッグ (Lou Gehrig) (1903-1941) がALSのため引退したことから、本疾患は一般に広く知られるようになった。
臨床症状・疫学
臨床症状
ALSは大脳皮質運動野に存在する上位運動ニューロンおよび下部脳幹運動神経核、脊髄前角に存在する下位運動ニューロンの神経変性を特徴とする。上位運動ニューロン障害により、深部腱反射の亢進、病的反射、痙縮などの症状を呈し、下位運動ニューロン障害により進行性の筋力低下、筋萎縮を呈する。典型的なALSでは、片側上肢(あるいは下肢)遠位筋の筋力低下と筋萎縮を自覚し、その後、症状はより近位筋および反対側に進展し、さらに下肢(上肢)、頸部筋、顔面、嚥下筋へ進行していく。また、こむら返りや、線維束性収縮(筋肉のぴくつき)をしばしば自覚する。一方、ALSの約10-20%には、構音障害、嚥下障害を主徴とする球麻痺を初発症状とするものがある。最終的には呼吸筋の麻痺をきたし、人工呼吸器を装着しない限り呼吸不全により死に至る。
感覚障害、眼球運動障害、膀胱直腸障害、褥瘡は、ALSにおいて通常出現せず、臨床的にはALSの四大陰性徴候と呼ばれるが、人工呼吸器を装着して長期に経過した症例では、眼球運動障害が出現することがある。
また、人工呼吸器装着後に長期生存した症例において、骨格筋麻痺、眼球運動障害の進行により補助機器によってもコミュニケーションをとることができない完全閉じ込め状態(Totally locked-in state: TLS)に至ることがある。本邦の全国調査では、人工呼吸器装着例の約13%にTLSを認めたとの報告がある[2]。
ALSの約15-30%に性格変化、言語障害、認知症を示す前頭側頭葉変性症(Frontotemporal Lobar Degeneration: FTLD)を合併するものがある。ALSとFTLDの一群において共通して蓄積するTDP-43タンパク質の発見を機に、臨床的、病理学的にもALSとFTLD-TDP(TDP-43の蓄積を特徴とするFTLDの一群)は一連の連続する疾患群であるという考え方が定着している。
ALSの亜型として下位運動ニューロンのみが障害され、筋萎縮が両上肢に限局するもの(Flail arm型)や上位運動ニューロンのみが障害される原発性側索硬化症と呼ばれるものがあり、これらの亜型は典型的ALSと比べて症状の進行が緩やかである[3][4]。
臨床経過・生命予後
多くのコホート研究での生存期間は、発症時から人工呼吸器装着時あるいは死亡時点までの期間とされている。海外の既報告では、孤発性ALSの生存期間中央値は、20-48ヶ月である。本邦での統計では、平均生存期間は約40ヶ月、中央値は31ヶ月であった。予後因子として、高齢発症、発症部位(呼吸障害、球麻痺で発症するケース)、低栄養は生存期間が短くなる予後不良因子としてほぼ確立している。このようなコホート研究や臨床治験においてよく用いられる重症度指標に、改訂ALS Functional Rating Scale (ALSFRS-R)がある(表1)。これは、言語、歩行、食事動作や嚥下、呼吸などの12項目の機能を点数化してその合計点数を数値化したものである(48点満点)[3]。
| ALSFRS-R (ALS functional rating scale) ※48点満点 | ||
| 1. 言語 | 4 | 会話は正常 |
| 3 | 会話障害が認められる | |
| 2 | 繰り返し聞くと意味がわかる | |
| 1 | 声以外の伝達手段と会話を併用 | |
| 0 | 実用的会話の喪失 | |
| 2. 唾液分泌 | 4 | 正常 |
| 3 | 口内の唾液はわずかだが、明らかに過剰(夜間はよだれが垂れることがある) | |
| 2 | 中程度に過剰な唾液(わずかによだれが垂れることがある) | |
| 1 | 顕著に過剰な唾液(よだれが垂れる) | |
| 0 | 著しいよだれ(絶えずティッシュペーパーやハンカチを必要とする) | |
| 3. 嚥下 | 4 | 正常な食事習慣 |
| 3 | 初期の摂食障害(時に食物を喉に詰まらせる) | |
| 2 | 食物の内容が変化(継続して食べられない) | |
| 1 | 補助的なチューブ栄養を必要とする | |
| 0 | 全面的に非経口性または腸管性栄養 | |
| 4. 書字 | 4 | 正常 |
| 3 | 遅い、または書きなぐる(すべての単語が判読可能) | |
| 2 | 一部の単語が判読不可能 | |
| 1 | ペンは握れるが、字を書けない | |
| 0 | ペンが握れない | |
| 5. 摂食動作: 胃瘻の設置の有無により、(1)(2)いずれかの一方で評価する | ||
| (1)(胃瘻なし)食事用具の使い方 | ||
| 4 | 正常 | |
| 3 | いくぶん遅く、ぎこりないが、他人の助けを必要としない | |
| 2 | フォーク・スプーンは使えるが、箸は使えない | |
| 1 | 食物は誰かに切ってもらわなければならないが、なんとかフォークまたはスプーンで食べることができる | |
| 0 | 誰かに食べさせてもらわなければならない | |
| (2)(胃瘻あり)指先の動作 | ||
| 4 | 正常 | |
| 3 | ぎこちないがすべての指先の作業ができる | |
| 2 | ボタンやファスナーをとめるのにある程度手助けが必要 | |
| 1 | 介護者にわずかに面倒をかける(身の回りの動作に手助けが必要) | |
| 0 | まったく指先の動作ができない | |
| 6. 着衣、身の回りの動作 | 4 | 障害なく正常に着る |
| 3 | 努力を要するが(あるいは効率が悪いが)独りで完全にできる | |
| 2 | 時折、手助けまたは代わりの方法が必要 | |
| 1 | 身の回りの動作に手助けが必要 | |
| 0 | 全面的に他人に依存 | |
| 7. 寝床での動作 | 4 | 正常 |
| 3 | いくぶん遅く、ぎこちないが、他人の助けを必要としない | |
| 2 | 独りで寝返ったり、寝具を整えられるが非常に苦労する | |
| 1 | 寝返りを始めることはできるが、独りで寝返ったり、寝具を整えることができない | |
| 0 | 自分ではどうすることもできない | |
| 8. 歩行 | 4 | 正常 |
| 3 | やや歩行が困難 | |
| 2 | 補助歩行 | |
| 1 | 歩行は不可能 | |
| 0 | 脚を動かすことができない | |
| 9. 階段をのぼる | 4 | 正常 |
| 3 | 遅い | |
| 2 | 軽度に不安定、疲れやすい | |
| 1 | 介助を要する | |
| 0 | のぼれない | |
| 呼吸(呼吸困難、起坐呼吸、呼吸不全の3項目を評価) | ||
| 10. 呼吸困難 | 4 | なし |
| 3 | 歩行中に起こる | |
| 2 | 日常動作(食事、入浴、着替え)のいずれかで起こる | |
| 1 | 坐位あるいは臥床安静時のいずれかで起こる | |
| 0 | 極めて困難で補助呼吸装置を考慮する | |
| 11. 起坐呼吸 | 4 | なし |
| 3 | 息切れのため夜間の睡眠がやや困難 | |
| 2 | 眠るのに支えとする枕が必要 | |
| 1 | 坐位でないと眠れない | |
| 0 | まったく眠ることができない | |
| 12. 呼吸不全 | 4 | なし |
| 3 | 間欠的に補助呼吸装置(BiPAPなど)が必要 | |
| 2 | 夜間に継続的に補助呼吸装置(BiPAPなど)が必要 | |
| 1 | 1日中(夜間、昼間とも)補助呼吸装置(BiPAPなど)が必要 | |
| 0 | 挿管または気管切開による人工呼吸が必要 | |
疫学
本邦では、特定疾患に指定されている難病であり、2013年度の受給者数(約9200人)および他の統計よりALSの有病率は7−10人/10万人と推察されている[3][4]。また発症率は、約2人/10万人/年である。
世界的に、ALSの有病率はほぼ均一であるが、例外的に発症率が高い地域が、紀伊半島(三重県南部・和歌山県)である。以前はグアム島においても発症率が高かったが、現在ではほぼ世界平均水準となっている。50歳未満での発症は少なく、60−70歳代にかけて最も多く発症する。やや男性に多く発症し、男性患者は女性の1.3−1.4倍である。発症のリスク因子として喫煙、頭部外傷やスポーツの関与について報告があるが、その結論は一定していない。
診断・検査
ALSの診断
ALSの診断には、
- 上位運動ニューロン徴候(深部腱反射亢進、病的反射の出現)と下位運動ニューロン徴候(筋萎縮、筋力低下、線維束性収縮)がみられること
- 症状が進行性であり、他の部位への進展がみられること
- 類似の症状を呈する他の疾患が除外されること
が要件とされ、診断の確かさを示す診断グレードとともにEl Escorial基準としてまとめられている[5](表2)。しかし、診療現場では、発症早期においてすべての要件を満たす例は多くなく、診断感度が低いことが指摘されていた。そこで筋電図異常をさらに重視した診断基準として2006年にAwaji基準が提唱された[6]。
Awaji基準の特徴は、
- 下位運動ニューロン症候に関して筋電図異常と臨床所見を等価と判断すること、
- 線維束性収縮電位を急性脱神経所見として採用したことである。
1の採用によって、”Clinically probable-laboratory-supported”という診断グレードは廃止された。Awaji基準と改訂El Escorial基準を比較した研究では、診断感度が向上したことが複数のグループから報告されているが、同時に”Clinically probable-laboratory-supported”という診断グレードを廃止して”Clinically probable“に統合したため、上位運動ニューロン障害を示す臨床所見を脳神経・頸髄・胸髄・腰仙髄のうち2部位に認める必要がある点において診断感度が低下した。
2015年には、”Clinically possible” 診断グレードの取り扱いを中心に、世界神経学会によるEl Escorial基準の一部改訂が行われた。ALSと診断する最低限の所見として以下のいずれか1項目を満たすことが提唱され[7]。
- 進行性の上位および下位運動ニューロン症候を少なくとも1領域に認めること(従来のclinically possible ALSカテゴリー)
- 下位運動ニューロン症候を2領域に認めること(臨床診断あるいは筋電図所見による)
また、遺伝性ALSについて以下の基準が提唱された。2親等以内にALSあるいはFTLD患者を有し、家系内でALS原因遺伝子に病的変異を認め、表現型が分離(segregation)される場合に遺伝性ALSと呼ぶ。この場合は、遺伝子所見は、上位運動ニューロン症候あるいは1領域の障害に同等と見なして診断する[7]。
| ALS診断における必須事項 |
| A. 以下が必要 (A:1) 下位運動ニューロン症候が臨床所見、電気生理学的検査、神経病理学的検査で示される。 (A:2) 上位運動ニューロン症候が臨床所見で示される。 (A:3) 症状、症候が一領域内あるいは他の領域に進行性に広がることが、病歴あるいは所見から示される。 |
| B. 以下が存在しない (B:1) 上位、下位運動ニューロン症候を説明する他疾患を示す電気生理学的所見あるいは病理学的所見。 (B:2) 臨床所見、電気生理学的所見を説明する他疾患を示す神経画像所見。 |
| 診断グレード |
| 身体を脳幹(脳神経)領域、頸髄領域、胸髄領域、腰仙髄領域の4種類に分ける。 |
| clinically definite ALS 臨床所見で3領域以上に上位および下位運動ニューロン症候を認める。 |
| clinically probable ALS 臨床所見で2領域以上に上位および下位運動ニューロン症候を認め、上位運動ニューロン症候のある部位の一部が下位運動ニューロン症候のある部位よりも頸側にある。 |
| clinically probable-laboratory-supported ALS 臨床所見で上位および下位運動ニューロン症候を1領域のみ、もしくは上位運動ニューロン症候のみを1領域に認め、かつ針筋電図で示された下位運動ニューロン症候を2領域以上で認める。 |
| clinically possible ALS 臨床所見で上位および下位運動ニューロン症候を1領域のみ、もしくは上位運動ニューロン症候のみを2領域以上に認める。 下位運動ニューロン症候のある部位を上位運動ニューロン症候のある部位より頸側に認め、clinically probable-laboratory-supported ALSの基準を満たさないものを含む。 十分な除外診断を必要とする。 |
検査所見
ALSの診断のため、電気生理学的検査(神経伝導検査、筋電図)、血液検査、髄液検査、神経画像検査などが行われる。
特に、電気生理学的検査は重要であり、神経伝導検査により、脱髄性ニューロパチーや感覚神経障害を来す他の末梢神経疾患を除外することができる。ALSの神経伝導検査では、運動神経における複合筋活動電位 (compound muscle action potential)の振幅低下が主な所見であり、伝導遅延や伝導ブロックは認めない。また感覚神経伝導は正常である。針筋電図では、脱神経所見(神経変性により骨格筋が運動神経による支配を受けなくなる状態)を検出する。具体的には、線維束性収縮電位 (fasciculation potentials)、線維自発電位 (fibrillation potentials)、陽性棘波 (positive sharp wave)と呼ばれる筋線維の自発的放電など脱神経早期の現象を反映した所見がみられる。また,慢性脱神経所見として、運動単位の振幅増大、運動単位発射頻度の増加など、脱神経が進行して、少ない運動神経でより多くの筋線維を支配する現象を反映した所見がみられる。
また、MRIなどの神経画像検査により、筋力低下を来す脳、脊髄疾患の鑑別を行う。ALSにおいては、T2強調画像において錐体路の高信号化の所見がみられることがある。血液・髄液検査では、ALSにおいて特徴的な異常所見はなく、他疾患の鑑別のために行われる[3][4]。
鑑別診断
ALSと鑑別すべき疾患として、脊髄性筋萎縮症、球脊髄性筋萎縮症、ポリオ後症候群、多巣性運動ニューロパチー、遺伝性ニューロパチー、多発性硬化症、筋炎、頸椎症、筋無力症など神経筋接合部の疾患、重金属中毒などがある。
治療
個々の治療法について、米国神経学会(American Academy of Neurology: AAN)あるいは日本神経学会(JNS)のALS診療ガイドラインにおけるグレード分類(表3)を示す[8]。
| AAN Level of Recommendations | |
| Level A | Established |
| Lebel B | Probable |
| Level C | Possible |
| Level U | Data inadequate or conflicting |
| 日本神経学会診療ガイドライン:グレード分類 | |
| グレードA | 強い科学的根拠があり、行うよう強く勧められる |
| グレードB | 科学的根拠があり、行うよう勧められる |
| グレードC1 | 科学的根拠はないが、行うよう勧められる |
| グレードC2 | 科学的根拠がなく,行わないよう勧められる |
| グレードD | 無効性あるいは害を示す科学的根拠があり、行わないよう勧められる |
薬物療法
リルゾール(商品名:リルテック)が長年ALS治療薬として推奨、使用されてきた(JNS, グレードA; AAN, レベルA)。リルゾールは、グルタミン酸による興奮神経毒性を抑制することで運動神経保護作用を発揮すると考えられている。これまでに行われた臨床治験からは、生存期間を平均2-3ヶ月延長する効果があることが知られている。
2015年より本邦においては、エダラボン(商品名:ラジカット)の点滴投与が発症早期のALSに対して保険適用となった。エダラボンは、酸化ストレスの軽減を通じた神経保護剤として脳梗塞急性期において使用されているが、早期ALS患者に限定した比較試験で、臨床症状の進行を遅らせる効果が認められた[10]。
栄養・理学療法
早期に体重が減少するケースは、ALSの予後不良因子として知られている。そこで、初期の体重減少を食い止めるため、栄養管理の重要性が提唱されている(JNS, グレードB)。ALSの症状の進行により、むせや嚥下障害による低栄養に対して、経口摂取を中止あるいは楽しみ程度として、胃瘻造設などによる経腸栄養を主栄養とすることは進行期の治療として定着している(JNS, グレードC1; AAN, レベルB)が、治療としての早期における栄養管理の検討が必要と考えられる。また、筋力保持や、関節の拘縮防止のため、理学療法も行われるが、過度の過重は筋力低下を増悪する可能性も指摘されている。
呼吸管理
ALSでは呼吸筋の麻痺による呼吸不全が死因となることがほとんどである。人工呼吸器の装着の判断は、疾患の告知とともに重要な問題となっている。呼吸不全の早期において、マスクによる呼吸補助(非侵襲的換気、Non-invasive Ventilation:NIV)を用いることで呼吸症状の一時的な改善や肺炎の予防を通じた生命予後の改善に結びついている(JNS, グレードB; AAN, レベルB)。
コミュニケーション
進行期では、四肢の麻痺や声が出しにくくなるため、コミュニケーションをとることが困難となる。目の動きを用いた文字盤による方法や、コンピューター等の方法により意思伝達を行うことが可能である。脳活動や脳血流をモニタリングして意思疎通を行うBMI (brain machine interface)の開発が進行しており、近い将来ALS患者への応用が期待される。
病理所見
大脳皮質の上位運動ニューロンおよび脊髄の下位運動ニューロンに選択的な変性と脱落を認める。特に脊髄では、下位運動ニューロンの変性に伴って、髄鞘の崩壊や反応性グリオーシスの亢進が顕著である。また、下位運動ニューロン軸索近位にはニューロフィラメントが蓄積して腫大したスフェロイドが認められる。通常、大脳の萎縮は認められないが、一部のALS症例で中心前回、特に錯体路の萎縮を認めるほか、FTLDを伴うALSでは側頭葉を中心とした萎縮が見られる[3]。
TDP-43陽性封入体
これまで、FTLDは病理学的にタウの蓄積を認めるもの(FTLD-tau)と、ユビキチン陽性、タウ陰性封入体を伴うもの(FTLD-U)の2群に分類されてきた。2006年、Araiら[11]、およびNeumannら[12]は、FTLD-UとALSに共通して認められるユビキチン陽性・タウ陰性の封入体の主要構成タンパク質としてTDP-43(TAR DNA binding protein 43)を同定した。この発見により、FTLDとALSがTDP-43の異常化を伴って神経変性を生じるという共通した疾患機序に基づくことが明らかとなった。
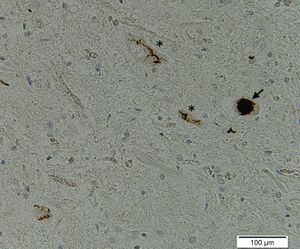
ALSやFTLDにおけるTDP-43陽性封入体は、アルツハイマー病におけるタウやパーキンソン病におけるα-シヌクレインと同様、線維構造をとった異常構造物として神経細胞内におけるスケイン様封入体 (skein-like inclusion)や円形封入体、またはグリア細胞内封入体として観察される(図1)。TDP-43陽性封入体はSOD1変異による家族性ALSを除いた、ほぼ全てのALSにおいて共通して見られることから、ALSの病態に深く関与していることが考えられる。生化学的解析から、病巣に蓄積したTDP-43は一部がC末端側で断片化しており、更に強いリン酸化を受けていることが判明している。培養細胞を用いた複数の研究から、TDP-43のC末端側断片はTDP-43凝集の核となることが示唆されているが、ALS患者の病巣から複数の断片が検出されることを根拠として凝集が先に生じる可能性も指摘されており、TDP-43陽性封入体の形成機序はALSの重要な研究課題となっている[13]。
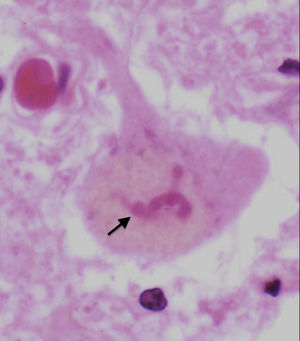
ブニナ小体
ブニナ小体とは残存運動ニューロンの細胞質に存在する好酸性の微小な円形封入体(図2)で、1962年にBuninaによって初めて報告された。通常、ブニナ小体は孤発性ALSの特徴として認められるが、TDP-43変異を有する遺伝性ALSでも高頻度に出現する。シスタチンC、トランスフェリン、およびペリフェリンに対する免疫組織染色で陽性を示すことから、これらのタンパク質が構成因子であると考えられているが、現在までのところALSの病態におけるブニナ小体の意義は不明である[14][15]。
病態生理
ALSの環境要因
ALSの集積地帯として知られたる紀伊半島やグアムでは、家族性発症率こそ高いもののメンデル様式の遺伝を示さないこと、および発症率に年代間で差があることから環境要因の存在が考えられた。しかし、現在までALSの原因となることを実証した環境要因は存在しない[16]。
家族性ALSの原因遺伝子
現在までに約20種類あまりの遺伝子が家族性ALSの原因遺伝子として同定されている(表4)。本邦で頻度の高い遺伝子異常として、SOD1(家族性ALSの約20%)、FUS/TLS (約1−5%)、TARDBP (TDP-43: 約1%)が知られる。C9orf72変異によるFTLDを伴うALS(FTLD-ALS)の頻度は、人種、地域によってかなり異なる。欧米では家族性ALSの約30-50%を占め、家族性ALSの原因として最も頻度が高いが、日本を含む東アジアでは極めて少ない。代表的な遺伝子を以下に概説する。
AD:常染色体優性遺伝、AR:常染色体劣性遺伝、XD:伴性優性遺伝
AD: 常染色体優性遺伝様式、AR: 常染色体劣性遺伝様式、XD: 伴性優性遺伝様式、FTD-ALS: 前頭側頭葉型認知症(Frontotemporal dementia; FTD)を伴うALS
SOD1
SOD1変異は家族性ALSの約20%を占め、本邦で最も頻度の高い遺伝子変異であり、150種類以上の変異が報告されている。また、孤発性ALSの一部にもSOD1変異を認める。SOD1はスーパーオキシドラジカル(O2−)を除去する酵素であるが、ALSの発症には変異SOD1自身の酵素活性は関係していない。従って、変異に伴う毒性獲得(gain of toxicity)がALSを引き起こす原因と考えられている。変異SOD1タンパク質には三次構造に大きな異常が見られることから、異常なオリゴマーの形成や蓄積に伴い、後述するタンパク質代謝異常やカルシウムシグナルの異常化、軸索輸送障害などの複数の毒性を発揮して、運動神経変性を引き起こすと考えられている[17]。
TARDBP (TDP-43)
孤発性ALSで封入体を形成するTDP-43についても、コードするTARDBP遺伝子上で常染色体優性遺伝形式による家族性ALSの家系が複数報告されている。孤発性ALSと同様に、病巣におけるTDP-43の異常蓄積は単なる二次的な変化ではなく、ALSの分子病態に一次的に関わると考えられている。しかし、TDP-43がSOD1の場合と同様に毒性獲得の機序に従うかは、未だ議論がある。TDP-43ノックアウトマウスは胎生致死で、生体内でもそのタンパク質量が厳格に制御されていることや、ALSではTDP-43が運動神経細胞の核から消失することから、機能喪失による神経変性機序(loss of function)も考えられている。一方、TDP-43変異によるALSが優性遺伝することや変異TDP-43トランスジェニックマウスが運動障害を示すことは毒性獲得説を示唆しており、今後の研究による解明が待たれる[18][19]。
FUS/TLS
FUS/TLS遺伝子がコードするFUSはRNA結合タンパク質で、TDP-43と同様、通常は核に局在するが、患者由来の変異FUSは細胞質へ蓄積し、FUS陽性/TDP-43陰性の好塩基性封入体を形成する。FUSはTDP-43に類似した構造や機能をもち、少なくとも一部は共通したRNA代謝異常の機序によってALSを発症すると考えられる[20]。
C9orf72
2011年にC9orf72が家族性FTLD-ALSの原因遺伝子として報告された。C9orf72によるFTLD-ALSは優性遺伝により発症し、患者では遺伝子のイントロンにおけるGGGGCC繰り返し配列(リピート)の異常な伸長がみられ、ALSの一部はリピート病として発症することが明らかとなった[21][22]。
C9orf72のGGGGCCリピートは、健常者で30リピート未満であるが、ALS/FTD患者では700〜1600近くに異常伸長している。異常リピートの保有率には地域差および人種差が存在し、北欧、特にフィンランドで最も多いことから、高い創始者効果をもった変異であると考えられている。C9orf72遺伝子の機能は不明であるが、最近、C9orf72欠損マウスがALS様の症状を示さないと報告された[23]ことから、C9orf72の異常は機能喪失よりも、むしろ毒性獲得によりALSを引き起こすことが示唆された。このGGGGCCリピートに由来するmRNAは核内での異常なRNA凝集体の形成(RNA foci)、および開始コドン非依存的な翻訳産物の蓄積(repeat associated non-ATG translation; RAN)を介して、運動神経への毒性を引き起こすと考えられている[24]。しかし、最近報告された、人工染色体により異常型C9orf72を導入したマウスではRNA fociの形成やRAN産物の蓄積などの病態は再現されたものの運動神経変性は生じておらず[25][26]、C9orf72の異常が運動神経変性を引き起こす機序について、より詳細な検討が必要と考えられる。
その他
上記の遺伝子のほかに、オプチニューリン (OPTN)やERBB4遺伝子変異を有する家族性ALSが本邦で発見、報告されている。
ALSの動物モデル
変異SOD1を過剰発現するトランスジェニックマウス(SOD1tgマウス)では、運動神経に細胞死が起こることによって進行性に下肢の麻痺や筋萎縮を示し、ALSの症状や病理変化をよく再現することからALSのモデル動物として頻用されている[27]。しかし、SOD1変異に伴うALSの病理組織ではTDP-43陽性封入体やブニナ小体を欠くなど、その病態が孤発性ALSと必ずしも一致しないことから、より孤発性ALSに近い病態の再現を目指した新たな動物モデルの作製が盛んに試みられている。具体的には、変異TDP-43や変異FUSを発現するトランスジェニックマウスが報告されている[19]ほか、アデノ随伴ウイルスベクター(AAV vector)[28]や人工染色体[25][26]を用いて、C9orf72の異常なリピート伸長を導入したマウスなどが報告されているが、運動神経に選択的な細胞死が起こるモデル動物の樹立には至っていない。
神経細胞内の分子病態
興奮毒性
上位と下位の運動神経間のシグナル伝達はグルタミン酸を神経伝達物質として用いるが、過剰のグルタミン酸はカルシウムイオンの細胞内への過剰な流入を引き起こして、有害であることが知られている。ALS患者の脊髄やSOD1tgマウスでは、シナプス間隙におけるグルタミン酸の回収を担う、アストロサイトのグルタミン酸トランスポーターGLT1/EAAT2の発現が低下しており、グルタミン酸回収量が低下している。また、孤発性ALSにおいて、運動神経のグルタミン酸受容体である、AMPA型グルタミン酸受容体がRNA編集の異常に伴ってカルシウムイオン易透過性になっていることも明らかにされた[29][30]。これらの異常により、運動神経への過剰なカルシウムイオンの流入が生じ、運動神経の変性を引き起こすものと考えられている。
最近の研究で、カルシウムイオン依存性のタンパク質分解酵素であるカルパインがTDP-43の異常断片化と易凝集化に関与していることが報告されたことも、興奮毒性の機序がALSにおける運動神経変性に深く関与していることを示唆している[31]。また、ALSの治療薬リルゾールは、主としてグルタミン酸受容体に対する拮抗阻害効果を通じて、この興奮毒性を緩和することが作用機序であると考えられている。
ミトコンドリア障害
ミトコンドリアは細胞のエネルギー産生器官として重要であり、酸化ストレスの原因となる活性酸素の産生やアポトーシスの誘導に深く関与する。
ALSの病態に関連した研究として、SOD1tgマウスにおいて変異SOD1がミトコンドリアの外膜に蓄積し、ミトコンドリアのATP産生を抑制すること、変異SOD1の存在下ではミトコンドリアのカルシウムイオンの緩衝作用が低下していること、また変異TDP-43の過剰発現に伴ってミトコンドリアの分裂が促進されることなどが報告されている。ミトコンドリアの品質管理異常が神経細胞変性につながることは、主にパーキンソン病に関してよく研究されているが、エネルギー要求度の高い運動神経が傷害されるALSにおいてもミトコンドリアの障害や異常なミトコンドリアの蓄積が運動神経変性に深く関与していることが推察される[32]。
小胞体ストレス
小胞体ストレス(endoplasmic reticulum stress; ER-stress)とは、正常な三次構造を形成できなかったタンパク質が小胞体に蓄積し、細胞への傷害を及ぼす現象である。このような悪影響を回避するため、細胞では小胞体ストレス応答によって分子シャペロンや小胞体関連分解(endoplasmic reticulum associated degradation; ERAD)が惹起され、速やかに異常タンパク質を除去される。SOD1tgマウスを用いた検討から、発症前の極めて早期から小胞体ストレス応答が活性化していることや、ERADの阻害に伴う過剰な小胞体ストレス応答により神経細胞死が引き起こされることが判明している[33]。
タンパク質分解障害
ユビキチン-プロテアソーム系(ubiquitin-proteasome system; UPS)は、細胞内の不要または異常なタンパク質を選択的に分解する重要な経路であり、その機能不全はALSに限らず、多くの神経変性疾患に共通して重要であると考えられている[34]。TDP-43陽性封入体を含め、ユビキチン陽性の封入体はALSの病巣において多数認められ、またプロテアソームの阻害が病態を増悪させて封入体の形成を促進することが知られている。
一方、細胞内における不要タンパク質のもう1つの分解系として、オートファジーと呼ばれる機構が存在し、細胞内の不要な物質や小器官をオートファゴソームと呼ばれる二重膜で包んだ後、リソソームとの融合により分解している。ALSではLC3やp62といったオートファジー関連タンパク質の異常な蓄積やオートファゴソームの数の増加が見られることに加え、家族性ALSの原因遺伝子であるオプチニューリン、および潜在的なALSの原因遺伝子として報告されたTBK1(TANK-binding kinase 1)はオートファジーの制御因子として知られており、オートファジー機構の破綻がALSにおける神経細胞変性に関与していることが示唆されている[35]。しかし、運動神経におけるオートファジーの誘導が神経細胞保護的であるのか、または過剰なオートファジーが細胞傷害的に影響しているのかは未だ議論がある。現時点では、薬剤等の投与を通じたオートファジーの誘導による運動神経保護に関して、十分な有効性は示されていない。
RNA代謝異常
家族性ALSの原因遺伝子にはTDP-43、FUS、hnRNAPA1/A2B1など、RNA結合タンパク質をコードする遺伝子が多数含まれており、変異に伴うRNA代謝の異常がALSを引き起こすことが示唆される。TDP-43やFUSはイントロンに結合してmRNAのスプライシングや安定性の制御に関与しており、これらの不調によるスプライシング異常や遺伝子制御異常がALSの病態に関与することが示唆されている[20][36][37][38]。また、ALSの運動神経ではTDP-43が制御するスプライシング複合体、スプライソソームの異常の報告がある[39]。これらのタンパク質は細胞内でストレス下の翻訳抑制などに関わるストレス顆粒(stress granule)と呼ばれる構造の構成分子であり、過剰なストレス顆粒の形成が神経細胞死に関与する可能性が指摘されている[18]。
細胞内輸送障害
運動神経は細胞体と末梢の神経筋接合部までを結ぶ、極めて長い軸索を有している。タンパク質や脂質などの合成や分解は主に細胞体で行われるため、軸索中の細胞内輸送は運動神経の機能に必須である。長い軸索を有する運動神経は細胞内輸送の破綻に対して脆弱であり、運動神経に選択的な変性につながるものと考えられる。これまで、ALSをはじめとして、球脊髄性筋萎縮症(spinal and bulbar muscular atrophy; SBMA)など、運動神経の変性を伴う多くの疾患で軸索機能の異常が報告されている[40]。
細胞内輸送に関わる家族性ALSの原因遺伝子として、アルシン (alsin)、プロフィリン1 (profilin 1)、CHMP2B、ダイナクチン1 (dynactin 1)などが報告されている。これらの動物モデルでは、ALS患者で見られる軸索の腫大化とニューロフィラメントの蓄積を伴って、運動機能障害を呈する。また、孤発性ALSではダイナクチン1の発現が低下して、軸索内の輸送に障害が生じていることが報告された[41]。
酸化ストレス
ALS患者の脊髄やSOD1tgマウスの腰髄では、タンパク質のカルボニル化や8-オキソ-2’-デオキシグアニンといった酸化ストレスマーカーが顕著に増加している。酸化ストレスは過酸化脂質の生成を介してスーパーオキシドラジカルを発生させて細胞傷害的に作用し、特に脳や神経系は脂質に富み、酸化ストレスに脆弱であることから、酸化ストレスの緩和はALSにおける神経細胞変性を抑制するための重要な標的と考えられている。実際、酸化ストレスを軽減する抗酸化物質の投与はSOD1tgマウスを用いた系で有効であることが報告されている[42]。さらに、酸化ストレスを軽減するエダラボンは、早期例に限定したALS治療薬として本邦で使用されている。
グリア細胞関連病態
ALSの脊髄では顕著な反応性グリオーシスの亢進が見られ、ミクログリアの活性化やアストロサイトの増殖、肥大化が観察されてきた。このような変化は従前、運動神経変性に伴う二次的なものと考えられてきたが、SOD1tgマウスにおいて、グリア細胞選択的に変異SOD1を除去するとSOD1tgマウスの生存期間が延長することから、グリア細胞が積極的にALSの病態に関与して運動神経変性を制御していることが明らかとなった[43][44]。このように非神経細胞であるグリア細胞の異常が神経細胞死を引き起こすことを「非自律性の神経細胞死(non-cell autonomous neuronal death)」と呼び、グリア細胞の病的変化が神経変性を促進するメカニズムを明らかにすることが重要な研究課題のひとつとなっている[45]。
関連項目
外部リンク
参考文献
- ↑ Jean-Martin Charcot, A Joffroy
Deux cas d'atrophie musculaire progressive : avec lésions de la substance grise et des faisceaux antéro-latéraux de la moelle épinière
V. Masson, P. 355-367, 630-649, 745-760, 1869 - ↑ 溝口功一、川田明弘、林秀明
TPPVを導入したALS患者のTLSの全国実態調査
臨床神経: 2008, 48: 476-80 - ↑ 3.0 3.1 3.2 3.3 3.4 祖父江 元(専門編集) 辻 省次(総編集)
すべてがわかるALS(筋萎縮性側索硬化症)・運動ニューロン疾患(アクチュアル脳・神経疾患の臨床)
中山書店, 2013 ISBN 978-4-521-73443-9 - ↑ 4.0 4.1 4.2 4.3 日本神経学会 監修
筋萎縮性側索硬化症 診療ガイドライン 2013
南江堂, 2013 ISBN 978-4-524-26646-3 - ↑ 5.0 5.1
Brooks, B.R., Miller, R.G., Swash, M., Munsat, T.L., & World Federation of Neurology Research Group on Motor Neuron Diseases (2000).
El Escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis. Amyotrophic lateral sclerosis and other motor neuron disorders : official publication of the World Federation of Neurology, Research Group on Motor Neuron Diseases, 1(5), 293-9. [PubMed:11464847] [WorldCat] - ↑
de Carvalho, M., Dengler, R., Eisen, A., England, J.D., Kaji, R., Kimura, J., ..., & Swash, M. (2008).
Electrodiagnostic criteria for diagnosis of ALS. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology, 119(3), 497-503. [PubMed:18164242] [WorldCat] [DOI] - ↑ 7.0 7.1
Ludolph, A., Drory, V., Hardiman, O., Nakano, I., Ravits, J., Robberecht, W., ..., & WFN Research Group On ALS/MND (2015).
A revision of the El Escorial criteria - 2015. Amyotrophic lateral sclerosis & frontotemporal degeneration, 16(5-6), 291-2. [PubMed:26121170] [WorldCat] [DOI] - ↑
Miller, R.G., Jackson, C.E., Kasarskis, E.J., England, J.D., Forshew, D., Johnston, W., ..., & Quality Standards Subcommittee of the American Academy of Neurology (2009).
Practice parameter update: the care of the patient with amyotrophic lateral sclerosis: multidisciplinary care, symptom management, and cognitive/behavioral impairment (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology, 73(15), 1227-33. [PubMed:19822873] [PMC] [WorldCat] [DOI] - ↑ Minds診療ガイドライン選定部会監修
Minds診療ガイドライン作成の手引き2007
医学書院 - ↑
Abe, K., Itoyama, Y., Sobue, G., Tsuji, S., Aoki, M., Doyu, M., ..., & Edaravone ALS Study Group (2014).
Confirmatory double-blind, parallel-group, placebo-controlled study of efficacy and safety of edaravone (MCI-186) in amyotrophic lateral sclerosis patients. Amyotrophic lateral sclerosis & frontotemporal degeneration, 15(7-8), 610-7. [PubMed:25286015] [PMC] [WorldCat] [DOI] - ↑
Arai, T., Hasegawa, M., Akiyama, H., Ikeda, K., Nonaka, T., Mori, H., ..., & Oda, T. (2006).
TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and biophysical research communications, 351(3), 602-11. [PubMed:17084815] [WorldCat] [DOI] - ↑
Neumann, M., Sampathu, D.M., Kwong, L.K., Truax, A.C., Micsenyi, M.C., Chou, T.T., ..., & Lee, V.M. (2006).
Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science (New York, N.Y.), 314(5796), 130-3. [PubMed:17023659] [WorldCat] [DOI] - ↑
Arai, T., Hasegawa, M., Nonoka, T., Kametani, F., Yamashita, M., Hosokawa, M., ..., & Akiyama, H. (2010).
Phosphorylated and cleaved TDP-43 in ALS, FTLD and other neurodegenerative disorders and in cellular models of TDP-43 proteinopathy. Neuropathology : official journal of the Japanese Society of Neuropathology, 30(2), 170-81. [PubMed:20102522] [WorldCat] [DOI] - ↑
Okamoto, K., Mizuno, Y., & Fujita, Y. (2008).
Bunina bodies in amyotrophic lateral sclerosis. Neuropathology : official journal of the Japanese Society of Neuropathology, 28(2), 109-15. [PubMed:18069968] [WorldCat] [DOI] - ↑
Mizuno, Y., Fujita, Y., Takatama, M., & Okamoto, K. (2011).
Peripherin partially localizes in Bunina bodies in amyotrophic lateral sclerosis. Journal of the neurological sciences, 302(1-2), 14-8. [PubMed:21241994] [WorldCat] [DOI] - ↑
Al-Chalabi, A., & Hardiman, O. (2013).
The epidemiology of ALS: a conspiracy of genes, environment and time. Nature reviews. Neurology, 9(11), 617-28. [PubMed:24126629] [WorldCat] [DOI] - ↑
Cleveland, D.W., & Rothstein, J.D. (2001).
From Charcot to Lou Gehrig: deciphering selective motor neuron death in ALS. Nature reviews. Neuroscience, 2(11), 806-19. [PubMed:11715057] [WorldCat] [DOI] - ↑ 18.0 18.1
Ling, S.C., Polymenidou, M., & Cleveland, D.W. (2013).
Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron, 79(3), 416-38. [PubMed:23931993] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
McGoldrick, P., Joyce, P.I., Fisher, E.M., & Greensmith, L. (2013).
Rodent models of amyotrophic lateral sclerosis. Biochimica et biophysica acta, 1832(9), 1421-36. [PubMed:23524377] [WorldCat] [DOI] - ↑ 20.0 20.1
Lagier-Tourenne, C., Polymenidou, M., Hutt, K.R., Vu, A.Q., Baughn, M., Huelga, S.C., ..., & Yeo, G.W. (2012).
Divergent roles of ALS-linked proteins FUS/TLS and TDP-43 intersect in processing long pre-mRNAs. Nature neuroscience, 15(11), 1488-97. [PubMed:23023293] [PMC] [WorldCat] [DOI] - ↑
DeJesus-Hernandez, M., Mackenzie, I.R., Boeve, B.F., Boxer, A.L., Baker, M., Rutherford, N.J., ..., & Rademakers, R. (2011).
Expanded GGGGCC hexanucleotide repeat in noncoding region of C9ORF72 causes chromosome 9p-linked FTD and ALS. Neuron, 72(2), 245-56. [PubMed:21944778] [PMC] [WorldCat] [DOI] - ↑
Renton, A.E., Majounie, E., Waite, A., Simón-Sánchez, J., Rollinson, S., Gibbs, J.R., ..., & Traynor, B.J. (2011).
A hexanucleotide repeat expansion in C9ORF72 is the cause of chromosome 9p21-linked ALS-FTD. Neuron, 72(2), 257-68. [PubMed:21944779] [PMC] [WorldCat] [DOI] - ↑
Koppers, M., Blokhuis, A.M., Westeneng, H.J., Terpstra, M.L., Zundel, C.A., Vieira de Sá, R., ..., & Pasterkamp, R.J. (2015).
C9orf72 ablation in mice does not cause motor neuron degeneration or motor deficits. Annals of neurology, 78(3), 426-38. [PubMed:26044557] [PMC] [WorldCat] [DOI] - ↑
Rohrer, J.D., Isaacs, A.M., Mizielinska, S., Mead, S., Lashley, T., Wray, S., ..., & Warren, J.D. (2015).
C9orf72 expansions in frontotemporal dementia and amyotrophic lateral sclerosis. The Lancet. Neurology, 14(3), 291-301. [PubMed:25638642] [WorldCat] [DOI] - ↑ 25.0 25.1
Peters, O.M., Cabrera, G.T., Tran, H., Gendron, T.F., McKeon, J.E., Metterville, J., ..., & Brown, R.H. (2015).
Human C9ORF72 Hexanucleotide Expansion Reproduces RNA Foci and Dipeptide Repeat Proteins but Not Neurodegeneration in BAC Transgenic Mice. Neuron, 88(5), 902-909. [PubMed:26637797] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
O'Rourke, J.G., Bogdanik, L., Muhammad, A.K.M.G., Gendron, T.F., Kim, K.J., Austin, A., ..., & Baloh, R.H. (2015).
C9orf72 BAC Transgenic Mice Display Typical Pathologic Features of ALS/FTD. Neuron, 88(5), 892-901. [PubMed:26637796] [PMC] [WorldCat] [DOI] - ↑
Gurney, M.E., Pu, H., Chiu, A.Y., Dal Canto, M.C., Polchow, C.Y., Alexander, D.D., ..., & Deng, H.X. (1994).
Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science (New York, N.Y.), 264(5166), 1772-5. [PubMed:8209258] [WorldCat] [DOI] - ↑
Chew, J., Gendron, T.F., Prudencio, M., Sasaguri, H., Zhang, Y.J., Castanedes-Casey, M., ..., & Petrucelli, L. (2015).
Neurodegeneration. C9ORF72 repeat expansions in mice cause TDP-43 pathology, neuronal loss, and behavioral deficits. Science (New York, N.Y.), 348(6239), 1151-4. [PubMed:25977373] [PMC] [WorldCat] [DOI] - ↑
Yamashita, T., & Kwak, S. (2014).
The molecular link between inefficient GluA2 Q/R site-RNA editing and TDP-43 pathology in motor neurons of sporadic amyotrophic lateral sclerosis patients. Brain research, 1584, 28-38. [PubMed:24355598] [WorldCat] [DOI] - ↑
Kawahara, Y., Ito, K., Sun, H., Aizawa, H., Kanazawa, I., & Kwak, S. (2004).
Glutamate receptors: RNA editing and death of motor neurons. Nature, 427(6977), 801. [PubMed:14985749] [WorldCat] [DOI] - ↑
Yamashita, T., Hideyama, T., Hachiga, K., Teramoto, S., Takano, J., Iwata, N., ..., & Kwak, S. (2012).
A role for calpain-dependent cleavage of TDP-43 in amyotrophic lateral sclerosis pathology. Nature communications, 3, 1307. [PubMed:23250437] [WorldCat] [DOI] - ↑
Tan, W., Pasinelli, P., & Trotti, D. (2014).
Role of mitochondria in mutant SOD1 linked amyotrophic lateral sclerosis. Biochimica et biophysica acta, 1842(8), 1295-301. [PubMed:24568860] [PMC] [WorldCat] [DOI] - ↑
Walker, A.K., & Atkin, J.D. (2011).
Stress signaling from the endoplasmic reticulum: A central player in the pathogenesis of amyotrophic lateral sclerosis. IUBMB life, 63(9), 754-63. [PubMed:21834058] [WorldCat] [DOI] - ↑
Ciechanover, A., & Brundin, P. (2003).
The ubiquitin proteasome system in neurodegenerative diseases: sometimes the chicken, sometimes the egg. Neuron, 40(2), 427-46. [PubMed:14556719] [WorldCat] [DOI] - ↑
Nixon, R.A. (2013).
The role of autophagy in neurodegenerative disease. Nature medicine, 19(8), 983-97. [PubMed:23921753] [WorldCat] [DOI] - ↑
Polymenidou, M., Lagier-Tourenne, C., Hutt, K.R., Huelga, S.C., Moran, J., Liang, T.Y., ..., & Cleveland, D.W. (2011).
Long pre-mRNA depletion and RNA missplicing contribute to neuronal vulnerability from loss of TDP-43. Nature neuroscience, 14(4), 459-68. [PubMed:21358643] [PMC] [WorldCat] [DOI] - ↑
Tollervey, J.R., Curk, T., Rogelj, B., Briese, M., Cereda, M., Kayikci, M., ..., & Ule, J. (2011).
Characterizing the RNA targets and position-dependent splicing regulation by TDP-43. Nature neuroscience, 14(4), 452-8. [PubMed:21358640] [PMC] [WorldCat] [DOI] - ↑
Udagawa, T., Fujioka, Y., Tanaka, M., Honda, D., Yokoi, S., Riku, Y., ..., & Sobue, G. (2015).
FUS regulates AMPA receptor function and FTLD/ALS-associated behaviour via GluA1 mRNA stabilization. Nature communications, 6, 7098. [PubMed:25968143] [PMC] [WorldCat] [DOI] - ↑
Tsuiji, H., Iguchi, Y., Furuya, A., Kataoka, A., Hatsuta, H., Atsuta, N., ..., & Yamanaka, K. (2013).
Spliceosome integrity is defective in the motor neuron diseases ALS and SMA. EMBO molecular medicine, 5(2), 221-34. [PubMed:23255347] [PMC] [WorldCat] [DOI] - ↑
De Vos, K.J., Grierson, A.J., Ackerley, S., & Miller, C.C. (2008).
Role of axonal transport in neurodegenerative diseases. Annual review of neuroscience, 31, 151-73. [PubMed:18558852] [WorldCat] [DOI] - ↑
Jiang, Y.M., Yamamoto, M., Kobayashi, Y., Yoshihara, T., Liang, Y., Terao, S., ..., & Sobue, G. (2005).
Gene expression profile of spinal motor neurons in sporadic amyotrophic lateral sclerosis. Annals of neurology, 57(2), 236-51. [PubMed:15668976] [WorldCat] [DOI] - ↑
Barber, S.C., Mead, R.J., & Shaw, P.J. (2006).
Oxidative stress in ALS: a mechanism of neurodegeneration and a therapeutic target. Biochimica et biophysica acta, 1762(11-12), 1051-67. [PubMed:16713195] [WorldCat] [DOI] - ↑
Boillée, S., Yamanaka, K., Lobsiger, C.S., Copeland, N.G., Jenkins, N.A., Kassiotis, G., ..., & Cleveland, D.W. (2006).
Onset and progression in inherited ALS determined by motor neurons and microglia. Science (New York, N.Y.), 312(5778), 1389-92. [PubMed:16741123] [WorldCat] [DOI] - ↑
Yamanaka, K., Chun, S.J., Boillee, S., Fujimori-Tonou, N., Yamashita, H., Gutmann, D.H., ..., & Cleveland, D.W. (2008).
Astrocytes as determinants of disease progression in inherited amyotrophic lateral sclerosis. Nature neuroscience, 11(3), 251-3. [PubMed:18246065] [PMC] [WorldCat] [DOI] - ↑
Ilieva, H., Polymenidou, M., & Cleveland, D.W. (2009).
Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. The Journal of cell biology, 187(6), 761-72. [PubMed:19951898] [PMC] [WorldCat] [DOI]