「細胞死」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の20版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/hibernation 山口 良文]、[http://researchmap.jp/masayukimiura 三浦 正幸]</font><br> | <font size="+1">[http://researchmap.jp/hibernation 山口 良文]、[http://researchmap.jp/masayukimiura 三浦 正幸]</font><br> | ||
''東京大学大学院薬学系研究科 遺伝学教室''<br> | ''東京大学大学院薬学系研究科 遺伝学教室''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年7月7日 原稿完成日:2015年7月17日<br> | ||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
英語名:cell | 英語名:cell death 独:Zelltod 仏:mort cellulaire | ||
{{box|text= 細胞が何らかの理由により細胞膜や核などの破綻をきたし、修復不可能となった不可逆的状態が細胞死である。物理的損傷等により一瞬のうちに細胞構造が破壊されるのを「事故的細胞死」とよぶ。一方、細胞内の遺伝的にコードされた分子機構が発動する細胞死は、「制御された細胞死」と呼ぶ。制御された細胞死には、アポトーシス、制御されたネクローシス、オートファジー細胞死等がある。神経系発生過程ではアポトーシスが大量に生じる。例えば、発生中の上皮構造において周辺細胞との上皮バリア構造を保ったままアポトーシスが起こると同時に細胞の頭頂部収縮を促すため上皮組織の屈曲が起こる。このようなメカニズムが神経管閉鎖へ関与している。また限られた神経栄養因子を競合する細胞の間では負けた細胞のアポトーシスが起こり、神経細胞と標的組織との数の調節(マッチング)のための機構として働くと考えられる。}} | |||
== | ==細胞死とは== | ||
細胞が何らかの理由により[[細胞膜]] | 細胞が何らかの理由により[[細胞膜]]や[[wikipedia:ja:核|核]]などの破綻をきたし、修復不可能となった不可逆的状態が細胞死である。かつては、発生過程で観察される[[プログラム細胞死]]の主要形態である[[アポトーシス]](apoptosis)と、それ以外の[[ネクローシス]](necrosis)とに細胞死を分類することもあった。しかし近年、多種多様な分子機構が細胞死に関与することが明らかとなり、細胞死を以下のように区別することが提唱されている<ref name=ref1><pubmed>4561027</pubmed></ref> <ref name=ref2><pubmed>25710534</pubmed></ref>。まず、強酸やアルカリ、熱、物理的損傷等の、外傷により一瞬のうちに細胞構造が破壊される細胞死は、「[[事故的細胞死]](accidental cell death:ACD)」と呼ぶ。かつてネクローシスと呼ばれたもののうち事故的に生じたものが含まれる。一方、細胞内の遺伝的にコードされた分子機構が発動する細胞死は、「[[制御された細胞死]](regulated cell death:RCD)」と呼ぶ。制御された細胞死には、アポトーシス、[[制御されたネクローシス]]、[[オートファジー細胞死]]、等がある。制御されたネクローシスはさらに複数の細胞死に分類されつつある。 | ||
多種多様な細胞死が見つかる一方、その命名は各研究者が独自に行なってきたため、細胞死の名称や定義が混乱している。これを受けて、オートファジー細胞死の例で見られるように、細胞死の定義と命名に関して整理を行なうべきとの提言が細胞死研究者のコミュニティから出されている<ref name=ref3 /> <ref name=ref22><pubmed>25236395</pubmed></ref>。今後の分子機構の解明次第で、パイロトーシスやフェロプトーシスなどの新しい細胞死に関しては、名称や定義が変化する可能性もあり、注意が必要である。 | |||
英語での発音についても、-ptosisの冒頭のpを発音するか否かは見解がわかれる。ApoptosisとPyroptosisについては、それぞれ命名者であるKerrらとCoocksonらが提唱した際に-ptosisのpは無声であるとしている<ref><pubmed>15784530</pubmed></ref>。これに従い、本稿では日本語でのカタカナ表記もアポトーシスとパイロトーシスとする。しかし実際の会話では、Apoptosisのpを-ptosisの由来のギリシャ語発音(πτῶσις)にならい発音する外国人が非常に多い。そこで本項では、発音の仕方が明確に記述されていないNecroptosis、Ferroptosisについては、pを発音するカタカナ表記である「ネクロプトーシス」「フェロプトーシス」を採用している<ref>[http://dimb.w3.kanazawa-u.ac.jp/essay/カタカナ標記.htm カタカナ標記について(金沢大学須田貴司教授による解説)]</ref>。 | |||
==アポトーシス== | ==アポトーシス== | ||
1972年、Kerr、Wyllie、Currieは、生理的条件下でおこる細胞死には[[細胞壊死]](necrosis)とは異なる、[[wikipedia:ja:細胞小器官|細胞小器官]]が正常な形態を保ちつつ、核の染色体が凝縮し、細胞全体が萎縮、断片化する死細胞があることを見いだした。そしてこの細胞死を、葉が木から落ちることを意味するギリシャ語から、アポトーシス(apoptosis)と命名した<ref name=ref1 />。 | |||
アポトーシス細胞は、組織切片上では[[ピクノーシス]](pyknosis)と呼ばれる細胞の縮小と[[クロマチン]]の凝縮、断片化を特徴とする。さらにアポトーシスが進行すると、細胞に大小の膜で囲まれたくびれが生じて(blebbing)、細胞は球状の小体([[アポトーシス小体]]: apoptotic body)に分かれて断片化する。このように、アポトーシスは元来形態学的分類から定義された言葉である。 | |||
一方、アポトーシスはその実行に能動的な遺伝子プログラム(後述)が関与するため、しばしば「プログラム細胞死(Programmed Cell Death:PCD)」と同一視されることがある。しかし、「プログラム細胞死」とは、正常発生で発生プログラム依存的に生じる細胞死のことを指した用語であり、アポトーシスとプログラム細胞死を同じ意味で用いるのは混同であり正しくない<ref name=ref2 />。こうした誤用を避けるためにも、細胞内在の遺伝子プログラムを用いる細胞死を「制御された細胞死(RCD)」と呼ぶことが提唱されている<ref name=ref3><pubmed>21760595</pubmed></ref>。 | |||
アポトーシスは、タンパク質すなわち遺伝子産物の制御による能動的な細胞死である。[[wikipedia:ja:ロバート・ホロビッツ|Horvitz]]らの[[線虫]]を用いた遺伝学的な研究によって、プログラム細胞死に影響のある変異体、中でも、全ての細胞死実行が抑制される[[ced-3]]、[[ced-4]]変異体や、これらの遺伝子の作用を抑制する変異体[[ced-9]]等が得られた<ref name=ref4><pubmed>838129</pubmed></ref> <ref name=ref5><pubmed>1560823</pubmed></ref>。CED-3は[[カスパーゼ]] (caspase)、CED-4はカスパーゼ活性化に働く[[アダプタータンパク質]][[Apaf-1]] (apoptotic protease activating factor-1)、CED-9はアポトーシス抑制活性を有する[[wikipedia:ja:がん遺伝子|がん遺伝子]][[bcl-2]]に相当する。 | |||
アポトーシス刺激を受けた細胞では、カスパーゼの活性化、[[ミトコンドリア]]膜の透過性増大・膜電位低下、細胞膜の[[フォスファチジルセリン]](phosphatidylserine: PS)の細胞表面への露出、クロマチンの切断が見られる<ref name=ref6><pubmed>9422506</pubmed></ref>。これらはアポトーシス細胞で一般的に観察されるため、アポトーシスのよいマーカーとして用いられる。しかし、これら変化は生理的な変化や[[細胞分化]]に伴って引き起こされる場合や、アポトーシス以外の原因で生じることもあるため、一部のマーカー変化だけでアポトーシスと断定できない点に留意が必要である。 | |||
アポトーシスの活性化経路としては、主に[[外因性経路|外因性(デスレセプター)経路]]と[[内因性経路|内因性(ミトコンドリア)経路]]が知られる。 | |||
*'''外因性経路'''では、[[TNF]]や[[Fasリガンド]]といった[[細胞死誘導因子]]が細胞に作用するとアポトーシスが誘導される。これら細胞死誘導因子が受容体に結合すると受容体直下には[[DISC]] ([[Death Inducing Signaling Complex]])と呼ばれる複合体が形成され、[[カスパーゼ8]]が活性化される。そして次に[[カスパーゼ3]]が活性化しアポトーシスが実行される。この他に活性化したカスパーゼ8がBH3-onlyファミリー [[Bid]]を切断し、切断された Bid (tBid)がミトコンドリアの[[Bax]]、[[Bak]]を凝集させて[[シトクロムc]]のミトコンドリアからの放出を促しApaf-1/[[カスパーゼ9]]/カスパーゼ3経路(ミトコンドリア経路)を活性化する経路が働く細胞もある。 | |||
*'''内因性経路'''では、ミトコンドリア[[膜電位]]低下が活性化の引き金となる。アポトーシスシグナルを受けた[[ほ乳類]]細胞では、種々のBH3 onlyタンパク質が発現誘導あるいは[[翻訳後修飾]]を受けてBcl−2ファミリータンパク質に作用し、ミトコンドリア膜電位低下およびシトクロムcの放出を促進する。放出されたシトクロムcは、アダプター分子Apaf-1に結合してApaf-1の多量体化がおこる。カスパーゼ9がアダプター分子Apaf-1によって多量体化され活性化されることで細胞死実行にいたるカスパーゼ分解カスケードが開始される。線虫のCED-4はApaf-1とホモロジーを持つ分子であるがシトクロムcを結合する[[WD40リピート]]を欠いている。線虫では通常はミトコンドリアにあるCED-9 (Bcl-2ファミリー分子)にCED-4が結合しているが、死に行く細胞でBH3 onlyタンパク質である[[Egl-1]]が発現するとCED-4と置き換わる。そして細胞質に移動したCED-4がCED-3と結合し、CED-3の多量体化を促進することで活性化する。 | |||
==制御されたネクローシス== | ==制御されたネクローシス== | ||
これまでは単なる事故的な細胞死とみなされてきた、細胞膜の破綻と内容物の流出を伴うネクローシスの中にも、遺伝子産物により異なる制御を受ける「制御されたネクローシス」(regulated necrosis)があることが近年明らかとなってきた。以下、制御されたネクローシスのうち、現在までに[[脳神経]]系で生じることが示されている、[[ネクロプトーシス]](necroptosis)、[[パイロトーシス]](pyroptosis)、[[フェロプトーシス]](ferroptosis)について解説する。注)命名に関して[[細胞死#細胞死とは|細胞死とは]]を参照 | |||
===ネクロプトーシス=== | ===ネクロプトーシス=== | ||
ネクロプトーシス(necroptosis)は、最もよく研究されている制御されたネクローシスである<ref name=ref7><pubmed>18408713</pubmed></ref> <ref name=ref8><pubmed>19109899</pubmed></ref>。ある種の細胞では[[TNFα]]刺激による外因性アポトーシス経路が阻害された場合にはネクローシス様の細胞死が代償的に生じるが、2005年にJunying Yuanらのグループがその阻害剤を同定し、[[Necrostatin-1|Necrostatin (Nec)-1]]と命名した<ref name=ref9><pubmed>16408008</pubmed></ref>。さらに [[Nec-1]]の標的因子のひとつとして[[receptor interacting protein kinase-1]]([[RIPK1]])と呼ばれる[[セリンスレオニンキナーゼ]]を同定したのを端緒に、その分子機構の解明に飛躍的な進歩がもたらされた<ref name=ref7 /> <ref name=ref8 />。ネクロプトーシスの実行には、RIPK1と相同性を有する[[RIPK3]]と呼ばれるキナーゼとその基質である[[mixed lineage kinase like]]([[MLKL]])が必須であるとされる<ref name=ref10><pubmed>25592536</pubmed></ref>。ネクロプトーシスに関与すると考えられてきたRIPK1は、ネクロプトーシスを促進する場合と抑制する場合があることが、最近の組織特異的なRIPK1[[遺伝子欠損マウス]]の解析から明らかになった。ネクロプトーシス実行時には、RIPK1、RIPK3、MLKLを含むNecrosomeと呼ばれるタンパク質複合体が形成される。多量体化し[[リン酸化]]により活性化したRIPK3はMLKLをリン酸化し、リン酸化MLKLは細胞膜上で膜孔を形成または細胞膜への[[イオンチャネル]]の配向を介して細胞膜の破裂を引き起こすというモデルが提唱されている<ref name=ref10><pubmed>25592536</pubmed></ref>。神経系では、虚血再灌流傷害時やALS(amyotrophic lateral sclerosis)等の病態に関与することが示唆されている<ref name=ref9><pubmed>16408008</pubmed></ref> <ref name=ref30><pubmed>24508385</pubmed></ref> <ref name=ref31><pubmed>25160988</pubmed></ref>。 | |||
ネクロプトーシス実行はさまざまな経路を介して生じるが、アポトーシスの制御と密接な関連を持つ。外因性アポトーシス経路活性化刺激が入った際に、カスパーゼ8と[[FADD]]が存在すればアポトーシスが実行される。活性化されたカスパーゼ8はRIPK1、RIPK3、[[CYLD]]などのネクロプトーシス誘導に関与する分子を切断、不活性化することでネクロプトーシス誘導をブロックしていると考えられる。逆にカスパーゼ8活性が化合物や[[wikipedia:ja:ウイルス|ウイルス]]由来の阻害タンパク質あるいは遺伝的欠損により失われた場合、ネクロプトーシスが実行される。同様に、[[wikipedia:ja:自然免疫経路|自然免疫経路]]である[[Toll-like receptor4|Toll-like receptor(TLR)4]]や[[TLR3]]によってもRIPK3-MLKL依存的なネクロプトーシスが生じる場合があり、パイロトーシスとのクロストークも示唆される。このように、ネクロプトーシス実行は細胞種・状況依存度が高いといえる<ref name=ref10 />。 | |||
===パイロトーシス=== | ===パイロトーシス=== | ||
[[細菌]] | [[wikipedia:ja:細菌|細菌]]などに感染した[[wikipedia:ja:マクロファージ|マクロファージ]]は、しばしば[[カスパーゼ1]]依存的 で[[インターロイキン1β]]([[IL-1β]])などの産生を伴うネクローシス様の細胞死を起こす。Cooksonら は、そのような細胞死をパイロトーシス(pyroptosis)と呼ぶことを提唱した<ref name=ref11><pubmed>11303500</pubmed></ref> <ref name=ref12><pubmed>19148178</pubmed></ref> 。パイロトーシスの特徴は当初、 | ||
# | #カスパーゼ1依存的であること | ||
#速やかな細胞の膨潤・破裂・細胞膜バリア機能の喪失を伴うこと | #速やかな細胞の膨潤・破裂・細胞膜バリア機能の喪失を伴うこと | ||
# | #[[wikipedia:ja:染色体|染色体]]の部分的断片化([[wikipedia:TUNEL assay|TUNEL]]陽性)が生じるがアポトーシスほど核の凝集も生じず[[カスパーゼ3]]活性化も生じないこと | ||
等が挙げられている<ref name=ref13><pubmed></pubmed></ref> | 等が挙げられている<ref name=ref13><pubmed>11029008</pubmed></ref>。その後、カスパーゼ1の活性化は[[インフラマソーム]]と呼ばれるタンパク質複合体を介して生じることや、刺激の種類によってはカスパーゼ1と類似の構造を持つカスパーゼ11がパイロトーシス様の細胞死を引き起こすこと、さらにカスパーゼ1活性非依存的なパイロトーシス様の細胞死が存在することも明らかとなった。パイロトーシスにこれらパイロトーシス様の細胞死まで含むべきか否か、その定義は未だ確定していない。あまりに細かい分類や名称の定義はかえって混乱を呼ぶ可能性もある。現状では、上記2、3の形態変化を示し、カスパーゼ1と類似の構造を持つ[[カスパーゼ4]]/[[カスパーゼ5|5]]/[[カスパーゼ11|11]]依存的な細胞死や、カスパーゼ1依存的ではないがその活性化を伴う細胞死を、広い意味でパイロトーシスとみなす考えもある<ref name=ref14><pubmed>25879289</pubmed></ref>。パイロトーシスは感染応答を示す免疫系細胞で研究が進んでいるが、神経細胞が示すカスパーゼ1依存的細胞死もパイロトーシスとみなせるとの報告がある<ref name=ref15><pubmed>24398937</pubmed></ref>。 | ||
===フェロプトーシス=== | ===フェロプトーシス=== | ||
フェロプトーシス( | フェロプトーシス(ferroptosis)は、[[Ras|RAS]]変異型がん選択的[[wikipedia:ja:抗がん剤|抗がん剤]]である[[wikipedia:ja:エラスチン|erastin]]により誘導される非アポトーシス性細胞死として報告され、[[wikipedia:ja:脂質|脂質]]の[[wikipedia:ja:過酸化|過酸化]]および[[wikipedia:ja:鉄|鉄]]イオン要求性を特徴とする<ref name=ref16><pubmed>22632970</pubmed></ref>。フェロプトーシスは、[[p53]]依存的な癌細胞の細胞死、[[グルタミン酸]][[興奮毒性]]神経細胞死、[[虚血]]再灌流時の細胞死において生じ、その阻害によりこれら細胞死を止めうるとの報告がある<ref name=ref16 /> <ref name=ref17><pubmed>25402683</pubmed></ref> <ref name=ref18><pubmed>25799988</pubmed></ref>。 | ||
==オートファジー細胞死== | ==オートファジー細胞死== | ||
細胞死実行過程でオートファジーが誘導され、かつオートファジーの実行が細胞死に必須な細胞死のことを指す<ref name=ref3 />。実際に[[ショウジョウバエ]]の[[wikipedia:ja:変態|変態]]時に[[wikipedia:ja:中腸|中腸]][[wikipedia:ja:上皮細胞|上皮細胞]]において生じることが遺伝学的・形態学的観察により示されている<ref name=ref19><pubmed>18083103</pubmed></ref> <ref name=ref20><pubmed>19818615</pubmed></ref>。歴史的には、「オートファジー細胞死」(autophagic cell death)という名称は、単に「形態学的にオートファジーを伴った細胞死」という意味であった<ref name=ref21><pubmed>2186664</pubmed></ref>。実際、死にかけ細胞で見られるオートファジーは細胞死実行のため誘導されたのではなく、何らかの[[ストレス]]に対する生存のための適応である場合も多い。しかし、「オートファジー細胞死」という名称はオートファジーが細胞死に必須であるという印象を与え、適応の結果としてオートファジーを伴っただけの細胞死を「オートファジー細胞死」と呼ぶのは、分子機構の理解のうえでも名称のうえでも混乱を招く原因となる。そこで、現在では、オートファジーの必要性を含有した細胞死にのみこの名称を適用するべきだと考え方が一般的となっている<ref name=ref3 />。オートファジーが細胞死実行に関与する例は先のショウジョウバエの例で観察されており、アポトーシス機構が破綻しているときの代償機構など、ある状況下・細胞種では確かに生じる機構といえる。 | |||
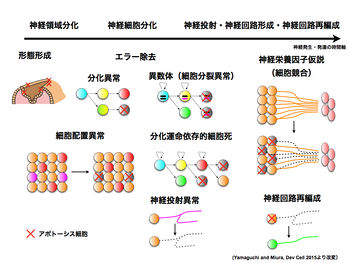
== | ==神経系における細胞死の役割== | ||
[[image:細胞死.jpg|thumb|350px|'''図.神経系における細胞死の役割''']] | |||
神経系発生過程ではアポトーシスが大量に生じることが知られており、その生理機能についても研究が比較的進んでいる(図)<ref name=ref2 />。 | |||
===形態形成=== | ===形態形成=== | ||
上皮組織においてアポトーシスによって細胞が死ぬ際には、周辺細胞との上皮バリア構造を保ったまま死に至ることができる。ネクローシスではこのようなバリア構造の保持ができないと考えられている。アポトーシスの際には、自身の上皮層からの脱落も促進するために隣接する細胞の頭頂部収縮を促す。こうして生じる張力が上皮組織の形態形成(morphogenesis)を促進することがショウジョウバエ胚背側閉鎖や[[wikipedia:ja:成虫原基|成虫原基]]で示されている<ref name=ref23><pubmed>25607361</pubmed></ref> <ref name=ref24><pubmed>18802000</pubmed></ref>。神経系発生過程では、アポトーシスを多量に伴う形態形成運動である[[神経管閉鎖]]への関与が哺乳類および[[鳥類]]で示唆されている<ref name=ref25><pubmed>22162136</pubmed></ref>。 | |||
===細胞競合=== | ===細胞競合=== | ||
細胞競合(cell | 細胞競合(cell competition)とは[[栄養因子]]の受容や増殖性に劣る細胞集団(敗者)が正常細胞集団(勝者)と接した場合、敗者の細胞がアポトーシスを起こして失われる現象である。ショウジョウバエ成虫原基などの上皮組織や、哺乳類初期胚や[[wikipedia:ja:心筋|心筋]]などでは増殖性に劣る細胞集団が排除されるとの報告がある<ref name=ref26><pubmed>19855017</pubmed></ref> <ref name=ref27><pubmed>25199831</pubmed></ref> <ref name=ref28><pubmed>23842495</pubmed></ref>。こうした競合的な細胞間のふるまいは、適応度の高い細胞が集団中で生きのこる基本的なプロセスと考えられる。一方、神経系では、標的からの限られた量の栄養因子に対する競合で見られる「[[神経栄養因子仮説]]」が古くから知られる細胞競合の代表例であり、末梢神経系細胞と標的組織との間で神経接続が生じる際に多くみられる。神経栄養因子仮説における競合は非増殖性の神経細胞間での競合が主であり、増殖性に関して適応度の高い細胞の選択機構ではなく、神経細胞と標的組織との数の調節(マッチング)のための機構と考えられる<ref name=ref29><pubmed>16776578</pubmed></ref>。 | ||
===エラー除去=== | ===エラー除去=== | ||
| 60行目: | 70行目: | ||
===分化運命依存的細胞死によるサイズ制御=== | ===分化運命依存的細胞死によるサイズ制御=== | ||
ショウジョウバエ神経系での解析から、多様な神経細胞を生み出す[[神経幹細胞]] | ショウジョウバエ神経系での解析から、多様な神経細胞を生み出す[[神経幹細胞]]の性質は、分裂回数、ステージ依存的に変化し、ある特定の分化段階に到達した神経幹細胞や神経細胞はアポトーシスにより除去されることが明らかになっている。こうした分化運命依存的細胞死の制御機構の破綻は、神経細胞数の過剰増加や神経線維の配線異常につながる<ref name=ref2 />。 | ||
==アポトーシス以外の細胞死の役割== | |||
新しく見つかってきた制御された細胞死の、生理的状況下の神経系における機能はまだほとんど不明である。病理的状況下におけるアポトーシス以外の細胞死の関与は、いくつか報告がある。ネクロプトーシスの関与を示す報告としては、ネクロプトーシスの阻害剤Nec-1が脳虚血に伴う障害を軽減させるという報告<ref name=ref9><pubmed>16408008</pubmed></ref>や、ALS(amyotrophic lateral sclerosis)患者由来のアストロサイトと運動神経細胞との共培養系で見られる運動神経細胞の細胞死が、RIP1とMLKL依存的なネクロプトーシスであるとの報告<ref name=ref30><pubmed>24508385</pubmed></ref>等がある。一方、パイロトーシスは感染時の神経細胞死で生じてうるとされる<ref name=ref15><pubmed>24398937</pubmed></ref>。フェロプトーシスはその阻害剤がグルタミン酸による興奮毒性神経細胞死を止めうるとの報告<ref name=ref16><pubmed>22632970</pubmed></ref>がある。 | |||
== 関連項目 == | |||
* [[カスパーゼ]] | |||
* [[細胞系譜]] | |||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2015年7月17日 (金) 10:32時点における最新版
山口 良文、三浦 正幸
東京大学大学院薬学系研究科 遺伝学教室
DOI:10.14931/bsd.6091 原稿受付日:2015年7月7日 原稿完成日:2015年7月17日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:cell death 独:Zelltod 仏:mort cellulaire
細胞が何らかの理由により細胞膜や核などの破綻をきたし、修復不可能となった不可逆的状態が細胞死である。物理的損傷等により一瞬のうちに細胞構造が破壊されるのを「事故的細胞死」とよぶ。一方、細胞内の遺伝的にコードされた分子機構が発動する細胞死は、「制御された細胞死」と呼ぶ。制御された細胞死には、アポトーシス、制御されたネクローシス、オートファジー細胞死等がある。神経系発生過程ではアポトーシスが大量に生じる。例えば、発生中の上皮構造において周辺細胞との上皮バリア構造を保ったままアポトーシスが起こると同時に細胞の頭頂部収縮を促すため上皮組織の屈曲が起こる。このようなメカニズムが神経管閉鎖へ関与している。また限られた神経栄養因子を競合する細胞の間では負けた細胞のアポトーシスが起こり、神経細胞と標的組織との数の調節(マッチング)のための機構として働くと考えられる。
細胞死とは
細胞が何らかの理由により細胞膜や核などの破綻をきたし、修復不可能となった不可逆的状態が細胞死である。かつては、発生過程で観察されるプログラム細胞死の主要形態であるアポトーシス(apoptosis)と、それ以外のネクローシス(necrosis)とに細胞死を分類することもあった。しかし近年、多種多様な分子機構が細胞死に関与することが明らかとなり、細胞死を以下のように区別することが提唱されている[1] [2]。まず、強酸やアルカリ、熱、物理的損傷等の、外傷により一瞬のうちに細胞構造が破壊される細胞死は、「事故的細胞死(accidental cell death:ACD)」と呼ぶ。かつてネクローシスと呼ばれたもののうち事故的に生じたものが含まれる。一方、細胞内の遺伝的にコードされた分子機構が発動する細胞死は、「制御された細胞死(regulated cell death:RCD)」と呼ぶ。制御された細胞死には、アポトーシス、制御されたネクローシス、オートファジー細胞死、等がある。制御されたネクローシスはさらに複数の細胞死に分類されつつある。
多種多様な細胞死が見つかる一方、その命名は各研究者が独自に行なってきたため、細胞死の名称や定義が混乱している。これを受けて、オートファジー細胞死の例で見られるように、細胞死の定義と命名に関して整理を行なうべきとの提言が細胞死研究者のコミュニティから出されている[3] [4]。今後の分子機構の解明次第で、パイロトーシスやフェロプトーシスなどの新しい細胞死に関しては、名称や定義が変化する可能性もあり、注意が必要である。
英語での発音についても、-ptosisの冒頭のpを発音するか否かは見解がわかれる。ApoptosisとPyroptosisについては、それぞれ命名者であるKerrらとCoocksonらが提唱した際に-ptosisのpは無声であるとしている[5]。これに従い、本稿では日本語でのカタカナ表記もアポトーシスとパイロトーシスとする。しかし実際の会話では、Apoptosisのpを-ptosisの由来のギリシャ語発音(πτῶσις)にならい発音する外国人が非常に多い。そこで本項では、発音の仕方が明確に記述されていないNecroptosis、Ferroptosisについては、pを発音するカタカナ表記である「ネクロプトーシス」「フェロプトーシス」を採用している[6]。
アポトーシス
1972年、Kerr、Wyllie、Currieは、生理的条件下でおこる細胞死には細胞壊死(necrosis)とは異なる、細胞小器官が正常な形態を保ちつつ、核の染色体が凝縮し、細胞全体が萎縮、断片化する死細胞があることを見いだした。そしてこの細胞死を、葉が木から落ちることを意味するギリシャ語から、アポトーシス(apoptosis)と命名した[1]。
アポトーシス細胞は、組織切片上ではピクノーシス(pyknosis)と呼ばれる細胞の縮小とクロマチンの凝縮、断片化を特徴とする。さらにアポトーシスが進行すると、細胞に大小の膜で囲まれたくびれが生じて(blebbing)、細胞は球状の小体(アポトーシス小体: apoptotic body)に分かれて断片化する。このように、アポトーシスは元来形態学的分類から定義された言葉である。
一方、アポトーシスはその実行に能動的な遺伝子プログラム(後述)が関与するため、しばしば「プログラム細胞死(Programmed Cell Death:PCD)」と同一視されることがある。しかし、「プログラム細胞死」とは、正常発生で発生プログラム依存的に生じる細胞死のことを指した用語であり、アポトーシスとプログラム細胞死を同じ意味で用いるのは混同であり正しくない[2]。こうした誤用を避けるためにも、細胞内在の遺伝子プログラムを用いる細胞死を「制御された細胞死(RCD)」と呼ぶことが提唱されている[3]。
アポトーシスは、タンパク質すなわち遺伝子産物の制御による能動的な細胞死である。Horvitzらの線虫を用いた遺伝学的な研究によって、プログラム細胞死に影響のある変異体、中でも、全ての細胞死実行が抑制されるced-3、ced-4変異体や、これらの遺伝子の作用を抑制する変異体ced-9等が得られた[7] [8]。CED-3はカスパーゼ (caspase)、CED-4はカスパーゼ活性化に働くアダプタータンパク質Apaf-1 (apoptotic protease activating factor-1)、CED-9はアポトーシス抑制活性を有するがん遺伝子bcl-2に相当する。
アポトーシス刺激を受けた細胞では、カスパーゼの活性化、ミトコンドリア膜の透過性増大・膜電位低下、細胞膜のフォスファチジルセリン(phosphatidylserine: PS)の細胞表面への露出、クロマチンの切断が見られる[9]。これらはアポトーシス細胞で一般的に観察されるため、アポトーシスのよいマーカーとして用いられる。しかし、これら変化は生理的な変化や細胞分化に伴って引き起こされる場合や、アポトーシス以外の原因で生じることもあるため、一部のマーカー変化だけでアポトーシスと断定できない点に留意が必要である。
アポトーシスの活性化経路としては、主に外因性(デスレセプター)経路と内因性(ミトコンドリア)経路が知られる。
- 外因性経路では、TNFやFasリガンドといった細胞死誘導因子が細胞に作用するとアポトーシスが誘導される。これら細胞死誘導因子が受容体に結合すると受容体直下にはDISC (Death Inducing Signaling Complex)と呼ばれる複合体が形成され、カスパーゼ8が活性化される。そして次にカスパーゼ3が活性化しアポトーシスが実行される。この他に活性化したカスパーゼ8がBH3-onlyファミリー Bidを切断し、切断された Bid (tBid)がミトコンドリアのBax、Bakを凝集させてシトクロムcのミトコンドリアからの放出を促しApaf-1/カスパーゼ9/カスパーゼ3経路(ミトコンドリア経路)を活性化する経路が働く細胞もある。
- 内因性経路では、ミトコンドリア膜電位低下が活性化の引き金となる。アポトーシスシグナルを受けたほ乳類細胞では、種々のBH3 onlyタンパク質が発現誘導あるいは翻訳後修飾を受けてBcl−2ファミリータンパク質に作用し、ミトコンドリア膜電位低下およびシトクロムcの放出を促進する。放出されたシトクロムcは、アダプター分子Apaf-1に結合してApaf-1の多量体化がおこる。カスパーゼ9がアダプター分子Apaf-1によって多量体化され活性化されることで細胞死実行にいたるカスパーゼ分解カスケードが開始される。線虫のCED-4はApaf-1とホモロジーを持つ分子であるがシトクロムcを結合するWD40リピートを欠いている。線虫では通常はミトコンドリアにあるCED-9 (Bcl-2ファミリー分子)にCED-4が結合しているが、死に行く細胞でBH3 onlyタンパク質であるEgl-1が発現するとCED-4と置き換わる。そして細胞質に移動したCED-4がCED-3と結合し、CED-3の多量体化を促進することで活性化する。
制御されたネクローシス
これまでは単なる事故的な細胞死とみなされてきた、細胞膜の破綻と内容物の流出を伴うネクローシスの中にも、遺伝子産物により異なる制御を受ける「制御されたネクローシス」(regulated necrosis)があることが近年明らかとなってきた。以下、制御されたネクローシスのうち、現在までに脳神経系で生じることが示されている、ネクロプトーシス(necroptosis)、パイロトーシス(pyroptosis)、フェロプトーシス(ferroptosis)について解説する。注)命名に関して細胞死とはを参照
ネクロプトーシス
ネクロプトーシス(necroptosis)は、最もよく研究されている制御されたネクローシスである[10] [11]。ある種の細胞ではTNFα刺激による外因性アポトーシス経路が阻害された場合にはネクローシス様の細胞死が代償的に生じるが、2005年にJunying Yuanらのグループがその阻害剤を同定し、Necrostatin (Nec)-1と命名した[12]。さらに Nec-1の標的因子のひとつとしてreceptor interacting protein kinase-1(RIPK1)と呼ばれるセリンスレオニンキナーゼを同定したのを端緒に、その分子機構の解明に飛躍的な進歩がもたらされた[10] [11]。ネクロプトーシスの実行には、RIPK1と相同性を有するRIPK3と呼ばれるキナーゼとその基質であるmixed lineage kinase like(MLKL)が必須であるとされる[13]。ネクロプトーシスに関与すると考えられてきたRIPK1は、ネクロプトーシスを促進する場合と抑制する場合があることが、最近の組織特異的なRIPK1遺伝子欠損マウスの解析から明らかになった。ネクロプトーシス実行時には、RIPK1、RIPK3、MLKLを含むNecrosomeと呼ばれるタンパク質複合体が形成される。多量体化しリン酸化により活性化したRIPK3はMLKLをリン酸化し、リン酸化MLKLは細胞膜上で膜孔を形成または細胞膜へのイオンチャネルの配向を介して細胞膜の破裂を引き起こすというモデルが提唱されている[13]。神経系では、虚血再灌流傷害時やALS(amyotrophic lateral sclerosis)等の病態に関与することが示唆されている[12] [14] [15]。
ネクロプトーシス実行はさまざまな経路を介して生じるが、アポトーシスの制御と密接な関連を持つ。外因性アポトーシス経路活性化刺激が入った際に、カスパーゼ8とFADDが存在すればアポトーシスが実行される。活性化されたカスパーゼ8はRIPK1、RIPK3、CYLDなどのネクロプトーシス誘導に関与する分子を切断、不活性化することでネクロプトーシス誘導をブロックしていると考えられる。逆にカスパーゼ8活性が化合物やウイルス由来の阻害タンパク質あるいは遺伝的欠損により失われた場合、ネクロプトーシスが実行される。同様に、自然免疫経路であるToll-like receptor(TLR)4やTLR3によってもRIPK3-MLKL依存的なネクロプトーシスが生じる場合があり、パイロトーシスとのクロストークも示唆される。このように、ネクロプトーシス実行は細胞種・状況依存度が高いといえる[13]。
パイロトーシス
細菌などに感染したマクロファージは、しばしばカスパーゼ1依存的 でインターロイキン1β(IL-1β)などの産生を伴うネクローシス様の細胞死を起こす。Cooksonら は、そのような細胞死をパイロトーシス(pyroptosis)と呼ぶことを提唱した[16] [17] 。パイロトーシスの特徴は当初、
- カスパーゼ1依存的であること
- 速やかな細胞の膨潤・破裂・細胞膜バリア機能の喪失を伴うこと
- 染色体の部分的断片化(TUNEL陽性)が生じるがアポトーシスほど核の凝集も生じずカスパーゼ3活性化も生じないこと
等が挙げられている[18]。その後、カスパーゼ1の活性化はインフラマソームと呼ばれるタンパク質複合体を介して生じることや、刺激の種類によってはカスパーゼ1と類似の構造を持つカスパーゼ11がパイロトーシス様の細胞死を引き起こすこと、さらにカスパーゼ1活性非依存的なパイロトーシス様の細胞死が存在することも明らかとなった。パイロトーシスにこれらパイロトーシス様の細胞死まで含むべきか否か、その定義は未だ確定していない。あまりに細かい分類や名称の定義はかえって混乱を呼ぶ可能性もある。現状では、上記2、3の形態変化を示し、カスパーゼ1と類似の構造を持つカスパーゼ4/5/11依存的な細胞死や、カスパーゼ1依存的ではないがその活性化を伴う細胞死を、広い意味でパイロトーシスとみなす考えもある[19]。パイロトーシスは感染応答を示す免疫系細胞で研究が進んでいるが、神経細胞が示すカスパーゼ1依存的細胞死もパイロトーシスとみなせるとの報告がある[20]。
フェロプトーシス
フェロプトーシス(ferroptosis)は、RAS変異型がん選択的抗がん剤であるerastinにより誘導される非アポトーシス性細胞死として報告され、脂質の過酸化および鉄イオン要求性を特徴とする[21]。フェロプトーシスは、p53依存的な癌細胞の細胞死、グルタミン酸興奮毒性神経細胞死、虚血再灌流時の細胞死において生じ、その阻害によりこれら細胞死を止めうるとの報告がある[21] [22] [23]。
オートファジー細胞死
細胞死実行過程でオートファジーが誘導され、かつオートファジーの実行が細胞死に必須な細胞死のことを指す[3]。実際にショウジョウバエの変態時に中腸上皮細胞において生じることが遺伝学的・形態学的観察により示されている[24] [25]。歴史的には、「オートファジー細胞死」(autophagic cell death)という名称は、単に「形態学的にオートファジーを伴った細胞死」という意味であった[26]。実際、死にかけ細胞で見られるオートファジーは細胞死実行のため誘導されたのではなく、何らかのストレスに対する生存のための適応である場合も多い。しかし、「オートファジー細胞死」という名称はオートファジーが細胞死に必須であるという印象を与え、適応の結果としてオートファジーを伴っただけの細胞死を「オートファジー細胞死」と呼ぶのは、分子機構の理解のうえでも名称のうえでも混乱を招く原因となる。そこで、現在では、オートファジーの必要性を含有した細胞死にのみこの名称を適用するべきだと考え方が一般的となっている[3]。オートファジーが細胞死実行に関与する例は先のショウジョウバエの例で観察されており、アポトーシス機構が破綻しているときの代償機構など、ある状況下・細胞種では確かに生じる機構といえる。
神経系における細胞死の役割
神経系発生過程ではアポトーシスが大量に生じることが知られており、その生理機能についても研究が比較的進んでいる(図)[2]。
形態形成
上皮組織においてアポトーシスによって細胞が死ぬ際には、周辺細胞との上皮バリア構造を保ったまま死に至ることができる。ネクローシスではこのようなバリア構造の保持ができないと考えられている。アポトーシスの際には、自身の上皮層からの脱落も促進するために隣接する細胞の頭頂部収縮を促す。こうして生じる張力が上皮組織の形態形成(morphogenesis)を促進することがショウジョウバエ胚背側閉鎖や成虫原基で示されている[27] [28]。神経系発生過程では、アポトーシスを多量に伴う形態形成運動である神経管閉鎖への関与が哺乳類および鳥類で示唆されている[29]。
細胞競合
細胞競合(cell competition)とは栄養因子の受容や増殖性に劣る細胞集団(敗者)が正常細胞集団(勝者)と接した場合、敗者の細胞がアポトーシスを起こして失われる現象である。ショウジョウバエ成虫原基などの上皮組織や、哺乳類初期胚や心筋などでは増殖性に劣る細胞集団が排除されるとの報告がある[30] [31] [32]。こうした競合的な細胞間のふるまいは、適応度の高い細胞が集団中で生きのこる基本的なプロセスと考えられる。一方、神経系では、標的からの限られた量の栄養因子に対する競合で見られる「神経栄養因子仮説」が古くから知られる細胞競合の代表例であり、末梢神経系細胞と標的組織との間で神経接続が生じる際に多くみられる。神経栄養因子仮説における競合は非増殖性の神経細胞間での競合が主であり、増殖性に関して適応度の高い細胞の選択機構ではなく、神経細胞と標的組織との数の調節(マッチング)のための機構と考えられる[33]。
エラー除去
神経系の発生過程では、エラーをきたした細胞の除去の際にアポトーシスが活用されている。ここで言うエラーには、細胞内在性のエラー(異数体、DNA修復異常、分化異常)、および、細胞集団内で見た時のエラー(細胞配置異常、異なる標的へのミスターゲッティング)等が知られる[2]。
分化運命依存的細胞死によるサイズ制御
ショウジョウバエ神経系での解析から、多様な神経細胞を生み出す神経幹細胞の性質は、分裂回数、ステージ依存的に変化し、ある特定の分化段階に到達した神経幹細胞や神経細胞はアポトーシスにより除去されることが明らかになっている。こうした分化運命依存的細胞死の制御機構の破綻は、神経細胞数の過剰増加や神経線維の配線異常につながる[2]。
アポトーシス以外の細胞死の役割
新しく見つかってきた制御された細胞死の、生理的状況下の神経系における機能はまだほとんど不明である。病理的状況下におけるアポトーシス以外の細胞死の関与は、いくつか報告がある。ネクロプトーシスの関与を示す報告としては、ネクロプトーシスの阻害剤Nec-1が脳虚血に伴う障害を軽減させるという報告[12]や、ALS(amyotrophic lateral sclerosis)患者由来のアストロサイトと運動神経細胞との共培養系で見られる運動神経細胞の細胞死が、RIP1とMLKL依存的なネクロプトーシスであるとの報告[14]等がある。一方、パイロトーシスは感染時の神経細胞死で生じてうるとされる[20]。フェロプトーシスはその阻害剤がグルタミン酸による興奮毒性神経細胞死を止めうるとの報告[21]がある。
関連項目
参考文献
- ↑ 1.0 1.1
Kerr, J.F., Wyllie, A.H., & Currie, A.R. (1972).
Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British journal of cancer, 26(4), 239-57. [PubMed:4561027] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4
Yamaguchi, Y., & Miura, M. (2015).
Programmed cell death in neurodevelopment. Developmental cell, 32(4), 478-90. [PubMed:25710534] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3
Galluzzi, L., Vitale, I., Abrams, J.M., Alnemri, E.S., Baehrecke, E.H., Blagosklonny, M.V., ..., & Kroemer, G. (2012).
Molecular definitions of cell death subroutines: recommendations of the Nomenclature Committee on Cell Death 2012. Cell death and differentiation, 19(1), 107-20. [PubMed:21760595] [PMC] [WorldCat] [DOI] - ↑
Galluzzi, L., Bravo-San Pedro, J.M., Vitale, I., Aaronson, S.A., Abrams, J.M., Adam, D., ..., & Kroemer, G. (2015).
Essential versus accessory aspects of cell death: recommendations of the NCCD 2015. Cell death and differentiation, 22(1), 58-73. [PubMed:25236395] [PMC] [WorldCat] [DOI] - ↑
Fink, S.L., & Cookson, B.T. (2005).
Apoptosis, pyroptosis, and necrosis: mechanistic description of dead and dying eukaryotic cells. Infection and immunity, 73(4), 1907-16. [PubMed:15784530] [PMC] [WorldCat] [DOI] - ↑ カタカナ標記について(金沢大学須田貴司教授による解説)
- ↑
Sulston, J.E., & Horvitz, H.R. (1977).
Post-embryonic cell lineages of the nematode, Caenorhabditis elegans. Developmental biology, 56(1), 110-56. [PubMed:838129] [WorldCat] [DOI] - ↑
Hengartner, M.O., Ellis, R.E., & Horvitz, H.R. (1992).
Caenorhabditis elegans gene ced-9 protects cells from programmed cell death. Nature, 356(6369), 494-9. [PubMed:1560823] [WorldCat] [DOI] - ↑
Enari, M., Sakahira, H., Yokoyama, H., Okawa, K., Iwamatsu, A., & Nagata, S. (1998).
A caspase-activated DNase that degrades DNA during apoptosis, and its inhibitor ICAD. Nature, 391(6662), 43-50. [PubMed:9422506] [WorldCat] [DOI] - ↑ 10.0 10.1
Degterev, A., Hitomi, J., Germscheid, M., Ch'en, I.L., Korkina, O., Teng, X., ..., & Yuan, J. (2008).
Identification of RIP1 kinase as a specific cellular target of necrostatins. Nature chemical biology, 4(5), 313-21. [PubMed:18408713] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Hitomi, J., Christofferson, D.E., Ng, A., Yao, J., Degterev, A., Xavier, R.J., & Yuan, J. (2008).
Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway. Cell, 135(7), 1311-23. [PubMed:19109899] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Degterev, A., Huang, Z., Boyce, M., Li, Y., Jagtap, P., Mizushima, N., ..., & Yuan, J. (2005).
Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury. Nature chemical biology, 1(2), 112-9. [PubMed:16408008] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Pasparakis, M., & Vandenabeele, P. (2015).
Necroptosis and its role in inflammation. Nature, 517(7534), 311-20. [PubMed:25592536] [WorldCat] [DOI] - ↑ 14.0 14.1
Re, D.B., Le Verche, V., Yu, C., Amoroso, M.W., Politi, K.A., Phani, S., ..., & Przedborski, S. (2014).
Necroptosis drives motor neuron death in models of both sporadic and familial ALS. Neuron, 81(5), 1001-1008. [PubMed:24508385] [PMC] [WorldCat] [DOI] - ↑
Jouan-Lanhouet, S., Riquet, F., Duprez, L., Vanden Berghe, T., Takahashi, N., & Vandenabeele, P. (2014).
Necroptosis, in vivo detection in experimental disease models. Seminars in cell & developmental biology, 35, 2-13. [PubMed:25160988] [WorldCat] [DOI] - ↑
Cookson, B.T., & Brennan, M.A. (2001).
Pro-inflammatory programmed cell death. Trends in microbiology, 9(3), 113-4. [PubMed:11303500] [WorldCat] [DOI] - ↑
Bergsbaken, T., Fink, S.L., & Cookson, B.T. (2009).
Pyroptosis: host cell death and inflammation. Nature reviews. Microbiology, 7(2), 99-109. [PubMed:19148178] [PMC] [WorldCat] [DOI] - ↑
Pinson, K.I., Brennan, J., Monkley, S., Avery, B.J., & Skarnes, W.C. (2000).
An LDL-receptor-related protein mediates Wnt signalling in mice. Nature, 407(6803), 535-8. [PubMed:11029008] [WorldCat] [DOI] - ↑
Jorgensen, I., & Miao, E.A. (2015).
Pyroptotic cell death defends against intracellular pathogens. Immunological reviews, 265(1), 130-42. [PubMed:25879289] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1
Adamczak, S.E., de Rivero Vaccari, J.P., Dale, G., Brand, F.J., Nonner, D., Bullock, M.R., ..., & Keane, R.W. (2014).
Pyroptotic neuronal cell death mediated by the AIM2 inflammasome. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 34(4), 621-9. [PubMed:24398937] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2
Dixon, S.J., Lemberg, K.M., Lamprecht, M.R., Skouta, R., Zaitsev, E.M., Gleason, C.E., ..., & Stockwell, B.R. (2012).
Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 149(5), 1060-72. [PubMed:22632970] [PMC] [WorldCat] [DOI] - ↑
Friedmann Angeli, J.P., Schneider, M., Proneth, B., Tyurina, Y.Y., Tyurin, V.A., Hammond, V.J., ..., & Conrad, M. (2014).
Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice. Nature cell biology, 16(12), 1180-91. [PubMed:25402683] [PMC] [WorldCat] [DOI] - ↑
Jiang, L., Kon, N., Li, T., Wang, S.J., Su, T., Hibshoosh, H., ..., & Gu, W. (2015).
Ferroptosis as a p53-mediated activity during tumour suppression. Nature, 520(7545), 57-62. [PubMed:25799988] [PMC] [WorldCat] [DOI] - ↑
Berry, D.L., & Baehrecke, E.H. (2007).
Growth arrest and autophagy are required for salivary gland cell degradation in Drosophila. Cell, 131(6), 1137-48. [PubMed:18083103] [PMC] [WorldCat] [DOI] - ↑
Denton, D., Shravage, B., Simin, R., Mills, K., Berry, D.L., Baehrecke, E.H., & Kumar, S. (2009).
Autophagy, not apoptosis, is essential for midgut cell death in Drosophila. Current biology : CB, 19(20), 1741-6. [PubMed:19818615] [PMC] [WorldCat] [DOI] - ↑
Clarke, P.G. (1990).
Developmental cell death: morphological diversity and multiple mechanisms. Anatomy and embryology, 181(3), 195-213. [PubMed:2186664] [WorldCat] [DOI] - ↑
Monier, B., Gettings, M., Gay, G., Mangeat, T., Schott, S., Guarner, A., & Suzanne, M. (2015).
Apico-basal forces exerted by apoptotic cells drive epithelium folding. Nature, 518(7538), 245-8. [PubMed:25607361] [WorldCat] [DOI] - ↑
Toyama, Y., Peralta, X.G., Wells, A.R., Kiehart, D.P., & Edwards, G.S. (2008).
Apoptotic force and tissue dynamics during Drosophila embryogenesis. Science (New York, N.Y.), 321(5896), 1683-6. [PubMed:18802000] [PMC] [WorldCat] [DOI] - ↑
Yamaguchi, Y., Shinotsuka, N., Nonomura, K., Takemoto, K., Kuida, K., Yosida, H., & Miura, M. (2011).
Live imaging of apoptosis in a novel transgenic mouse highlights its role in neural tube closure. The Journal of cell biology, 195(6), 1047-60. [PubMed:22162136] [PMC] [WorldCat] [DOI] - ↑
Martín, F.A., Herrera, S.C., & Morata, G. (2009).
Cell competition, growth and size control in the Drosophila wing imaginal disc. Development (Cambridge, England), 136(22), 3747-56. [PubMed:19855017] [WorldCat] [DOI] - ↑
Villa Del Campo, C., Clavería, C., Sierra, R., & Torres, M. (2014).
Cell competition promotes phenotypically silent cardiomyocyte replacement in the mammalian heart. Cell reports, 8(6), 1741-1751. [PubMed:25199831] [WorldCat] [DOI] - ↑
Clavería, C., Giovinazzo, G., Sierra, R., & Torres, M. (2013).
Myc-driven endogenous cell competition in the early mammalian embryo. Nature, 500(7460), 39-44. [PubMed:23842495] [WorldCat] [DOI] - ↑
Buss, R.R., Sun, W., & Oppenheim, R.W. (2006).
Adaptive roles of programmed cell death during nervous system development. Annual review of neuroscience, 29, 1-35. [PubMed:16776578] [WorldCat] [DOI]