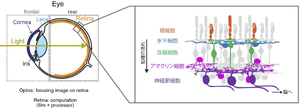
網膜
松本彰弘、米原 圭祐
国立遺伝学研究所 遺伝形質研究系
DOI:10.14931/bsd.10516 原稿受付日:2023年9月27日 原稿完成日:2023年10月6日
担当編集委員:渡辺 雅彦 (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)
外界の光は、眼球の光学系を介し網膜に結像する。網膜は視覚系の感覚器官であり、多種多様な神経細胞が精緻な神経回路を形成する神経組織である。網膜の機能的な真価は、カメラフィルムのように単に光の配列情報を撮像・保持するのではなく、情報を環境あるいは生態学的なニッチに応じて処理、圧縮する演算にある。網膜は、情報を脳へと”垂れ流し”にするのではなく、顕著性や重要性に応じてフィルタリングしながら、それらを適切な脳部位へと振り分けている。
網膜とは
視覚系の感覚器官である網膜は、眼球の壁に張り付いたシート状の組織である。眼球に入った光は、角膜や水晶体などの光学系を経て網膜に結像する(図1)。網膜は光を感受し、中枢の神経系が読み取ることのできる電気的な神経信号へと変換する。内部の神経回路の働きによって視野のなかの顕著な特徴を抽出、符号化し、それらを並列に脳へと伝送する。
発達
脊椎動物では、発生段階初期において、間脳に由来する神経外胚葉が陥入して窪み状の神経管が形成される(眼小窩、optic pit)。この窪みがやがてふくらんだ胞状(眼胞、optic vesicle)となり、外側の外胚葉に触れると、さらに陥入を起こし、眼杯(optic cup)を形成する。分化が進むと、眼杯の窪みの部分(眼杯内板)が感覚神経細胞を含む網膜となり、外側(眼杯外板)はメラニン色素を含む色素上皮層となる。つまり、網膜は間脳の一部が突出して形成される組織であり、中枢神経系の一部である。
組織構築
網膜は組織学的に異なる10層からなる。眼底側を外層、眼球中心側を内層とし、外層側から網膜色素上皮層、視細胞層(桿体・錐体層)、外境界膜層、外顆粒層、外網状層、内顆粒層、内網状層、神経節細胞層、視神経線維層、内境界膜層と定義される。
多くの脊椎動物の網膜はその基本設計を共有している。すなわち、光を受容する視細胞、介在神経細胞である水平細胞、双極細胞、アマクリン細胞、そして脳への出力を行う神経節細胞という「五つのクラスの神経細胞」及びミュラー細胞という「グリア細胞」が存在し、「三つの細胞体層」と「二つのシナプス層」が交互に配置される、という組織学的構造である[1][2]。Ramón y Cajalは、ゴルジ染色した細胞プロセスの詳細な観察から、内網状層が組織学的に複数の亜層に分かれることを示唆した。後に、内網状層の亜層は機能的にも異なっており、遠位側(亜層a;視細胞層側)は明るさの減少(オフ)を、近位側(亜層b;神経節細胞層側)は明るさの増加(オン)を処理する経路にわかれることが同定された[3]。
それぞれの細胞クラスには、遺伝学的、形態学的、生理学的に異なるサブタイプが存在しており、とりわけ網膜内層では亜層の異なる位置に双極細胞、アマクリン細胞、神経節細胞のサブタイプが分岐し、亜層内での処理に機能的な特異性を与えている[4]。
細胞
視細胞
視細胞は、網膜における入力細胞であり、光を感知し、神経伝達物質を介して介在神経細胞である双極細胞と水平細胞へ情報を伝達する。視細胞で感受された光信号は、細胞内の生化学過程を経て、電気的な神経信号へと変換される(光電位変換)。視細胞は、暗いときに正に分極(脱分極)しており、外網状層に神経伝達物質であるグルタミン酸を放出している。光に反応して過分極し、そのグルタミン酸放出を止める。つまり、視覚系の感覚刺激である光刺激は、感覚反応として抑制を生じさせ、伝達物質の停止によってシナプス後細胞へと情報を伝える。
種類
視細胞には、錐体と桿体の二つの種類が存在する。外節部の形状が異なり、錐体は「円錐状」、桿体は「棒状」になっている。桿体は、錐体と比較して光に対する感度が高く、より暗い視環境(薄明視)で動作する。錐体は、桿体より感度は低いが、より明るい視環境(昼間視)でも飽和せずに動作することができる。霊長類や鳥類など中心窩をもつ動物の網膜では、錐体が中心窩近傍に凝集し、桿体が周辺に分布する。
視物質
錐体の視物質には波長の吸収スペクトルの相違による種類が存在する。ヒトでは3つの種類が存在し、それぞれが短波長(Short-wavelength、青色)型、中波長(Middle-wavelength、緑色)型、長波長(Long-wavelength、赤色)型である。進化系統学的にはヒトの赤色型と緑色型はともに長波長型に属し、ヌクレオチド配列の98 %が相同しており[5]、吸収波長極大の違いもわずか(~30 nm)である。
桿体の視物質はロドプシンと呼ばれる。ロドプシンはおよそ500 nmに極大吸収波長をもつ。桿体視物質にはロドプシン一種類しか存在しないため、薄暗い視環境では色覚が機能しにくい。例えば、薄明視のとき、「強度が弱いが吸光度の高い緑色(波長500 nm)の光」と「強度が強いが吸光度の低い赤色(600 nm)の光」とで、ロドプシンの光子吸収効率がほとんど同じになってしまうため弁別することができない。
シナプス構造
視細胞の軸索終末部は窪んでおり、その窪みに双極細胞や水平細胞の神経突起が入り込んだ三つ組み構造をとる(図2)。放出準備にあるシナプス小胞は、シナプスリボンとよばれる板状構造によって放出部位に繋留されており、膜興奮に応じた素早く大量の伝達物質の放出を可能にしている[6]。
水平細胞
水平細胞は、GABA作動性の介在神経細胞で、細胞体は内顆粒層の外層側に位置し、樹状突起は外網状層に分岐する。視細胞からの入力を受け、その入力強度に応じて視細胞をフィードバック抑制、あるいは双極細胞をフィードフォワード抑制することで、視細胞-双極細胞間のシナプス伝達を修飾する[7]。水平細胞同士は樹状突起に発現するギャップ結合を介して電気的に結合するため、受容野はそれぞれの樹状突起の広がり(30~200 µm)よりもはるかに大きく(数mmに及ぶ)、双極細胞受容野での周辺抑制の形成や背景光へのコントラスト順応に寄与するとされる。また、こうした水平細胞による網膜外層での修飾は、神経節細胞での視覚応答特性やゲイン制御など様々に影響する[8][9]。
種類
水平細胞の種類については動物種間差があり[10]、種類ごとの機能的な違いについてもはっきりと分かっていない。ネコなどの水平細胞には有軸索と無軸索の二つの種類が存在する。有軸索の水平細胞では、樹状突起は錐体終末へ、軸索は桿体終末へ接続する[11]。げっ歯類の網膜を調べた研究では、モルモットでは有軸索/無軸索の二種類が、ラットやマウスでは一種類のみが確認されている[10]。
魚類やカメの網膜には、波長感度の異なる水平細胞タイプが存在する。Tomita [12]は、コイ網膜の水平細胞に、赤色(~650 nm)で応答感度が最大になるH1型、青から緑色(450-500 nm)で過分極し、かつ補色の赤色で脱分極するH2型、青色と赤色で過分極し、かつ補色の緑色で脱分極するH3型が存在することを報告している。これらの波長感度は、接続する錐体の種類と水平細胞からの側抑制によって形成されると考えられる[13]。
双極細胞
双極細胞は、グルタミン酸作動性の介在神経細胞であり、細胞体は網膜の中間層(内顆粒層)に位置し、樹状突起が外網状層側へ、軸索終末が内網状層側へと両極(bipolar)に伸びる形態学的特徴をもつ。視細胞から入力を受け、緩電位応答によってアマクリン細胞と神経節細胞へと出力する。樹状突起は水平細胞から、また軸索終末はアマクリン細胞からの入力によってシナプス伝達が修飾される。
視覚系において、最初にオンとオフへと経路が分離されるのが双極細胞(オン型/オフ型双極細胞)である。さらに、接続する視細胞に応じてオン型錐体双極細胞、オフ型錐体双極細胞、桿体双極細胞へと分類される。すべての桿体双極細胞はオン型である。内網状層の遠位側にはオフ型双極細胞が、近位側にはオン型双極細胞が軸索終末を伸ばす。これら双極細胞は、遺伝学的・形態学的・生理学的特徴からさらに亜種へと分けられ、それぞれ内網状層の異なる層に分岐する。マウス網膜では15タイプが同定されている[14][15]。
明暗変化への感受性を形成する応答機構
視細胞の応答極性がオフ型(明るくなると過分極する)であるため、オン型双極細胞では応答極性を反転させる機構が必要である。オン型双極細胞の樹状突起には、代謝型グルタミン酸受容体6型(mGluR6)が発現しており、暗い時(オフ)には視細胞から放出されるグルタミン酸を受容し、共役する三量体Gタンパク質が活性型となることで、陽イオンチャネルのTRPM1を抑制し、陽イオンの流入が止まり過分極する。輝度が増加する(オン)とmGluR6カスケードによるTRPM1チャネルの抑制が解除されるので、脱分極を起こす[16]。
一方、オフ型の双極細胞は、樹状突起にイオンチャネル型グルタミン酸受容体(主にAMPA/KA受容体)を発現しており、視細胞からのグルタミン酸放出に反応して脱分極を起こす[17]。
シナプス小胞の開口放出
双極細胞からのグルタミン酸放出は、活動電位ではなく緩電位(脱分極)による。P/Q型Ca2+チャネルを発現する多くの中枢神経系の神経細胞と異なり、双極細胞軸索終末にはL型Ca2+チャネルが発現する。L型Ca2+電流は活性が遅いものの、軸索終末でのCa2+過程は非常に急峻で、その膜電位変化に伴うシナプス遅延はわずか1 ms以下である[18]。これは一般的な神経筋などの活動電位を伴うシナプス伝達に比肩する。双極細胞の軸索終末は、視細胞終末と同様にシナプスリボン構造をもっており、放出準備にあるシナプス小胞が放出部位に繋留されている。リボン直下にはCa2+チャネルが集積しており(アクティブ・ゾーン)、光刺激に対して複数の小胞から同期的に、かつ一過性に開口放出する。一方、リボンから離れた(リボン・フリー)シナプス部位では、放出は非同期的かつ持続的に行われる[18][19][20]。これら一過性/持続性放出は、それぞれ異なる情報を処理すると考えられる。例えば、ラット網膜の桿体型双極細胞では、一過性放出が順応コントラストを、持続性放出が平均輝度をそれぞれ符号化する[21]。
アマクリン細胞
アマクリン細胞は、網膜内層における介在神経細胞であり、双極細胞からのグルタミン酸入力を受け、双極細胞やアマクリン細胞、神経節細胞へ出力する。Ramón y Cajalは、明瞭に識別可能な軸索をもたないことから、ギリシャ語で"lacking-long-fiber"を意味する「a-makrós-inos(アマクリン)」と名付けた。多くのアマクリン細胞は樹状突起様の細く複雑に分岐した神経線維をもち、シナプス入力と出力の位置が構造的に判然とわかれていない[22]が、軸索様の太く分岐のない神経線維をもつタイプや、樹状突起様/軸索様の神経線維が異なる層ごとに分岐するタイプも発見されている。
多くのアマクリン細胞が内顆粒層の最も内側(内網状層のすぐ上)を占めるため、その層を特にアマクリン細胞層と呼ぶ。また、神経節細胞層に細胞体が位置する細胞タイプを特に異所性(displaced)アマクリン細胞と呼ぶ。
細胞タイプ
アマクリン細胞は、網膜の神経細胞のなかで最も多くの種類をもつ。形態学的には動物種に関わらずおよそ30-60の種類が存在し[22][23]、マウス網膜では電子顕微鏡解析により45種類が報告されていた[24]。免疫組織化学研究から、GABA、グリシン、グルタミン酸などのアミノ酸、アセチルコリン、またセロトニンやドーパミンなどのモノアミン系や神経ペプチドなど多様な伝達物質をもつことがわかっている[22][25]。近年の網羅的1細胞遺伝子発現解析では、マウス網膜には遺伝学的には63タイプが存在し、そのうちGABA作動性(70%)が最も多く、次いでグリシン作動性(17%)であることが報告された[26]。
これまで主に樹状突起形態、神経伝達物質、細胞体位置などを基準とした分類が試みられてきており、いくつかの細胞タイプが同定されている。近年同定された遺伝学的タイプとの相関については今後の研究が待ち望まれている。
スターバースト細胞
スターバースト細胞は、霊長類を含め多くの脊椎動物の網膜に共通して存在する。樹状突起は、200-300 µmほどの広がりをもつ中-大型細胞で、その放射状に伸びる特徴的な形態から「星状(スターバースト)細胞」と呼ばれる(図3)。神経伝達物質としてGABAとアセチルコリンを共放出し、網膜では唯一のコリン作動性細胞である。スターバースト細胞には、細胞体が内顆粒層に位置するオフ型、細胞体が神経節細胞層に位置する異所性のオン型細胞が存在する。オフ型、オン型のそれぞれが内網状層の特定の位置に樹状突起を分岐するため、アセチルコリン合成酵素(コリンアセチル基転移酵素; choline acetyltransferase, ChAT)抗体による免疫組織化学的標識によって可視化することで、組織学的分類の基準になる。
スターバースト細胞には、視覚的な動きの方向に対する選択性(方向選択性)がある。視覚運動が、細胞体から樹状突起の先端方向、つまり遠心性方向に動くときに強く活動し、逆に樹状突起先端から細胞体方向へ動く、つまり求心性方向へ動くときにはあまり活動しない。
AII細胞
AII細胞は、多くの脊椎動物の網膜に共通に存在する代表的なグリシン作動性細胞である。細胞体は内顆粒層に位置し、細胞体から伸びる主樹状突起(primary dendrite)を起点に、細胞体近位では太く短い突起状の構造(lobular appendages)を内網状層オフ層に、遠位では細い複数の樹状突起(arboreal dendrites)をオン層に分岐する。樹状突起の広がりは30-50 µmほどで小型の細胞に分類される。
AII細胞は、遠位の樹状突起において、桿体型双極細胞から興奮性入力を、A17細胞など他のアマクリン細胞から抑制性入力を受ける。また、ギャップ結合(コネキシン36、45)を介して周囲のAII細胞、およびオン型錐体双極細胞と電気的に連絡する[27]。一方、近位の樹状突起では、オフ型錐体双極細胞とシナプスを形成し、グリシンを放出する。つまりAII細胞は、(オン型)桿体経路から、電気シナプスを介してオン型錐体経路へと、化学シナプスを介してオフ型錐体経路へと情報を振り分けている。
AII-AII間の電気的結合性はドーパミンによって制御されており、暗時はトレーサーカップリングの結合性が低く、一つのAII細胞に導入したトレーサーで周囲の20細胞ほどが染色されるが、明時には300細胞ほどが染色される[28]。網膜では、ドーパミン作動性細胞がメラトニンと共役し、明所視/昼間にはドーパミン濃度が高く、暗所視/夜間には低くなるので、明暗順応や概日リズムとの関わりが示唆される。
Wide-field細胞
アマクリン細胞の一部は、軸索様の太く分岐の少ない神経線維をもち、電位依存性Na+チャネルによる活動電位を生じる。概してこれらは数百µmから1mm以上に及ぶ大きな樹状突起をもつため、「Wide-field細胞」と呼ばれる。Wide-field細胞は、受容野周辺、あるいは古典的受容野の外側(far-surround)での修飾を担う。例えば、Wide-field細胞はその受容野も大きいため、視野全体を覆うような大きな運動刺激によく応答し、逆に視野の局所に時空間位相の異なる局所運動が存在するときにはあまり応答しない。そのため、Wide-field細胞からの抑制性入力を受ける神経節細胞に、運動が視野全体ではなく局所的な場合のみに発火する性質を与えたり(オブジェクトモーション細胞)[29]、眼球運動に伴って視野全体が急速に動くときに神経節細胞の発火を抑制(サッカード抑制)する[30]。
神経節細胞
神経節細胞は、網膜の出力細胞であり、双極細胞からグルタミン酸作動性の興奮性入力を受け、活動電位を生じる。またアマクリン細胞から主にGABAやグリシン作動性の抑制性入力を受け、活動が抑制される。細胞体は神経節細胞層に位置し、樹状突起を網膜内網状層に分岐させる。形態学的特徴や遺伝学的特徴、生理学的特性によって多くの種類に分類され、マウス網膜では40以上が機能的に同定されている[31][32][33]。
神経節細胞は、その応答性からオン型、オフ型、オンオフ型の3つに大別される。さらにスパイク発火の動態(持続型、一過性型)や視覚特徴(コントラスト、時空間周波数、色、視覚運動など)への感度による様々な亜種が存在する。それぞれ内網状層の異なる亜層に樹状突起を分岐し[34]、双極細胞やアマクリン細胞と回路を形成する。
特徴検出器
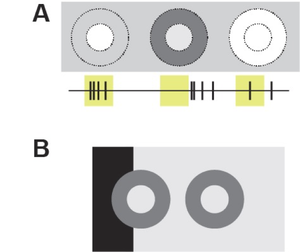
神経節細胞は、視野における特定の視覚特徴を検出する「特徴検出器」と見なすことができる。Lettvinらは、カエル網膜の神経節細胞を視覚応答に基づいて4つのクラスに分類した[35]。
- クラスI)受容野内の明暗変化に反応するコントラスト検出器
- クラスII)コントラスト定義された凸型の小さな形状に反応する凸型検出器
- クラスIII)視覚的な動きに反応する運動検出器
- クラスIV)明るさが徐々に暗くなる(黒い円盤が徐々に大きくなる)ときに反応するディミング検出器
これらの検出器が感受する刺激パターンは、カエルの生存に関わる行動と連関する生態学的意義を持つと考えられている。例えば、受容野内を動き回る小型の影は、カエルにとって餌となる虫を意味する。拡大する黒い円盤は、背後や上空から大きな外敵(捕食者)が自分に近づいてくることを意味する。実際、カエルだけでなく、魚類やげっ歯類など、様々な動物に拡大する黒い円盤を頭上に呈示すると、逃避やすくみなどの恐怖行動が誘発される[36][37]。面白いことに、カエルの視覚システムでは、網膜に存在するディミング検出器(神経節細胞)群が単にスパイク発火するのではなく、これらが同期的かつ周期的にスパイク発火を生じることで逃避行動が誘発されることが分かっている[38]。

マウスにおける網膜神経節細胞から脳への代表的な投射。
dLGN(背側外側膝状体; dorsal lateral geniculate nucleus)、vLGN(腹側外側膝状体; ventral lateral geniculate nucleus)、SC(上丘; superior colliculus)、NOT/DTN(視索核; nucleus of the optic tract / 背側終止核; dorsal terminal nucleus)、MTN(腹側終止核; medial terminal nucleus)、SCN(視交叉上核; suprachiasmatic nucleus)
投射
神経節細胞から脳への投射(図4)は、投射先の機能から二つに大別される。一つは「視覚像形成(image-forming)」、他方は「非視覚像形成(non-image-forming)」である。視覚像形成経路は、外側膝状体を介して一次視覚野(V1)へと至る経路で、明暗、大きさ、形、色、視覚的な動きなど私たちの視覚世界を構成する情報が処理される。一方、非視覚像形成経路は、主な投射先として、視覚-運動協応に関わる上丘、概日リズムに関わる視交叉上核、視野を安定させる眼球運動に関わる視蓋前域や副視索核などがある。これらは私たちの顕在的に意識される情報ではないものの、視知覚の安定や外界世界における身体の定位など様々な処理に貢献する。
ミュラーグリア細胞
ミュラーグリア細胞は、網膜に特有な放射状グリア細胞である。細胞体は内顆粒層に位置する。細胞体から伸びる突起は、網膜と色素上皮層との境目にある外境界膜から、網膜と硝子体との境目にある内境界膜の間を貫通する柱のような形状をしており、両境界膜の構成に寄与する。神経細胞へのエネルギー供給や、細胞外へ放出された伝達物質の取り込み、細胞外K+濃度の制御など、網膜細胞の代謝や活動性の維持に関わる様々な機能を担う。
他のグリア細胞と同様、ミュラーグリア細胞の重要な役割の一つは、シナプス伝達における恒常性の維持である[39]。プレシナプスから放出された神経伝達物質の再取込みや分解、グルタミン酸合成酵素の誘導、細胞外イオンバランスの制御、また栄養因子の放出や錐体視細胞外節の貪食など、細胞の機能性維持に寄与する[40]。さらに、ミュラーグリア細胞は、周囲の組織と比較して高い屈折率をもち、網膜組織に低散乱性を与え、またそれらが光の伝播方向に沿って平行配置されていることから、歪みの少ない光情報を低損失で視細胞へと転送する「オプティカルファイバー」のような役目をもつことも示唆されている[41]。
ミュラーグリア細胞は、組織の損傷や障害に応じて増殖を起こしたり、また形態や機能の変化させる(グリオーシス)。ミュラーグリア細胞のグリオーシスは、神経細胞を細胞死から防御するための様々な因子を放出したり、グルタミン酸の神経毒性を防ぐことで、神経細胞の維持に貢献する[42]。
網膜神経回路による情報表現
中心-周辺拮抗型受容野
双極細胞、アマクリン細胞、神経節細胞の受容野は同心円構造をとり、受容野中心と周辺とで応答性が拮抗する(図5A)。例えば、オン型双極細胞は、受容野中心へのオン刺激に脱分極し、その周囲に環状のオフ刺激を呈示すると過分極する。
中心-周辺拮抗型受容野の形成機構は、周辺からの側方向的なシナプス伝達におけるゲイン制御(側抑制)を基本とする。例えばオン型双極細胞では、受容野周辺にオフ刺激を呈示すると視細胞が脱分極し、直下の水平細胞が興奮する。活性化した水平細胞は側方向的に受容野中心の視細胞を抑制し、過分極させる。結果としてグルタミン酸放出が止まり、オン型双極細胞はmGluR6受容体を介して脱分極を起こす。
拮抗型受容野は、信号強度の増強に寄与すると考えられる。拮抗型受容野が最もよく応答するパターンは、受容野中心と周辺がともに興奮性に働く明暗エッジである(図5B)。一方で、受容野全面を覆う低コントラストの像では周辺抑制のために応答が弱くなる。つまり、拮抗型受容野の機能は、定常な特徴をノイズとして無視し、「輝度の変化分」を検出して増強することにある。
図と地の分離
脳が処理する網膜像は二次元像であるため、立体像としての視知覚を構成するためには、背景(地)と物体(図)を分離して認識する必要がある。網膜では、前述したオブジェクトモーション細胞が、背景から局所運動成分を検出することで図と地の分離に貢献することが示唆されている[29]。また生体では、自律的な眼球運動(固視微動)による網膜像の揺動のために、オブジェクトと周辺(背景)でテクスチャの位相がずれ、運動しない物体に対してもオブジェクトモーション検出回路が機能すると考えられる。

A. 方向選択性神経節細胞(Direction-selective ganglion cell; DSGC)。特定の方向(preferred direction)に動く視覚刺激に強く応答し、その逆の方向(null direction)に対してはほとんど応答しない。
B. マウスでは、生後から開眼までに自発的な神経活動(retinal wave)が生じ、シナプス形成や神経回路構築に貢献する。生後9日目ほどまではコリン作動性、その後開眼する14日目ほどまではグルタミン酸作動性の自発的神経活動が生じることが分かっている(上図)。方向選択性回路における抑制性シナプス(スターバースト細胞-方向選択性神経節細胞間)は、コリン作動性自発的神経活動の時期を経て、空間対称から非対称へと再編成される(下図)。
C. 運動検出器。時間動態の速い素子(fast)と遅延フィルタを経由する遅い素子(slow)からの入力を受ける。
D. 遅い素子側から運動刺激が呈示されたときにはシナプス遅延が相殺され、入力加算が生じる。
運動方向選択性
ハエや魚類、カメ、マウス、ウサギ、霊長類など多くの動物に共通して、動きの方向と速度に調節性をもつ方向選択性神経節細胞が存在する。これらの細胞は、特定の方向(選好方向)へ動く物体には強く反応するが、逆の方向(非選好方向)へはほとんど反応しない(図6A)。方向選択性神経節細胞は、形態学的、生理学的特徴から二つに大別される。すなわち、内網状層のオン層に樹状突起を伸ばし、遅い動きによく応答するオン型細胞と、内網状層のオン層とオフ層の二層に樹状突起を伸ばし、速い動きによく応答するオンオフ型細胞である。オン型細胞は、主に副視索核や視蓋前域へ投射し、視野の動きに伴う網膜像の揺動を安定させる反射的な眼球運動の制御に関わる<[43][44][45]。オンオフ型は、主に上丘や外側膝状体へと投射し、身体運動(回転や前方への移動など)に伴う視野全体の動き(オプティカルフロー)の処理に関わると考えられている[46][47]。
主な方向選択性形成機構は、スターバースト細胞からの空間非対称な抑制性入力である(図6B)。スターバースト細胞と方向選択性細胞とのシナプス結合は、非選好方向側でより多くなっており[48]、スターバースト細胞の遠心性方向選択性に応じた方向に対して強い抑制性入力が生じる。マウス網膜では、生後2週目までにシナプスが空間対称から非対称へと再編成が起こることがわかっている[49][50]。こうしたシナプスの再編成は、視覚経験には依存せず(再編成は開眼前に完了する)、発達期における自発的な神経発火(retinal wave)[51]や回路形成のための分子機構が貢献することが見出されてきている[45] 。
一方で、双極細胞からのグルタミン酸入力も方向選択性形成に寄与する。古典的な運動検出器では、速い(一過性型)入力と遅い(持続型)入力素子を仮定し、視覚運動が遅い素子から速い素子の側へと呈示されると、入力遅延が相殺され加算が生じる(図6C、D)。スターバースト細胞は、細胞体の近位に持続型、遠位に一過性型の双極細胞から入力を受けるため[52]、遠心性方向への動きで加算が生じる[53]。この加算過程は動きの速度と入力素子間の距離が対応する必要があるため、速度への調節性が伴う。オン型方向選択性細胞は、同様の加算機構をもつが、双極細胞の空間的な配置が遅い動きに対応している[54]。また、オンオフ型方向選択性細胞については、接続する双極細胞の特定のタイプ(T7オン型、T2オフ型)からのグルタミン酸放出に方向選択性が存在し、かつその選好方向が方向選択性細胞と一致するため、調節性が増強される[55]。
関連項目
参考文献
- ↑
Wässle, H. (2004).
Parallel processing in the mammalian retina. Nature reviews. Neuroscience, 5(10), 747-57. [PubMed:15378035] [WorldCat] [DOI] - ↑
Baden, T., Euler, T., & Berens, P. (2020).
Understanding the retinal basis of vision across species. Nature reviews. Neuroscience, 21(1), 5-20. [PubMed:31780820] [WorldCat] [DOI] - ↑
Famiglietti, E.V., Kaneko, A., & Tachibana, M. (1977).
Neuronal architecture of on and off pathways to ganglion cells in carp retina. Science (New York, N.Y.), 198(4323), 1267-9. [PubMed:73223] [WorldCat] [DOI] - ↑
Roska, B., & Werblin, F. (2001).
Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature, 410(6828), 583-7. [PubMed:11279496] [WorldCat] [DOI] - ↑
Asenjo, A.B., Rim, J., & Oprian, D.D. (1994).
Molecular determinants of human red/green color discrimination. Neuron, 12(5), 1131-8. [PubMed:8185948] [WorldCat] [DOI] - ↑
Sterling, P., & Matthews, G. (2005).
Structure and function of ribbon synapses. Trends in neurosciences, 28(1), 20-9. [PubMed:15626493] [WorldCat] [DOI] - ↑
Barnes, S., Grove, J.C.R., McHugh, C.F., Hirano, A.A., & Brecha, N.C. (2020).
Horizontal Cell Feedback to Cone Photoreceptors in Mammalian Retina: Novel Insights From the GABA-pH Hybrid Model. Frontiers in cellular neuroscience, 14, 595064. [PubMed:33328894] [PMC] [WorldCat] [DOI] - ↑
Chaya, T., Matsumoto, A., Sugita, Y., Watanabe, S., Kuwahara, R., Tachibana, M., & Furukawa, T. (2017).
Versatile functional roles of horizontal cells in the retinal circuit. Scientific reports, 7(1), 5540. [PubMed:28717219] [PMC] [WorldCat] [DOI] - ↑
Drinnenberg, A., Franke, F., Morikawa, R.K., Jüttner, J., Hillier, D., Hantz, P., ..., & Roska, B. (2018).
How Diverse Retinal Functions Arise from Feedback at the First Visual Synapse. Neuron, 99(1), 117-134.e11. [PubMed:29937281] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Peichl, L., & González-Soriano, J. (1994).
Morphological types of horizontal cell in rodent retinae: a comparison of rat, mouse, gerbil, and guinea pig. Visual neuroscience, 11(3), 501-17. [PubMed:8038125] [WorldCat] [DOI] - ↑
Boycott, B.B., Peichl, L., & Wässle, H. (1978).
Morphological types of horizontal cell in the retina of the domestic cat. Proceedings of the Royal Society of London. Series B, Biological sciences, 203(1152), 229-45. [PubMed:84387] [WorldCat] [DOI] - ↑
Tomita, T. (1965).
Electrophysiological study of the mechanisms subserving color coding in the fish retina. Cold Spring Harbor symposia on quantitative biology, 30, 559-66. [PubMed:5219504] [WorldCat] [DOI] - ↑
Stell, W.K., Lightfood, D.O., Wheeler, T.G., & Leeper, H.F. (1975).
Goldfish retina: functional polarization of cone horizontal cell dendrites and synapses. Science (New York, N.Y.), 190(4218), 989-90. [PubMed:1188380] [WorldCat] [DOI] - ↑
Shekhar, K., Lapan, S.W., Whitney, I.E., Tran, N.M., Macosko, E.Z., Kowalczyk, M., ..., & Sanes, J.R. (2016).
Comprehensive Classification of Retinal Bipolar Neurons by Single-Cell Transcriptomics. Cell, 166(5), 1308-1323.e30. [PubMed:27565351] [PMC] [WorldCat] [DOI] - ↑
Tsukamoto, Y., & Omi, N. (2017).
Classification of Mouse Retinal Bipolar Cells: Type-Specific Connectivity with Special Reference to Rod-Driven AII Amacrine Pathways. Frontiers in neuroanatomy, 11, 92. [PubMed:29114208] [PMC] [WorldCat] [DOI] - ↑
Koike, C., Obara, T., Uriu, Y., Numata, T., Sanuki, R., Miyata, K., ..., & Furukawa, T. (2010).
TRPM1 is a component of the retinal ON bipolar cell transduction channel in the mGluR6 cascade. Proceedings of the National Academy of Sciences of the United States of America, 107(1), 332-7. [PubMed:19966281] [PMC] [WorldCat] [DOI] - ↑
DeVries, S.H. (2000).
Bipolar cells use kainate and AMPA receptors to filter visual information into separate channels. Neuron, 28(3), 847-56. [PubMed:11163271] [WorldCat] [DOI] - ↑ 18.0 18.1
von Gersdorff, H., Sakaba, T., Berglund, K., & Tachibana, M. (1998).
Submillisecond kinetics of glutamate release from a sensory synapse. Neuron, 21(5), 1177-88. [PubMed:9856472] [WorldCat] [DOI] - ↑
Sakaba, T., Tachibana, M., Matsui, K., & Minami, N. (1997).
Two components of transmitter release in retinal bipolar cells: exocytosis and mobilization of synaptic vesicles. Neuroscience research, 27(4), 357-70. [PubMed:9152048] [WorldCat] [DOI] - ↑
Midorikawa, M., Tsukamoto, Y., Berglund, K., Ishii, M., & Tachibana, M. (2007).
Different roles of ribbon-associated and ribbon-free active zones in retinal bipolar cells. Nature neuroscience, 10(10), 1268-76. [PubMed:17828257] [WorldCat] [DOI] - ↑
Oesch, N.W., & Diamond, J.S. (2011).
Ribbon synapses compute temporal contrast and encode luminance in retinal rod bipolar cells. Nature neuroscience, 14(12), 1555-61. [PubMed:22019730] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2
Diamond, J.S. (2017).
Inhibitory Interneurons in the Retina: Types, Circuitry, and Function. Annual review of vision science, 3, 1-24. [PubMed:28617659] [WorldCat] [DOI] - ↑
Werblin, F.S. (2011).
The retinal hypercircuit: a repeating synaptic interactive motif underlying visual function. The Journal of physiology, 589(Pt 15), 3691-702. [PubMed:21669978] [PMC] [WorldCat] [DOI] - ↑
Helmstaedter, M., Briggman, K.L., Turaga, S.C., Jain, V., Seung, H.S., & Denk, W. (2013).
Connectomic reconstruction of the inner plexiform layer in the mouse retina. Nature, 500(7461), 168-74. [PubMed:23925239] [WorldCat] [DOI] - ↑
Koontz, M.A., Hendrickson, L.E., Brace, S.T., & Hendrickson, A.E. (1993).
Immunocytochemical localization of GABA and glycine in amacrine and displaced amacrine cells of macaque monkey retina. Vision research, 33(18), 2617-28. [PubMed:8296457] [WorldCat] [DOI] - ↑
Yan, W., Laboulaye, M.A., Tran, N.M., Whitney, I.E., Benhar, I., & Sanes, J.R. (2020).
Mouse Retinal Cell Atlas: Molecular Identification of over Sixty Amacrine Cell Types. The Journal of neuroscience : the official journal of the Society for Neuroscience, 40(27), 5177-5195. [PubMed:32457074] [PMC] [WorldCat] [DOI] - ↑
Mills, S.L., O'Brien, J.J., Li, W., O'Brien, J., & Massey, S.C. (2001).
Rod pathways in the mammalian retina use connexin 36. The Journal of comparative neurology, 436(3), 336-50. [PubMed:11438934] [PMC] [WorldCat] - ↑
Bloomfield, S.A., Xin, D., & Osborne, T. (1997).
Light-induced modulation of coupling between AII amacrine cells in the rabbit retina. Visual neuroscience, 14(3), 565-76. [PubMed:9194323] [WorldCat] [DOI] - ↑ 29.0 29.1
Olveczky, B.P., Baccus, S.A., & Meister, M. (2003).
Segregation of object and background motion in the retina. Nature, 423(6938), 401-8. [PubMed:12754524] [WorldCat] [DOI] - ↑
Roska, B., & Werblin, F. (2003).
Rapid global shifts in natural scenes block spiking in specific ganglion cell types. Nature neuroscience, 6(6), 600-8. [PubMed:12740583] [WorldCat] [DOI] - ↑
Baden, T., Berens, P., Franke, K., Román Rosón, M., Bethge, M., & Euler, T. (2016).
The functional diversity of retinal ganglion cells in the mouse. Nature, 529(7586), 345-50. [PubMed:26735013] [PMC] [WorldCat] [DOI] - ↑
Goetz, J., Jessen, Z.F., Jacobi, A., Mani, A., Cooler, S., Greer, D., ..., & Schwartz, G.W. (2022).
Unified classification of mouse retinal ganglion cells using function, morphology, and gene expression. Cell reports, 40(2), 111040. [PubMed:35830791] [PMC] [WorldCat] [DOI] - ↑
Tran, N.M., Shekhar, K., Whitney, I.E., Jacobi, A., Benhar, I., Hong, G., ..., & Sanes, J.R. (2019).
Single-Cell Profiles of Retinal Ganglion Cells Differing in Resilience to Injury Reveal Neuroprotective Genes. Neuron, 104(6), 1039-1055.e12. [PubMed:31784286] [PMC] [WorldCat] [DOI] - ↑
Sümbül, U., Song, S., McCulloch, K., Becker, M., Lin, B., Sanes, J.R., ..., & Seung, H.S. (2014).
A genetic and computational approach to structurally classify neuronal types. Nature communications, 5, 3512. [PubMed:24662602] [PMC] [WorldCat] [DOI] - ↑ Lettvin JY, Maturana HR, McCulloch WS, Pitts WH. (1959) What the Frog’s Eye Tells the Frog’s Brain. Proceedings of the IRE. 47: 1940–1951
- ↑
Pereira, A.G., & Moita, M.A. (2016).
Is there anybody out there? Neural circuits of threat detection in vertebrates. Current opinion in neurobiology, 41, 179-187. [PubMed:27750206] [WorldCat] [DOI] - ↑
Yilmaz, M., & Meister, M. (2013).
Rapid innate defensive responses of mice to looming visual stimuli. Current biology : CB, 23(20), 2011-5. [PubMed:24120636] [PMC] [WorldCat] [DOI] - ↑
Ishikane, H., Gangi, M., Honda, S., & Tachibana, M. (2005).
Synchronized retinal oscillations encode essential information for escape behavior in frogs. Nature neuroscience, 8(8), 1087-95. [PubMed:15995702] [WorldCat] [DOI] - ↑
Goldman, D. (2014).
Müller glial cell reprogramming and retina regeneration. Nature reviews. Neuroscience, 15(7), 431-42. [PubMed:24894585] [PMC] [WorldCat] [DOI] - ↑
Wang, J.S., & Kefalov, V.J. (2011).
The cone-specific visual cycle. Progress in retinal and eye research, 30(2), 115-28. [PubMed:21111842] [PMC] [WorldCat] [DOI] - ↑
Franze, K., Grosche, J., Skatchkov, S.N., Schinkinger, S., Foja, C., Schild, D., ..., & Guck, J. (2007).
Muller cells are living optical fibers in the vertebrate retina. Proceedings of the National Academy of Sciences of the United States of America, 104(20), 8287-92. [PubMed:17485670] [PMC] [WorldCat] [DOI] - ↑
Bringmann, A., Iandiev, I., Pannicke, T., Wurm, A., Hollborn, M., Wiedemann, P., ..., & Reichenbach, A. (2009).
Cellular signaling and factors involved in Müller cell gliosis: neuroprotective and detrimental effects. Progress in retinal and eye research, 28(6), 423-51. [PubMed:19660572] [WorldCat] [DOI] - ↑
Oyster, C.W., Takahashi, E., & Collewijn, H. (1972).
Direction-selective retinal ganglion cells and control of optokinetic nystagmus in the rabbit. Vision research, 12(2), 183-93. [PubMed:5033683] [WorldCat] [DOI] - ↑
Yoshida, K., Watanabe, D., Ishikane, H., Tachibana, M., Pastan, I., & Nakanishi, S. (2001).
A key role of starburst amacrine cells in originating retinal directional selectivity and optokinetic eye movement. Neuron, 30(3), 771-80. [PubMed:11430810] [WorldCat] [DOI] - ↑ 45.0 45.1
Yonehara, K., Fiscella, M., Drinnenberg, A., Esposti, F., Trenholm, S., Krol, J., ..., & Roska, B. (2016).
Congenital Nystagmus Gene FRMD7 Is Necessary for Establishing a Neuronal Circuit Asymmetry for Direction Selectivity. Neuron, 89(1), 177-93. [PubMed:26711119] [PMC] [WorldCat] [DOI] - ↑
Rasmussen, R., & Yonehara, K. (2020).
Contributions of Retinal Direction Selectivity to Central Visual Processing. Current biology : CB, 30(15), R897-R903. [PubMed:32750354] [WorldCat] [DOI] - ↑
Sabbah, S., Gemmer, J.A., Bhatia-Lin, A., Manoff, G., Castro, G., Siegel, J.K., ..., & Berson, D.M. (2017).
A retinal code for motion along the gravitational and body axes. Nature, 546(7659), 492-497. [PubMed:28607486] [PMC] [WorldCat] [DOI] - ↑
Briggman, K.L., Helmstaedter, M., & Denk, W. (2011).
Wiring specificity in the direction-selectivity circuit of the retina. Nature, 471(7337), 183-8. [PubMed:21390125] [WorldCat] [DOI] - ↑
Yonehara, K., Balint, K., Noda, M., Nagel, G., Bamberg, E., & Roska, B. (2011).
Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature, 469(7330), 407-10. [PubMed:21170022] [WorldCat] [DOI] - ↑
Wei, W., Hamby, A.M., Zhou, K., & Feller, M.B. (2011).
Development of asymmetric inhibition underlying direction selectivity in the retina. Nature, 469(7330), 402-6. [PubMed:21131947] [PMC] [WorldCat] [DOI] - ↑
Tiriac, A., & Feller, M.B. (2022).
Roles of visually evoked and spontaneous activity in the development of retinal direction selectivity maps. Trends in neurosciences, 45(7), 529-538. [PubMed:35491255] [WorldCat] [DOI] - ↑
Kim, J.S., Greene, M.J., Zlateski, A., Lee, K., Richardson, M., Turaga, S.C., ..., & EyeWirers (2014).
Space-time wiring specificity supports direction selectivity in the retina. Nature, 509(7500), 331-336. [PubMed:24805243] [PMC] [WorldCat] [DOI] - ↑
Srivastava, P., de Rosenroll, G., Matsumoto, A., Michaels, T., Turple, Z., Jain, V., ..., & Awatramani, G.B. (2022).
Spatiotemporal properties of glutamate input support direction selectivity in the dendrites of retinal starburst amacrine cells. eLife, 11. [PubMed:36346388] [PMC] [WorldCat] [DOI] - ↑
Matsumoto, A., Briggman, K.L., & Yonehara, K. (2019).
Spatiotemporally Asymmetric Excitation Supports Mammalian Retinal Motion Sensitivity. Current biology : CB, 29(19), 3277-3288.e5. [PubMed:31564498] [PMC] [WorldCat] [DOI] - ↑
Matsumoto, A., Agbariah, W., Nolte, S.S., Andrawos, R., Levi, H., Sabbah, S., & Yonehara, K. (2021).
Direction selectivity in retinal bipolar cell axon terminals. Neuron, 109(18), 2928-2942.e8. [PubMed:34390651] [PMC] [WorldCat] [DOI]