髄鞘
吉村 武、池中 一裕
自然科学研究機構生理学研究所 分子生理研究系 分子神経生理研究部門
DOI:10.14931/bsd.564 原稿受付日:2012年2月3日 原稿完成日:2013年12月7日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名:myelin, myelin sheath, medullary sheath 独:Myelin 仏:myéline
同義語:ミエリン、ミエリン鞘
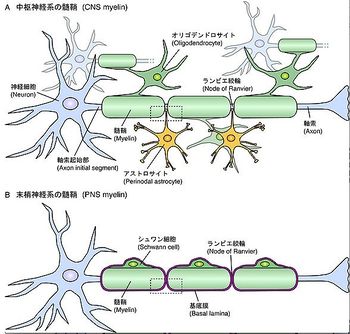
髄鞘は神経細胞の軸索を何重にも取り囲んでいる密な膜構造である。髄鞘は脂質に富み絶縁体として働く。髄鞘は導線を覆うビニール管のように軸索全体を覆っているのではなく、一定の間隔を開けている。隙間はランビエ絞輪(node of Ranvier)と呼ばれ、この部分でしか活動電位を発生させることができない。ゆえに、髄鞘化されていない軸索では活動電位は連続的に伝わるが、髄鞘化された軸索では活動電位はランビエ絞輪の部分のみを経由して飛び飛びに伝わる。このような現象を跳躍伝導と呼び、髄鞘の存在によって伝導速度の上昇が可能となる。髄鞘を形成しているのはグリア細胞(神経膠細胞、glial cell)であり、中枢神経系ではオリゴデンドロサイト(希突起膠細胞、oligodendrocyte)、末梢神経系ではシュワン細胞(Schwann cell)によって形成される。髄鞘は単に絶縁体として働くだけでなく、軸索との間に緊密な相互作用を行い、様々な神経機能を調節している。脱髄疾患や髄鞘形成不全では種々の神経症状を呈し、致死性の場合もある。
髄鞘とは
髄鞘はmedullary sheathの訳語であり、「髄質の神経線維が持っている鞘」のことである。英語名はmyelinがよく使われており、1854年にR. Virchow博士により発見され命名された[1]。髄鞘は脂質が主成分であるため、神経細胞の軸索を外部から電気的に遮断する絶縁体として機能する[2][3][4]。髄鞘は脂質に富む細胞膜の多重層構造であるため白色に見える。脳や脊髄の切断面を観察すると、やや桃色を帯びた灰白色の部分(灰白質)と白色の部分(白質)を明瞭に区別することができる。灰白質は神経細胞の細胞体が密集した部分であり、これらの神経細胞から伸びた軸索が通る部分が白質である。白質には有髄神経線維が多く存在するため白色に見える。
軸索は多数の髄鞘で隈無く覆われているわけではない。髄鞘の長さは0.1〜1 mm程度であり、髄鞘間には隙間がある。この隙間はランビエ絞輪と呼ばれる(図1)。軸索は神経細胞の細胞体の軸索小丘(axon hillock)に始まり、この場所と最初の髄鞘が現れる間の領域は軸索起始部(axon initial segment)と呼ばれる[5]。軸索起始部とランビエ絞輪は共に活動電位の発生に重要である。軸索起始部で最初の活動電位が生じ、それが隣のランビエ絞輪における活動電位を引き起こす。そして次々に隣のランビエ絞輪の活動電位が引き起こされ、活動電位が髄鞘で絶縁された部分を飛び越えていく。このような現象を跳躍伝導と呼ぶ。この様式は伝導速度を飛躍的に上げ、信号の減衰を防ぎ、長距離の信号伝達を可能にするだけでなく、興奮が軸索の狭い場所に限定されることにより代謝エネルギーの節約にも役立っている。
形成する細胞
髄鞘を形成しているのはグリア細胞であり、中枢神経系の髄鞘はオリゴデンドロサイト、末梢神経系の髄鞘はシュワン細胞によって形成される(図1)。中枢神経系では1つのオリゴデンドロサイトが複数の突起を出し、突起毎に1本の軸索を認識して何重にも軸索を取り囲んだ後、細胞質成分を押し出して密な膜構造(髄鞘)を形成する(図2)。それに対して、末梢神経系ではシュワン細胞そのものが軸索を取り囲む。1つのシュワン細胞は軸索束を取り囲んだ後、1本の軸索を選別して、その1本の軸索で髄鞘を形成する[6]。末梢神経系の髄鞘ではシュワン細胞の細胞質が髄鞘の中に取り残された部分(シュミット・ランターマンの切痕)がある(図3)。
中枢神経系のランビエ絞輪にはアストロサイトが突起を伸ばして接触しているが、末梢神経系ではシュワン細胞の微小突起が覆っている。また、末梢神経系の髄鞘は基底膜で覆われているが、中枢神経系の髄鞘にはそれが見られない。
成分と構造
髄鞘は細胞形質膜の多層構造体であるため、他の多くの細胞の形質膜や細胞内小胞膜と比べてタンパク質成分が少ない。脂質が約70〜80%(乾燥重量比)程度を占め、残り約20〜30%がタンパク質である。このため、髄鞘は他の膜よりも比重が軽いためショ糖密度勾配遠心法により他の膜と分離して調整することができる。髄鞘を構成する主な脂質は糖脂質ガラクトセレブロシドとその硫酸化誘導体スルファチドである[7]。中枢神経系と末梢神経系では髄鞘を産生するグリア細胞が異なり、髄鞘を構築する様式も異なるので、これらの髄鞘を構成するタンパク質の多くは異なる。しかし、中には共通して存在するタンパク質もある。中枢神経系の髄鞘ではPLPとMBPが主成分のタンパク質であり、その他にMOG、MAG、CNPaseなどが存在する。末梢神経系の髄鞘ではP0とP2が主成分のタンパク質であり、PMP22、MAG、CNPaseなども発現している。
近年、軸索と髄鞘の間では絶えず活発な情報交換が行なわれていることが示されたため、髄鞘は単に絶縁体として働くだけでなく、軸索輸送や軸索径の調節などに重要な役割を担うことが明らかとなってきた[8][9][10]。髄鞘の重要な働きの1つとして、軸索の機能的ドメイン形成がある[11]。有髄神経の軸索は髄鞘が取り巻くことによって、ランビエ絞輪・パラノード・ジャクスタパラノード・インターノードといったそれぞれに特徴的形態を持つ4つのドメインに分けられる(図3)。これらの各ドメインは、イオンチャネルや接着分子などの膜タンパク質がドメイン特異的に集積することにより、形態的のみならず機能的にも異なっている。ランビエ絞輪には活動電位発生に関わる電位依存性ナトリウムチャネル、ジャクスタパラノードには電位依存性カリウムチャネルがそれぞれ集積している。この2つのチャネルを隔てるパラノード部分には、軸索と髄鞘の間に作られたパラノーダルジャンクションと呼ばれる細胞間結合が存在する。このジャンクション形成は軸索の機能ドメインの維持に必要であり、Casprやcontactin、NF155などがジャンクション形成に重要である。
脱髄疾患および髄鞘形成不全
脱髄疾患(demyelinating disease)は神経疾患の1種で、有髄神経の髄鞘が障害されることで起こる疾患であり、いったん髄鞘が形成された後に障害される疾患のことを示す[8]。髄鞘の消失により神経伝導速度が遅くなり、様々な神経症状が引き起こされる。脱髄が起こる場所により症状は千差万別であり、手足のしびれや運動麻痺、感覚麻痺、視力障害などが起こる。中枢神経系の脱髄疾患には日本で特定疾患に認定されている多発性硬化症(multiple sclerosis; MS)や白質ジストロフィー(leukodystrophy)などがある。末梢神経系の脱髄疾患には日本で特定疾患に認定されているギラン・バレー症候群(Guillain-Barré syndrome; GBS)や慢性炎症性脱髄性多発神経炎(Chronic inflammatory demyelinating polyneuropathy; CIDP)、シャルコー・マリー・トゥース病(Charcot-Marie-Tooth disease; CMT)などがある。遺伝子変異などが原因で最初から髄鞘形成が不完全になることは髄鞘形成不全(dysmyelination)と言う。髄鞘形成不全と関連づけられている疾患として、ある種の白質ジストロフィーなどが挙げられる[10]。また、最近の研究により統合失調症(schizophrenia)との関連が示唆されている[9][10]。
髄鞘を持つ動物
神経系において情報を高速処理するために、伝導速度を上げることは重要である。このため、進化の過程で神経系は2つの仕組みを獲得してきた。1つは、軸索の直径を巨大化させることである。例としてイカの巨大軸索が挙げられる。もう1つは髄鞘を持つことである。多くの動物種がこれらの仕組みを利用している。髄鞘はヤツメウナギやヌタウナギなどの脊椎動物として最も古い無顎類に属する円口類を除く脊椎動物に存在し、軟骨魚類以降の脊椎動物が持つ特徴的な構造体と考えられてきた。しかし、平行進化によって無脊椎動物の中には髄鞘様の構造を持つものが存在する(図4)。エビやミミズ、ある種のミジンコの仲間などが髄鞘様の構造を有する[12]。
関連語
参考文献
- ↑ Virchow R.
Über das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben.
Virchows Arch. Pathol. Anat., 6, 562–572, 1854 - ↑ 北村邦男
脳と神経 分子神経生物科学入門, 金子章道・河村光毅・植村慶一 編, ミエリン
共立出版(東京), p. 216-224, 1999 - ↑ 石橋智子、馬場広子、池中一裕
脳神経科学, 伊藤正男 監修, 金澤一郎・篠田義一・廣川信隆・御子柴克彦・宮下保司 編集, ミエリンとミエリン形成
三輪書店(東京), p. 117-127, 2003 - ↑ 渡辺雅彦
みる見るわかる 脳・神経科学入門講座 改訂版 前編
羊土社(東京), 2008 - ↑
Rasband, M.N. (2010).
The axon initial segment and the maintenance of neuronal polarity. Nature reviews. Neuroscience, 11(8), 552-62. [PubMed:20631711] [WorldCat] [DOI] - ↑
Pereira, J.A., Lebrun-Julien, F., & Suter, U. (2012).
Molecular mechanisms regulating myelination in the peripheral nervous system. Trends in neurosciences, 35(2), 123-34. [PubMed:22192173] [WorldCat] [DOI] - ↑
Coetzee, T., Suzuki, K., & Popko, B. (1998).
New perspectives on the function of myelin galactolipids. Trends in neurosciences, 21(3), 126-30. [PubMed:9530920] [WorldCat] [DOI] - ↑ 8.0 8.1
Nave, K.A., & Trapp, B.D. (2008).
Axon-glial signaling and the glial support of axon function. Annual review of neuroscience, 31, 535-61. [PubMed:18558866] [WorldCat] [DOI] - ↑ 9.0 9.1
Fields, R.D. (2008).
White matter in learning, cognition and psychiatric disorders. Trends in neurosciences, 31(7), 361-70. [PubMed:18538868] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Nave, K.A. (2010).
Myelination and the trophic support of long axons. Nature reviews. Neuroscience, 11(4), 275-83. [PubMed:20216548] [WorldCat] [DOI] - ↑
Poliak, S., & Peles, E. (2003).
The local differentiation of myelinated axons at nodes of Ranvier. Nature reviews. Neuroscience, 4(12), 968-80. [PubMed:14682359] [WorldCat] [DOI] - ↑
Hartline, D.K., & Colman, D.R. (2007).
Rapid conduction and the evolution of giant axons and myelinated fibers. Current biology : CB, 17(1), R29-35. [PubMed:17208176] [WorldCat] [DOI]