バーグマングリア
藤島 和人、見学 美根子
京都大学 物質ー細胞統合システム拠点
DOI:10.14931/bsd.2374 原稿受付日:2012年10月31日 原稿完成日:2015年1月5日
担当編集委員:上口 裕之(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:Bergmann glia, Golgi epithelial cell, radial epithelial cell
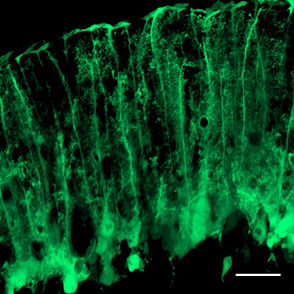
アデノ随伴ウイルスベクターで一部のバーグマングリアにGFPを強制発現し、可視化している。スケールバーは20 µm。
同義語:ベルグマン膠細胞、ゴルジ上皮細胞
歴史
Ramón y Cajalが1911年に出版した著名な解剖書中で、小脳皮質に柵状構造を形成する放射状線維を1850年代に最初に記載したBergmannに因み、「バーグマン線維をもつ上皮細胞」と表現したことから、バーグマングリアの名が使われるようになった。1885年に放射状線維がグリア細胞に由来することを見出したCamillo Golgiの名を取り、ゴルジ上皮細胞と呼ばれることもある。
形態
組織像
(スケールバーは2 µm)
写真提供:京都府立医大 小野勝彦博士
バーグマングリアの細胞体は、小脳皮質プルキンエ細胞層に整列するプルキンエ細胞の細胞体周辺に不規則に配置する(図1)。プルキンエ細胞とバーグマングリアの割合はおよそ1:8とされる。細胞体から垂線方向に伸び脳表の軟膜へ到達する特徴的な放射状線維(radial fiber)は細胞毎に5本程度で、幹に多数の薄片状または刺状の突起を形成する。同一の細胞に由来する放射状線維は、扇形に展開するプルキンエ細胞樹状突起と垂直に小脳冠状面(正中面に垂直な面)に広がる傾向がある(図2)。樹状突起と異なり、放射状線維は分岐が少なく先細りしない。先端で膨張してendfeetを形成し、軟膜と結合する。
微細構造
電子顕微鏡では電子密度が低くミトコンドリアなどの細胞内小器官がまばらで明調な細胞として観察される(図3)。明調な放射状線維から突出した薄片状突起は、プルキンエ細胞の樹状突起スパイン上に形成される、平行線維(顆粒細胞軸索)、登上線維(下オリーブ核ニューロン軸索)、抑制性介在ニューロンとのシナプスを被包する(図4)。放射状線維末端のendfeetは二重膜が渦巻状に折り畳まれた球根様の構造で、軟膜上皮細胞と密接に結合する。
分子発現
(スケールバーは0.5 µm)
写真提供:京都府立医大 小野勝彦博士
バーグマングリアは中間系フィラメントGFAP (glial fibrillary acidic protein)、グリア型グルタミン酸輸送体EAAT1(GLAST)、脂質結合分子brain lipid-binding protein(BLBP、別名FABP7)などのアストロサイト系譜細胞のマーカー分子の多くを発現する。その他、成熟したアストロサイトには消失するヴィメンチン(vimentin)の強い発現が見られ、Sox1, Sox2, Hes1, RC1抗原などの幹細胞マーカーの発現がある[1]。網膜ミューラーグリアと共に、放射状線維をもつ形態的特徴と未分化なアストロサイト特有の分子発現から神経幹細胞の放射状グリアと比較されるが、2012年現在ではバーグマングリアが幹細胞として機能する証拠はない。
発生
バーグマングリアは、興奮性ニューロンを除く多くの小脳皮質細胞(プルキンエ細胞、抑制性介在ニューロン、各種グリア細胞)が産生される第4脳室に面する脳室帯の放射状グリア(神経幹細胞)から分化する。同じ脳室帯からアストロサイトやオリゴデンドロサイトなどが胎生期から生後の長い期間に産生され続けるのに対し、バーグマングリアはプルキンエ細胞の産生が終る直後の短い期間(マウスでは胎生13.5日から14.5日)に誕生することが確かめられている[2]。脳室帯で誕生したバーグマングリアは小脳皮質へ細胞移動し、生後1週目(マウス)までにプルキンエ細胞層周辺に配置して複数の放射状線維を形成する[3][4]。この時期にもバーグマンクリアは分裂により数を増やしているとされる[5][6]。放射状線維は生後発達中に次第に径を増し、グルタミン酸輸送体EAAT1が集積する薄片状突起を多数形成する。薄片状突起はまず細胞体付近で形成され、プルキンエ細胞樹状突起の伸展に伴い徐々に先端へ広がり、プルキンエ細胞樹状突起上のスパインを被包する[7][8]。プルキンエ細胞樹状突起に発現するNotchリガンドのDelta/Notch-like EGF-related protein(DNER)の欠損動物で放射状線維の分化が遅延することから、プルキンエ細胞との相互作用によりバーグマングリアのNotchシグナルが活性化することが放射状線維分化を促進すると考えられる[9]。
機能
バーグマングリアは個体の一生を通じて様々な機能を果たす。
支持構造
バーグマングリアの放射状線維は分子層を柵状に縦断し、小脳皮質の支持構造となる一方、先端部のendfeetは軟膜境界を覆い、軟膜外と皮質のグリア境界膜(glia limitans)として機能する。Endfeetと軟膜の結合にはβ1-インテグリンが関与し、β1-インテグリン欠損動物ではendfeetの発達が阻害され、著しい小脳皮質形成不全が起こる[10]。
分化制御
放射状線維は、生後発達期には小脳軟膜直下の外顆粒層から皮質深層の内顆粒層へ移動する顆粒細胞の足場になると考えられている。また同時期にプルキンエ細胞樹状突起もグリア線維を伝うように伸展する。詳細な機構は不明であるが、バーグマングリアに発現する受容体型チロシンホスファターゼPTPζの機能阻害によりプルキンエ細胞樹状突起形成に異常が生じるという報告がある[11]。
神経活動制御
放射状線維上に形成される薄片状突起は、プルキンエ細胞樹状突起のシナプスを5個程度の単位で包囲し、機能的に独立したミクロドメインを形成する。バーグマングリアにはグリア型グルタミン酸輸送体のEAAT1(GLAST)およびEAAT2(GLT1)が発現し、プルキンエ細胞の興奮性シナプス間隙に放出されたグルタミン酸を素早く取り込む。グルタミン酸はグリア細胞内でグルタミンに代謝され、ニューロンに取り込まれた後再度グルタミン酸に変換される。グリア型グルタミン酸トランスポーターによるグルタミン酸の取り込みは、(1)神経伝達を終了させ、興奮性シナプス後電流の早いキネティクスを可能にする、(2)シナプス外へのグルタミン酸漏出を抑える、(3)グルタミン酸刺激の持続による興奮毒性を抑える、などの生理的機能をもつ。
バーグマングリアに特に発現の多いEAAT1の欠損マウスでは、生後発達期における平行線維-プルキンエ細胞間シナプスにおけるシナプス後電流の遷延[12]と外傷に対する遅延性神経細胞死の拡大[13]が見られる。また、プルキンエ細胞シナプスのミクロドメイン区画化が不完全になり、近接するプルキンエ細胞を支配する登上線維シナプスからのグルタミン酸漏出や異所的シナプスの形成による登上線維多重支配が見られる[14]。
バーグマングリアにはカルシウムイオン透過性AMPA型グルタミン酸受容体が発現し、グルタミン酸刺激に対しCa2+流入が起こり、内向き整流性の速い電流応答を示す。生体内では登上線維および平行線維に由来するグルタミン酸を受容すると考えられるが、バーグマングリアとプルキンエ細胞の発火は必ずしも同期せず、Ca2+-伝達物質放出連関や短期可塑性などの応答特性も異なることから、プルキンエ細胞シナプスからの漏出ではなく、登上線維および平行線維終末付近でバーグマングリアに対する異所性(シナプス外)の放出があると考えられる[15]。バーグマングリアにはGABAA受容体も発現し、プルキンエ細胞樹状突起および細胞体の抑制性シナプスの付近に集積する[16]。神経伝達物質応答能があるため、バーグマングリアは求心性線維終末の位置を検知し、シナプス周辺に薄片状突起を発達させることが可能になるのかもしれない。バーグマングリアのAMPA型グルタミン酸受容体の透過性を変化させると、グリア突起が退縮してミクロドメインが解離し、登上線維、平行線維ともシナプス後電流が遷延し、さらには登上線維異所支配が誘発される[17]。
バーグマングリアには代謝型グルタミン酸受容体やATP受容体(P2Y受容体)なども発現し、これらが電流応答の特性に寄与すると考えられる。自発運動中の動物において、バーグマングリアに強いCa2+濃度上昇が起こり[18]、しばしば波状に伝播していくのが観察されるが[19]、バーグマングリアの活動の生理的意義についてコンセンサスは得られていない。
病理
遺伝性脊髄小脳失調症7型(spinocerebellar ataxia type 7; SCA7)では、原因遺伝子Ataxin-7の変異によりバーグマンクリアにおけるEAAT1発現が減少し、興奮毒性による進行性のプルキンエ細胞の脱落が起こると考えられている[20]。
また、遺伝性脊髄小脳失調症1型の原因遺伝子Ataxin-1の変異によりバーグマンクリアの増殖が抑えられ、プルキンエ細胞の脱落が誘発されるとする報告がある[21]。
参考文献
- ↑
Koirala, S., & Corfas, G. (2010).
Identification of novel glial genes by single-cell transcriptional profiling of Bergmann glial cells from mouse cerebellum. PloS one, 5(2), e9198. [PubMed:20169146] [PMC] [WorldCat] [DOI] - ↑
Sudarov, A., Turnbull, R.K., Kim, E.J., Lebel-Potter, M., Guillemot, F., & Joyner, A.L. (2011).
Ascl1 genetics reveals insights into cerebellum local circuit assembly. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(30), 11055-69. [PubMed:21795554] [PMC] [WorldCat] [DOI] - ↑
Yamada, K., Fukaya, M., Shibata, T., Kurihara, H., Tanaka, K., Inoue, Y., & Watanabe, M. (2000).
Dynamic transformation of Bergmann glial fibers proceeds in correlation with dendritic outgrowth and synapse formation of cerebellar Purkinje cells. The Journal of comparative neurology, 418(1), 106-20. [PubMed:10701759] [WorldCat] - ↑
Yuasa, S. (1996).
Bergmann glial development in the mouse cerebellum as revealed by tenascin expression. Anatomy and embryology, 194(3), 223-34. [PubMed:8849669] [WorldCat] [DOI] - ↑
Das, G.D., Lammert, G.L., & McAllister, J.P. (1974).
Contact guidance and migratory cells in the developing cerebellum. Brain research, 69(1), 13-29. [PubMed:4817907] [WorldCat] [DOI] - ↑
Shiga, T., Ichikawa, M., & Hirata, Y. (1983).
Spatial and temporal pattern of postnatal proliferation of Bergmann glial cells in rat cerebellum: an autoradiographic study. Anatomy and embryology, 167(2), 203-11. [PubMed:6614505] [WorldCat] [DOI] - ↑
Altman, J. (1972).
Postnatal development of the cerebellar cortex in the rat. II. Phases in the maturation of Purkinje cells and of the molecular layer. The Journal of comparative neurology, 145(4), 399-463. [PubMed:5044254] [WorldCat] [DOI] - ↑
Yamada, K., & Watanabe, M. (2002).
Cytodifferentiation of Bergmann glia and its relationship with Purkinje cells. Anatomical science international, 77(2), 94-108. [PubMed:12418089] [WorldCat] [DOI] - ↑
Eiraku, M., Tohgo, A., Ono, K., Kaneko, M., Fujishima, K., Hirano, T., & Kengaku, M. (2005).
DNER acts as a neuron-specific Notch ligand during Bergmann glial development. Nature neuroscience, 8(7), 873-80. [PubMed:15965470] [WorldCat] [DOI] - ↑
Graus-Porta, D., Blaess, S., Senften, M., Littlewood-Evans, A., Damsky, C., Huang, Z., ..., & Müller, U. (2001).
Beta1-class integrins regulate the development of laminae and folia in the cerebral and cerebellar cortex. Neuron, 31(3), 367-79. [PubMed:11516395] [WorldCat] [DOI] - ↑
Tanaka, M., Maeda, N., Noda, M., & Marunouchi, T. (2003).
A chondroitin sulfate proteoglycan PTPzeta /RPTPbeta regulates the morphogenesis of Purkinje cell dendrites in the developing cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(7), 2804-14. [PubMed:12684467] [PMC] [WorldCat] - ↑
Marcaggi, P., Billups, D., & Attwell, D. (2003).
The role of glial glutamate transporters in maintaining the independent operation of juvenile mouse cerebellar parallel fibre synapses. The Journal of physiology, 552(Pt 1), 89-107. [PubMed:12878755] [PMC] [WorldCat] [DOI] - ↑
Watase, K., Hashimoto, K., Kano, M., Yamada, K., Watanabe, M., Inoue, Y., ..., & Tanaka, K. (1998).
Motor discoordination and increased susceptibility to cerebellar injury in GLAST mutant mice. The European journal of neuroscience, 10(3), 976-88. [PubMed:9753165] [WorldCat] [DOI] - ↑
Takayasu, Y., Iino, M., Shimamoto, K., Tanaka, K., & Ozawa, S. (2006).
Glial glutamate transporters maintain one-to-one relationship at the climbing fiber-Purkinje cell synapse by preventing glutamate spillover. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(24), 6563-72. [PubMed:16775144] [PMC] [WorldCat] [DOI] - ↑
Matsui, K., Jahr, C.E., & Rubio, M.E. (2005).
High-concentration rapid transients of glutamate mediate neural-glial communication via ectopic release. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(33), 7538-47. [PubMed:16107641] [PMC] [WorldCat] [DOI] - ↑
Riquelme, R., Miralles, C.P., & De Blas, A.L. (2002).
Bergmann glia GABA(A) receptors concentrate on the glial processes that wrap inhibitory synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(24), 10720-30. [PubMed:12486165] [PMC] [WorldCat] - ↑
Iino, M., Goto, K., Kakegawa, W., Okado, H., Sudo, M., Ishiuchi, S., ..., & Ozawa, S. (2001).
Glia-synapse interaction through Ca2+-permeable AMPA receptors in Bergmann glia. Science (New York, N.Y.), 292(5518), 926-9. [PubMed:11340205] [WorldCat] [DOI] - ↑
Nimmerjahn, A., Mukamel, E.A., & Schnitzer, M.J. (2009).
Motor behavior activates Bergmann glial networks. Neuron, 62(3), 400-12. [PubMed:19447095] [PMC] [WorldCat] [DOI] - ↑
Hoogland, T.M., Kuhn, B., Göbel, W., Huang, W., Nakai, J., Helmchen, F., ..., & Wang, S.S. (2009).
Radially expanding transglial calcium waves in the intact cerebellum. Proceedings of the National Academy of Sciences of the United States of America, 106(9), 3496-501. [PubMed:19211787] [PMC] [WorldCat] [DOI] - ↑
Custer, S.K., Garden, G.A., Gill, N., Rueb, U., Libby, R.T., Schultz, C., ..., & La Spada, A.R. (2006).
Bergmann glia expression of polyglutamine-expanded ataxin-7 produces neurodegeneration by impairing glutamate transport. Nature neuroscience, 9(10), 1302-11. [PubMed:16936724] [WorldCat] [DOI] - ↑
Shiwaku, H., Yoshimura, N., Tamura, T., Sone, M., Ogishima, S., Watase, K., ..., & Okazawa, H. (2010).
Suppression of the novel ER protein Maxer by mutant ataxin-1 in Bergman glia contributes to non-cell-autonomous toxicity. The EMBO journal, 29(14), 2446-60. [PubMed:20531390] [PMC] [WorldCat] [DOI]