「プロスタグランジン」の版間の差分
細 →関連項目 |
|||
| (3人の利用者による、間の19版が非表示) | |||
| 1行目: | 1行目: | ||
英:prostaglandin、英略語:PG、独:Prostaglandine、仏:prostaglandine<br> | |||
プロスタグランジンは五員環構造を含む20個の炭素鎖からなる生理活性[[wikipedia:ja:脂質|脂質]]である<ref name="ref1"><pubmed>116251</pubmed></ref>。プロスタグランジンと構造の類似した[[トロンボキサン]]を併せてプロスタノイド(prostanoid)と称する。1930年に[[wikipedia:ja:ヒト|ヒト]]の[[wikipedia:ja:精液|精液]]に含まれる[[wikipedia:ja:子宮|子宮]]収縮物質として発見された。[[wikipedia:ja:非ステロイド性抗炎症薬|非ステロイド性抗炎症薬]](NSAID)の抗[[wikipedia:ja:炎症|炎症]]作用、[[wikipedia:ja:鎮痛|鎮痛]]作用、[[wikipedia:ja:解熱|解熱]]作用は、主にプロスタノイドの合成阻害によると考えられている<ref name="ref2"><pubmed>9597150</pubmed></ref>。生体には五員環構造の側鎖や炭素鎖の二重結合の数の異なる多種のプロスタノイドが存在するが、これまでの研究では主にプロスタグランジンD<sub>2</sub> (PGD<sub>2</sub>)、プロスタグランジンE<sub>2</sub>(PGE<sub>2</sub>)、プロスタグランジンF<sub>2α</sub>(PGF<sub>2α</sub>)、 プロスタサイクリン(プロスタグランジンI<sub>2</sub>、PGI<sub>2</sub>)、トロンボキサンA<sub>2</sub>(TXA<sub>2</sub>)の役割が解析されてきた。PGD<sub>2</sub>、PGE<sub>2</sub>、PGF<sub>2α</sub>、PGI<sub>2</sub>、TXA<sub>2</sub>はDP、EP、FP、IP、TPと呼ばれる特異的な[[Gタンパク質共役型受容体]]を介して、多様な生理機能、病態生理機能に関わる<ref name="ref3"><pubmed>21357250</pubmed></ref>。これらの機能には、[[wikipedia:ja:循環器|循環器]]・[[wikipedia:ja:消化器|消化器]]・[[wikipedia:ja:骨|骨]]の[[wikipedia:ja:恒常性|恒常性]]維持、[[wikipedia:ja:卵巣|卵巣]]や子宮といった[[wikipedia:ja:生殖器|生殖器]]の機能、局所炎症に伴う[[wikipedia:ja:血管透過性|血管透過性]]亢進や[[wikipedia:ja:疼痛|疼痛]]惹起、[[wikipedia:ja:細胞性免疫|細胞性免疫]]応答、[[睡眠]]、疾病時の発熱や[[wikipedia:ja:内分泌|内分泌]]応答、[[神経変性疾患]]や[[脳虚血]]に伴う[[神経細胞死]]、脳機能的充血、[[シナプス可塑性]]や[[記憶学習]]、[[心理ストレス]]下での[[情動]]制御などが含まれる。 | |||
[[Image:ProstanoidSignaling.jpg|thumb|350px|'''図''']] | |||
== プロスタグランジン生合成 == | |||
== | 炭素鎖内の二重結合を二つ有するPGD<sub>2</sub>、PGE<sub>2</sub>、PGF<sub>2α</sub>、PGI<sub>2</sub>、TXA<sub>2</sub>は、遊離[[アラキドン酸]]から生成される<ref name="ref2" /><ref name="ref3" /><ref name="ref4"><pubmed>21942677</pubmed></ref><ref name="ref5"><pubmed>18834304</pubmed></ref><ref name="ref6"><pubmed>14636669</pubmed></ref>。まず、酸素添加酵素である[[シクロオキシゲナーゼ]]([[cyclooxygenase]]; [[COX]])により、アラキドン酸からプロスタグランジンG<sub>2</sub>(PGG<sub>2</sub>)、さらにプロスタグランジンH<sub>2</sub>(PGH<sub>2</sub>)が産生される。次いで特異的な合成酵素の働きにより、PGH<sub>2</sub>が各種PGに変換される。 | ||
一般にPG生成は[[phospholipase A2|phospholipase A<sub>2</sub>]](PLA<sub>2</sub>)により細胞膜中のリン脂質からアラキドン酸が切り出されて開始すると考えられている<ref name="ref5" /><ref name="ref6" />。例えば、[[wikipedia:ja:マクロファージ|マクロファージ]]からのPG産生は[[cytosolic PLA2|cytosolic PLA<sub>2</sub>]] (cPLA<sub>2</sub>)の遺伝子欠損によりほぼ完全に消失する。cPLA<sub>2</sub>の活性は細胞内[[Ca2+|Ca<sup>2+</sup>]]上昇によるcPLA<sub>2</sub>の膜移行、[[MAPキナーゼ]]などによる[[リン酸化]]、遺伝子発現制御といった複数のメカニズムにより制御されている。しかし近年、脳、肝臓、肺の遊離アラキドン酸とその下流で生成されるPGの多くが、[[モノアシルグリセロールリパーゼ]](monoacylglycerol lipase; MAGL)依存的な[[内因性カナビノイド]][[2-アラキドノイルグリセロール]](2-arachidonyl-glycerol; 2-AG)の[[wikipedia:ja:加水分解|加水分解]]により生ずることが報告されている<ref name="ref7"><pubmed> 22021672 </pubmed></ref>。 | |||
COXには[[COX-1]]と[[COX-2]]と呼ばれる二つのアイソフォームが存在する<ref name="ref2" /><ref name="ref3" /><ref name="ref4" /><ref name="ref5" /><ref name="ref6" />。一般に、COX-1は刺激による誘導性が乏しいことから構成型と呼ばれ、COX-2は刺激により[[遺伝子発現]]が誘導されることから誘導型と呼ばれるが、[[脳]]や[[wikipedia:ja:腎臓|腎臓]]ではCOX-1、COX-2のいずれも恒常的に発現している。生理的条件ではCOX-1は[[ミクログリア]]や血管周囲マクロファージに<ref name="ref8"><pubmed>22022466</pubmed></ref>、COX-2は[[大脳皮質]]や[[海馬]]などの[[錐体細胞]]に発現している<ref name="ref9"><pubmed>8352945</pubmed></ref>。さらに炎症や神経変性疾患では、[[血管内皮細胞]]や[[グリア細胞]]にもCOX-2の発現が誘導される<ref name="ref10"><pubmed>15353317</pubmed></ref><ref name="ref11"><pubmed>15081582</pubmed></ref>。COXは[[wikipedia:ja:非ステロイド性抗炎症薬|非ステロイド性抗炎症薬]](NSAID)の主たる標的分子であり、NSAIDの抗炎症作用、鎮痛作用、解熱作用はPGの合成阻害活性によると考えられている<ref name="ref2" />。 | |||
COXには[[COX-1]]と[[COX-2]]と呼ばれる二つのアイソフォームが存在する<ref name="ref2" /><ref name="ref3" /><ref name="ref4" /><ref name="ref5" /><ref name="ref6" />。一般に、COX-1は刺激による誘導性が乏しいことから構成型と呼ばれ、COX-2は刺激により[[遺伝子発現]]が誘導されることから誘導型と呼ばれるが、[[脳]]や[[ | |||
PGH<sub>2</sub>から各種PG合成を触媒する酵素群も多数同定されている<ref name="ref4" /><ref name="ref6" />。PGH<sub>2</sub>からPGD<sub>2</sub>の合成には[[PGD合成酵素]](PGDS)が関与し、[[造血器型PGDS]](hematopoietic PGDS; H-PGDS)と[[リポカリン型PGDS]](lipocalin-type PGDS; L-PGDS)の二種類が存在する<ref name="ref12"><pubmed>12432930</pubmed></ref>。PGH<sub>2</sub>からPGE<sub>2</sub>の合成に関わる[[PGE合成酵素]](PGES)には、[[cytosolic PGES]](cPGES)、[[microsomal PGES-1]](mPGES-1)、[[microsomal PGES-2]](mPGES-2)の三つのアイソフォームが報告され、それぞれ異なる機能を有することが示されている<ref name="ref6" />。COXとPGESの共役にはアイソフォーム特異性があることが知られ、cPGESはCOX-1と、mPGES-1はCOX-2と、mPGES-2はCOX-1とCOX-2の両方と共役しPGE<sub>2</sub>合成に関わるとされる。PGH<sub>2</sub>からPGF<sub>2α</sub>の合成には[[PGF合成酵素]](PGFS)が関与し、現在まで[[aldo-keto reductase (AKR) 1C]] familyや[[AKR5A]] familyがPGFS活性を持つことが報告されている<ref name="ref13"><pubmed>12432932</pubmed></ref>。PGH<sub>2</sub>からPGI<sub>2</sub>やTXA<sub>2</sub>の合成には[[シトクロームp450]]ファミリーに属する[[PGI合成酵素]](PGIS)や[[TXA合成酵素]](TXAS)が関与する<ref name="ref14"><pubmed>8777569</pubmed></ref>。 | PGH<sub>2</sub>から各種PG合成を触媒する酵素群も多数同定されている<ref name="ref4" /><ref name="ref6" />。PGH<sub>2</sub>からPGD<sub>2</sub>の合成には[[PGD合成酵素]](PGDS)が関与し、[[造血器型PGDS]](hematopoietic PGDS; H-PGDS)と[[リポカリン型PGDS]](lipocalin-type PGDS; L-PGDS)の二種類が存在する<ref name="ref12"><pubmed>12432930</pubmed></ref>。PGH<sub>2</sub>からPGE<sub>2</sub>の合成に関わる[[PGE合成酵素]](PGES)には、[[cytosolic PGES]](cPGES)、[[microsomal PGES-1]](mPGES-1)、[[microsomal PGES-2]](mPGES-2)の三つのアイソフォームが報告され、それぞれ異なる機能を有することが示されている<ref name="ref6" />。COXとPGESの共役にはアイソフォーム特異性があることが知られ、cPGESはCOX-1と、mPGES-1はCOX-2と、mPGES-2はCOX-1とCOX-2の両方と共役しPGE<sub>2</sub>合成に関わるとされる。PGH<sub>2</sub>からPGF<sub>2α</sub>の合成には[[PGF合成酵素]](PGFS)が関与し、現在まで[[aldo-keto reductase (AKR) 1C]] familyや[[AKR5A]] familyがPGFS活性を持つことが報告されている<ref name="ref13"><pubmed>12432932</pubmed></ref>。PGH<sub>2</sub>からPGI<sub>2</sub>やTXA<sub>2</sub>の合成には[[シトクロームp450]]ファミリーに属する[[PGI合成酵素]](PGIS)や[[TXA合成酵素]](TXAS)が関与する<ref name="ref14"><pubmed>8777569</pubmed></ref>。 | ||
== | == プロスタグランジン受容体 == | ||
PGD<sub>2</sub>、PGE<sub>2</sub>、PGF<sub>2α</sub>、PGI<sub>2</sub>、TXA<sub>2</sub>は、それぞれ[[ | PGD<sub>2</sub>、PGE<sub>2</sub>、PGF<sub>2α</sub>、PGI<sub>2</sub>、TXA<sub>2</sub>は、それぞれ[[DP]]、[[EP]]、[[FP]]、[[IP]]、[[TP]]と呼ばれるGタンパク質共役型受容体に結合して作用を発揮する<ref name="ref3" />。DPには[[DP1]]と[[DP2]]が、EPには[[EP1]]、[[EP2]]、[[EP3]]、[[EP4]]が存在し、それぞれ異なる遺伝子によりコードされている。 | ||
これらPG受容体は組織、細胞レベルの発現分布や[[細胞内情報伝達]]が異なることで、特異的な機能を発揮すると考えられている<ref name="ref3" />。DP2以外の八種の受容体はプロスタノイド受容体ファミリーを形成し、細胞内情報伝達とその作用からrelaxant receptor、contractile receptor、inhibitory receptorの三種に分類されている<ref name="ref3" />。Relaxant receptorは主に[[Gs]]を介して[[ | これらPG受容体は組織、細胞レベルの発現分布や[[細胞内情報伝達]]が異なることで、特異的な機能を発揮すると考えられている<ref name="ref3" />。DP2以外の八種の受容体はプロスタノイド受容体ファミリーを形成し、細胞内情報伝達とその作用からrelaxant receptor、contractile receptor、inhibitory receptorの三種に分類されている<ref name="ref3" />。Relaxant receptorは主に[[Gs]]を介して[[cAMP]]上昇を惹起し[[平滑筋]]の弛緩を誘導する受容体で、DP1、EP2、EP4、IPを含む。Contractile receptorは主に細胞内Ca<sup>2+</sup>上昇を惹起し平滑筋の収縮を誘導する受容体で、TP、FP、EP1を含む。Inhibitory receptorは主に[[Gi]]を介するcAMP抑制により平滑筋の弛緩を抑制する受容体で、EP3を含む。但し、EP3にはマウスでは三種、ヒトでは四種のalternative splicingアイソフォームが存在し、ヒトTPにもαとβと呼ばれる二つのアイソフォームが存在する。これらのアイソフォームは異なる細胞内情報伝達に共役することが知られている。DP2は他の八種の受容体とは別のファミリーに属し、CRTH2やGPR44とも称される<ref name="ref15"><pubmed>12895600</pubmed></ref>。Giと共役して[[Th2細胞]]、[[wikipedia:ja:好酸球|好酸球]]、[[wikipedia:ja:好塩基球|好塩基球]]の遊走を誘導することが知られている。 | ||
このように、プロスタグランジンの生合成や作用に関わる分子種は多岐にわたるが、PG生合成酵素群やPG受容体の[[遺伝子欠損マウス]]や特異的阻害薬に登場により、各種PGとその受容体の特異的な役割が解明されてきた。本稿では、脳機能と関連の深い機能に限って紹介する。 | |||
== 脳機能におけるプロスタグランジンの役割 == | == 脳機能におけるプロスタグランジンの役割 == | ||
| 99行目: | 27行目: | ||
=== 疾病応答 === | === 疾病応答 === | ||
感染や組織損傷は局所炎症に留まらず、発熱、[[視床下部-下垂体-副腎系]](hypothalamus-pituitary-adrenal axis; HPA)活性化、[[食欲]]不振、[[疲労]]、[[傾眠]]、[[痛覚]]過敏といった全身症状を呈する<ref name="ref16"><pubmed>18073775</pubmed></ref>。これらの症状は[[ | 感染や組織損傷は局所炎症に留まらず、発熱、[[視床下部-下垂体-副腎系]](hypothalamus-pituitary-adrenal axis; HPA)活性化、[[食欲]]不振、[[疲労]]、[[傾眠]]、[[痛覚]]過敏といった全身症状を呈する<ref name="ref16"><pubmed>18073775</pubmed></ref>。これらの症状は[[wikipedia:ja:疾病応答|疾病応答]](sickness behavior; sickness response)と呼ばれ、生存を促進する適応的反応と考えられている。PG合成を阻害するNSAIDはこれらの多くの症状を改善することから、疾病応答におけるPGの役割が推測されてきた<ref name="ref17"><pubmed>22837039</pubmed></ref><ref name="ref18"><pubmed>19275907</pubmed></ref>。[[wikipedia:ja:細菌|細菌]][[wikipedia:ja:内毒素|内毒素]]である[[wikipedia:ja:リポ多糖類|リポ多糖類]](lipopolysaccharide; LPS)や[[サイトカイン]]の一種[[IL-1β]]を末梢に投与すると疾病応答の多くが再現されることから、疾病応答におけるPGE<sub>2</sub>の作用機序に関する研究にはLPSやIL-1βを全身投与した小動物を用いた疾病応答モデルが主に用いられてきた。 | ||
=== 発熱 === | === 発熱 === | ||
[[視床下部]][[視索前野]]へのNSAIDやPGE2の局所注入実験により、視索前野におけるPGE2産生が疾病応答モデルによる[[体温調節の神経回路|発熱]]に寄与することが示唆されてきた<ref name="ref17" />。その後、[[遺伝子改変マウス]]の解析により、PGE2生合成に関わるCOX-2とmPGES-1が疾病応答モデルにおける発熱に必須であることが示された<ref name="ref19"><pubmed>10216176</pubmed></ref><ref name="ref20"><pubmed>14566340</pubmed></ref>。LPSの全身投与により、COX-2とmPGES-1が脳内の[[ | [[視床下部]][[視索前野]]へのNSAIDやPGE2の局所注入実験により、視索前野におけるPGE2産生が疾病応答モデルによる[[体温調節の神経回路|発熱]]に寄与することが示唆されてきた<ref name="ref17" />。その後、[[遺伝子改変マウス]]の解析により、PGE2生合成に関わるCOX-2とmPGES-1が疾病応答モデルにおける発熱に必須であることが示された<ref name="ref19"><pubmed>10216176</pubmed></ref><ref name="ref20"><pubmed>14566340</pubmed></ref>。LPSの全身投与により、COX-2とmPGES-1が脳内の[[wikipedia:ja:血管内皮|血管内皮]]細胞に共に誘導されることから、疾病時の発熱には血管内皮細胞からのPGE2産生が関与することが示唆された<ref name="ref10" /><ref name="ref21"><pubmed>11306620</pubmed></ref>。しかし、血管内皮細胞でのCOX-2とmPGES-1の遺伝子発現誘導はLPS投与から一時間程度の発熱の初期相には見られない。一方、[[wikipedia:ja:肺|肺]]や[[wikipedia:ja:肝臓|肝臓]]におけるマクロファージではCOX-2の発現は末梢へのLPS投与により速やかに誘導され、末梢血中のPGE2濃度も速やかに上昇する<ref name="ref22"><pubmed>16933973</pubmed></ref>。さらに末梢血中へのPGE2阻害[[wikipedia:ja:抗体|抗体]]投与により発熱が遅延することから、発熱の初期相には脳外で産生されたPGE2の関与が示唆された<ref name="ref22" />。 | ||
EP3欠損マウスではLPSやIL-1βによる発熱応答は消失することから、疾病時の発熱にはEP3が主に働くことが示された<ref name="ref23"><pubmed>9751056</pubmed></ref><ref name="ref24"><pubmed>12837930</pubmed></ref>。しかしEP1欠損マウスでもLPSの投与量によって発熱応答に異常を認めることから、部分的にEP1の関与もある<ref name="ref24" />。さらに[[条件付け欠損マウス]]により、疾病応答における発熱には視索前野神経細胞におけるEP3が必須であることが示された<ref name="ref25"><pubmed>17676060</pubmed></ref>。EP3は視索前野の[[抑制性神経細胞]]に発現しているが、この神経細胞は[[淡蒼縫線核]](raphe pallidus; RPa)にある[[交感神経系]]の[[前運動神経]]を直接的あるいは間接的に抑制する<ref name="ref26"><pubmed>12040067</pubmed></ref>。EP3の活性化は視索前野の抑制性神経細胞を抑制することで、RPaの交感神経系を脱抑制すると考えられている。発熱は皮膚血管収縮による放熱減少、[[ | EP3欠損マウスではLPSやIL-1βによる発熱応答は消失することから、疾病時の発熱にはEP3が主に働くことが示された<ref name="ref23"><pubmed>9751056</pubmed></ref><ref name="ref24"><pubmed>12837930</pubmed></ref>。しかしEP1欠損マウスでもLPSの投与量によって発熱応答に異常を認めることから、部分的にEP1の関与もある<ref name="ref24" />。さらに[[条件付け欠損マウス]]により、疾病応答における発熱には視索前野神経細胞におけるEP3が必須であることが示された<ref name="ref25"><pubmed>17676060</pubmed></ref>。EP3は視索前野の[[抑制性神経細胞]]に発現しているが、この神経細胞は[[淡蒼縫線核]](raphe pallidus; RPa)にある[[交感神経系]]の[[前運動神経]]を直接的あるいは間接的に抑制する<ref name="ref26"><pubmed>12040067</pubmed></ref>。EP3の活性化は視索前野の抑制性神経細胞を抑制することで、RPaの交感神経系を脱抑制すると考えられている。発熱は皮膚血管収縮による放熱減少、[[wikipedia:ja:褐色脂肪組織|褐色脂肪組織]]からの熱産生促進、ふるえと呼ばれる不随意の筋収縮により誘導される。脳領域不活性化実験から、視索前野におけるEP3活性化は、RPaへの直接投射により皮膚血管の収縮を促し、[[視床下部背内側]](dorsomedial hypothalamus; DMH)を経てRPaへ至る間接投射を介して褐色脂肪組織の熱産生を惹起すると考えられている<ref name="ref27"><pubmed>19327390</pubmed></ref>。 | ||
=== HPA系活性化 === | === HPA系活性化 === | ||
視床下部の[[室傍核]](paraventricular hypothalamic nucleus; PVN)の小細胞領域には[[コルチコトロピン放出因子]](corticotropin-releasing hormone; CRH)陽性の神経細胞が存在する。このCRH陽性神経細胞は[[正中隆起]](median eminence; ME)に[[軸索]]を投射しており、神経細胞の活性化に応じてCRHを[[下垂体門脈系]]に放出する。CRHは[[下垂体前葉]]からの[[副腎皮質刺激ホルモン]](adrenocorticotropic hormone; ACTH)放出を誘導し、ACTHは[[wikipedia:ja:副腎皮質|副腎皮質]]から[[糖質コルチコイド]]放出を促す。この一連の過程をHPA系活性化と称する。視索前野へのNSAIDとPGE<sub>2</sub>の局所投与実験から、LPSによるHPA系活性化に視索前野におけるPGE<sub>2</sub>作用が関与することが示唆されてきた<ref name="ref28"><pubmed>9922367</pubmed></ref>。 | |||
LPS投与によるHPA系活性化にはタイミングによって異なるPGE<sub>2</sub>生成機構が関与する。すなわちCOX-2やmPGES-1の欠損マウスではLPS投与から6時間後の[[コルチコステロン]]放出は減弱するが、LPS投与から1時間後では減弱を認めない<ref name="ref29"><pubmed>19193887</pubmed></ref>。LPS投与により脳内の血管内皮細胞におけるCOX-2とmPGES-1の発現が共に誘導されることから、LPSによるHPA系活性化の後期相に血管内皮からのPGE2産生が関与する可能性が示唆される。一方、COX-1欠損マウスではLPS投与から1時間後のコルチコステロン上昇が消失するのに対し、6時間後のコルチコステロン上昇は正常であることから、HPA系活性化の初期相にはCOX-1を介したPG産生が関わる<ref name="ref30"><pubmed>20034541</pubmed></ref>。COX-1特異的阻害薬の脳室内投与によりLPS投与によるHPA系活性化の初期相が阻害されることから、COX-1の作用点は脳内であると考えられる<ref name="ref31"><pubmed>19828811</pubmed></ref>。生理的条件下ではCOX-1はミクログリアや血管周囲マクロファージに発現しているが、LPS投与により速やかに血管内皮に誘導されることが報告されている<ref name="ref31" />。 | LPS投与によるHPA系活性化にはタイミングによって異なるPGE<sub>2</sub>生成機構が関与する。すなわちCOX-2やmPGES-1の欠損マウスではLPS投与から6時間後の[[コルチコステロン]]放出は減弱するが、LPS投与から1時間後では減弱を認めない<ref name="ref29"><pubmed>19193887</pubmed></ref>。LPS投与により脳内の血管内皮細胞におけるCOX-2とmPGES-1の発現が共に誘導されることから、LPSによるHPA系活性化の後期相に血管内皮からのPGE2産生が関与する可能性が示唆される。一方、COX-1欠損マウスではLPS投与から1時間後のコルチコステロン上昇が消失するのに対し、6時間後のコルチコステロン上昇は正常であることから、HPA系活性化の初期相にはCOX-1を介したPG産生が関わる<ref name="ref30"><pubmed>20034541</pubmed></ref>。COX-1特異的阻害薬の脳室内投与によりLPS投与によるHPA系活性化の初期相が阻害されることから、COX-1の作用点は脳内であると考えられる<ref name="ref31"><pubmed>19828811</pubmed></ref>。生理的条件下ではCOX-1はミクログリアや血管周囲マクロファージに発現しているが、LPS投与により速やかに血管内皮に誘導されることが報告されている<ref name="ref31" />。 | ||
| 117行目: | 45行目: | ||
=== 摂食行動 === | === 摂食行動 === | ||
mPGES-1欠損マウスでは、IL-1βの[[ | mPGES-1欠損マウスでは、IL-1βの[[wikipedia:ja:腹腔|腹腔]]内投与による[[摂食制御の神経回路|摂食行動]]抑制がほぼ完全に消失することから、疾病時の食欲不振の少なくとも一部にPGE2が関与することが示唆されている<ref name="ref33"><pubmed>16554545</pubmed></ref><ref name="ref34"><pubmed>16946079</pubmed></ref>。EP4アゴニストの[[脳室]]内投与により摂食行動が抑制されること、PGE2の[[脳室]]内投与による摂食行動の抑制がEP4阻害薬により消失することから、食欲不振におけるEP4の役割が示唆されている<ref name="ref35"><pubmed>16997129</pubmed></ref>。一方、DP1活性化は[[NPY受容体]][[Y1]]依存的に摂食行動を促進することが示されている<ref name="ref36"><pubmed>18258196</pubmed></ref>。 | ||
=== 覚醒睡眠 === | === 覚醒睡眠 === | ||
PGD<sub>2</sub>が睡眠促進物質であることはPGD<sub>2</sub>の[[側脳室]]投与により示された<ref name="ref37"><pubmed>10724461</pubmed></ref>。PGD合成酵素には[[L-PGDS]]と[[H-PGDS]]があるが、L-PGDSの[[阻害薬]]であるSeCl<sub>4</sub>とL-PGDS欠損マウスを用いて、L-PGDSが生理的な睡眠に関与することが示された<ref name="ref38"><pubmed>17093043</pubmed></ref>。さらにL-PGDS欠損マウスを用いた解析から、断眠によりL-PGDS依存的に脳内のPGD2が蓄積し、このPGD2生成が断眠後のノンレム睡眠のリバウンドに必須であることが示されている<ref name="ref39">Eguchi, N., Kuwahata, Y., Pinzar, E., Mochizuki, T., Urade, Y., Hayaishi, O. (1999) Sleep of gene-knockout and transgenic mice for prostaglandin D synthase. Sleep Res. Online 2 Suppl-1, 665</ref>。PGD<sub>2</sub>による睡眠促進作用はDP1を介することがDP1欠損マウスを用いて示されている<ref name="ref40"><pubmed>11562489</pubmed></ref>。L-PGDSは[[軟髄膜]]、[[脈絡叢]]、[[オリゴデンドロサイト]]に発現するのに対し、DP1は睡眠誘導に関わる腹外側視索前野の近傍の軟髄膜に限局して発現する<ref name="ref40" />。PGD<sub>2</sub>による睡眠促進作用は[[ | PGD<sub>2</sub>が睡眠促進物質であることはPGD<sub>2</sub>の[[側脳室]]投与により示された<ref name="ref37"><pubmed>10724461</pubmed></ref>。PGD合成酵素には[[L-PGDS]]と[[H-PGDS]]があるが、L-PGDSの[[阻害薬]]であるSeCl<sub>4</sub>とL-PGDS欠損マウスを用いて、L-PGDSが生理的な睡眠に関与することが示された<ref name="ref38"><pubmed>17093043</pubmed></ref>。さらにL-PGDS欠損マウスを用いた解析から、断眠によりL-PGDS依存的に脳内のPGD2が蓄積し、このPGD2生成が断眠後のノンレム睡眠のリバウンドに必須であることが示されている<ref name="ref39">Eguchi, N., Kuwahata, Y., Pinzar, E., Mochizuki, T., Urade, Y., Hayaishi, O. (1999) Sleep of gene-knockout and transgenic mice for prostaglandin D synthase. Sleep Res. Online 2 Suppl-1, 665</ref>。PGD<sub>2</sub>による睡眠促進作用はDP1を介することがDP1欠損マウスを用いて示されている<ref name="ref40"><pubmed>11562489</pubmed></ref>。L-PGDSは[[軟髄膜]]、[[脈絡叢]]、[[オリゴデンドロサイト]]に発現するのに対し、DP1は睡眠誘導に関わる腹外側視索前野の近傍の軟髄膜に限局して発現する<ref name="ref40" />。PGD<sub>2</sub>による睡眠促進作用は[[アデノシンA2a受容体|アデノシンA<sub>2a</sub>受容体]]の阻害薬の腹腔内投与により阻害される<ref name="ref41"><pubmed>8650205</pubmed></ref>。以上の結果から、L-PGDSにより産生されたPGD<sub>2</sub>が軟膜に発現するDP1に結合し、[[くも膜下腔]]のアデノシン濃度を上昇させ、アデノシンA<sub>2a</sub>受容体を介して睡眠を誘導すると考えられている。一方、PGE<sub>2</sub>は[[覚醒促進物質]]であり、[[隆起乳頭体核]](tuberomammillary nucleus; TMN)の[[ヒスタミン]]神経細胞に発現したEP4に作用し、ヒスタミンの生合成と[[大脳皮質]]での放出を促進することが示唆されている<ref name="ref42"><pubmed>12853415</pubmed></ref>。 | ||
=== 疼痛 === | === 疼痛 === | ||
| 135行目: | 63行目: | ||
脳内のPGE<sub>2</sub>は、疾病応答のみならず、心理[[ストレス]]下での情動制御にも関与することが示されている<ref name="ref53"><pubmed>21116297</pubmed></ref>。EP1欠損マウスは、[[社会行動]]の破綻と[[攻撃性]]の亢進、断崖からの異常な飛び降り行動、[[音驚愕反応]]の亢進を呈する<ref name="ref54"><pubmed>16247016</pubmed></ref>。一方、[[オープンフィールド]]における運動量、[[高架式十字迷路]]における[[不安行動]]、[[Y字迷路]]における短期[[記憶]][[学習]]、ホームケージにおける行動には明らかな異常を認めない。これらの行動異常から、心理ストレス下での衝動性制御におけるEP1の役割が提唱されている。この行動異常の一部はEP1阻害薬投与により再現される。さらにEP1アゴニストの脳室内投与により攻撃性が抑制されることから、EP1の作用点は脳内にあることが示唆された<ref name="ref54" />。 | 脳内のPGE<sub>2</sub>は、疾病応答のみならず、心理[[ストレス]]下での情動制御にも関与することが示されている<ref name="ref53"><pubmed>21116297</pubmed></ref>。EP1欠損マウスは、[[社会行動]]の破綻と[[攻撃性]]の亢進、断崖からの異常な飛び降り行動、[[音驚愕反応]]の亢進を呈する<ref name="ref54"><pubmed>16247016</pubmed></ref>。一方、[[オープンフィールド]]における運動量、[[高架式十字迷路]]における[[不安行動]]、[[Y字迷路]]における短期[[記憶]][[学習]]、ホームケージにおける行動には明らかな異常を認めない。これらの行動異常から、心理ストレス下での衝動性制御におけるEP1の役割が提唱されている。この行動異常の一部はEP1阻害薬投与により再現される。さらにEP1アゴニストの脳室内投与により攻撃性が抑制されることから、EP1の作用点は脳内にあることが示唆された<ref name="ref54" />。 | ||
[[衝動性]]の制御には[[ドーパミン]]など[[モノアミン系]]の重要性が知られている。ドーパミン放出の生化学的指標であるドーパミン代謝回転計測や[[脳微小透析法]]による細胞外ドーパミン濃度計測から、EP1欠損マウスの[[前頭前皮質]]や[[線条体]]ではドーパミン放出が亢進していることが示唆された<ref name="ref54" /><ref name="ref55"><pubmed>20092576</pubmed></ref>。さらにEP1欠損マウスの攻撃性や音驚愕反応の亢進が[[ドーパミンD1様受容体]]阻害薬により消失することから<ref name="ref54" />、EP1欠損マウスの行動異常の少なくとも一部はドーパミン系亢進によると考えられている。このEP1作用に合致し、EP1アゴニストにより[[黒質緻密部]] | [[衝動性]]の制御には[[ドーパミン]]など[[モノアミン系]]の重要性が知られている。ドーパミン放出の生化学的指標であるドーパミン代謝回転計測や[[脳微小透析法]]による細胞外ドーパミン濃度計測から、EP1欠損マウスの[[前頭前皮質]]や[[線条体]]ではドーパミン放出が亢進していることが示唆された<ref name="ref54" /><ref name="ref55"><pubmed>20092576</pubmed></ref>。さらにEP1欠損マウスの攻撃性や音驚愕反応の亢進が[[ドーパミンD1様受容体]]阻害薬により消失することから<ref name="ref54" />、EP1欠損マウスの行動異常の少なくとも一部はドーパミン系亢進によると考えられている。このEP1作用に合致し、EP1アゴニストにより[[黒質緻密部]]のドーパミン神経細胞への抑制性シナプス入力が増強されることが示されている<ref name="ref55" />。 | ||
EP1によるドーパミン系抑制は[[反復ストレス]]による情動変容誘導にも重要である<ref name="ref56"><pubmed>22442093</pubmed></ref>。反復社会挫折ストレスは社会的忌避行動や不安様行動を誘導するが、EP1欠損マウスではこれらの情動変容が観察されない。[[社会挫折ストレス]]は[[前頭前皮質]]に投射する[[腹側被蓋野]]([[ventral tegmental area]]; [[VTA]] | EP1によるドーパミン系抑制は[[反復ストレス]]による情動変容誘導にも重要である<ref name="ref56"><pubmed>22442093</pubmed></ref>。反復社会挫折ストレスは社会的忌避行動や不安様行動を誘導するが、EP1欠損マウスではこれらの情動変容が観察されない。[[社会挫折ストレス]]は[[前頭前皮質]]に投射する[[腹側被蓋野]]([[ventral tegmental area]]; [[VTA]])ドーパミン神経細胞を活性化し、社会的忌避行動の発現を抑制する。社会挫折ストレスの反復により前頭前皮質ドーパミン系の応答は抑制されるが、EP1欠損マウスではこの前頭前皮質ドーパミン系の抑制が消失する。さらにEP1欠損マウスへのドーパミンD1様受容体阻害薬の投与により社会的忌避行動が回復することから、PGE<sub>2</sub>-EP1系による前頭前皮質ドーパミン系の抑制が反復ストレスによる情動変容に関わることが示唆される。反復ストレスによる社会的忌避行動誘導にはCOX-1が特異的に関与する<ref name="ref56" />。脳内ではCOX-1は[[ミクログリア]]に発現しており、反復ストレスによりミクログリア活性化が誘導されることが組織学的に示唆されている<ref name="ref56" />。これらの結果は、反復ストレスによる情動変容にミクログリア由来のPGE<sub>2</sub>産生が関与する可能性を提示するが、今後の検証が必要である。 | ||
一方、EP1欠損マウスでは、細胞外ドーパミン濃度を上昇させる[[コカイン]] | 一方、EP1欠損マウスでは、細胞外ドーパミン濃度を上昇させる[[コカイン]]やドーパミンD1様受容体アゴニストの全身投与による運動量増加の度合いが減弱している<ref name="ref57"><pubmed>18032663</pubmed></ref>。EP1は線条体では[[直接路]]と[[間接路]]を形成する[[中型有棘細胞]]に発現している。線条体[[スライス]]におけるEP1活性化は、ドーパミンD1受容体活性化による[[DARPP-32]] Thr34リン酸化亢進と[[ドーパミンD2受容体]]活性化によるDARPP-32 Thr34リン酸化抑制のいずれも促進することが示されている。 | ||
=== シナプス可塑性と記憶学習 === | === シナプス可塑性と記憶学習 === | ||
| 145行目: | 73行目: | ||
海馬へのPG合成阻害薬の投与により、[[迷路|水迷路試験]]における海馬依存的な長期的[[空間学習]]の障害が認められる<ref name="ref58"><pubmed> 11917005 </pubmed></ref>。さらにEP2欠損マウスでも海馬依存的な[[文脈型恐怖条件付け]]<ref name="ref59"><pubmed> 19416671 </pubmed></ref>や水迷路試験による長期的空間学習<ref name="ref60"><pubmed> 19012750 </pubmed></ref>が障害されるとの報告がある。この行動異常に合致し、EP2欠損マウスでは海馬の複数のシナプスで[[シナプス長期可塑性]]の異常が報告されている<ref name="ref59" /><ref name="ref60" />。一方で、海馬でのIL-1βの過剰発現は海馬でのPGE<sub>2</sub>産生と同時に、海馬依存的な文脈型恐怖条件付けの障害を惹起するが、この両者がCOX-1欠損マウスでは見られない<ref name="ref61"><pubmed> 20412387 </pubmed></ref>。さらに背側海馬へのPGE<sub>2</sub>の局所投与により、海馬依存的な文脈型恐怖条件付けが障害される<ref name="ref62"><pubmed> 18035502 </pubmed></ref>。これらの結果は、海馬機能における生理的なPGE<sub>2</sub>の役割に対し、過度のPGE<sub>2</sub>産生は海馬機能を障害する可能性を示唆している。 | 海馬へのPG合成阻害薬の投与により、[[迷路|水迷路試験]]における海馬依存的な長期的[[空間学習]]の障害が認められる<ref name="ref58"><pubmed> 11917005 </pubmed></ref>。さらにEP2欠損マウスでも海馬依存的な[[文脈型恐怖条件付け]]<ref name="ref59"><pubmed> 19416671 </pubmed></ref>や水迷路試験による長期的空間学習<ref name="ref60"><pubmed> 19012750 </pubmed></ref>が障害されるとの報告がある。この行動異常に合致し、EP2欠損マウスでは海馬の複数のシナプスで[[シナプス長期可塑性]]の異常が報告されている<ref name="ref59" /><ref name="ref60" />。一方で、海馬でのIL-1βの過剰発現は海馬でのPGE<sub>2</sub>産生と同時に、海馬依存的な文脈型恐怖条件付けの障害を惹起するが、この両者がCOX-1欠損マウスでは見られない<ref name="ref61"><pubmed> 20412387 </pubmed></ref>。さらに背側海馬へのPGE<sub>2</sub>の局所投与により、海馬依存的な文脈型恐怖条件付けが障害される<ref name="ref62"><pubmed> 18035502 </pubmed></ref>。これらの結果は、海馬機能における生理的なPGE<sub>2</sub>の役割に対し、過度のPGE<sub>2</sub>産生は海馬機能を障害する可能性を示唆している。 | ||
シナプス可塑性におけるPGの関与は大脳皮質や小脳でも報告されている。[[ラット]][[視覚野]]の第IV層を刺激した際の第II/III層[[錐体細胞]] | シナプス可塑性におけるPGの関与は大脳皮質や小脳でも報告されている。[[ラット]][[視覚野]]の第IV層を刺激した際の第II/III層[[錐体細胞]]における興奮性シナプス応答は高周波数刺激により[[シナプス長期増強]]を示すが、このシナプス長期増強は[[RNA干渉法]]によるEP2の発現抑制により減弱し、EP3の発現抑制により亢進する。この結果は、大脳皮質のシナプス長期増強においてEP2とEP3が反対の作用を持つことを示唆する<ref name="ref63"><pubmed> 17021176 </pubmed></ref>。[[小脳]][[プルキンエ細胞]]の[[シナプス長期抑制]]はPG生成に関わるcPLA<sub>2</sub>α欠損マウスにより消失し、この異常が外来性に加えたアラキドン酸やPGD<sub>2</sub>、PGE<sub>2</sub>により正常化することも報告されているが、この作用を介達する受容体はまだ分かっていない<ref name="ref64"><pubmed> 20133605 </pubmed></ref>。 | ||
=== 脳機能的充血 === | === 脳機能的充血 === | ||
| 153行目: | 81行目: | ||
=== 高血圧 === | === 高血圧 === | ||
近年、血中の[[アンジオテンシンII]]による交感神経系の活性化と高血圧における[[脳弓下器官]](subfornical organ; SFO)の関与が示唆されている。COX-1とEP1の遺伝子欠損マウスでは、アンジオテンシンII(angiotensin II; Ang II)投与による[[ | 近年、血中の[[アンジオテンシンII]]による交感神経系の活性化と高血圧における[[脳弓下器官]](subfornical organ; SFO)の関与が示唆されている。COX-1とEP1の遺伝子欠損マウスでは、アンジオテンシンII(angiotensin II; Ang II)投与による[[wikipedia:ja:高血圧|高血圧]]誘導が消失する<ref name="ref69"><pubmed>22371360</pubmed></ref>。AngIIはSFOにおける[[wikipedia:ja:活性酸素|活性酸素]]種の誘導を惹起するが、この活性酸素種の誘導がCOX-1やEP1の遺伝子欠損およびEP1阻害薬により消失する。さらに、EP1欠損マウスの脳弓下器官にEP1を再導入すると、Ang IIによる高血圧が正常に誘導されることから、Ang IIはSFOのCOX-1-PGE2-EP1系を介して活性酸素種を発生させ、これが交感神経系の活性化と高血圧を誘導すると考えられている。 | ||
=== 神経細胞死 === | === 神経細胞死 === | ||
| 161行目: | 89行目: | ||
神経細胞死におけるPGE<sub>2</sub>の作用機序についてはPGE受容体欠損マウスを用いた解析から、少なくともEP1、EP2、EP3の関与が示されている。[[NMDA]]の局所投与による神経細胞死や[[脳虚血]]による[[梗塞]]巣はEP1阻害薬投与やEP1欠損マウスでは減弱する<ref name="ref71"><pubmed>16432513</pubmed></ref><ref name="ref72"><pubmed>17600836</pubmed></ref>。興奮毒性には細胞内Ca2+上昇が重要であるが、NMDA刺激による[[Na+-Ca2+交換輸送体|Na<sup>+</sup>-Ca<sup>2+</sup>交換輸送体]]の機能低下と細胞内Ca<sup>2+</sup>上昇にEP1が関与することが遺伝子欠損マウスと特異的阻害薬により示されている<ref name="ref71" />。 | 神経細胞死におけるPGE<sub>2</sub>の作用機序についてはPGE受容体欠損マウスを用いた解析から、少なくともEP1、EP2、EP3の関与が示されている。[[NMDA]]の局所投与による神経細胞死や[[脳虚血]]による[[梗塞]]巣はEP1阻害薬投与やEP1欠損マウスでは減弱する<ref name="ref71"><pubmed>16432513</pubmed></ref><ref name="ref72"><pubmed>17600836</pubmed></ref>。興奮毒性には細胞内Ca2+上昇が重要であるが、NMDA刺激による[[Na+-Ca2+交換輸送体|Na<sup>+</sup>-Ca<sup>2+</sup>交換輸送体]]の機能低下と細胞内Ca<sup>2+</sup>上昇にEP1が関与することが遺伝子欠損マウスと特異的阻害薬により示されている<ref name="ref71" />。 | ||
一方、[[初代培養]]した海馬神経細胞や海馬[[スライス標品]] | 一方、[[初代培養]]した海馬神経細胞や海馬[[スライス標品]]ではグルタミン酸受容体活性化による神経細胞死がEP2アゴニストや[[アロステリック]]なEP2[[賦活薬]]により減弱することが報告されている<ref name="ref73"><pubmed> 14715958 </pubmed></ref><ref name="ref74"><pubmed> 20080612 </pubmed></ref>。この結果に合致し、EP2欠損マウスでは脳虚血モデルにおける梗塞巣が増大する<ref name="ref75"><pubmed> 15852374 </pubmed></ref>。しかし、後に詳述する[[神経変性疾患]]モデルマウスにおける神経細胞死はEP2欠損により減弱し<ref name="ref76"><pubmed>16267225</pubmed></ref><ref name="ref77"><pubmed>18825663</pubmed></ref>、[[ピロカルピン]]投与による神経細胞死もEP2阻害薬により減弱することから<ref name="ref78"><pubmed>22323596</pubmed></ref>、神経細胞死におけるEP2の役割は複雑である。 | ||
EP3の活性化は興奮毒性による神経細胞死を促進することが示されている。大脳皮質へのNMDA局所投与や海馬スライスへのグルタミン酸投与による神経細胞死はEP3の機能阻害により減弱し、EP3アゴニストにより増強する<ref name="ref79"><pubmed>17275922</pubmed></ref><ref name="ref80"><pubmed>20590584</pubmed></ref>。[[カイニン酸]]投与による神経細胞死に伴い、血管周囲に隣接する[[アストロサイト]]の突起endfeetにはEP3の発現が誘導され<ref name="ref70" />、さらにカイニン酸投与によるアストロサイトでの細胞内Ca<sup>2+</sup>濃度上昇にEP3が関与していることが薬理学的に示されている<ref name="ref81"><pubmed>21219953</pubmed></ref>。これらの結果から、カイニン酸による血管内皮からのPGE<sub>2</sub>がアストロサイトのEP3に作用する可能性が指摘されている。 | EP3の活性化は興奮毒性による神経細胞死を促進することが示されている。大脳皮質へのNMDA局所投与や海馬スライスへのグルタミン酸投与による神経細胞死はEP3の機能阻害により減弱し、EP3アゴニストにより増強する<ref name="ref79"><pubmed>17275922</pubmed></ref><ref name="ref80"><pubmed>20590584</pubmed></ref>。[[カイニン酸]]投与による神経細胞死に伴い、血管周囲に隣接する[[アストロサイト]]の突起endfeetにはEP3の発現が誘導され<ref name="ref70" />、さらにカイニン酸投与によるアストロサイトでの細胞内Ca<sup>2+</sup>濃度上昇にEP3が関与していることが薬理学的に示されている<ref name="ref81"><pubmed>21219953</pubmed></ref>。これらの結果から、カイニン酸による血管内皮からのPGE<sub>2</sub>がアストロサイトのEP3に作用する可能性が指摘されている。 | ||
| 167行目: | 95行目: | ||
=== アルツハイマー病 === | === アルツハイマー病 === | ||
アルツハイマー病(Alzheimer’s disease; AD)は、[[認知機能]]低下、[[人格]]の変化を主とする[[認知症]]の一種である。脳病理所見としては、びまん性の[[脳萎縮]]と大脳皮質に[[βアミロイド]](Aβ)の蓄積である[[老人斑]]と[[神経原線維変化]]を認める。ADの小動物モデルとして、家族性ADの原因遺伝子として同定された[[アミロイド前駆タンパク質]](amyloid precursor protein; APP)や[[プレセニリン]](presenilin)の変異体を発現させた遺伝子改変マウスがある。これらAD小動物モデルでは、EP1、EP2、EP4の欠損により[[Aβ42]]、[[Aβ40]]の産生や[[アミロイド斑]]の形成が減少することが示されている<ref name="ref76" /><ref name="ref82"><pubmed>22015313</pubmed></ref><ref name="ref83"><pubmed>22044482</pubmed></ref>。この変化に合致し、EP1欠損によりADモデルでの神経細胞死が減少し、[[受動的回避行動テスト]]における恐怖条件付けの障害が改善することが示されている<ref name="ref82" />。EP4欠損によりモリス水迷路試験における長期空間学習の障害が改善することも報告されている<ref name="ref83" />。 | |||
培養細胞を用いた実験から、EP1、EP2、EP4が特異的な作用機序を介してAD病態に関わることが示唆されている。例えばEP1を欠損した初代培養神経細胞では、Aβ投与による細胞内Ca2+上昇と神経細胞死が減弱する<ref name="ref82" />。一方、HEK293細胞における過剰発現系を用いて、EP2やEP4の活性化がAβ産生を増強することが示された<ref name="ref84"><pubmed>19407341</pubmed></ref>。また、Aβによる神経細胞死はミクログリアの共培養により促進されるが、この作用はミクログリアのEP2に依存することが示されており<ref name="ref85"><pubmed>15793296</pubmed></ref>、ADの病態にミクログリアのEP2が関わる可能性も示唆されている。 | |||
=== 筋萎縮性側索硬化症 === | === 筋萎縮性側索硬化症 === | ||
| 179行目: | 107行目: | ||
=== 精神疾患 === | === 精神疾患 === | ||
PG合成を阻害するNSAIDである[[セレコキシブ]]の併用により、既存の[[抗うつ薬]]の治療効果が増強されることを示す臨床報告が散見される。[[統合失調症]] | PG合成を阻害するNSAIDである[[セレコキシブ]]の併用により、既存の[[抗うつ薬]]の治療効果が増強されることを示す臨床報告が散見される。[[統合失調症]]でもセレコキシブの併用により抗精神病薬の作用が増強されることも報告されている<ref name="ref87"><pubmed>12042193</pubmed></ref><ref name="ref88"><pubmed>20570110</pubmed></ref><ref name="ref89"><pubmed>16491133</pubmed></ref><ref name="ref90"><pubmed>22516310</pubmed></ref>。これらの結果は、[[うつ病]]や統合失調症の病態にPGが関与する可能性を提示する。 | ||
一方、[[選択的セロトニン再取り込み阻害薬]]([[SSRI]])である[[シタロプラム]]や[[フルオキセチン]]は、前頭前皮質での[[炎症性サイトカイン]]の発現誘導や[[尾懸垂試験]]や[[強制水泳試験]]での[[抑うつ様行動]]を抑制するが、SSRIのこれらの作用がNSAIDである[[イブプロフェン]]や[[アスピリン]]で阻害されることが報告された<ref name="ref91"><pubmed>21518864</pubmed></ref>。さらに、[[シタロプラム]]服用によるうつ病の寛解率は、NSAID服用群の方が非服用群よりも有意に低いことも示く、SSRIの治療効果にもPGが関与する可能性が示唆されている<ref name="ref91" />。 | 一方、[[選択的セロトニン再取り込み阻害薬]]([[SSRI]])である[[シタロプラム]]や[[フルオキセチン]]は、前頭前皮質での[[炎症性サイトカイン]]の発現誘導や[[尾懸垂試験]]や[[強制水泳試験]]での[[抑うつ様行動]]を抑制するが、SSRIのこれらの作用がNSAIDである[[イブプロフェン]]や[[アスピリン]]で阻害されることが報告された<ref name="ref91"><pubmed>21518864</pubmed></ref>。さらに、[[シタロプラム]]服用によるうつ病の寛解率は、NSAID服用群の方が非服用群よりも有意に低いことも示く、SSRIの治療効果にもPGが関与する可能性が示唆されている<ref name="ref91" />。 | ||
これらの結果から、精神疾患の病態や薬物治療において複数のPG作用が示唆されるが、NSAIDにはPG合成阻害以外の作用もあることから、PG関連分子群の遺伝子改変マウスや特異的化合物を用いた解析が重要になると考えられる。 | |||
== 関連項目 == | == 関連項目 == | ||
* [[アラキドン酸 | *[[アラキドン酸]] | ||
*[[エンドカナビノイド]] | |||
* [[エンドカナビノイド]] | *[[エイコサノイド]] | ||
* [[エイコサノイド]] | *[[ロイコトリエン]] | ||
* [[ロイコトリエン]] | |||
== | == 参考文献 == | ||
<references /> | |||
(執筆担当者:古屋敷智之、北岡志保 担当編集委員:林康紀) | |||
2012年10月2日 (火) 00:51時点における版
英:prostaglandin、英略語:PG、独:Prostaglandine、仏:prostaglandine
プロスタグランジンは五員環構造を含む20個の炭素鎖からなる生理活性脂質である[1]。プロスタグランジンと構造の類似したトロンボキサンを併せてプロスタノイド(prostanoid)と称する。1930年にヒトの精液に含まれる子宮収縮物質として発見された。非ステロイド性抗炎症薬(NSAID)の抗炎症作用、鎮痛作用、解熱作用は、主にプロスタノイドの合成阻害によると考えられている[2]。生体には五員環構造の側鎖や炭素鎖の二重結合の数の異なる多種のプロスタノイドが存在するが、これまでの研究では主にプロスタグランジンD2 (PGD2)、プロスタグランジンE2(PGE2)、プロスタグランジンF2α(PGF2α)、 プロスタサイクリン(プロスタグランジンI2、PGI2)、トロンボキサンA2(TXA2)の役割が解析されてきた。PGD2、PGE2、PGF2α、PGI2、TXA2はDP、EP、FP、IP、TPと呼ばれる特異的なGタンパク質共役型受容体を介して、多様な生理機能、病態生理機能に関わる[3]。これらの機能には、循環器・消化器・骨の恒常性維持、卵巣や子宮といった生殖器の機能、局所炎症に伴う血管透過性亢進や疼痛惹起、細胞性免疫応答、睡眠、疾病時の発熱や内分泌応答、神経変性疾患や脳虚血に伴う神経細胞死、脳機能的充血、シナプス可塑性や記憶学習、心理ストレス下での情動制御などが含まれる。
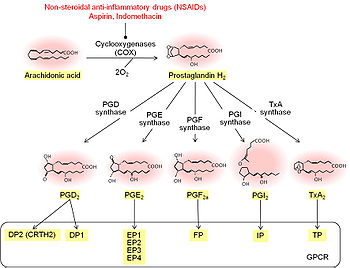
プロスタグランジン生合成
炭素鎖内の二重結合を二つ有するPGD2、PGE2、PGF2α、PGI2、TXA2は、遊離アラキドン酸から生成される[2][3][4][5][6]。まず、酸素添加酵素であるシクロオキシゲナーゼ(cyclooxygenase; COX)により、アラキドン酸からプロスタグランジンG2(PGG2)、さらにプロスタグランジンH2(PGH2)が産生される。次いで特異的な合成酵素の働きにより、PGH2が各種PGに変換される。
一般にPG生成はphospholipase A2(PLA2)により細胞膜中のリン脂質からアラキドン酸が切り出されて開始すると考えられている[5][6]。例えば、マクロファージからのPG産生はcytosolic PLA2 (cPLA2)の遺伝子欠損によりほぼ完全に消失する。cPLA2の活性は細胞内Ca2+上昇によるcPLA2の膜移行、MAPキナーゼなどによるリン酸化、遺伝子発現制御といった複数のメカニズムにより制御されている。しかし近年、脳、肝臓、肺の遊離アラキドン酸とその下流で生成されるPGの多くが、モノアシルグリセロールリパーゼ(monoacylglycerol lipase; MAGL)依存的な内因性カナビノイド2-アラキドノイルグリセロール(2-arachidonyl-glycerol; 2-AG)の加水分解により生ずることが報告されている[7]。
COXにはCOX-1とCOX-2と呼ばれる二つのアイソフォームが存在する[2][3][4][5][6]。一般に、COX-1は刺激による誘導性が乏しいことから構成型と呼ばれ、COX-2は刺激により遺伝子発現が誘導されることから誘導型と呼ばれるが、脳や腎臓ではCOX-1、COX-2のいずれも恒常的に発現している。生理的条件ではCOX-1はミクログリアや血管周囲マクロファージに[8]、COX-2は大脳皮質や海馬などの錐体細胞に発現している[9]。さらに炎症や神経変性疾患では、血管内皮細胞やグリア細胞にもCOX-2の発現が誘導される[10][11]。COXは非ステロイド性抗炎症薬(NSAID)の主たる標的分子であり、NSAIDの抗炎症作用、鎮痛作用、解熱作用はPGの合成阻害活性によると考えられている[2]。
PGH2から各種PG合成を触媒する酵素群も多数同定されている[4][6]。PGH2からPGD2の合成にはPGD合成酵素(PGDS)が関与し、造血器型PGDS(hematopoietic PGDS; H-PGDS)とリポカリン型PGDS(lipocalin-type PGDS; L-PGDS)の二種類が存在する[12]。PGH2からPGE2の合成に関わるPGE合成酵素(PGES)には、cytosolic PGES(cPGES)、microsomal PGES-1(mPGES-1)、microsomal PGES-2(mPGES-2)の三つのアイソフォームが報告され、それぞれ異なる機能を有することが示されている[6]。COXとPGESの共役にはアイソフォーム特異性があることが知られ、cPGESはCOX-1と、mPGES-1はCOX-2と、mPGES-2はCOX-1とCOX-2の両方と共役しPGE2合成に関わるとされる。PGH2からPGF2αの合成にはPGF合成酵素(PGFS)が関与し、現在までaldo-keto reductase (AKR) 1C familyやAKR5A familyがPGFS活性を持つことが報告されている[13]。PGH2からPGI2やTXA2の合成にはシトクロームp450ファミリーに属するPGI合成酵素(PGIS)やTXA合成酵素(TXAS)が関与する[14]。
プロスタグランジン受容体
PGD2、PGE2、PGF2α、PGI2、TXA2は、それぞれDP、EP、FP、IP、TPと呼ばれるGタンパク質共役型受容体に結合して作用を発揮する[3]。DPにはDP1とDP2が、EPにはEP1、EP2、EP3、EP4が存在し、それぞれ異なる遺伝子によりコードされている。
これらPG受容体は組織、細胞レベルの発現分布や細胞内情報伝達が異なることで、特異的な機能を発揮すると考えられている[3]。DP2以外の八種の受容体はプロスタノイド受容体ファミリーを形成し、細胞内情報伝達とその作用からrelaxant receptor、contractile receptor、inhibitory receptorの三種に分類されている[3]。Relaxant receptorは主にGsを介してcAMP上昇を惹起し平滑筋の弛緩を誘導する受容体で、DP1、EP2、EP4、IPを含む。Contractile receptorは主に細胞内Ca2+上昇を惹起し平滑筋の収縮を誘導する受容体で、TP、FP、EP1を含む。Inhibitory receptorは主にGiを介するcAMP抑制により平滑筋の弛緩を抑制する受容体で、EP3を含む。但し、EP3にはマウスでは三種、ヒトでは四種のalternative splicingアイソフォームが存在し、ヒトTPにもαとβと呼ばれる二つのアイソフォームが存在する。これらのアイソフォームは異なる細胞内情報伝達に共役することが知られている。DP2は他の八種の受容体とは別のファミリーに属し、CRTH2やGPR44とも称される[15]。Giと共役してTh2細胞、好酸球、好塩基球の遊走を誘導することが知られている。
このように、プロスタグランジンの生合成や作用に関わる分子種は多岐にわたるが、PG生合成酵素群やPG受容体の遺伝子欠損マウスや特異的阻害薬に登場により、各種PGとその受容体の特異的な役割が解明されてきた。本稿では、脳機能と関連の深い機能に限って紹介する。
脳機能におけるプロスタグランジンの役割
疾病応答
感染や組織損傷は局所炎症に留まらず、発熱、視床下部-下垂体-副腎系(hypothalamus-pituitary-adrenal axis; HPA)活性化、食欲不振、疲労、傾眠、痛覚過敏といった全身症状を呈する[16]。これらの症状は疾病応答(sickness behavior; sickness response)と呼ばれ、生存を促進する適応的反応と考えられている。PG合成を阻害するNSAIDはこれらの多くの症状を改善することから、疾病応答におけるPGの役割が推測されてきた[17][18]。細菌内毒素であるリポ多糖類(lipopolysaccharide; LPS)やサイトカインの一種IL-1βを末梢に投与すると疾病応答の多くが再現されることから、疾病応答におけるPGE2の作用機序に関する研究にはLPSやIL-1βを全身投与した小動物を用いた疾病応答モデルが主に用いられてきた。
発熱
視床下部視索前野へのNSAIDやPGE2の局所注入実験により、視索前野におけるPGE2産生が疾病応答モデルによる発熱に寄与することが示唆されてきた[17]。その後、遺伝子改変マウスの解析により、PGE2生合成に関わるCOX-2とmPGES-1が疾病応答モデルにおける発熱に必須であることが示された[19][20]。LPSの全身投与により、COX-2とmPGES-1が脳内の血管内皮細胞に共に誘導されることから、疾病時の発熱には血管内皮細胞からのPGE2産生が関与することが示唆された[10][21]。しかし、血管内皮細胞でのCOX-2とmPGES-1の遺伝子発現誘導はLPS投与から一時間程度の発熱の初期相には見られない。一方、肺や肝臓におけるマクロファージではCOX-2の発現は末梢へのLPS投与により速やかに誘導され、末梢血中のPGE2濃度も速やかに上昇する[22]。さらに末梢血中へのPGE2阻害抗体投与により発熱が遅延することから、発熱の初期相には脳外で産生されたPGE2の関与が示唆された[22]。
EP3欠損マウスではLPSやIL-1βによる発熱応答は消失することから、疾病時の発熱にはEP3が主に働くことが示された[23][24]。しかしEP1欠損マウスでもLPSの投与量によって発熱応答に異常を認めることから、部分的にEP1の関与もある[24]。さらに条件付け欠損マウスにより、疾病応答における発熱には視索前野神経細胞におけるEP3が必須であることが示された[25]。EP3は視索前野の抑制性神経細胞に発現しているが、この神経細胞は淡蒼縫線核(raphe pallidus; RPa)にある交感神経系の前運動神経を直接的あるいは間接的に抑制する[26]。EP3の活性化は視索前野の抑制性神経細胞を抑制することで、RPaの交感神経系を脱抑制すると考えられている。発熱は皮膚血管収縮による放熱減少、褐色脂肪組織からの熱産生促進、ふるえと呼ばれる不随意の筋収縮により誘導される。脳領域不活性化実験から、視索前野におけるEP3活性化は、RPaへの直接投射により皮膚血管の収縮を促し、視床下部背内側(dorsomedial hypothalamus; DMH)を経てRPaへ至る間接投射を介して褐色脂肪組織の熱産生を惹起すると考えられている[27]。
HPA系活性化
視床下部の室傍核(paraventricular hypothalamic nucleus; PVN)の小細胞領域にはコルチコトロピン放出因子(corticotropin-releasing hormone; CRH)陽性の神経細胞が存在する。このCRH陽性神経細胞は正中隆起(median eminence; ME)に軸索を投射しており、神経細胞の活性化に応じてCRHを下垂体門脈系に放出する。CRHは下垂体前葉からの副腎皮質刺激ホルモン(adrenocorticotropic hormone; ACTH)放出を誘導し、ACTHは副腎皮質から糖質コルチコイド放出を促す。この一連の過程をHPA系活性化と称する。視索前野へのNSAIDとPGE2の局所投与実験から、LPSによるHPA系活性化に視索前野におけるPGE2作用が関与することが示唆されてきた[28]。
LPS投与によるHPA系活性化にはタイミングによって異なるPGE2生成機構が関与する。すなわちCOX-2やmPGES-1の欠損マウスではLPS投与から6時間後のコルチコステロン放出は減弱するが、LPS投与から1時間後では減弱を認めない[29]。LPS投与により脳内の血管内皮細胞におけるCOX-2とmPGES-1の発現が共に誘導されることから、LPSによるHPA系活性化の後期相に血管内皮からのPGE2産生が関与する可能性が示唆される。一方、COX-1欠損マウスではLPS投与から1時間後のコルチコステロン上昇が消失するのに対し、6時間後のコルチコステロン上昇は正常であることから、HPA系活性化の初期相にはCOX-1を介したPG産生が関わる[30]。COX-1特異的阻害薬の脳室内投与によりLPS投与によるHPA系活性化の初期相が阻害されることから、COX-1の作用点は脳内であると考えられる[31]。生理的条件下ではCOX-1はミクログリアや血管周囲マクロファージに発現しているが、LPS投与により速やかに血管内皮に誘導されることが報告されている[31]。
LPSによるACTH分泌にはPG依存的なメカニズムとPG非依存的なメカニズムが共に関わるが、PGE受容体欠損マウスを用いた解析から、LPSによるPG依存的な分泌にはEP1とEP3が共に必要であることが示されている[32]。HPA系活性化におけるEP1とEP3の作用部位は確定していない。
摂食行動
mPGES-1欠損マウスでは、IL-1βの腹腔内投与による摂食行動抑制がほぼ完全に消失することから、疾病時の食欲不振の少なくとも一部にPGE2が関与することが示唆されている[33][34]。EP4アゴニストの脳室内投与により摂食行動が抑制されること、PGE2の脳室内投与による摂食行動の抑制がEP4阻害薬により消失することから、食欲不振におけるEP4の役割が示唆されている[35]。一方、DP1活性化はNPY受容体Y1依存的に摂食行動を促進することが示されている[36]。
覚醒睡眠
PGD2が睡眠促進物質であることはPGD2の側脳室投与により示された[37]。PGD合成酵素にはL-PGDSとH-PGDSがあるが、L-PGDSの阻害薬であるSeCl4とL-PGDS欠損マウスを用いて、L-PGDSが生理的な睡眠に関与することが示された[38]。さらにL-PGDS欠損マウスを用いた解析から、断眠によりL-PGDS依存的に脳内のPGD2が蓄積し、このPGD2生成が断眠後のノンレム睡眠のリバウンドに必須であることが示されている[39]。PGD2による睡眠促進作用はDP1を介することがDP1欠損マウスを用いて示されている[40]。L-PGDSは軟髄膜、脈絡叢、オリゴデンドロサイトに発現するのに対し、DP1は睡眠誘導に関わる腹外側視索前野の近傍の軟髄膜に限局して発現する[40]。PGD2による睡眠促進作用はアデノシンA2a受容体の阻害薬の腹腔内投与により阻害される[41]。以上の結果から、L-PGDSにより産生されたPGD2が軟膜に発現するDP1に結合し、くも膜下腔のアデノシン濃度を上昇させ、アデノシンA2a受容体を介して睡眠を誘導すると考えられている。一方、PGE2は覚醒促進物質であり、隆起乳頭体核(tuberomammillary nucleus; TMN)のヒスタミン神経細胞に発現したEP4に作用し、ヒスタミンの生合成と大脳皮質での放出を促進することが示唆されている[42]。
疼痛
疼痛には末梢性と中枢性のPGE2作用が関与する[43][44]。例えば、LPS投与による末梢炎症は急性の内臓痛を示す酢酸ライジング反応を増強するが、この疼痛反応はEP3欠損マウスとIP欠損マウスで減弱する[45]。また、足底部に投与したPGE2とPGI2はそれぞれEP1とIPを介して温熱性疼痛過敏を誘導する[46]。この作用に合致し、EP1とIPは後根神経節の一次感覚神経細胞に発現しており、熱と酸による疼痛に関わるカプサイシン受容体TRPV1の応答性を増強することが示されている[46]。
一方、局所炎症による疼痛過敏は腰椎くも膜下腔へのCOX-2阻害薬投与により抑制され[47]、腰椎くも膜下腔へのPGE2投与により熱への痛覚過敏や接触性アロディニア(触覚刺激による激痛)が誘導されることから[48]、炎症性疼痛には中枢神経系のPGE2作用も関与すると考えられている。EP2欠損マウスでは局所炎症や腰椎くも膜下腔へのPGE2投与による痛覚過敏が消失することが示されている[49]。一方、皮下組織へのPGE2投与による痛覚過敏には異常を認めないことから、疼痛におけるEP2の作用は中枢性であると考えられた。この作用機序として、EP2は脊髄のグリシン受容体GlyRα3のリン酸化を惹起し、グリシン作動性抑制性シナプス入力を減弱することが示されている[50]。EP2に加え、腰椎くも膜下腔へのPGE2投与によるアロディニアはEP1欠損マウスで消失することも報告されている[48]。
末梢神経損傷に起因する神経因性疼痛におけるPGの役割には不明な点が多いが、mPGES-1の遺伝子欠損[51]や腰椎くも膜下腔へのEP1特異的阻害薬投与[52]によりマウスにおける神経因性疼痛が生じないことが報告されている。
ドーパミン系と情動
脳内のPGE2は、疾病応答のみならず、心理ストレス下での情動制御にも関与することが示されている[53]。EP1欠損マウスは、社会行動の破綻と攻撃性の亢進、断崖からの異常な飛び降り行動、音驚愕反応の亢進を呈する[54]。一方、オープンフィールドにおける運動量、高架式十字迷路における不安行動、Y字迷路における短期記憶学習、ホームケージにおける行動には明らかな異常を認めない。これらの行動異常から、心理ストレス下での衝動性制御におけるEP1の役割が提唱されている。この行動異常の一部はEP1阻害薬投与により再現される。さらにEP1アゴニストの脳室内投与により攻撃性が抑制されることから、EP1の作用点は脳内にあることが示唆された[54]。
衝動性の制御にはドーパミンなどモノアミン系の重要性が知られている。ドーパミン放出の生化学的指標であるドーパミン代謝回転計測や脳微小透析法による細胞外ドーパミン濃度計測から、EP1欠損マウスの前頭前皮質や線条体ではドーパミン放出が亢進していることが示唆された[54][55]。さらにEP1欠損マウスの攻撃性や音驚愕反応の亢進がドーパミンD1様受容体阻害薬により消失することから[54]、EP1欠損マウスの行動異常の少なくとも一部はドーパミン系亢進によると考えられている。このEP1作用に合致し、EP1アゴニストにより黒質緻密部のドーパミン神経細胞への抑制性シナプス入力が増強されることが示されている[55]。
EP1によるドーパミン系抑制は反復ストレスによる情動変容誘導にも重要である[56]。反復社会挫折ストレスは社会的忌避行動や不安様行動を誘導するが、EP1欠損マウスではこれらの情動変容が観察されない。社会挫折ストレスは前頭前皮質に投射する腹側被蓋野(ventral tegmental area; VTA)ドーパミン神経細胞を活性化し、社会的忌避行動の発現を抑制する。社会挫折ストレスの反復により前頭前皮質ドーパミン系の応答は抑制されるが、EP1欠損マウスではこの前頭前皮質ドーパミン系の抑制が消失する。さらにEP1欠損マウスへのドーパミンD1様受容体阻害薬の投与により社会的忌避行動が回復することから、PGE2-EP1系による前頭前皮質ドーパミン系の抑制が反復ストレスによる情動変容に関わることが示唆される。反復ストレスによる社会的忌避行動誘導にはCOX-1が特異的に関与する[56]。脳内ではCOX-1はミクログリアに発現しており、反復ストレスによりミクログリア活性化が誘導されることが組織学的に示唆されている[56]。これらの結果は、反復ストレスによる情動変容にミクログリア由来のPGE2産生が関与する可能性を提示するが、今後の検証が必要である。
一方、EP1欠損マウスでは、細胞外ドーパミン濃度を上昇させるコカインやドーパミンD1様受容体アゴニストの全身投与による運動量増加の度合いが減弱している[57]。EP1は線条体では直接路と間接路を形成する中型有棘細胞に発現している。線条体スライスにおけるEP1活性化は、ドーパミンD1受容体活性化によるDARPP-32 Thr34リン酸化亢進とドーパミンD2受容体活性化によるDARPP-32 Thr34リン酸化抑制のいずれも促進することが示されている。
シナプス可塑性と記憶学習
海馬へのPG合成阻害薬の投与により、水迷路試験における海馬依存的な長期的空間学習の障害が認められる[58]。さらにEP2欠損マウスでも海馬依存的な文脈型恐怖条件付け[59]や水迷路試験による長期的空間学習[60]が障害されるとの報告がある。この行動異常に合致し、EP2欠損マウスでは海馬の複数のシナプスでシナプス長期可塑性の異常が報告されている[59][60]。一方で、海馬でのIL-1βの過剰発現は海馬でのPGE2産生と同時に、海馬依存的な文脈型恐怖条件付けの障害を惹起するが、この両者がCOX-1欠損マウスでは見られない[61]。さらに背側海馬へのPGE2の局所投与により、海馬依存的な文脈型恐怖条件付けが障害される[62]。これらの結果は、海馬機能における生理的なPGE2の役割に対し、過度のPGE2産生は海馬機能を障害する可能性を示唆している。
シナプス可塑性におけるPGの関与は大脳皮質や小脳でも報告されている。ラット視覚野の第IV層を刺激した際の第II/III層錐体細胞における興奮性シナプス応答は高周波数刺激によりシナプス長期増強を示すが、このシナプス長期増強はRNA干渉法によるEP2の発現抑制により減弱し、EP3の発現抑制により亢進する。この結果は、大脳皮質のシナプス長期増強においてEP2とEP3が反対の作用を持つことを示唆する[63]。小脳プルキンエ細胞のシナプス長期抑制はPG生成に関わるcPLA2α欠損マウスにより消失し、この異常が外来性に加えたアラキドン酸やPGD2、PGE2により正常化することも報告されているが、この作用を介達する受容体はまだ分かっていない[64]。
脳機能的充血
脳機能的充血とは、神経細胞の代謝亢進により細動脈が拡張されて生ずる局所的な脳血流量の増大である。COX-2欠損マウスやCOX-2阻害薬を投与したマウスでは、洞毛刺激により生ずる体性感覚野での機能的充血が起こらない[65]。アストロサイトにおける細胞内Ca2+の上昇は脳内の細動脈の拡張を誘導するが、この作用にPG合成酵素のCOX-1が関与することを示唆する報告もある[66]。しかしCOX-1欠損マウスでは、高炭酸ガス血症による脳血流増加は消失するのに対し、洞毛刺激による体性感覚野での機能的充血には異常を認めず[67]、COX-1の役割は確立していない。PGE2は強い大脳細動脈の拡張作用を示すことから[68]、脳機能的充血におけるPGE2の関与が推測されている。
高血圧
近年、血中のアンジオテンシンIIによる交感神経系の活性化と高血圧における脳弓下器官(subfornical organ; SFO)の関与が示唆されている。COX-1とEP1の遺伝子欠損マウスでは、アンジオテンシンII(angiotensin II; Ang II)投与による高血圧誘導が消失する[69]。AngIIはSFOにおける活性酸素種の誘導を惹起するが、この活性酸素種の誘導がCOX-1やEP1の遺伝子欠損およびEP1阻害薬により消失する。さらに、EP1欠損マウスの脳弓下器官にEP1を再導入すると、Ang IIによる高血圧が正常に誘導されることから、Ang IIはSFOのCOX-1-PGE2-EP1系を介して活性酸素種を発生させ、これが交感神経系の活性化と高血圧を誘導すると考えられている。
神経細胞死
興奮毒性による神経細胞死におけるPGの役割は数多く報告されている。大脳皮質や海馬の興奮性神経細胞では、神経活動によりCOX-2が誘導される[21]。またカイニン酸の局所投与によるグルタミン酸受容体刺激では8時間以降の後期でCOX-2とmPGES-1が血管内皮に発現誘導され、カイニン酸刺激による海馬でのPGE2産生誘導と神経細胞死の誘導にmPGES-1が関与することが遺伝子欠損マウスにより示されている[70]。
神経細胞死におけるPGE2の作用機序についてはPGE受容体欠損マウスを用いた解析から、少なくともEP1、EP2、EP3の関与が示されている。NMDAの局所投与による神経細胞死や脳虚血による梗塞巣はEP1阻害薬投与やEP1欠損マウスでは減弱する[71][72]。興奮毒性には細胞内Ca2+上昇が重要であるが、NMDA刺激によるNa+-Ca2+交換輸送体の機能低下と細胞内Ca2+上昇にEP1が関与することが遺伝子欠損マウスと特異的阻害薬により示されている[71]。
一方、初代培養した海馬神経細胞や海馬スライス標品ではグルタミン酸受容体活性化による神経細胞死がEP2アゴニストやアロステリックなEP2賦活薬により減弱することが報告されている[73][74]。この結果に合致し、EP2欠損マウスでは脳虚血モデルにおける梗塞巣が増大する[75]。しかし、後に詳述する神経変性疾患モデルマウスにおける神経細胞死はEP2欠損により減弱し[76][77]、ピロカルピン投与による神経細胞死もEP2阻害薬により減弱することから[78]、神経細胞死におけるEP2の役割は複雑である。
EP3の活性化は興奮毒性による神経細胞死を促進することが示されている。大脳皮質へのNMDA局所投与や海馬スライスへのグルタミン酸投与による神経細胞死はEP3の機能阻害により減弱し、EP3アゴニストにより増強する[79][80]。カイニン酸投与による神経細胞死に伴い、血管周囲に隣接するアストロサイトの突起endfeetにはEP3の発現が誘導され[70]、さらにカイニン酸投与によるアストロサイトでの細胞内Ca2+濃度上昇にEP3が関与していることが薬理学的に示されている[81]。これらの結果から、カイニン酸による血管内皮からのPGE2がアストロサイトのEP3に作用する可能性が指摘されている。
アルツハイマー病
アルツハイマー病(Alzheimer’s disease; AD)は、認知機能低下、人格の変化を主とする認知症の一種である。脳病理所見としては、びまん性の脳萎縮と大脳皮質にβアミロイド(Aβ)の蓄積である老人斑と神経原線維変化を認める。ADの小動物モデルとして、家族性ADの原因遺伝子として同定されたアミロイド前駆タンパク質(amyloid precursor protein; APP)やプレセニリン(presenilin)の変異体を発現させた遺伝子改変マウスがある。これらAD小動物モデルでは、EP1、EP2、EP4の欠損によりAβ42、Aβ40の産生やアミロイド斑の形成が減少することが示されている[76][82][83]。この変化に合致し、EP1欠損によりADモデルでの神経細胞死が減少し、受動的回避行動テストにおける恐怖条件付けの障害が改善することが示されている[82]。EP4欠損によりモリス水迷路試験における長期空間学習の障害が改善することも報告されている[83]。
培養細胞を用いた実験から、EP1、EP2、EP4が特異的な作用機序を介してAD病態に関わることが示唆されている。例えばEP1を欠損した初代培養神経細胞では、Aβ投与による細胞内Ca2+上昇と神経細胞死が減弱する[82]。一方、HEK293細胞における過剰発現系を用いて、EP2やEP4の活性化がAβ産生を増強することが示された[84]。また、Aβによる神経細胞死はミクログリアの共培養により促進されるが、この作用はミクログリアのEP2に依存することが示されており[85]、ADの病態にミクログリアのEP2が関わる可能性も示唆されている。
筋萎縮性側索硬化症
筋萎縮性側索硬化症(amyotrophic lateral sclerosis; ALS)は運動神経系の神経細胞変性により、重篤な筋肉の萎縮と筋力低下をきたす神経変性疾患で、呼吸筋麻痺により死にいたる病である。有効な治療法は確立しておらず、小動物モデルを用いた病態解析が精力的に行われている。ALSの動物モデルには、家族性ALSの原因遺伝子の一つsuper oxide dismutase 1 (SOD1)の変異体を発現させたトランスジェニックマウス(G93A SOD1 Tgマウス)が多用されている。この小動物モデルでは、誘導型一酸化窒素合成酵素(inducible nitric oxide synthase; iNOS)、NADPHオキシダーゼの発現誘導に加え、COX-2とEP2の発現も誘導される[77]。マウスALSモデルではアストロサイトやミクログリアでEP2の発現が誘導され、ALS患者の脊髄ではアストロサイトにEP2の発現が観察される。さらに、EP2を欠損したALSモデルマウスでは、iNOS、NADPHオキシダーゼ、COX-2の発現誘導が低下し、生存期間も延長した。これらの結果は、グリア細胞のEP2が酸化ストレスを介して病態進行に関与することを示唆する。
G93A SOD1 Tgマウスから採取した初代アストロサイトとヒトES細胞由来運動ニューロンとの共培養により、運動ニューロン数の減少が観察されるが、このモデルではアストロサイトにおけるDP1の発現上昇が確認されている[86]。さらに、正常アストロサイトとヒトES細胞由来運動ニューロンとの培養系にPGD2を添加すると運動ニューロン数の減少が観察される。これらの結果は、変異SOD1による非自律性神経細胞死にDP1が関与する可能性を示している。
精神疾患
PG合成を阻害するNSAIDであるセレコキシブの併用により、既存の抗うつ薬の治療効果が増強されることを示す臨床報告が散見される。統合失調症でもセレコキシブの併用により抗精神病薬の作用が増強されることも報告されている[87][88][89][90]。これらの結果は、うつ病や統合失調症の病態にPGが関与する可能性を提示する。
一方、選択的セロトニン再取り込み阻害薬(SSRI)であるシタロプラムやフルオキセチンは、前頭前皮質での炎症性サイトカインの発現誘導や尾懸垂試験や強制水泳試験での抑うつ様行動を抑制するが、SSRIのこれらの作用がNSAIDであるイブプロフェンやアスピリンで阻害されることが報告された[91]。さらに、シタロプラム服用によるうつ病の寛解率は、NSAID服用群の方が非服用群よりも有意に低いことも示く、SSRIの治療効果にもPGが関与する可能性が示唆されている[91]。
これらの結果から、精神疾患の病態や薬物治療において複数のPG作用が示唆されるが、NSAIDにはPG合成阻害以外の作用もあることから、PG関連分子群の遺伝子改変マウスや特異的化合物を用いた解析が重要になると考えられる。
関連項目
参考文献
- ↑
Moncada, S., & Vane, J.R. (1978).
Pharmacology and endogenous roles of prostaglandin endoperoxides, thromboxane A2, and prostacyclin. Pharmacological reviews, 30(3), 293-331. [PubMed:116251] [WorldCat] - ↑ 2.0 2.1 2.2 2.3
Vane, J.R., Bakhle, Y.S., & Botting, R.M. (1998).
Cyclooxygenases 1 and 2. Annual review of pharmacology and toxicology, 38, 97-120. [PubMed:9597150] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4 3.5
Narumiya, S., & Furuyashiki, T. (2011).
Fever, inflammation, pain and beyond: prostanoid receptor research during these 25 years. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 25(3), 813-8. [PubMed:21357250] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Smith, W.L., Urade, Y., & Jakobsson, P.J. (2011).
Enzymes of the cyclooxygenase pathways of prostanoid biosynthesis. Chemical reviews, 111(10), 5821-65. [PubMed:21942677] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Shimizu, T. (2009).
Lipid mediators in health and disease: enzymes and receptors as therapeutic targets for the regulation of immunity and inflammation. Annual review of pharmacology and toxicology, 49, 123-50. [PubMed:18834304] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4
Murakami, M., & Kudo, I. (2004).
Recent advances in molecular biology and physiology of the prostaglandin E2-biosynthetic pathway. Progress in lipid research, 43(1), 3-35. [PubMed:14636669] [WorldCat] - ↑
Nomura, D.K., Morrison, B.E., Blankman, J.L., Long, J.Z., Kinsey, S.G., Marcondes, M.C., ..., & Cravatt, B.F. (2011).
Endocannabinoid hydrolysis generates brain prostaglandins that promote neuroinflammation. Science (New York, N.Y.), 334(6057), 809-13. [PubMed:22021672] [PMC] [WorldCat] [DOI] - ↑
Anrather, J., Gallo, E.F., Kawano, T., Orio, M., Abe, T., Gooden, C., ..., & Iadecola, C. (2011).
Purinergic signaling induces cyclooxygenase-1-dependent prostanoid synthesis in microglia: roles in the outcome of excitotoxic brain injury. PloS one, 6(10), e25916. [PubMed:22022466] [PMC] [WorldCat] [DOI] - ↑
Yamagata, K., Andreasson, K.I., Kaufmann, W.E., Barnes, C.A., & Worley, P.F. (1993).
Expression of a mitogen-inducible cyclooxygenase in brain neurons: regulation by synaptic activity and glucocorticoids. Neuron, 11(2), 371-86. [PubMed:8352945] [WorldCat] [DOI] - ↑ 10.0 10.1
Matsumura, K., & Kobayashi, S. (2004).
Signaling the brain in inflammation: the role of endothelial cells. Frontiers in bioscience : a journal and virtual library, 9, 2819-26. [PubMed:15353317] [WorldCat] [DOI] - ↑
Consilvio, C., Vincent, A.M., & Feldman, E.L. (2004).
Neuroinflammation, COX-2, and ALS--a dual role? Experimental neurology, 187(1), 1-10. [PubMed:15081582] [WorldCat] [DOI] - ↑
Urade, Y., & Eguchi, N. (2002).
Lipocalin-type and hematopoietic prostaglandin D synthases as a novel example of functional convergence. Prostaglandins & other lipid mediators, 68-69, 375-82. [PubMed:12432930] [WorldCat] - ↑
Watanabe, K. (2002).
Prostaglandin F synthase. Prostaglandins & other lipid mediators, 68-69, 401-7. [PubMed:12432932] [WorldCat] - ↑
Tanabe, T., & Ullrich, V. (1995).
Prostacyclin and thromboxane synthases. Journal of lipid mediators and cell signalling, 12(2-3), 243-55. [PubMed:8777569] [WorldCat] - ↑
Nagata, K., & Hirai, H. (2003).
The second PGD(2) receptor CRTH2: structure, properties, and functions in leukocytes. Prostaglandins, leukotrienes, and essential fatty acids, 69(2-3), 169-77. [PubMed:12895600] [WorldCat] [DOI] - ↑
Dantzer, R., O'Connor, J.C., Freund, G.G., Johnson, R.W., & Kelley, K.W. (2008).
From inflammation to sickness and depression: when the immune system subjugates the brain. Nature reviews. Neuroscience, 9(1), 46-56. [PubMed:18073775] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Saper, C.B., Romanovsky, A.A., & Scammell, T.E. (2012).
Neural circuitry engaged by prostaglandins during the sickness syndrome. Nature neuroscience, 15(8), 1088-95. [PubMed:22837039] [PMC] [WorldCat] [DOI] - ↑
Pecchi, E., Dallaporta, M., Jean, A., Thirion, S., & Troadec, J.D. (2009).
Prostaglandins and sickness behavior: old story, new insights. Physiology & behavior, 97(3-4), 279-92. [PubMed:19275907] [WorldCat] [DOI] - ↑
Li, S., Wang, Y., Matsumura, K., Ballou, L.R., Morham, S.G., & Blatteis, C.M. (1999).
The febrile response to lipopolysaccharide is blocked in cyclooxygenase-2(-/-), but not in cyclooxygenase-1(-/-) mice. Brain research, 825(1-2), 86-94. [PubMed:10216176] [WorldCat] [DOI] - ↑
Engblom, D., Saha, S., Engström, L., Westman, M., Audoly, L.P., Jakobsson, P.J., & Blomqvist, A. (2003).
Microsomal prostaglandin E synthase-1 is the central switch during immune-induced pyresis. Nature neuroscience, 6(11), 1137-8. [PubMed:14566340] [WorldCat] [DOI] - ↑ 21.0 21.1
Yamagata, K., Matsumura, K., Inoue, W., Shiraki, T., Suzuki, K., Yasuda, S., ..., & Kobayashi, S. (2001).
Coexpression of microsomal-type prostaglandin E synthase with cyclooxygenase-2 in brain endothelial cells of rats during endotoxin-induced fever. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(8), 2669-77. [PubMed:11306620] [PMC] [WorldCat] - ↑ 22.0 22.1
Steiner, A.A., Ivanov, A.I., Serrats, J., Hosokawa, H., Phayre, A.N., Robbins, J.R., ..., & Romanovsky, A.A. (2006).
Cellular and molecular bases of the initiation of fever. PLoS biology, 4(9), e284. [PubMed:16933973] [PMC] [WorldCat] [DOI] - ↑
Ushikubi, F., Segi, E., Sugimoto, Y., Murata, T., Matsuoka, T., Kobayashi, T., ..., & Narumiya, S. (1998).
Impaired febrile response in mice lacking the prostaglandin E receptor subtype EP3. Nature, 395(6699), 281-4. [PubMed:9751056] [WorldCat] [DOI] - ↑ 24.0 24.1
Oka, T., Oka, K., Kobayashi, T., Sugimoto, Y., Ichikawa, A., Ushikubi, F., ..., & Saper, C.B. (2003).
Characteristics of thermoregulatory and febrile responses in mice deficient in prostaglandin EP1 and EP3 receptors. The Journal of physiology, 551(Pt 3), 945-54. [PubMed:12837930] [PMC] [WorldCat] [DOI] - ↑
Lazarus, M., Yoshida, K., Coppari, R., Bass, C.E., Mochizuki, T., Lowell, B.B., & Saper, C.B. (2007).
EP3 prostaglandin receptors in the median preoptic nucleus are critical for fever responses. Nature neuroscience, 10(9), 1131-3. [PubMed:17676060] [WorldCat] [DOI] - ↑
Nakamura, K., Matsumura, K., Kaneko, T., Kobayashi, S., Katoh, H., & Negishi, M. (2002).
The rostral raphe pallidus nucleus mediates pyrogenic transmission from the preoptic area. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(11), 4600-10. [PubMed:12040067] [PMC] [WorldCat] [DOI] - ↑
Nakamura, Y., Nakamura, K., & Morrison, S.F. (2009).
Different populations of prostaglandin EP3 receptor-expressing preoptic neurons project to two fever-mediating sympathoexcitatory brain regions. Neuroscience, 161(2), 614-20. [PubMed:19327390] [PMC] [WorldCat] [DOI] - ↑
Turnbull, A.V., & Rivier, C.L. (1999).
Regulation of the hypothalamic-pituitary-adrenal axis by cytokines: actions and mechanisms of action. Physiological reviews, 79(1), 1-71. [PubMed:9922367] [WorldCat] [DOI] - ↑
Elander, L., Engström, L., Ruud, J., Mackerlova, L., Jakobsson, P.J., Engblom, D., ..., & Blomqvist, A. (2009).
Inducible prostaglandin E2 synthesis interacts in a temporally supplementary sequence with constitutive prostaglandin-synthesizing enzymes in creating the hypothalamic-pituitary-adrenal axis response to immune challenge. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(5), 1404-13. [PubMed:19193887] [PMC] [WorldCat] [DOI] - ↑
Elander, L., Ruud, J., Korotkova, M., Jakobsson, P.J., & Blomqvist, A. (2010).
Cyclooxygenase-1 mediates the immediate corticosterone response to peripheral immune challenge induced by lipopolysaccharide. Neuroscience letters, 470(1), 10-2. [PubMed:20034541] [WorldCat] [DOI] - ↑ 31.0 31.1
García-Bueno, B., Serrats, J., & Sawchenko, P.E. (2009).
Cerebrovascular cyclooxygenase-1 expression, regulation, and role in hypothalamic-pituitary-adrenal axis activation by inflammatory stimuli. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(41), 12970-81. [PubMed:19828811] [PMC] [WorldCat] [DOI] - ↑
Matsuoka, Y., Furuyashiki, T., Bito, H., Ushikubi, F., Tanaka, Y., Kobayashi, T., ..., & Narumiya, S. (2003).
Impaired adrenocorticotropic hormone response to bacterial endotoxin in mice deficient in prostaglandin E receptor EP1 and EP3 subtypes. Proceedings of the National Academy of Sciences of the United States of America, 100(7), 4132-7. [PubMed:12642666] [PMC] [WorldCat] [DOI] - ↑
Pecchi, E., Dallaporta, M., Thirion, S., Salvat, C., Berenbaum, F., Jean, A., & Troadec, J.D. (2006).
Involvement of central microsomal prostaglandin E synthase-1 in IL-1beta-induced anorexia. Physiological genomics, 25(3), 485-92. [PubMed:16554545] [WorldCat] [DOI] - ↑
Elander, L., Engström, L., Hallbeck, M., & Blomqvist, A. (2007).
IL-1beta and LPS induce anorexia by distinct mechanisms differentially dependent on microsomal prostaglandin E synthase-1. American journal of physiology. Regulatory, integrative and comparative physiology, 292(1), R258-67. [PubMed:16946079] [WorldCat] [DOI] - ↑
Ohinata, K., Suetsugu, K., Fujiwara, Y., & Yoshikawa, M. (2006).
Activation of prostaglandin E receptor EP4 subtype suppresses food intake in mice. Prostaglandins & other lipid mediators, 81(1-2), 31-6. [PubMed:16997129] [WorldCat] [DOI] - ↑
Ohinata, K., Takagi, K., Biyajima, K., Fujiwara, Y., Fukumoto, S., Eguchi, N., ..., & Yoshikawa, M. (2008).
Central prostaglandin D(2) stimulates food intake via the neuropeptide Y system in mice. FEBS letters, 582(5), 679-84. [PubMed:18258196] [WorldCat] [DOI] - ↑
Hayaishi, O. (2000).
Molecular mechanisms of sleep-wake regulation: a role of prostaglandin D2. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 355(1394), 275-80. [PubMed:10724461] [PMC] [WorldCat] [DOI] - ↑
Qu, W.M., Huang, Z.L., Xu, X.H., Aritake, K., Eguchi, N., Nambu, F., ..., & Hayaishi, O. (2006).
Lipocalin-type prostaglandin D synthase produces prostaglandin D2 involved in regulation of physiological sleep. Proceedings of the National Academy of Sciences of the United States of America, 103(47), 17949-54. [PubMed:17093043] [PMC] [WorldCat] [DOI] - ↑ Eguchi, N., Kuwahata, Y., Pinzar, E., Mochizuki, T., Urade, Y., Hayaishi, O. (1999) Sleep of gene-knockout and transgenic mice for prostaglandin D synthase. Sleep Res. Online 2 Suppl-1, 665
- ↑ 40.0 40.1
Mizoguchi, A., Eguchi, N., Kimura, K., Kiyohara, Y., Qu, W.M., Huang, Z.L., ..., & Hayaishi, O. (2001).
Dominant localization of prostaglandin D receptors on arachnoid trabecular cells in mouse basal forebrain and their involvement in the regulation of non-rapid eye movement sleep. Proceedings of the National Academy of Sciences of the United States of America, 98(20), 11674-9. [PubMed:11562489] [PMC] [WorldCat] [DOI] - ↑
Satoh, S., Matsumura, H., Suzuki, F., & Hayaishi, O. (1996).
Promotion of sleep mediated by the A2a-adenosine receptor and possible involvement of this receptor in the sleep induced by prostaglandin D2 in rats. Proceedings of the National Academy of Sciences of the United States of America, 93(12), 5980-4. [PubMed:8650205] [PMC] [WorldCat] [DOI] - ↑
Huang, Z.L., Sato, Y., Mochizuki, T., Okada, T., Qu, W.M., Yamatodani, A., ..., & Hayaishi, O. (2003).
Prostaglandin E2 activates the histaminergic system via the EP4 receptor to induce wakefulness in rats. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(14), 5975-83. [PubMed:12853415] [PMC] [WorldCat] - ↑
Zeilhofer, H.U. (2007).
Prostanoids in nociception and pain. Biochemical pharmacology, 73(2), 165-74. [PubMed:16959219] [WorldCat] [DOI] - ↑
Ito, S., Okuda-Ashitaka, E., & Minami, T. (2001).
Central and peripheral roles of prostaglandins in pain and their interactions with novel neuropeptides nociceptin and nocistatin. Neuroscience research, 41(4), 299-332. [PubMed:11755218] [WorldCat] [DOI] - ↑
Ueno, A., Matsumoto, H., Naraba, H., Ikeda, Y., Ushikubi, F., Matsuoka, T., ..., & Oh-ishi, S. (2001).
Major roles of prostanoid receptors IP and EP(3) in endotoxin-induced enhancement of pain perception. Biochemical pharmacology, 62(2), 157-60. [PubMed:11389873] [WorldCat] [DOI] - ↑ 46.0 46.1
Moriyama, T., Higashi, T., Togashi, K., Iida, T., Segi, E., Sugimoto, Y., ..., & Tominaga, M. (2005).
Sensitization of TRPV1 by EP1 and IP reveals peripheral nociceptive mechanism of prostaglandins. Molecular pain, 1, 3. [PubMed:15813989] [PMC] [WorldCat] [DOI] - ↑
Samad, T.A., Moore, K.A., Sapirstein, A., Billet, S., Allchorne, A., Poole, S., ..., & Woolf, C.J. (2001).
Interleukin-1beta-mediated induction of Cox-2 in the CNS contributes to inflammatory pain hypersensitivity. Nature, 410(6827), 471-5. [PubMed:11260714] [WorldCat] [DOI] - ↑ 48.0 48.1
Minami, T., Nakano, H., Kobayashi, T., Sugimoto, Y., Ushikubi, F., Ichikawa, A., ..., & Ito, S. (2001).
Characterization of EP receptor subtypes responsible for prostaglandin E2-induced pain responses by use of EP1 and EP3 receptor knockout mice. British journal of pharmacology, 133(3), 438-44. [PubMed:11375261] [PMC] [WorldCat] [DOI] - ↑
Reinold, H., Ahmadi, S., Depner, U.B., Layh, B., Heindl, C., Hamza, M., ..., & Zeilhofer, H.U. (2005).
Spinal inflammatory hyperalgesia is mediated by prostaglandin E receptors of the EP2 subtype. The Journal of clinical investigation, 115(3), 673-9. [PubMed:15719070] [PMC] [WorldCat] [DOI] - ↑
Ahmadi, S., Lippross, S., Neuhuber, W.L., & Zeilhofer, H.U. (2002).
PGE(2) selectively blocks inhibitory glycinergic neurotransmission onto rat superficial dorsal horn neurons. Nature neuroscience, 5(1), 34-40. [PubMed:11740501] [WorldCat] [DOI] - ↑
Mabuchi, T., Kojima, H., Abe, T., Takagi, K., Sakurai, M., Ohmiya, Y., ..., & Ito, S. (2004).
Membrane-associated prostaglandin E synthase-1 is required for neuropathic pain. Neuroreport, 15(9), 1395-8. [PubMed:15194860] [WorldCat] [DOI] - ↑
Kunori, S., Matsumura, S., Okuda-Ashitaka, E., Katano, T., Audoly, L.P., Urade, Y., & Ito, S. (2011).
A novel role of prostaglandin E2 in neuropathic pain: blockade of microglial migration in the spinal cord. Glia, 59(2), 208-18. [PubMed:21125641] [WorldCat] [DOI] - ↑
Furuyashiki, T., & Narumiya, S. (2011).
Stress responses: the contribution of prostaglandin E(2) and its receptors. Nature reviews. Endocrinology, 7(3), 163-75. [PubMed:21116297] [WorldCat] [DOI] - ↑ 54.0 54.1 54.2 54.3
Matsuoka, Y., Furuyashiki, T., Yamada, K., Nagai, T., Bito, H., Tanaka, Y., ..., & Narumiya, S. (2005).
Prostaglandin E receptor EP1 controls impulsive behavior under stress. Proceedings of the National Academy of Sciences of the United States of America, 102(44), 16066-71. [PubMed:16247016] [PMC] [WorldCat] [DOI] - ↑ 55.0 55.1
Tanaka, Y., Furuyashiki, T., Momiyama, T., Namba, H., Mizoguchi, A., Mitsumori, T., ..., & Narumiya, S. (2009).
Prostaglandin E receptor EP1 enhances GABA-mediated inhibition of dopaminergic neurons in the substantia nigra pars compacta and regulates dopamine level in the dorsal striatum. The European journal of neuroscience, 30(12), 2338-46. [PubMed:20092576] [WorldCat] [DOI] - ↑ 56.0 56.1 56.2
Tanaka, K., Furuyashiki, T., Kitaoka, S., Senzai, Y., Imoto, Y., Segi-Nishida, E., ..., & Narumiya, S. (2012).
Prostaglandin E2-mediated attenuation of mesocortical dopaminergic pathway is critical for susceptibility to repeated social defeat stress in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(12), 4319-29. [PubMed:22442093] [PMC] [WorldCat] [DOI] - ↑
Kitaoka, S., Furuyashiki, T., Nishi, A., Shuto, T., Koyasu, S., Matsuoka, T., ..., & Narumiya, S. (2007).
Prostaglandin E2 acts on EP1 receptor and amplifies both dopamine D1 and D2 receptor signaling in the striatum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(47), 12900-7. [PubMed:18032663] [PMC] [WorldCat] [DOI] - ↑
Teather, L.A., Packard, M.G., & Bazan, N.G. (2002).
Post-training cyclooxygenase-2 (COX-2) inhibition impairs memory consolidation. Learning & memory (Cold Spring Harbor, N.Y.), 9(1), 41-7. [PubMed:11917005] [PMC] [WorldCat] [DOI] - ↑ 59.0 59.1
Savonenko, A., Munoz, P., Melnikova, T., Wang, Q., Liang, X., Breyer, R.M., ..., & Andreasson, K. (2009).
Impaired cognition, sensorimotor gating, and hippocampal long-term depression in mice lacking the prostaglandin E2 EP2 receptor. Experimental neurology, 217(1), 63-73. [PubMed:19416671] [PMC] [WorldCat] [DOI] - ↑ 60.0 60.1
Yang, H., Zhang, J., Breyer, R.M., & Chen, C. (2009).
Altered hippocampal long-term synaptic plasticity in mice deficient in the PGE2 EP2 receptor. Journal of neurochemistry, 108(1), 295-304. [PubMed:19012750] [PMC] [WorldCat] [DOI] - ↑
Matousek, S.B., Hein, A.M., Shaftel, S.S., Olschowka, J.A., Kyrkanides, S., & O'Banion, M.K. (2010).
Cyclooxygenase-1 mediates prostaglandin E(2) elevation and contextual memory impairment in a model of sustained hippocampal interleukin-1beta expression. Journal of neurochemistry, 114(1), 247-58. [PubMed:20412387] [PMC] [WorldCat] [DOI] - ↑
Hein, A.M., Stutzman, D.L., Bland, S.T., Barrientos, R.M., Watkins, L.R., Rudy, J.W., & Maier, S.F. (2007).
Prostaglandins are necessary and sufficient to induce contextual fear learning impairments after interleukin-1 beta injections into the dorsal hippocampus. Neuroscience, 150(4), 754-63. [PubMed:18035502] [PMC] [WorldCat] [DOI] - ↑
Akaneya, Y., & Tsumoto, T. (2006).
Bidirectional trafficking of prostaglandin E2 receptors involved in long-term potentiation in visual cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(40), 10209-21. [PubMed:17021176] [PMC] [WorldCat] [DOI] - ↑
Le, T.D., Shirai, Y., Okamoto, T., Tatsukawa, T., Nagao, S., Shimizu, T., & Ito, M. (2010).
Lipid signaling in cytosolic phospholipase A2alpha-cyclooxygenase-2 cascade mediates cerebellar long-term depression and motor learning. Proceedings of the National Academy of Sciences of the United States of America, 107(7), 3198-203. [PubMed:20133605] [PMC] [WorldCat] [DOI] - ↑
Niwa, K., Araki, E., Morham, S.G., Ross, M.E., & Iadecola, C. (2000).
Cyclooxygenase-2 contributes to functional hyperemia in whisker-barrel cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(2), 763-70. [PubMed:10632605] [PMC] [WorldCat] - ↑
Takano, T., Tian, G.F., Peng, W., Lou, N., Libionka, W., Han, X., & Nedergaard, M. (2006).
Astrocyte-mediated control of cerebral blood flow. Nature neuroscience, 9(2), 260-7. [PubMed:16388306] [WorldCat] [DOI] - ↑
Niwa, K., Haensel, C., Ross, M.E., & Iadecola, C. (2001).
Cyclooxygenase-1 participates in selected vasodilator responses of the cerebral circulation. Circulation research, 88(6), 600-8. [PubMed:11282894] [WorldCat] [DOI] - ↑
Ellis, E.F., Wei, E.P., & Kontos, H.A. (1979).
Vasodilation of cat cerebral arterioles by prostaglandins D2, E2, G2, and I2. The American journal of physiology, 237(3), H381-5. [PubMed:382872] [WorldCat] [DOI] - ↑
Cao, X., Peterson, J.R., Wang, G., Anrather, J., Young, C.N., Guruju, M.R., ..., & Davisson, R.L. (2012).
Angiotensin II-dependent hypertension requires cyclooxygenase 1-derived prostaglandin E2 and EP1 receptor signaling in the subfornical organ of the brain. Hypertension (Dallas, Tex. : 1979), 59(4), 869-76. [PubMed:22371360] [PMC] [WorldCat] [DOI] - ↑ 70.0 70.1
Takemiya, T., Matsumura, K., Sugiura, H., Maehara, M., Yasuda, S., Uematsu, S., ..., & Yamagata, K. (2010).
Endothelial microsomal prostaglandin E synthase-1 exacerbates neuronal loss induced by kainate. Journal of neuroscience research, 88(2), 381-90. [PubMed:19658194] [WorldCat] [DOI] - ↑ 71.0 71.1
Kawano, T., Anrather, J., Zhou, P., Park, L., Wang, G., Frys, K.A., ..., & Iadecola, C. (2006).
Prostaglandin E2 EP1 receptors: downstream effectors of COX-2 neurotoxicity. Nature medicine, 12(2), 225-9. [PubMed:16432513] [WorldCat] [DOI] - ↑
Saleem, S., Li, R.C., Wei, G., & Doré, S. (2007).
Effects of EP1 receptor on cerebral blood flow in the middle cerebral artery occlusion model of stroke in mice. Journal of neuroscience research, 85(11), 2433-40. [PubMed:17600836] [PMC] [WorldCat] [DOI] - ↑
McCullough, L., Wu, L., Haughey, N., Liang, X., Hand, T., Wang, Q., ..., & Andreasson, K. (2004).
Neuroprotective function of the PGE2 EP2 receptor in cerebral ischemia. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(1), 257-68. [PubMed:14715958] [PMC] [WorldCat] [DOI] - ↑
Jiang, J., Ganesh, T., Du, Y., Thepchatri, P., Rojas, A., Lewis, I., ..., & Dingledine, R. (2010).
Neuroprotection by selective allosteric potentiators of the EP2 prostaglandin receptor. Proceedings of the National Academy of Sciences of the United States of America, 107(5), 2307-12. [PubMed:20080612] [PMC] [WorldCat] [DOI] - ↑
Liu, D., Wu, L., Breyer, R., Mattson, M.P., & Andreasson, K. (2005).
Neuroprotection by the PGE2 EP2 receptor in permanent focal cerebral ischemia. Annals of neurology, 57(5), 758-61. [PubMed:15852374] [WorldCat] [DOI] - ↑ 76.0 76.1
Liang, X., Wang, Q., Hand, T., Wu, L., Breyer, R.M., Montine, T.J., & Andreasson, K. (2005).
Deletion of the prostaglandin E2 EP2 receptor reduces oxidative damage and amyloid burden in a model of Alzheimer's disease. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(44), 10180-7. [PubMed:16267225] [PMC] [WorldCat] [DOI] - ↑ 77.0 77.1
Liang, X., Wang, Q., Shi, J., Lokteva, L., Breyer, R.M., Montine, T.J., & Andreasson, K. (2008).
The prostaglandin E2 EP2 receptor accelerates disease progression and inflammation in a model of amyotrophic lateral sclerosis. Annals of neurology, 64(3), 304-14. [PubMed:18825663] [PMC] [WorldCat] [DOI] - ↑
Jiang, J., Ganesh, T., Du, Y., Quan, Y., Serrano, G., Qui, M., ..., & Dingledine, R. (2012).
Small molecule antagonist reveals seizure-induced mediation of neuronal injury by prostaglandin E2 receptor subtype EP2. Proceedings of the National Academy of Sciences of the United States of America, 109(8), 3149-54. [PubMed:22323596] [PMC] [WorldCat] [DOI] - ↑
Ahmad, M., Ahmad, A.S., Zhuang, H., Maruyama, T., Narumiya, S., & Doré, S. (2007).
Stimulation of prostaglandin E2-EP3 receptors exacerbates stroke and excitotoxic injury. Journal of neuroimmunology, 184(1-2), 172-9. [PubMed:17275922] [PMC] [WorldCat] [DOI] - ↑
Ikeda-Matsuo, Y., Tanji, H., Ota, A., Hirayama, Y., Uematsu, S., Akira, S., & Sasaki, Y. (2010).
Microsomal prostaglandin E synthase-1 contributes to ischaemic excitotoxicity through prostaglandin E2 EP3 receptors. British journal of pharmacology, 160(4), 847-59. [PubMed:20590584] [PMC] [WorldCat] [DOI] - ↑
Takemiya, T., Matsumura, K., Sugiura, H., Yasuda, S., Uematsu, S., Akira, S., & Yamagata, K. (2011).
Endothelial microsomal prostaglandin E synthase-1 facilitates neurotoxicity by elevating astrocytic Ca2+ levels. Neurochemistry international, 58(4), 489-96. [PubMed:21219953] [WorldCat] [DOI] - ↑ 82.0 82.1 82.2
Zhen, G., Kim, Y.T., Li, R.C., Yocum, J., Kapoor, N., Langer, J., ..., & Doré, S. (2012).
PGE2 EP1 receptor exacerbated neurotoxicity in a mouse model of cerebral ischemia and Alzheimer's disease. Neurobiology of aging, 33(9), 2215-9. [PubMed:22015313] [PMC] [WorldCat] [DOI] - ↑ 83.0 83.1
Hoshino, T., Namba, T., Takehara, M., Murao, N., Matsushima, T., Sugimoto, Y., ..., & Mizushima, T. (2012).
Improvement of cognitive function in Alzheimer's disease model mice by genetic and pharmacological inhibition of the EP(4) receptor. Journal of neurochemistry, 120(5), 795-805. [PubMed:22044482] [WorldCat] [DOI] - ↑
Hoshino, T., Namba, T., Takehara, M., Nakaya, T., Sugimoto, Y., Araki, W., ..., & Mizushima, T. (2009).
Prostaglandin E2 stimulates the production of amyloid-beta peptides through internalization of the EP4 receptor. The Journal of biological chemistry, 284(27), 18493-502. [PubMed:19407341] [PMC] [WorldCat] [DOI] - ↑
Shie, F.S., Breyer, R.M., & Montine, T.J. (2005).
Microglia lacking E Prostanoid Receptor subtype 2 have enhanced Abeta phagocytosis yet lack Abeta-activated neurotoxicity. The American journal of pathology, 166(4), 1163-72. [PubMed:15793296] [PMC] [WorldCat] [DOI] - ↑
Di Giorgio, F.P., Boulting, G.L., Bobrowicz, S., & Eggan, K.C. (2008).
Human embryonic stem cell-derived motor neurons are sensitive to the toxic effect of glial cells carrying an ALS-causing mutation. Cell stem cell, 3(6), 637-48. [PubMed:19041780] [WorldCat] [DOI] - ↑
Müller, N., Riedel, M., Scheppach, C., Brandstätter, B., Sokullu, S., Krampe, K., ..., & Schwarz, M.J. (2002).
Beneficial antipsychotic effects of celecoxib add-on therapy compared to risperidone alone in schizophrenia. The American journal of psychiatry, 159(6), 1029-34. [PubMed:12042193] [WorldCat] [DOI] - ↑
Müller, N., Krause, D., Dehning, S., Musil, R., Schennach-Wolff, R., Obermeier, M., ..., & Riedel, M. (2010).
Celecoxib treatment in an early stage of schizophrenia: results of a randomized, double-blind, placebo-controlled trial of celecoxib augmentation of amisulpride treatment. Schizophrenia research, 121(1-3), 118-24. [PubMed:20570110] [WorldCat] [DOI] - ↑
Müller, N., Schwarz, M.J., Dehning, S., Douhe, A., Cerovecki, A., Goldstein-Müller, B., ..., & Riedel, M. (2006).
The cyclooxygenase-2 inhibitor celecoxib has therapeutic effects in major depression: results of a double-blind, randomized, placebo controlled, add-on pilot study to reboxetine. Molecular psychiatry, 11(7), 680-4. [PubMed:16491133] [WorldCat] [DOI] - ↑
Abbasi, S.H., Hosseini, F., Modabbernia, A., Ashrafi, M., & Akhondzadeh, S. (2012).
Effect of celecoxib add-on treatment on symptoms and serum IL-6 concentrations in patients with major depressive disorder: randomized double-blind placebo-controlled study. Journal of affective disorders, 141(2-3), 308-14. [PubMed:22516310] [WorldCat] [DOI] - ↑ 91.0 91.1
Warner-Schmidt, J.L., Vanover, K.E., Chen, E.Y., Marshall, J.J., & Greengard, P. (2011).
Antidepressant effects of selective serotonin reuptake inhibitors (SSRIs) are attenuated by antiinflammatory drugs in mice and humans. Proceedings of the National Academy of Sciences of the United States of America, 108(22), 9262-7. [PubMed:21518864] [PMC] [WorldCat] [DOI]
(執筆担当者:古屋敷智之、北岡志保 担当編集委員:林康紀)