「アセチルコリン」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の26版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Acetylcholine 英語略名:ACh | 英語名:Acetylcholine 英語略名:ACh | ||
アセチルコリンは最も早く同定された神経伝達物質である。末梢神経系では、運動神経の神経筋接合部、交感神経および副交感神経の節前線維の終末、副交感神経の節後線維の終末などのシナプスで伝達物質として働く。中枢神経系の一部にもアセチルコリンを伝達物質とする神経が存在する。また、神経系以外でも化学伝達物質として幅広い作用を発揮する。 | |||
== 発見 == | == 発見 == | ||
1914年にHenry H. Daleよって発見された。Otto Loewiは、2つのカエル摘出心標本を用い、迷走神経を刺激中に採取した心灌流液で別の標本の心収縮が抑制されることを示すなどの実験を行い、アセチルコリンが神経伝達物質であることを証明した。DaleとLoewiは、これらの業績によって1936年にノーベル生理学・医学賞を受賞している。 | |||
== 化学構造 == | |||
コリンと酢酸のエステル化合物で、四級アンモニウム構造をもつ。 | |||
== 生合成 == | == 生合成 == | ||
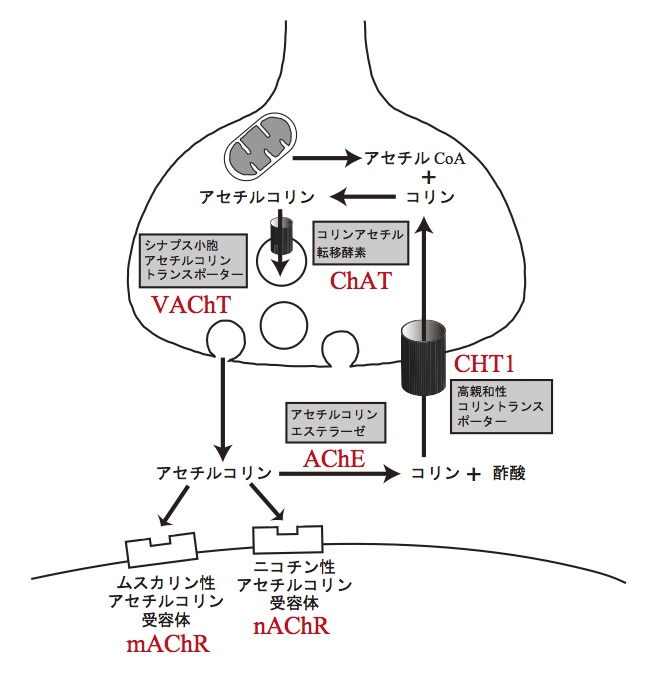
コリンアセチル転移酵素(acetyl-CoA: choline O-acetyltransferase; ChAT, EC 2.3.1.6)によりコリンとアセチルCoAから合成される。ChATは細胞質に存在す可溶性蛋白質であるが、神経軸索を経て終末部に運ばれる。ChATの比活性(specific activity)は極めて高く、通常の条件では、連続した神経活動時にもアセチルコリンが不足することはない。ChATのコリンに対する親和性(Km)は細胞内のコリン濃度に比べて大きいため、コリンの供給がアセチルコリン合成の律速段階となる。ChATの特異抗体による免疫組織化学がアセチルコリンを合成する神経(コリン作動性神経)の細胞体や軸索を同定する目的で繁用される。 | |||
== コリンの取り込み == | == コリンの取り込み == | ||
アセチルコリン合成の基質となるコリンの大部分は細胞外から供給される。コリンの輸送系は高親和性 (Km 1〜5 | アセチルコリン合成の基質となるコリンの大部分は細胞外から供給される。コリンの輸送系は高親和性 (Km 1〜5 mM)と低親和性 (Km 50〜100 mM)の2種類が知られているが、コリン作動性性神経には特異的な高親和性の取り込みが観察され、その活性は神経活動に依存して上昇する。高親和性コリントランスポーター (high-affinity choline transporter; CHT1, SLC5A7)はNa+依存性グルコーストランスポーターファミリーに属する13回膜貫通型の蛋白質であり、コリン作動性神経での高親和性コリン取り込みを担う。CHT1は、速い軸索流により神経終末部に輸送される。静止状態ではCHT1の大部分はシナプス小胞膜に局在するが、神経活動時にシナプス小胞の開口放出に伴ってCHT1が形質膜に移行することで、細胞外からのコリン輸送活性が上昇すると考えられる。 | ||
== 貯蔵、放出 == | == 貯蔵、放出 == | ||
細胞質で合成されたアセチルコリンは、小胞アセチルコリントランスポーター(vesicular acetylcholine transporter; VAChT, SLC18A3)の働きにより、プロトン電気化学勾配を駆動力としてシナプス小胞に輸送される。一個のシナプス小胞には1,000から50,000分子のアセチルコリンが含まれると概算される。VAChTはChAT遺伝子の第一イントロンに全長がコードされ、共通の転写制御を受けると考えられている。実際にVAChTとChATの発現は共通の部位・細胞で観察される。 | |||
神経終末部にインパルスが到達すると、シナプス小胞に蓄えられたアセチルコリンは開口放出(exocytosis) | 神経終末部にインパルスが到達すると、シナプス小胞に蓄えられたアセチルコリンは開口放出(exocytosis)により放出される。この過程には細胞内でのカルシウムイオンの上昇が重要である。アセチルコリンの放出は、一つのシナプス小胞に蓄えられた数千分子が1単位として同期放出される素量的放出(quantal release)として検出される。 | ||
== 代謝、分解 == | == 代謝、分解 == | ||
細胞外に放出されたアセチルコリンは、アセチルコリンエステラーゼ(acetylcholinesterase; AChE, EC3.1.1.7)によって極めて短時間 (ミリ秒の時間単位)で分解され、コリンと酢酸になる。この分解によって化学伝達は終了するとともに、コリンは高親和性コリントランスポーターによって効率良くシナプス前終末に取り込まれてアセチルコリン合成に再利用される。アセチルコリンを分解する酵素は、アセチルコリンエステラーゼの他にブチルコリンエステラーゼ(偽性コリンエステラーゼ)が知られている。コリンエステラーゼに対して阻害活性を持つ薬物は、シナプス間隙のアセチルコリンを増やして化学伝達を増強するため、様々な薬物として臨床応用されている。このうち、ネオスチグミンは重症筋無力症、術後腸管麻痺、排尿障害などに、ドネペジル、ガランタミン、リバスチグミンはアルツハイマー病に適応される。 | |||
== 受容体 == | == 受容体 == | ||
<span> アセチルコリンの受容体は、ニコチン性アセチルコリン受容体とムスカリン性アセチルコリン受容体に大別され、それぞれアセチルコリンによるニコチン様作用(骨格筋や神経節での刺激作用)とムスカリン様作用(副交感神経支配器官での刺激作用)を担う。</span> | |||
nicotinic acetylcholine receptor; nAChR | <!--[if !supportLists]--><span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>ニコチン性アセチルコリン受容体</span><span lang="EN-US">(nicotinic acetylcholine receptor; nAChR)</span> | ||
<span>陽イオン選択性のイオンチャネル内蔵型受容体であり、アセチルコリンやニコチンが結合すると、ごく短時間(ミリ秒単位)に</span><span lang="EN-US">Na<sup>+</sup>, K<sup>+</sup>, Ca<sup>2+</sup></span><span>などのイオン透過性が亢進する。</span><span lang="EN-US">nAChR</span><span>は、神経筋接合部、自律神経節、副腎髄質、中枢神経系などに分布する。ニコチン受容体は、類似構造をもつ複数サブユニットが会合した5</span><span>量体として機能する。様々な動物種で、</span><span lang="EN-US" style="font-family:Symbol">α </span><span lang="EN-US">(</span><span lang="EN-US" style="font-family:Symbol">α</span><span lang="EN-US">1</span><span>〜</span><span lang="EN-US">10), </span><span lang="EN-US" style="font-family:Symbol">β</span><span lang="EN-US"> (</span><span lang="EN-US" style="font-family:Symbol">β</span><span lang="EN-US">1</span><span>〜</span><span lang="EN-US">4), </span><span lang="EN-US" style="font-family:Symbol">γ</span><span lang="EN-US">, </span><span lang="EN-US" style="font-family:Symbol">δ</span><span lang="EN-US">, </span><span lang="EN-US" style="font-family:Symbol">ε</span><span>の</span><span lang="EN-US">17</span><span>種類のサブユニットが存在し、それらの組み合わせにより骨格筋型</span><span lang="EN-US">(Nm)</span><span>と神経型</span><span lang="EN-US">(Nn)</span><span>に大別される。骨格筋型</span><span lang="EN-US">nAChR</span><span>は</span><span lang="EN-US" style="font-family:Symbol">α</span><span lang="EN-US">1</span><span>が</span><span lang="EN-US">2</span><span>個</span><span lang="EN-US">, </span><span lang="EN-US" style="font-family:Symbol">β</span><span lang="EN-US">1, </span><span lang="EN-US" style="font-family:Symbol">δ</span><span lang="EN-US">(</span><span>または</span><span lang="EN-US" style="font-family:Symbol">ε), γ</span><span>が各</span><span lang="EN-US" style="font-family:Symbol">1</span><span>個の</span><span lang="EN-US" style="mso-bidi-font-family:Marlett">5</span><span>量体からなる</span><span>。神経型</span><span lang="EN-US">nAChR</span><span>は、</span><span lang="EN-US">α</span><span>と</span><span lang="EN-US">β</span><span>からなるヘテロ</span><span lang="EN-US">5</span><span>量体、あるいは同一の</span><span lang="EN-US">α</span><span>からなるホモ</span><span lang="EN-US">5</span><span>量体の構造をとるが、サブユニット構成により高度に多様性に富み、それぞれ独自のチャネル特性を持つとされる。</span><span lang="EN-US">1</span><span>つの</span><span lang="EN-US">nAChR</span><span>には</span><span lang="EN-US">2</span><span>分子のアセチルコリンが結合してチャネルを開口させる。パンクロニウム、ベクロニウムなどの</span><span lang="EN-US">Nm</span><span>を遮断する薬物は筋弛緩薬である。バレニクリンは</span><span lang="EN-US">nAChR</span><span>の部分作動薬で、ニコチン依存症に対する禁煙補助薬として用いられる。重症筋無力症では、筋肉型</span><span lang="EN-US">nAChR</span><span>に対する自己抗体の産生が報告されている。</span> | |||
=== ムスカリン性アセチルコリン受容体 = | <!--[if !supportLists]--><span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>ムスカリン性アセチルコリン受容体</span> <span lang="EN-US">(muscarinic acetylcholine receptor; mAChR)</span> | ||
<span lang="EN-US">GTP</span><span>結合蛋白質に共役した代謝型受容体</span><span lang="EN-US">(GPCR)</span><span>であり、</span><span lang="EN-US">M<sub>1</sub></span><span>〜</span><span lang="EN-US">M<sub>5</sub></span><span>の5種類のサブタイプが存在する。</span><span lang="EN-US">M<sub>1</sub>, M<sub>3</sub>, M<sub>5</sub></span><span>は、百日咳毒素非感受性の</span><span lang="EN-US">GTP</span><span>結合蛋白質</span><span lang="EN-US">(G<sub>q/11</sub>)</span><span>と共役して、ホスファチジルイノシトール代謝回転の促進と細胞内</span><span lang="EN-US">Ca<sup>2+</sup></span><span>濃度の上昇を引き起こす。</span><span lang="EN-US">M<sub>2</sub></span><span>と</span><span lang="EN-US">M<sub>4</sub></span><span>は、百日咳毒素感受性の</span><span lang="EN-US">GTP</span><span>結合蛋白質</span><span lang="EN-US">(G<sub>i/o</sub>)</span><span>と共役し、アデニル酸シクラーゼを抑制して細胞内</span><span lang="EN-US">cAMP</span><span>濃度の低下や、内向き整流</span><span lang="EN-US">K<sup>+</sup></span><span>チャネルの活性化を引き起こす。</span><span lang="EN-US">mAChR</span><span>は、副交感神経支配器官に分布して、消化管や肺などの平滑筋収縮や分泌腺刺激、心臓機能の抑制などを担う。また中枢神経系、末梢神経系にも広く分布して神経伝達の修飾に関与する。ベタネコールやピロカルピンなどのコリンエステル類および天然アルカロイドが作用薬として、アトロピンと類似構造をもつ天然または合成アルカロイドが遮断薬として、どちらも臨床適応される。完全にサブタイプ特異的なリガンド開発は困難とされているが、幾つかのサブタイプに対する作用薬またはアロステリックリガンドが、アルツハイマー病や統合失調症の創薬ターゲットとして注目されている。</span><br> | |||
[[Image:Hidemimisawa fig 1.jpg|図1 神経終末におけるアセチルコリンの合成、分布、代謝、受容体]] | |||
== 主たるアセチルコリン含有神経の分布 == | == 主たるアセチルコリン含有神経の分布 == | ||
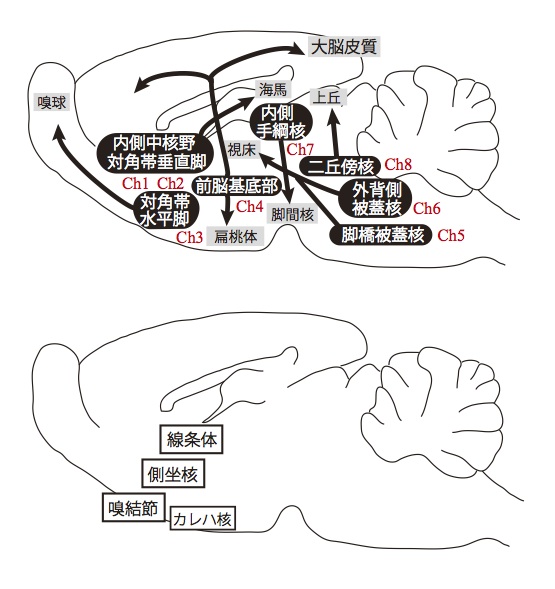
<span> 中枢神経系でのアセチルコリン含有神経(コリン作動性神経)は、限局した脳部位に存在し、</span><span lang="EN-US">Ch1</span><span>〜</span><span lang="EN-US">8</span><span>に分類される。細胞体から長い軸索を伸ばす投射神経と、比較的短い軸索を伸ばす局所回路神経に大別される。</span> | |||
<!--[if !supportLists]--><span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>投射神経(および代表的投射部位)</span> | |||
= | <span lang="EN-US">Ch1: </span><span>内側中隔野から海馬へ</span> | ||
<span lang="EN-US">Ch2: </span><span>対角帯垂直脚から海馬へ</span> | |||
<span lang="EN-US">Ch3: </span><span>対角帯水平脚から嗅球へ</span> | |||
<span lang="EN-US">Ch4: </span><span>マイネルト基底核や無名室から大脳皮質や扁桃体へ</span> | |||
<span lang="EN-US">Ch5: </span><span>脚橋被蓋核から視床へ</span> | |||
<span lang="EN-US">Ch6: </span><span>外背側被蓋核から視床へ</span> | |||
<span lang="EN-US">Ch7: </span><span>内側手綱核から脚間核へ</span> | |||
<span lang="EN-US">Ch8: </span><span>二丘傍核から上丘へ</span> | |||
<span>その他:脳の運動神経諸核および脊髄の運動神経から筋肉へ、交感神経節前神経(脊髄側角)から節後神経へ</span> | |||
<!--[if !supportLists]--><span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>局所回路神経</span> | |||
<span>線条体、側坐核、嗅結節、カレハ核などに小型の介在神経が存在する。</span><br> | |||
[[Image:Hidemimisawa fig 2.jpg|図2 ラット脳のアセチルコリン含有神経の分布:投射神経(上)と局所回路神経(下)]] | |||
== 機能 == | == 機能 == | ||
<span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>大脳皮質</span> | |||
<span>前脳基底部のコリン作動性神経は、大脳皮質の広範な領域に投射して、アセチルコリンを供給する。投射を受ける細胞(主として錐体細胞)との間には明確なシナプス構造が認められる場合と、認められない場合があり、後者の場合を拡散性伝達</span><span lang="EN-US">(diffuse transmission)</span><span>と呼ぶことがある。アセチルコリンは、一般的には錐体細胞の興奮性を上昇させるが、一方で錐体細胞サブタイプごとに作用が異なることも知られている。さらに、アセチルコリンは</span><span lang="EN-US">GABA</span><span>作動性の抑制性介在神経にも作用する。大脳皮質のアセチルコリンは、脳の感覚入力処理におけるSN比の調整に関与する「感覚ゲート」を駆動するとされる。この働きは認知機能の基盤となる注意、集中などに重要であり、アルツハイマー病や統合失調症の患者ではこの機能に変化が見られることが知られている。</span> | |||
=== | <!--[if !supportLists]--><span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>大脳基底核</span> | ||
運動制御に重要とされる線条体の</span><span lang="EN-US">GABA</span><span>作動性投射神経の機能は、線条体神経の1〜2%を占めるコリン作動性介在神経と黒質緻密部からのドパミン神経入力によって調節される。パーキンソン病患者では、ドパミンの欠乏とそれに伴うアセチルコリン放出の増加により、大脳基底核の神経回路が抑制された状態となる。 | |||
<!--[if !supportLists]--><span lang="EN-US" style="font-family:Wingdings;mso-fareast-font-family:Wingdings; mso-bidi-font-family:Wingdings"><span style="mso-list:Ignore">n </span></span><span>中脳</span> | |||
脚橋被蓋核と背外側被蓋核のコリン作動性神経は上行性と下降性の2種類の投射経路をもつ。視床へ投射する上行性投射系は、網様体賦活系の一部として睡眠サイクルや覚醒レベルの調節に関与する。脳幹網様体へ投射する下降性投射系は歩行運動、姿勢反射、筋緊張の調節などに関与する。また、脚橋被蓋核のコリン作動性神経は視床のほか大脳基底核にも投射する。特に、黒質緻密部のドパミン神経細胞に投射して、ドパミンの放出を促進する。パーキンソン病患者では、この部位のコリン作動性神経が減少することでドパミン放出が減弱していることも病状の一因になると考えられている。 | |||
== 非神経性アセチルコリン == | == 非神経性アセチルコリン == | ||
アセチルコリンは、真性細菌などの原核生物を始めとして、ほぼすべての生物での存在が報告されている。植物では水や電解質、栄養物質などの輸送に関与するとされるが、その生理的役割は不明な点が多い。タケノコの先端部には、哺乳動物の脳をはるかに超える量のアセチルコリンが含まれている。ヒトを含めた哺乳動物では、様々な非神経細胞や組織でアセチルコリンの合成と放出が確認されている。このうち、免疫系細胞、血管内皮細胞、胎盤、ケラチノサイト、気道上皮細胞、消化管上皮細胞、膀胱上皮細胞などでは、神経系とは独立した非神経性アセチルコリンが局所の細胞間情報伝達を担うことが報告されている。 | |||
== 参考文献 == | |||
== | |||
(執筆者:三澤日出巳 編集担当委員:尾藤晴彦) | |||
2013年1月16日 (水) 09:30時点における版
英語名:Acetylcholine 英語略名:ACh
アセチルコリンは最も早く同定された神経伝達物質である。末梢神経系では、運動神経の神経筋接合部、交感神経および副交感神経の節前線維の終末、副交感神経の節後線維の終末などのシナプスで伝達物質として働く。中枢神経系の一部にもアセチルコリンを伝達物質とする神経が存在する。また、神経系以外でも化学伝達物質として幅広い作用を発揮する。
発見
1914年にHenry H. Daleよって発見された。Otto Loewiは、2つのカエル摘出心標本を用い、迷走神経を刺激中に採取した心灌流液で別の標本の心収縮が抑制されることを示すなどの実験を行い、アセチルコリンが神経伝達物質であることを証明した。DaleとLoewiは、これらの業績によって1936年にノーベル生理学・医学賞を受賞している。
化学構造
コリンと酢酸のエステル化合物で、四級アンモニウム構造をもつ。
生合成
コリンアセチル転移酵素(acetyl-CoA: choline O-acetyltransferase; ChAT, EC 2.3.1.6)によりコリンとアセチルCoAから合成される。ChATは細胞質に存在す可溶性蛋白質であるが、神経軸索を経て終末部に運ばれる。ChATの比活性(specific activity)は極めて高く、通常の条件では、連続した神経活動時にもアセチルコリンが不足することはない。ChATのコリンに対する親和性(Km)は細胞内のコリン濃度に比べて大きいため、コリンの供給がアセチルコリン合成の律速段階となる。ChATの特異抗体による免疫組織化学がアセチルコリンを合成する神経(コリン作動性神経)の細胞体や軸索を同定する目的で繁用される。
コリンの取り込み
アセチルコリン合成の基質となるコリンの大部分は細胞外から供給される。コリンの輸送系は高親和性 (Km 1〜5 mM)と低親和性 (Km 50〜100 mM)の2種類が知られているが、コリン作動性性神経には特異的な高親和性の取り込みが観察され、その活性は神経活動に依存して上昇する。高親和性コリントランスポーター (high-affinity choline transporter; CHT1, SLC5A7)はNa+依存性グルコーストランスポーターファミリーに属する13回膜貫通型の蛋白質であり、コリン作動性神経での高親和性コリン取り込みを担う。CHT1は、速い軸索流により神経終末部に輸送される。静止状態ではCHT1の大部分はシナプス小胞膜に局在するが、神経活動時にシナプス小胞の開口放出に伴ってCHT1が形質膜に移行することで、細胞外からのコリン輸送活性が上昇すると考えられる。
貯蔵、放出
細胞質で合成されたアセチルコリンは、小胞アセチルコリントランスポーター(vesicular acetylcholine transporter; VAChT, SLC18A3)の働きにより、プロトン電気化学勾配を駆動力としてシナプス小胞に輸送される。一個のシナプス小胞には1,000から50,000分子のアセチルコリンが含まれると概算される。VAChTはChAT遺伝子の第一イントロンに全長がコードされ、共通の転写制御を受けると考えられている。実際にVAChTとChATの発現は共通の部位・細胞で観察される。
神経終末部にインパルスが到達すると、シナプス小胞に蓄えられたアセチルコリンは開口放出(exocytosis)により放出される。この過程には細胞内でのカルシウムイオンの上昇が重要である。アセチルコリンの放出は、一つのシナプス小胞に蓄えられた数千分子が1単位として同期放出される素量的放出(quantal release)として検出される。
代謝、分解
細胞外に放出されたアセチルコリンは、アセチルコリンエステラーゼ(acetylcholinesterase; AChE, EC3.1.1.7)によって極めて短時間 (ミリ秒の時間単位)で分解され、コリンと酢酸になる。この分解によって化学伝達は終了するとともに、コリンは高親和性コリントランスポーターによって効率良くシナプス前終末に取り込まれてアセチルコリン合成に再利用される。アセチルコリンを分解する酵素は、アセチルコリンエステラーゼの他にブチルコリンエステラーゼ(偽性コリンエステラーゼ)が知られている。コリンエステラーゼに対して阻害活性を持つ薬物は、シナプス間隙のアセチルコリンを増やして化学伝達を増強するため、様々な薬物として臨床応用されている。このうち、ネオスチグミンは重症筋無力症、術後腸管麻痺、排尿障害などに、ドネペジル、ガランタミン、リバスチグミンはアルツハイマー病に適応される。
受容体
アセチルコリンの受容体は、ニコチン性アセチルコリン受容体とムスカリン性アセチルコリン受容体に大別され、それぞれアセチルコリンによるニコチン様作用(骨格筋や神経節での刺激作用)とムスカリン様作用(副交感神経支配器官での刺激作用)を担う。
n ニコチン性アセチルコリン受容体(nicotinic acetylcholine receptor; nAChR)
陽イオン選択性のイオンチャネル内蔵型受容体であり、アセチルコリンやニコチンが結合すると、ごく短時間(ミリ秒単位)にNa+, K+, Ca2+などのイオン透過性が亢進する。nAChRは、神経筋接合部、自律神経節、副腎髄質、中枢神経系などに分布する。ニコチン受容体は、類似構造をもつ複数サブユニットが会合した5量体として機能する。様々な動物種で、α (α1〜10), β (β1〜4), γ, δ, εの17種類のサブユニットが存在し、それらの組み合わせにより骨格筋型(Nm)と神経型(Nn)に大別される。骨格筋型nAChRはα1が2個, β1, δ(またはε), γが各1個の5量体からなる。神経型nAChRは、αとβからなるヘテロ5量体、あるいは同一のαからなるホモ5量体の構造をとるが、サブユニット構成により高度に多様性に富み、それぞれ独自のチャネル特性を持つとされる。1つのnAChRには2分子のアセチルコリンが結合してチャネルを開口させる。パンクロニウム、ベクロニウムなどのNmを遮断する薬物は筋弛緩薬である。バレニクリンはnAChRの部分作動薬で、ニコチン依存症に対する禁煙補助薬として用いられる。重症筋無力症では、筋肉型nAChRに対する自己抗体の産生が報告されている。
n ムスカリン性アセチルコリン受容体 (muscarinic acetylcholine receptor; mAChR)
GTP結合蛋白質に共役した代謝型受容体(GPCR)であり、M1〜M5の5種類のサブタイプが存在する。M1, M3, M5は、百日咳毒素非感受性のGTP結合蛋白質(Gq/11)と共役して、ホスファチジルイノシトール代謝回転の促進と細胞内Ca2+濃度の上昇を引き起こす。M2とM4は、百日咳毒素感受性のGTP結合蛋白質(Gi/o)と共役し、アデニル酸シクラーゼを抑制して細胞内cAMP濃度の低下や、内向き整流K+チャネルの活性化を引き起こす。mAChRは、副交感神経支配器官に分布して、消化管や肺などの平滑筋収縮や分泌腺刺激、心臓機能の抑制などを担う。また中枢神経系、末梢神経系にも広く分布して神経伝達の修飾に関与する。ベタネコールやピロカルピンなどのコリンエステル類および天然アルカロイドが作用薬として、アトロピンと類似構造をもつ天然または合成アルカロイドが遮断薬として、どちらも臨床適応される。完全にサブタイプ特異的なリガンド開発は困難とされているが、幾つかのサブタイプに対する作用薬またはアロステリックリガンドが、アルツハイマー病や統合失調症の創薬ターゲットとして注目されている。
主たるアセチルコリン含有神経の分布
中枢神経系でのアセチルコリン含有神経(コリン作動性神経)は、限局した脳部位に存在し、Ch1〜8に分類される。細胞体から長い軸索を伸ばす投射神経と、比較的短い軸索を伸ばす局所回路神経に大別される。
n 投射神経(および代表的投射部位)
Ch1: 内側中隔野から海馬へ
Ch2: 対角帯垂直脚から海馬へ
Ch3: 対角帯水平脚から嗅球へ
Ch4: マイネルト基底核や無名室から大脳皮質や扁桃体へ
Ch5: 脚橋被蓋核から視床へ
Ch6: 外背側被蓋核から視床へ
Ch7: 内側手綱核から脚間核へ
Ch8: 二丘傍核から上丘へ
その他:脳の運動神経諸核および脊髄の運動神経から筋肉へ、交感神経節前神経(脊髄側角)から節後神経へ
n 局所回路神経
線条体、側坐核、嗅結節、カレハ核などに小型の介在神経が存在する。
機能
n 大脳皮質
前脳基底部のコリン作動性神経は、大脳皮質の広範な領域に投射して、アセチルコリンを供給する。投射を受ける細胞(主として錐体細胞)との間には明確なシナプス構造が認められる場合と、認められない場合があり、後者の場合を拡散性伝達(diffuse transmission)と呼ぶことがある。アセチルコリンは、一般的には錐体細胞の興奮性を上昇させるが、一方で錐体細胞サブタイプごとに作用が異なることも知られている。さらに、アセチルコリンはGABA作動性の抑制性介在神経にも作用する。大脳皮質のアセチルコリンは、脳の感覚入力処理におけるSN比の調整に関与する「感覚ゲート」を駆動するとされる。この働きは認知機能の基盤となる注意、集中などに重要であり、アルツハイマー病や統合失調症の患者ではこの機能に変化が見られることが知られている。
n 大脳基底核
運動制御に重要とされる線条体のGABA作動性投射神経の機能は、線条体神経の1〜2%を占めるコリン作動性介在神経と黒質緻密部からのドパミン神経入力によって調節される。パーキンソン病患者では、ドパミンの欠乏とそれに伴うアセチルコリン放出の増加により、大脳基底核の神経回路が抑制された状態となる。
n 中脳
脚橋被蓋核と背外側被蓋核のコリン作動性神経は上行性と下降性の2種類の投射経路をもつ。視床へ投射する上行性投射系は、網様体賦活系の一部として睡眠サイクルや覚醒レベルの調節に関与する。脳幹網様体へ投射する下降性投射系は歩行運動、姿勢反射、筋緊張の調節などに関与する。また、脚橋被蓋核のコリン作動性神経は視床のほか大脳基底核にも投射する。特に、黒質緻密部のドパミン神経細胞に投射して、ドパミンの放出を促進する。パーキンソン病患者では、この部位のコリン作動性神経が減少することでドパミン放出が減弱していることも病状の一因になると考えられている。
非神経性アセチルコリン
アセチルコリンは、真性細菌などの原核生物を始めとして、ほぼすべての生物での存在が報告されている。植物では水や電解質、栄養物質などの輸送に関与するとされるが、その生理的役割は不明な点が多い。タケノコの先端部には、哺乳動物の脳をはるかに超える量のアセチルコリンが含まれている。ヒトを含めた哺乳動物では、様々な非神経細胞や組織でアセチルコリンの合成と放出が確認されている。このうち、免疫系細胞、血管内皮細胞、胎盤、ケラチノサイト、気道上皮細胞、消化管上皮細胞、膀胱上皮細胞などでは、神経系とは独立した非神経性アセチルコリンが局所の細胞間情報伝達を担うことが報告されている。
参考文献
(執筆者:三澤日出巳 編集担当委員:尾藤晴彦)