「免疫組織化学法」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の6版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/masahikowatanabe 渡辺 雅彦]</font><br> | <font size="+1">[http://researchmap.jp/masahikowatanabe 渡辺 雅彦]</font><br> | ||
''北海道大学大学院医学研究科解剖学講座''<br> | ''北海道大学大学院医学研究科解剖学講座''<br> | ||
DOI:<selfdoi /> 原稿受付日:2013年6月14日 原稿完成日:2014年7月24日<br> | |||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
英語名:immunohistochemistry 独:Immunhistochemie 仏:immunohistochimie | |||
{{box|text= 免疫組織化学法は、[[wj:抗原抗体反応|抗原抗体反応]]を利用して、[[wj:抗原|抗原]]物質の局在やそれを発現する細胞要素を可視化する組織化学法である。その分子を発現する細胞組織の同定や、抗原を有する細胞の形態を観察する方法として、最も汎用性に富む組織化学研究手法である。}} | {{box|text= 免疫組織化学法は、[[wj:抗原抗体反応|抗原抗体反応]]を利用して、[[wj:抗原|抗原]]物質の局在やそれを発現する細胞要素を可視化する組織化学法である。その分子を発現する細胞組織の同定や、抗原を有する細胞の形態を観察する方法として、最も汎用性に富む組織化学研究手法である。}} | ||
| 14行目: | 14行目: | ||
==免疫組織化学法とは== | ==免疫組織化学法とは== | ||
[[免疫組織化学]]法は、特定の[[wj:抗原|抗原]] (antigen)に結合する[[wj:抗体|抗体]] (antibody)との[[wj:抗原抗体反応|抗原抗体反応]] | [[免疫組織化学]]法は、特定の[[wj:抗原|抗原]] (antigen)に結合する[[wj:抗体|抗体]] (antibody)との[[wj:抗原抗体反応|抗原抗体反応]]を利用して、抗原物質の局在やそれを発現する細胞要素を可視化する組織化学法を指す<ref>組織細胞化学 2005 ー遺伝子、分子、小器官、細胞をみるー<br>日本細胞組織化学会編、''学際企画''、2005年</ref>。特に、培養細胞などの単離細胞を染色する方法を[[wj:免疫細胞化学法|免疫細胞化学法]] (immunocytochemistry)として呼び分ける場合、免疫組織化学法は組織[[切片]]や個体全体を染色する方法の意味を持つ。 | ||
==基本的原理== | ==基本的原理== | ||
| 26行目: | 26行目: | ||
==それぞれの検出法の利点== | ==それぞれの検出法の利点== | ||
蛍光抗体法の利点は、異なる励起波長の[[wj:蛍光物質|蛍光物質]]([[w:Fluorescein isothiocyanate|FITC]]、[[w:Cy3#Cy3_and_Cy5|Cy3]]、[[w:Cy3#Cy3_and_Cy5|Cy5]]、[[w:Alexa Fluor|Alexa]]など)や同じ励起波長でも発光波長が異なる[[wj:量子ドット|量子ドット]] (Quantum dot)をレポーターとすることにより複数の分子の同時検出(多重染色)が容易にできることである。その際、使用する一次抗体を作成した動物種が異なっていることが必要条件となる。 | |||
酵素抗体法、特に[[wj:ペルオキシダーゼ|ペルオキシダーゼ]] | 酵素抗体法、特に[[wj:ペルオキシダーゼ|ペルオキシダーゼ]]を利用した[[酵素抗体法]]の利点は、光学顕微鏡と電子顕微鏡の両方で検出が可能であることと、検出感度が高いことである。しかし、酵素反応物が拡散し周囲に沈着するため、電子顕微鏡レベルの酵素抗体法では、正確に抗原存在部位を特定することはできない。 | ||
これを克服する免疫電顕法は、非拡散性の金属粒子をレポーターとした[[金コロイド免疫電顕法]]や[[銀増感免疫電顕法]] | これを克服する免疫電顕法は、非拡散性の金属粒子をレポーターとした[[金コロイド免疫電顕法]]や[[銀増感免疫電顕法]]であるが、感度の点では酵素抗体法に劣る。[[wj:ストレプトアビジン|ストレプトアビジン]]に[[wj:蛍光色素|蛍光色素]]と金粒子が結合したFluoroNanogold標識ストレプトアビジンを用いたり、植物由来の[[wj:フォトトロピン|フォトトロピン]] (phototropin) 2を改変した蛍光タンパク質[[miniSOG]]を目的の分子のタグとして用いると、蛍光顕微鏡と電子顕微鏡の両方で目的分子の観察や検出を行うことができる<ref><pubmed>21483721</pubmed></ref>。免疫組織化学を行うにあたっては、目的に応じてどの方法を選択するのがよいのか、どの方法を組み合わせるとゴールに到達できるのかを、予め検討しておくことが重要である。 | ||
==関連項目== | ==関連項目== | ||
2018年3月26日 (月) 19:32時点における最新版
渡辺 雅彦
北海道大学大学院医学研究科解剖学講座
DOI:10.14931/bsd.3952 原稿受付日:2013年6月14日 原稿完成日:2014年7月24日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:immunohistochemistry 独:Immunhistochemie 仏:immunohistochimie
免疫組織化学法は、抗原抗体反応を利用して、抗原物質の局在やそれを発現する細胞要素を可視化する組織化学法である。その分子を発現する細胞組織の同定や、抗原を有する細胞の形態を観察する方法として、最も汎用性に富む組織化学研究手法である。
免疫組織化学法とは
免疫組織化学法は、特定の抗原 (antigen)に結合する抗体 (antibody)との抗原抗体反応を利用して、抗原物質の局在やそれを発現する細胞要素を可視化する組織化学法を指す[1]。特に、培養細胞などの単離細胞を染色する方法を免疫細胞化学法 (immunocytochemistry)として呼び分ける場合、免疫組織化学法は組織切片や個体全体を染色する方法の意味を持つ。
基本的原理
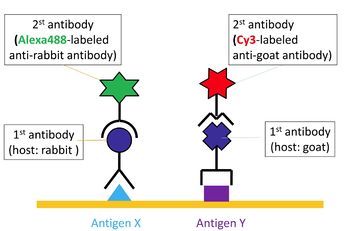
まずタンパク質などの分子を抗原として結合する一次抗体 (primary antibody)を用いて、細胞や組織切片上で抗原抗体反応を行う。次に、レポーター分子を結合した二次抗体 (secondary antibody)を、一次抗体に結合させる(図1)。
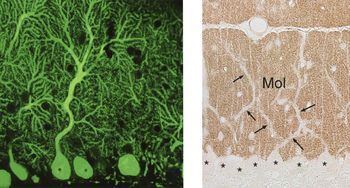
レポーターが蛍光物質であれば蛍光顕微鏡や共焦点レーザー顕微鏡で蛍光を検出する蛍光抗体法 (immunofluorescence)となり、レポーターが酵素であれば酵素組織化学で発色(発光)させ光学顕微鏡で反応部位を観察する酵素抗体法 (immunoenzyme method)となる(図2)。
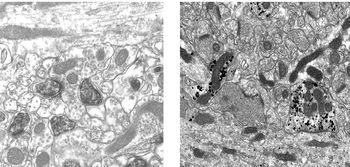
また、レポーターが重金属であれば電子顕微鏡で観察できるようになり、免疫電顕法 (immunoelectron microscopy)とよぶ(図3)。
その分子を発現する細胞組織の同定や、抗原を有する細胞の形態を観察する方法として、最も汎用性に富む組織化学研究手法である。
それぞれの検出法の利点
蛍光抗体法の利点は、異なる励起波長の蛍光物質(FITC、Cy3、Cy5、Alexaなど)や同じ励起波長でも発光波長が異なる量子ドット (Quantum dot)をレポーターとすることにより複数の分子の同時検出(多重染色)が容易にできることである。その際、使用する一次抗体を作成した動物種が異なっていることが必要条件となる。
酵素抗体法、特にペルオキシダーゼを利用した酵素抗体法の利点は、光学顕微鏡と電子顕微鏡の両方で検出が可能であることと、検出感度が高いことである。しかし、酵素反応物が拡散し周囲に沈着するため、電子顕微鏡レベルの酵素抗体法では、正確に抗原存在部位を特定することはできない。
これを克服する免疫電顕法は、非拡散性の金属粒子をレポーターとした金コロイド免疫電顕法や銀増感免疫電顕法であるが、感度の点では酵素抗体法に劣る。ストレプトアビジンに蛍光色素と金粒子が結合したFluoroNanogold標識ストレプトアビジンを用いたり、植物由来のフォトトロピン (phototropin) 2を改変した蛍光タンパク質miniSOGを目的の分子のタグとして用いると、蛍光顕微鏡と電子顕微鏡の両方で目的分子の観察や検出を行うことができる[2]。免疫組織化学を行うにあたっては、目的に応じてどの方法を選択するのがよいのか、どの方法を組み合わせるとゴールに到達できるのかを、予め検討しておくことが重要である。
関連項目
参考文献
- ↑ 組織細胞化学 2005 ー遺伝子、分子、小器官、細胞をみるー
日本細胞組織化学会編、学際企画、2005年 - ↑
Shu, X., Lev-Ram, V., Deerinck, T.J., Qi, Y., Ramko, E.B., Davidson, M.W., ..., & Tsien, R.Y. (2011).
A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS biology, 9(4), e1001041. [PubMed:21483721] [PMC] [WorldCat] [DOI]