「PSD-95」の版間の差分
細 →ファミリー |
細編集の要約なし |
||
| (4人の利用者による、間の18版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">坪山 幸太郎、[http://researchmap.jp/tanakasj 田中 慎二]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | <font size="+1">坪山 幸太郎、[http://researchmap.jp/tanakasj 田中 慎二]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | ||
''東京大学大学院医学系研究科''<br> | ''東京大学大学院医学系研究科''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2013年10月31日 原稿完成日:2013年月日<br> | |||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
{{box|text= | |||
PSD-95(postsynaptic density protein 95)は、シナプス後部の主要な足場タンパク質であり、シナプス後肥厚部(postsynaptic density; PSD)において最も豊富に存在しているタンパク質の一つである。SAP-90 (synapse-associated protein 90)、DLG4 (disks large homolog 4)としても知られている。PSD-95は、足場タンパクとしてNR2A-D、GluR6、neuroligin、nNOSなど様々な分子と相互作用し、シナプス機能の維持や可塑性などに寄与すると考えられている。 | |||
PSDには同様の構造を持ったタンパク質としてPSD-93、SAP97、SAP102が存在し、これらを含めてPSD-95 familyと呼ぶ。これら分子の発達に伴う発現パターンは異なっており、げっ歯類の海馬においては、PSD-95およびPSD-93は生後10日目あたりから発現量が増えるのに対し、SAP102は生後1週齢で既に発現量が高い<ref name=ref1><pubmed>10648730</pubmed></ref>。SAP-97については生後2週齢頃から遺伝子発現が増加することが報告されている<ref name=ref2><pubmed>7891172</pubmed></ref>。 | |||
プロテオミクス解析や全反射顕微鏡を用いたシナプス分子の数の定量結果から、PSD family分子はシナプス後部に300個ほど存在するとされている<ref name=ref3><pubmed>16061821</pubmed></ref> <ref name=ref4><pubmed>16118638</pubmed></ref>。 | |||
}} | |||
== 構造 == | == 構造 == | ||
[[image:PSD-95 fig1.jpg|thumb|350px|'''図1.PSD-95の構造''']] | [[image:PSD-95 fig1.jpg|thumb|350px|'''図1.PSD-95の構造''']] | ||
[[image:PSD-95 fig2.jpg|thumb|350px|'''図2.シナプス後部構造におけるPSD-95''']] | [[image:PSD-95 fig2.jpg|thumb|350px|'''図2.シナプス後部構造におけるPSD-95''']] | ||
[[PSD]]-95はMAGUK(membrane-associated guanylate kinase)familyに属しており、N末端側から、3つのPDZドメイン、1つのSH3([[Src]] homology 3)ドメイン、1つのGK(Guanylate kinase-like)ドメインを持つ。PSD-95のαアイソフォームは、N末端に[[パルミトイル化]]反応を受けうる2つのシステインを含み、βアイソフォームはL27ドメインを持つ。N末端のパルミトイル化はPSD-95のシナプス後膜への局在に重要である<ref name=ref5><pubmed>11955437</pubmed></ref>。 | |||
===PDZ ドメイン=== | ===PDZ ドメイン=== | ||
PDZドメインは、リガンドタンパク質のC末端に結合する90程度のアミノ酸残基を含む構造である(詳細はPDZドメインタンパク質の項を参照)。PSD-95に含まれる、3つのPDZドメインはすべて、リガンドタンパク質のC末端から3番目の位置がセリンまたはスレオニンであるクラスIに分類される。PSD-95のPDZドメインと結合する蛋[[白質]]としてNR2A-D、GluR6、nAChRc、ErbB4、Kir2-5、Neuroligin、nNosなどがあげられ、これらのC末端がいずれかのPDZドメインに結合する<ref name=ref6><pubmed>15378037</pubmed></ref>。また、AMPARは補助サブユニットであるTARP(transmembrane AMPAR regulatory proteins)がPDZドメインと結合することによって間接的にPSD-95と結合することが示されている<ref name=ref7><pubmed>11140673</pubmed></ref>。 | |||
===SH3ドメイン、GKドメイン=== | ===SH3ドメイン、GKドメイン=== | ||
SH3ドメインとGKドメインはPSD- | SH3ドメインとGKドメインはPSD-95のC末端側に位置する。これらのドメインは分子内で相互作用しており、PSD-95の分子的な安定性の向上に役だっていると考えられている。また、この相互作用は分子間でも見られ、複数のPSD-95間における会合にも資している。SH3ドメインやGKドメインには同種の分子だけでなく[[GKAP]]、SPAR、AKAP79/150、Pyk2など様々な分子と相互作用する<ref name=ref7 /> <ref name=ref8><pubmed>18206289</pubmed></ref>。 | ||
==シナプス伝達機能への関与== | |||
PSD-95はシナプスを構成する幅広い分子の足場となることで、シナプス機能やシナプス可塑性に重要な役割を果たす。PSD-95の発現を変化させた様々な実験から、PSD-95がシナプス伝達、特にAMPA型[[グルタミン酸]]受容体を介したシナプス伝達機能に重要であるという知見が報告されている。[[海馬]][[スライス培養]]系においてsh-RNAによりPSD-95を[[ノックダウン]]した[[錐体細胞]]では、AMPA受容体依存性のevoked EPSC振幅およびmEPSC頻度 の低下が見られる<ref name=ref9><pubmed>17046693</pubmed></ref>。一方、PSD-95ノックアウトマウスの急性スライスを用いた研究では、AMPA受容体を介したEPSCに変化が見られないと報告されたが<ref name=ref10><pubmed>9853749</pubmed></ref>、PSD-93とのダブルノックアウトマウスではEPSCが大きく低下することが分かり、PSD-95単独のノックアウトマウスではその機能がPSD-93によって補償されている可能性が示唆されている<ref name=ref9 />。さらに、別系統のノックアウトマウスでは、幼若期(生後14-24日)において、AMPAR依存性のevoked EPSC振幅およびmEPSC頻度の低下が見られている<ref name=ref11><pubmed>7891172</pubmed></ref>。また、PSD-95を過剰発現させた場合には、evoked EPSC振幅やmEPSC振幅が増加することが報告されている<ref name=ref12><pubmed>11082065</pubmed></ref> <ref name=ref13><pubmed>12359873</pubmed></ref>。 | |||
NMDA受容体についても同様の実験が行われている。しかし、PSD-95はNMDA受容体に直接結合するにも関わらず、PSD-95の発現を操作しても、NMDA受容体依存性のEPSCに変化がないことが報告されており<ref name=ref9 /> <ref name=ref10 />、詳細な役割は不明である。 | |||
== | PSD-95はシナプス伝達の長期可塑性にも関与する。PSD-95ノックアウトマウスの海馬スライスでは、高頻度刺激で生じるシナプス長期増強(long-term potentiation; LTP)が促進される一方で、低頻度刺激で生じるシナプス長期抑制(long-term depression; LTD)は抑制される<ref name=ref10 />。逆に、PSD-95を過剰発現させた細胞では、LTPが抑制され、LTDが亢進する<ref name=ref14><pubmed>12843250</pubmed></ref>。ノックアウトマウスにおいても空間学習能力の異常が認められており、脳機能の可塑的な変化が個体レベルでも阻害されることが分かっている10。シナプス長期可塑性を調節する分子機構として、LTDに関しては、PSD-95がLTD発現に必要なシグナルタンパク質であるAKAP79/150と[[PP2B]]の足場となり、NMDA受容体から流入する[[カルシウム]]シグナルとこれらシグナルタンパク質を結び付けているとするモデルが提唱されている<ref name=ref15><pubmed>18215622</pubmed></ref>。また、シナプスへの局在に重要な295番目のセリン残基がシナプス長期可塑性の発現に重要であることが報告されている<ref name=ref16><pubmed>17988632</pubmed></ref>。 | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2013年10月31日 (木) 09:50時点における版
坪山 幸太郎、田中 慎二、岡部 繁男
東京大学大学院医学系研究科
DOI XXXX/XXXX 原稿受付日:2013年10月31日 原稿完成日:2013年月日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
PSD-95(postsynaptic density protein 95)は、シナプス後部の主要な足場タンパク質であり、シナプス後肥厚部(postsynaptic density; PSD)において最も豊富に存在しているタンパク質の一つである。SAP-90 (synapse-associated protein 90)、DLG4 (disks large homolog 4)としても知られている。PSD-95は、足場タンパクとしてNR2A-D、GluR6、neuroligin、nNOSなど様々な分子と相互作用し、シナプス機能の維持や可塑性などに寄与すると考えられている。
PSDには同様の構造を持ったタンパク質としてPSD-93、SAP97、SAP102が存在し、これらを含めてPSD-95 familyと呼ぶ。これら分子の発達に伴う発現パターンは異なっており、げっ歯類の海馬においては、PSD-95およびPSD-93は生後10日目あたりから発現量が増えるのに対し、SAP102は生後1週齢で既に発現量が高い[1]。SAP-97については生後2週齢頃から遺伝子発現が増加することが報告されている[2]。 プロテオミクス解析や全反射顕微鏡を用いたシナプス分子の数の定量結果から、PSD family分子はシナプス後部に300個ほど存在するとされている[3] [4]。
構造
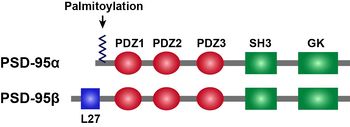
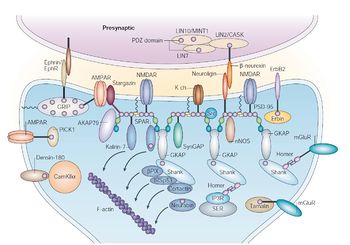
PSD-95はMAGUK(membrane-associated guanylate kinase)familyに属しており、N末端側から、3つのPDZドメイン、1つのSH3(Src homology 3)ドメイン、1つのGK(Guanylate kinase-like)ドメインを持つ。PSD-95のαアイソフォームは、N末端にパルミトイル化反応を受けうる2つのシステインを含み、βアイソフォームはL27ドメインを持つ。N末端のパルミトイル化はPSD-95のシナプス後膜への局在に重要である[5]。
PDZ ドメイン
PDZドメインは、リガンドタンパク質のC末端に結合する90程度のアミノ酸残基を含む構造である(詳細はPDZドメインタンパク質の項を参照)。PSD-95に含まれる、3つのPDZドメインはすべて、リガンドタンパク質のC末端から3番目の位置がセリンまたはスレオニンであるクラスIに分類される。PSD-95のPDZドメインと結合する蛋白質としてNR2A-D、GluR6、nAChRc、ErbB4、Kir2-5、Neuroligin、nNosなどがあげられ、これらのC末端がいずれかのPDZドメインに結合する[6]。また、AMPARは補助サブユニットであるTARP(transmembrane AMPAR regulatory proteins)がPDZドメインと結合することによって間接的にPSD-95と結合することが示されている[7]。
SH3ドメイン、GKドメイン
SH3ドメインとGKドメインはPSD-95のC末端側に位置する。これらのドメインは分子内で相互作用しており、PSD-95の分子的な安定性の向上に役だっていると考えられている。また、この相互作用は分子間でも見られ、複数のPSD-95間における会合にも資している。SH3ドメインやGKドメインには同種の分子だけでなくGKAP、SPAR、AKAP79/150、Pyk2など様々な分子と相互作用する[7] [8]。
シナプス伝達機能への関与
PSD-95はシナプスを構成する幅広い分子の足場となることで、シナプス機能やシナプス可塑性に重要な役割を果たす。PSD-95の発現を変化させた様々な実験から、PSD-95がシナプス伝達、特にAMPA型グルタミン酸受容体を介したシナプス伝達機能に重要であるという知見が報告されている。海馬スライス培養系においてsh-RNAによりPSD-95をノックダウンした錐体細胞では、AMPA受容体依存性のevoked EPSC振幅およびmEPSC頻度 の低下が見られる[9]。一方、PSD-95ノックアウトマウスの急性スライスを用いた研究では、AMPA受容体を介したEPSCに変化が見られないと報告されたが[10]、PSD-93とのダブルノックアウトマウスではEPSCが大きく低下することが分かり、PSD-95単独のノックアウトマウスではその機能がPSD-93によって補償されている可能性が示唆されている[9]。さらに、別系統のノックアウトマウスでは、幼若期(生後14-24日)において、AMPAR依存性のevoked EPSC振幅およびmEPSC頻度の低下が見られている[11]。また、PSD-95を過剰発現させた場合には、evoked EPSC振幅やmEPSC振幅が増加することが報告されている[12] [13]。
NMDA受容体についても同様の実験が行われている。しかし、PSD-95はNMDA受容体に直接結合するにも関わらず、PSD-95の発現を操作しても、NMDA受容体依存性のEPSCに変化がないことが報告されており[9] [10]、詳細な役割は不明である。
PSD-95はシナプス伝達の長期可塑性にも関与する。PSD-95ノックアウトマウスの海馬スライスでは、高頻度刺激で生じるシナプス長期増強(long-term potentiation; LTP)が促進される一方で、低頻度刺激で生じるシナプス長期抑制(long-term depression; LTD)は抑制される[10]。逆に、PSD-95を過剰発現させた細胞では、LTPが抑制され、LTDが亢進する[14]。ノックアウトマウスにおいても空間学習能力の異常が認められており、脳機能の可塑的な変化が個体レベルでも阻害されることが分かっている10。シナプス長期可塑性を調節する分子機構として、LTDに関しては、PSD-95がLTD発現に必要なシグナルタンパク質であるAKAP79/150とPP2Bの足場となり、NMDA受容体から流入するカルシウムシグナルとこれらシグナルタンパク質を結び付けているとするモデルが提唱されている[15]。また、シナプスへの局在に重要な295番目のセリン残基がシナプス長期可塑性の発現に重要であることが報告されている[16]。
参考文献
- ↑
Sans, N., Petralia, R.S., Wang, Y.X., Blahos, J., Hell, J.W., & Wenthold, R.J. (2000).
A developmental change in NMDA receptor-associated proteins at hippocampal synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(3), 1260-71. [PubMed:10648730] [PMC] [WorldCat] - ↑
Müller, B.M., Kistner, U., Veh, R.W., Cases-Langhoff, C., Becker, B., Gundelfinger, E.D., & Garner, C.C. (1995).
Molecular characterization and spatial distribution of SAP97, a novel presynaptic protein homologous to SAP90 and the Drosophila discs-large tumor suppressor protein. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(3 Pt 2), 2354-66. [PubMed:7891172] [WorldCat] - ↑
Chen, X., Vinade, L., Leapman, R.D., Petersen, J.D., Nakagawa, T., Phillips, T.M., ..., & Reese, T.S. (2005).
Mass of the postsynaptic density and enumeration of three key molecules. Proceedings of the National Academy of Sciences of the United States of America, 102(32), 11551-6. [PubMed:16061821] [PMC] [WorldCat] [DOI] - ↑
Sugiyama, Y., Kawabata, I., Sobue, K., & Okabe, S. (2005).
Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature methods, 2(9), 677-84. [PubMed:16118638] [WorldCat] [DOI] - ↑
El-Husseini, A.e.l.-.D., Schnell, E., Dakoji, S., Sweeney, N., Zhou, Q., Prange, O., ..., & Bredt, D.S. (2002).
Synaptic strength regulated by palmitate cycling on PSD-95. Cell, 108(6), 849-63. [PubMed:11955437] [WorldCat] [DOI] - ↑
Kim, E., & Sheng, M. (2004).
PDZ domain proteins of synapses. Nature reviews. Neuroscience, 5(10), 771-81. [PubMed:15378037] [WorldCat] [DOI] - ↑ 7.0 7.1
Chen, L., Chetkovich, D.M., Petralia, R.S., Sweeney, N.T., Kawasaki, Y., Wenthold, R.J., ..., & Nicoll, R.A. (2001).
Stargazin regulates synaptic targeting of AMPA receptors by two distinct mechanisms. Nature, 408(6815), 936-43. [PubMed:11140673] [WorldCat] [DOI] - ↑
Han, K., & Kim, E. (2008).
Synaptic adhesion molecules and PSD-95. Progress in neurobiology, 84(3), 263-83. [PubMed:18206289] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Elias, G.M., Funke, L., Stein, V., Grant, S.G., Bredt, D.S., & Nicoll, R.A. (2006).
Synapse-specific and developmentally regulated targeting of AMPA receptors by a family of MAGUK scaffolding proteins. Neuron, 52(2), 307-20. [PubMed:17046693] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Migaud, M., Charlesworth, P., Dempster, M., Webster, L.C., Watabe, A.M., Makhinson, M., ..., & Grant, S.G. (1998).
Enhanced long-term potentiation and impaired learning in mice with mutant postsynaptic density-95 protein. Nature, 396(6710), 433-9. [PubMed:9853749] [WorldCat] [DOI] - ↑
Müller, B.M., Kistner, U., Veh, R.W., Cases-Langhoff, C., Becker, B., Gundelfinger, E.D., & Garner, C.C. (1995).
Molecular characterization and spatial distribution of SAP97, a novel presynaptic protein homologous to SAP90 and the Drosophila discs-large tumor suppressor protein. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(3 Pt 2), 2354-66. [PubMed:7891172] [WorldCat] - ↑
El-Husseini, A.E., Schnell, E., Chetkovich, D.M., Nicoll, R.A., & Bredt, D.S. (2000).
PSD-95 involvement in maturation of excitatory synapses. Science (New York, N.Y.), 290(5495), 1364-8. [PubMed:11082065] [WorldCat] - ↑
Schnell, E., Sizemore, M., Karimzadegan, S., Chen, L., Bredt, D.S., & Nicoll, R.A. (2002).
Direct interactions between PSD-95 and stargazin control synaptic AMPA receptor number. Proceedings of the National Academy of Sciences of the United States of America, 99(21), 13902-7. [PubMed:12359873] [PMC] [WorldCat] [DOI] - ↑
Stein, V., House, D.R., Bredt, D.S., & Nicoll, R.A. (2003).
Postsynaptic density-95 mimics and occludes hippocampal long-term potentiation and enhances long-term depression. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(13), 5503-6. [PubMed:12843250] [PMC] [WorldCat] - ↑
Xu, W., Schlüter, O.M., Steiner, P., Czervionke, B.L., Sabatini, B., & Malenka, R.C. (2008).
Molecular dissociation of the role of PSD-95 in regulating synaptic strength and LTD. Neuron, 57(2), 248-62. [PubMed:18215622] [PMC] [WorldCat] [DOI] - ↑
Kim, M.J., Futai, K., Jo, J., Hayashi, Y., Cho, K., & Sheng, M. (2007).
Synaptic accumulation of PSD-95 and synaptic function regulated by phosphorylation of serine-295 of PSD-95. Neuron, 56(3), 488-502. [PubMed:17988632] [WorldCat] [DOI]