「アミロイドβタンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の19版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/_tomitataisuke 富田 泰輔]</font><br> | <font size="+1">[http://researchmap.jp/_tomitataisuke 富田 泰輔]</font><br> | ||
''東京大学 薬学研究科''<br> | ''東京大学 薬学研究科''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2013年12月7日 原稿完成日:2013年月日<br> | |||
担当編集委員:[http://researchmap.jp/read0141446 漆谷 真] | 担当編集委員:[http://researchmap.jp/read0141446 漆谷 真](京都大学 大学院医学研究科)<br> | ||
</div> | </div> | ||
| 11行目: | 11行目: | ||
{{box|text= | {{box|text= | ||
[[アルツハイマー病]]の病理学的特徴の一つである[[老人斑]]の主要構成成分は、アミロイドβタンパク質(Aβ)と呼ばれる40アミノ酸程度のペプチドである。Aβ沈着が病理学的に捉えられる最初期病変であること、Aβが凝集し、直接[[神経細胞毒性]]を示しうること、そして[[家族性アルツハイマー病]]患者の遺伝学的解析から、Aβの産生および蓄積の異常が[[アルツハイマー病]]の発症に深く関係しているという「[[アミロイドカスケード仮説]] | [[アルツハイマー病]]の病理学的特徴の一つである[[老人斑]]の主要構成成分は、アミロイドβタンパク質(Aβ)と呼ばれる40アミノ酸程度のペプチドである。Aβ沈着が病理学的に捉えられる最初期病変であること、Aβが凝集し、直接[[神経細胞毒性]]を示しうること、そして[[家族性アルツハイマー病]]患者の遺伝学的解析から、Aβの産生および蓄積の異常が[[アルツハイマー病]]の発症に深く関係しているという「[[アミロイドカスケード仮説]]」が現在広く支持されている。 | ||
}} | }} | ||
(編集コメント:抄録ですので、セクレターゼによるAPPからの産生、分解、治療戦略も含めて頂ければと思います) | |||
==アミロイドβタンパク質とは== | ==アミロイドβタンパク質とは== | ||
[[Image:TTfig1.PNG|thumb|350px|'''図1.Aβ産生経路'''<br>APPはβ及びγセクレターゼによる切断を受ける。]] | [[Image:TTfig1.PNG|thumb|350px|'''図1.Aβ産生経路'''<br>APPはβ及びγセクレターゼによる切断を受ける。]] | ||
アルツハイマー病患者脳において蓄積している[[脳血管アミロイドアンギオパチー]]や老人斑の生化学的解析から、その主要構成成分として同定された40アミノ酸程度のペプチドである<ref><pubmed> 6375662 </pubmed></ref> | |||
アルツハイマー病患者脳において蓄積している[[脳血管アミロイドアンギオパチー]]や老人斑の生化学的解析から、その主要構成成分として同定された40アミノ酸程度のペプチドである<ref><pubmed> 6375662 </pubmed></ref>。Aβ沈着が病理学的に捉えられる最初期病変であること、Aβが凝集し、直接神経細胞毒性を示しうること、そして家族性[[アルツハイマー病]]患者の遺伝学的解析から、Aβの産生および蓄積の異常が[[アルツハイマー病]]の発症に深く関係しているという「アミロイドカスケード仮説」が現在広く支持されている。 | |||
==産生== | ==産生== | ||
cDNAクローニングによりAβは前駆タンパク質である[[Amyloid-β precursor protein]]([[APP]])の部分断片であること、[[βセクレターゼ]]および[[γセクレターゼ]]による連続した二段階切断によって切りだされ、細胞外へと[[分泌]]されることが示された<ref><pubmed> 20139999 </pubmed></ref>。 | cDNAクローニングによりAβは前駆タンパク質である[[Amyloid-β precursor protein]]([[APP]])の部分断片であること、[[βセクレターゼ]]および[[γセクレターゼ]]による連続した二段階切断によって切りだされ、細胞外へと[[分泌]]されることが示された<ref><pubmed> 20139999 </pubmed></ref>。 | ||
一方APPにはAβ配列の16番目で[[αセクレターゼ]]による切断を受ける代謝経路も存在する。この結果生じたC末端断片もγセクレターゼによる切断を受けてp3と呼ばれる短い断片が分泌される。この場合はAβ産生には至らないため、[[アルツハイマー病]]発症に対して防御的な経路と考えられる。 | |||
一方APPにはAβ配列の16番目で[[αセクレターゼ]]による切断を受ける代謝経路も存在する。この結果生じたC末端断片もγセクレターゼによる切断を受けてp3と呼ばれる短い断片が分泌される。この場合はAβ産生には至らないため、[[アルツハイマー病]] | |||
APPのα、β切断によって細胞外領域が分泌されるが、このような現象は[[エクトドメインシェディング]]とも呼ばれ、様々な膜タンパク質において観察されている<ref><pubmed> 22991436 </pubmed></ref>。そしてシェディングによって生じる膜結合型の断片がさらに引き続いて膜内配列におけるγ切断をうけるI型膜貫通蛋白も多く知られており、APPファミリー分子の他にも[[Notch]]や[[Cadherin]]、[[CD44]]、[[Neuregulin]]、[[ErbB4]]、[[Alcadein]]、[[Neuroligin]]などがその切断を介して神経・グリア細胞の分化、[[神経可塑性]]や神経生存性に重要な役割を果たすことが示されている<ref><pubmed> 16630834 </pubmed></ref><ref><pubmed> 19038214 </pubmed></ref><ref><pubmed> 21865451 </pubmed></ref><ref><pubmed> 21982365 </pubmed></ref><ref><pubmed> 23083742 </pubmed></ref>。また一部の基質ではAβ様分泌ペプチドの産生が確認されている<ref><pubmed> 20049724 </pubmed></ref><ref><pubmed> 21681798 </pubmed></ref>。しかしその生理的機能は定かではなく、またAβ以外の分子が凝集能を示すことは報告されていない。また多くの場合、シェディングの役割は細胞表面膜に存在する基質の量を低下させることに寄与している。したがってAβが産生されるプロセスは比較的普遍的な膜タンパク質代謝の一つであり<ref><pubmed> 15173829 </pubmed></ref>、シェディングによって生じた膜結合型断片を分解する過程で生じた産物とも考えられる。 | |||
一方、γセクレターゼ切断によって放出される細胞質内領域が何らかの役割を果たしていることが多い。特に膜受容体型転写因子であるNotchは、近接する細胞に発現しているリガンドの結合を契機として[[ADAM10]]によりシェディングを受け、引き続きγセクレターゼによって転写活性化ドメインを含む細胞質内領域を放出し、遺伝子発現を調節している<ref><pubmed> 23028119 </pubmed></ref><ref><pubmed> 24099003 </pubmed></ref>。 | |||
==Aβの凝集性と沈着様式== | |||
Aβの特徴はその凝集性の高さであり、[[wikipedia:ja:|緩衝液]]中に高濃度で存在するだけで凝集してアミロイド線維を形成する。凝集したAβは分解抵抗性を示す。人工合成ペプチドを用いた解析から、その線維形成過程は主にAβの一次配列とアミノ酸長に依存することが示されている。特に産生時のγセクレターゼによる切断部位の多様性によって生じる最C末端長の違いが、生理的条件下で生じうるAβの凝集性を変化させる要因である。Aβの主な分子種として、第40番目のアミノ酸であるValで終わるAβ40、第42番目のアミノ酸であるAlaで終わるAβ42が知られている。通常、神経細胞からはAβ40がAβ42に比して10倍近く多く産生される<ref><pubmed> 7640283 </pubmed></ref>。 | |||
このうちAβ42は<i>in vitro</i>で凝集性が高く<ref><pubmed> 8490014 </pubmed></ref>、AD患者脳においても初期から優位に蓄積することが知られている<ref><pubmed> 8043280 </pubmed></ref>。最近、Aβ43が更に凝集性が高い分子種であり、AD脳でも蓄積していることが示され、AβのC末端長の重要性が再確認されている<ref><pubmed> 21725313 </pubmed></ref>。また産生後に生じる最N末端の部分分解とピログルタミル化<ref><pubmed> 7857653 </pubmed></ref>も非常に疎水性が上がるため重要であると考えられている。そのためアルツハイマー病患者脳に老人斑として蓄積している最も主要なAβは、3番目の[[グルタミン酸]]がピログルタミル化し、最C末端が42番目のアラニンで終わっている分子種であると想定されている。 | |||
==家族性アルツハイマー病とAβ== | ==家族性アルツハイマー病とAβ== | ||
家族性アルツハイマー病(FAD)に連鎖する遺伝子変異([http://www.molgen.ua.ac.be/ADMutations/ Alzheimer Disease & Frontotemporal Dementia Mutation Database])の多くはこのAβの産生量[[Image:TTfig2.PNG|thumb|350px|'''図2.Aβ産生量を変化させる遺伝子変異'''<br>β及びγセクレターゼによる切断に影響を与える遺伝子変異。]]もしくは凝集性を高める性質を示し、[[アルツハイマー病]]におけるアミロイドカスケード仮説の強い根拠となっている。 | |||
===総Aβ産生量を変化させる遺伝子変異=== | ===総Aβ産生量を変化させる遺伝子変異=== | ||
βセクレターゼ活性は[[BACE1]]と呼ばれる[[膜結合型アスパラギン酸プロテアーゼ]]によって担われており、その切断が総Aβ産生量を規定している。βセクレターゼ切断部位近傍に存在するSwedish変異(KM670/671NL)<ref><pubmed> 1302033 </pubmed></ref>、Italian変異(A673V(Aβ配列としてA2V))<ref><pubmed> 19286555 </pubmed></ref>は、APPのBACE1に対する親和性を高め、総Aβ産生量を上昇させる。またβセクレターゼの切断部位にはAβ配列内にもう一つ存在し、β’切断部位と呼称されている。この切断はN末端が短いAβ産生につながるが、β’切断部位の変異であるLeuven変異(E682K(Aβ配列としてE11K))がβ’切断を抑制し、結果的に総Aβ産生量を増加させる効果を持つ<ref><pubmed> 21500352 </pubmed></ref>。 | |||
一方ごく最近、アイスランド国民の全ゲノムシーケンシング解析からアルツハイマー病および老化に伴う認知機能低下に対して防御的に作用するrare variantとしてAβ産生を40%低下させるIcelandic変異(A673T(Aβ配列としてA2T))が同定された<ref><pubmed> 22801501 </pubmed></ref>。この変異はβセクレターゼによる切断効率を低下させることが示されている。この変異はAβ産生量の変化がアルツハイマー病の発症リスクを規定していることを明確にしたと言える。 | |||
これまでにBACE1遺伝子変異は報告されていないが、アルツハイマー病患者脳や[[脳脊髄液]]中でBACE1タンパク質<ref><pubmed> 12514700 </pubmed></ref>や活性<ref><pubmed> 12223024 </pubmed></ref><ref><pubmed> 14978286 </pubmed></ref> | これまでにBACE1遺伝子変異は報告されていないが、アルツハイマー病患者脳や[[脳脊髄液]]中でBACE1タンパク質<ref><pubmed> 12514700 </pubmed></ref>や活性<ref><pubmed> 12223024 </pubmed></ref><ref><pubmed> 14978286 </pubmed></ref>の上昇が報告されている。すなわち、老化に伴うBACE1活性の変動が孤発性アルツハイマー病発症機序に影響を与えている可能性が示唆されている。また最近になり、神経細胞における主たるαセクレターゼであるADAM10の機能欠失型変異が見出され、非Aβ産生経路の抑制がアルツハイマー病を惹起することも示された<ref><pubmed> 24055016 </pubmed></ref>。 | ||
===凝集性の高いAβ42の産生比率を変化させる遺伝子変異=== | ===凝集性の高いAβ42の産生比率を変化させる遺伝子変異=== | ||
APP配列内のAβ配列近傍に存在するFAD変異は、Aβ分子そのものに影響を与えないが、その産生量を変化させる。世界で初めて家族性アルツハイマー病に連鎖する遺伝子変異として見出されたのがそのような変異のひとつであるLondon変異(V717I)である<ref><pubmed> 1671712 </pubmed></ref>。長らくこのLondon変異が引き起こす生化学的変化については不明であったが、[[wikipedia:ja: 武田薬品工業|武田薬品工業株式会社]] | APP配列内のAβ配列近傍に存在するFAD変異は、Aβ分子そのものに影響を与えないが、その産生量を変化させる。世界で初めて家族性アルツハイマー病に連鎖する遺伝子変異として見出されたのがそのような変異のひとつであるLondon変異(V717I)である<ref><pubmed> 1671712 </pubmed></ref>。長らくこのLondon変異が引き起こす生化学的変化については不明であったが、[[wikipedia:ja: 武田薬品工業|武田薬品工業株式会社]]の鈴木、尾高らがAβの最C末端の違いを認識する断端抗体を樹立し、その抗体を利用したサンドイッチELISA法が開発されたことによって、London変異が分泌AβのC末端長に影響を与えることが示された<ref><pubmed> 8191290 </pubmed></ref>。 | ||
同様にAβのC末側に存在するIranian変異(T714A)、Austrian変異(T714I)、German変異(V715A)、French変異(V715M)、Florida変異(I716V)、Iberian変異(I716F)、London変異(V717Iの他、L、F、G)、Australian変異(L723P)、Belgian変異(K724N)などは、いずれもγセクレターゼによる切断を変化させ、総Aβ産生量には大きな影響を与えずに特に凝集性の高いAβ42の産生比率(総Aβ産生量に対する)を上昇させる。またFlemish変異(A692G(Aβ配列としてA21G))はAβ産生量を増大させる。これはA21を含む領域がAPPに存在するγセクレターゼ活性を抑制するドメインであり、Flemish変異はその抑制効果を低下させるため、Aβ産生量を増加させると考えられている<ref><pubmed> 20062056 </pubmed></ref>。 | 同様にAβのC末側に存在するIranian変異(T714A)、Austrian変異(T714I)、German変異(V715A)、French変異(V715M)、Florida変異(I716V)、Iberian変異(I716F)、London変異(V717Iの他、L、F、G)、Australian変異(L723P)、Belgian変異(K724N)などは、いずれもγセクレターゼによる切断を変化させ、総Aβ産生量には大きな影響を与えずに特に凝集性の高いAβ42の産生比率(総Aβ産生量に対する)を上昇させる。またFlemish変異(A692G(Aβ配列としてA21G))はAβ産生量を増大させる。これはA21を含む領域がAPPに存在するγセクレターゼ活性を抑制するドメインであり、Flemish変異はその抑制効果を低下させるため、Aβ産生量を増加させると考えられている<ref><pubmed> 20062056 </pubmed></ref>。 | ||
一方で、ほとんどのFADは[[Presenilin 1]]もしくは[[Presenilin 2|2]] | 一方で、ほとんどのFADは[[Presenilin 1]]もしくは[[Presenilin 2|2]]遺伝子上の点突然変異に連鎖する。Presenlinはγセクレターゼの活性中心サブユニットであり、[[ニカストリン]]、[[Aph-1]]、[[Pen-2]]と膜タンパク複合体として機能する<ref><pubmed> 12660785 </pubmed></ref>。その遺伝子変異はほぼ全てAβ42産生比率を上昇させる。γセクレターゼは特殊な切断様式をとる膜内配列切断アスパラギン酸プロテアーゼ<ref><pubmed> 23585568 </pubmed></ref>であり、Presenilin遺伝子のFAD変異がどのような影響を及ぼしているかは未だ定かではないが、何れにせよいずれの変異もγセクレターゼによる切断様式を変化させ、Aβ42の産生比率を特異的に増加させることでアルツハイマー病の発症過程を促進していると考えられている。 | ||
βセクレターゼに対するIcelandic変異のように、γセクレターゼによるAβ42産生を抑制する変異は未だ見出されていないが、アルツハイマー病に関連する遺伝学的予防因子<i>PICALM</i><ref><pubmed> 24162737 </pubmed></ref>の発現量低下がγセクレターゼの細胞内輸送を変化させることでAβ42産生量を低下させることが報告されている。 | βセクレターゼに対するIcelandic変異のように、γセクレターゼによるAβ42産生を抑制する変異は未だ見出されていないが、アルツハイマー病に関連する遺伝学的予防因子<i>PICALM</i><ref><pubmed> 24162737 </pubmed></ref>の発現量低下がγセクレターゼの細胞内輸送を変化させることでAβ42産生量を低下させることが報告されている。 | ||
=== | ===Aβの凝集性を変化させる遺伝子変異=== | ||
[[Image:TTfig3.PNG|thumb|350px|'''図3.Aβの凝集性を変化させる遺伝子変異'''<br>Aβ配列内部の変異は凝集性に影響を与える。]] | [[Image:TTfig3.PNG|thumb|350px|'''図3.Aβの凝集性を変化させる遺伝子変異'''<br>Aβ配列内部の変異は凝集性に影響を与える。]] | ||
Aβ配列内にも多くのFAD変異が存在し、多くの場合はAβの凝集性に大きな影響を与える。Aβ配列のN末端側にある変異は、British変異(H677R(Aβ配列としてH6R))、Tottori変異(D678N(Aβ配列としてD7N))そしてItalian変異(A673V(Aβ配列としてA2V))である。British変異およびTottori変異は、いずれもAβアミロイド線維形成を亢進させる<ref><pubmed> 17170111 </pubmed></ref>。Italian変異については、βセクレターゼによる切断を亢進させると同時に凝集性を高める<ref><pubmed> 19286555 </pubmed></ref>。 | |||
一方、Aβ配列の中央部に位置する変異としては、Arctic変異(E693G(Aβ配列としてE22G))、Osaka変異(ΔE693(Aβ配列としてΔE22))、Iowa変異(D694N(Aβ配列としてD23N))が存在する。Dutch変異(E693Q(Aβ配列としてE22Q))はオランダ型[[遺伝性アミロイド性脳出血]]に連鎖する変異として発見された。Dutch変異、Arctic変異ともに<i>in vitro</i>でアミロイド線維形成能が高いこと<ref><pubmed> 12944403 </pubmed></ref>が示されている。加えて、Arctic変異はAβ線維形成過程の中間段階で生じるプロトフィブリルの形成を亢進・安定化することが観察されている<ref><pubmed> 11528419 </pubmed></ref>。Osaka変異は、2008年に本邦より報告された比較的新しい変異である。興味深いことに、この変異をもつAβはアミロイド線維を形成せずオリゴマーの形で留まり、シナプス毒性を示す<ref><pubmed> 18300294 </pubmed></ref>。 | 一方、Aβ配列の中央部に位置する変異としては、Arctic変異(E693G(Aβ配列としてE22G))、Osaka変異(ΔE693(Aβ配列としてΔE22))、Iowa変異(D694N(Aβ配列としてD23N))が存在する。Dutch変異(E693Q(Aβ配列としてE22Q))はオランダ型[[遺伝性アミロイド性脳出血]]に連鎖する変異として発見された。Dutch変異、Arctic変異ともに<i>in vitro</i>でアミロイド線維形成能が高いこと<ref><pubmed> 12944403 </pubmed></ref>が示されている。加えて、Arctic変異はAβ線維形成過程の中間段階で生じるプロトフィブリルの形成を亢進・安定化することが観察されている<ref><pubmed> 11528419 </pubmed></ref>。Osaka変異は、2008年に本邦より報告された比較的新しい変異である。興味深いことに、この変異をもつAβはアミロイド線維を形成せずオリゴマーの形で留まり、シナプス毒性を示す<ref><pubmed> 18300294 </pubmed></ref>。 | ||
== | ==Aβの分解== | ||
生理的条件下ではAβは[[ネプリライシン]] | 生理的条件下ではAβは[[ネプリライシン]]などの酵素により分解されるため、脳内でのAβの半減期は30分程度である<ref><pubmed> 19741145 </pubmed></ref>。その他にも[[インスリン分解酵素]]や、プラスミン、エンドセリン変換酵素、カテプシン、KLK7、MMPなどがAβ分解酵素として同定されている。Aβはグリア細胞による貪食を受けることも知られている。さらに血管内皮細胞を介したトランスエンドサイトーシスによって排出される可能性も示唆されている。アルツハイマー病の遺伝学的リスク因子として最も強い[[wikipedia:en: Apolipoprotein_E|Apolipoprotein E]]はAβ分解システムに関与している<ref><pubmed> 18549781 </pubmed></ref><ref><pubmed> 21715678 </pubmed></ref>ことが示唆されている他、孤発性アルツハイマー病患者においてはAβクリアランス速度が有意に低下している<ref><pubmed> 21148344 </pubmed></ref>ことが示されており、Aβ分解・代謝経路の全容解明が待たれている。 | ||
==脳内Aβ濃度を保つシステムと機能== | ==脳内Aβ濃度を保つシステムと機能== | ||
脳内におけるAβ産生はBACE1発現量が最も高い神経細胞が主に担い<ref><pubmed> 10549806 </pubmed></ref>、その産生量は神経活動に依存している<ref><pubmed> 12670422 </pubmed></ref>。そのメカニズムとしてBACE1<ref><pubmed> 21715678 </pubmed></ref>やγセクレターゼ<ref><pubmed> 23563578 </pubmed></ref>、そしてαセクレターゼであるADAM10<ref><pubmed> 23676497 </pubmed></ref>の活性が神経活動に応じて変化することが示されている。 | 脳内におけるAβ産生はBACE1発現量が最も高い神経細胞が主に担い<ref><pubmed> 10549806 </pubmed></ref>、その産生量は神経活動に依存している<ref><pubmed> 12670422 </pubmed></ref>。そのメカニズムとしてBACE1<ref><pubmed> 21715678 </pubmed></ref>やγセクレターゼ<ref><pubmed> 23563578 </pubmed></ref>、そしてαセクレターゼであるADAM10<ref><pubmed> 23676497 </pubmed></ref>の活性が神経活動に応じて変化することが示されている。 | ||
このような神経活動に依存したAβ産生亢進は、昏睡患者における意識レベルと脳脊髄液中Aβ量の相関<ref><pubmed> 18755980 </pubmed></ref>や、睡眠・覚醒と関連した脳内Aβ量の日周期変動<ref><pubmed> 19779148</pubmed></ref>、さらに老人斑沈着を認める非認知症者における異常な脳活動の上昇<ref><pubmed> 19640477 </pubmed></ref>とも関連が示唆されている。その一方で高濃度のAβは神経細胞を異常興奮させること、一方で神経活動を低下させたり、神経細胞死を招くことが実験系で示されている。このような観点から、神経活動依存性に産生されるAβがフィードバック的に脳内における神経活動の制御に関わっているという可能性も提示されている。しかしAPPノックアウトマウスにおける神経可塑性異常については報告されておらず、Aβの生理的意義については不明である。 | |||
なおAPPの生理機能については、シナプス小胞の輸送や神経突起の伸長に関与していることが示唆されているが<ref><pubmed> 22355794 </pubmed></ref>、哺乳類においてはファミリー分子であるAPLP1、APLP2が相補的に機能している。そのためAPPノックアウトマウスで大きな異常は認められていないが、APP/APLP2ダブルノックアウトマウスでは脳の発生異常が報告されている。しかしAPLPファミリーとAPPではAβ部分の一次配列が全く異なっており、少なくともAβはAPP機能には必要ないと考えられる。 | |||
==Aβを標的とした抗アルツハイマー病治療薬開発戦略== | ==Aβを標的とした抗アルツハイマー病治療薬開発戦略== | ||
アミロイドカスケード仮説に基づき、Aβを標的とした抗アルツハイマー病戦略は根治療法として期待され、特にセクレターゼ活性制御によるAβ産生メカニズムの抑制、Aβ凝集阻害によるアミロイド形成抑制、そしてAβ除去を促進するアミロイド沈着の抑制を主たる薬効とする治療薬開発が推進されてきた。この中でセクレターゼ活性制御のうちγセクレターゼ阻害薬[[wikipedia:en:Semagacestrat|Semagacestat]]の治験は副作用を生じたため開発が中止された。現在ではAβ42産生のみを特異的に低下させるγセクレターゼ制御薬(モジュレーター)や、βセクレターゼ阻害薬の治験が精力的に進められている<ref><pubmed> 19402777 </pubmed></ref>。Aβ凝集阻害については[[wikipedia:en:scyllo-Inositol|scyllo-Inositol]]を用いた治験が行われたが、やはり副作用のため開発中止となった。Aβ除去を目的としたストラテジーについては、現在は特にAβに対する獲得免疫を利用した抗体やワクチンによる治療薬開発が進められている。またAβの凝集性を高めるピログルタミル化を担う酵素Glutaminyl Cyclaseも、新たな創薬戦略として注目されている<ref><pubmed> 18836460 </pubmed></ref>。 | |||
アミロイドカスケード仮説に基づき、Aβを標的とした抗アルツハイマー病戦略は根治療法として期待され、特にセクレターゼ活性制御によるAβ産生メカニズムの抑制、Aβ凝集阻害によるアミロイド形成抑制、そしてAβ除去を促進するアミロイド沈着の抑制を主たる薬効とする治療薬開発が推進されてきた。この中でセクレターゼ活性制御のうちγセクレターゼ阻害薬[[wikipedia:en:Semagacestrat|Semagacestat]] | |||
剖検脳[[Image:TTfig7.PNG|thumb|350px|'''図4.アルツハイマー病の進行と分子病態'''<br>Aβ蓄積は15-20年以上前から開始していると推測されている。]]において老人斑の疾患特異性が高いのに対して、神経原線維変化は様々な神経変性疾患において観察されること、そして非認知症健常者においても老人斑蓄積が認められることから、Aβ蓄積とタウ病変である神経原線維変化の関係については、長らく様々な議論がなされてきた。しかしほぼ全てのFAD遺伝子変異がAβ蓄積を亢進する一方で、Aβ産生を抑制する変異が認知機能低下に対する防御的変異として同定されたこと、またタウ遺伝子変異に起因し、老人斑蓄積を認めない[[wikipedia:ja:前頭側頭葉変性症|前頭側頭葉変性症]]が見出され、Aβは[[アルツハイマー病]]を惹起する毒性分子であり、タウ病変はその下流で神経細胞死に直接関与するプロセスであると考えられるようになった。そしてモデルマウスを用いて、Aβ蓄積がタウ病変を亢進させる<ref><pubmed> 11520987 </pubmed></ref><ref><pubmed> 11520988 </pubmed></ref>ことや、脳脊髄液中のタウ濃度を上昇させる<ref><pubmed> 23863834 </pubmed></ref>ことが示された。 | |||
一方でこれまでに多くのAβに対する治療法開発が失敗に終わってきた。特にAβワクチン療法AN-1792の治験では、老人斑蓄積が消失している患者が確認されたにも関わらず認知機能の低下は抑制されておらず<ref><pubmed> 12640446 </pubmed></ref>、アミロイドカスケード仮説に基づいた抗Aβ療法に疑義が呈された。しかし近年の大規模臨床観察研究や、FAD変異キャリヤーのバイオマーカー解析などから、Aβ蓄積は[[アルツハイマー病]]発症から15-20年以上前に始まり、引き続いてタウ病変が惹起されること<ref><pubmed> 22784036 </pubmed></ref>、老人斑蓄積が確認される健常者やMCIがADを発症する確率が有意に高いことが明らかとなり<ref><pubmed> 19587325 </pubmed></ref><ref><pubmed> 19346482 </pubmed></ref>、Aβの蓄積が脳[[アミロイドーシス]]としての[[アルツハイマー病]]病変における最上流プロセスであることは間違いないと考えられている。そして抗Aβ抗体医薬の一つ[[wikipedia:en:Solanezumab|Solanezumab]]の治験においては、全体としてはエンドポイントが達成できなかったものの、mild-to-moderateに分類される、比較的早期の[[アルツハイマー病]]患者においては認知機能の低下が抑制されたと報告されている([https://investor.lilly.com/releasedetail.cfm?releaseid=711933 Detailed Results of the Phase 3 Solanezumab EXPEDITION Studies])。そのような観点から、未発症期に個々人のAD発症リスクを正しく理解して抗Aβ療法を先制医療として開始することが正しいのではないかと考えられている。 | |||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2013年12月9日 (月) 11:45時点における版
英:amyloid-β protein、Aβ
同義語:アミロイドβペプチド、amyloid-β peptide、βアミロイド、β-amyloid
アルツハイマー病の病理学的特徴の一つである老人斑の主要構成成分は、アミロイドβタンパク質(Aβ)と呼ばれる40アミノ酸程度のペプチドである。Aβ沈着が病理学的に捉えられる最初期病変であること、Aβが凝集し、直接神経細胞毒性を示しうること、そして家族性アルツハイマー病患者の遺伝学的解析から、Aβの産生および蓄積の異常がアルツハイマー病の発症に深く関係しているという「アミロイドカスケード仮説」が現在広く支持されている。
(編集コメント:抄録ですので、セクレターゼによるAPPからの産生、分解、治療戦略も含めて頂ければと思います)
アミロイドβタンパク質とは
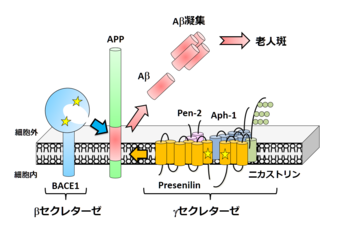
APPはβ及びγセクレターゼによる切断を受ける。
アルツハイマー病患者脳において蓄積している脳血管アミロイドアンギオパチーや老人斑の生化学的解析から、その主要構成成分として同定された40アミノ酸程度のペプチドである[1]。Aβ沈着が病理学的に捉えられる最初期病変であること、Aβが凝集し、直接神経細胞毒性を示しうること、そして家族性アルツハイマー病患者の遺伝学的解析から、Aβの産生および蓄積の異常がアルツハイマー病の発症に深く関係しているという「アミロイドカスケード仮説」が現在広く支持されている。
産生
cDNAクローニングによりAβは前駆タンパク質であるAmyloid-β precursor protein(APP)の部分断片であること、βセクレターゼおよびγセクレターゼによる連続した二段階切断によって切りだされ、細胞外へと分泌されることが示された[2]。
一方APPにはAβ配列の16番目でαセクレターゼによる切断を受ける代謝経路も存在する。この結果生じたC末端断片もγセクレターゼによる切断を受けてp3と呼ばれる短い断片が分泌される。この場合はAβ産生には至らないため、アルツハイマー病発症に対して防御的な経路と考えられる。
APPのα、β切断によって細胞外領域が分泌されるが、このような現象はエクトドメインシェディングとも呼ばれ、様々な膜タンパク質において観察されている[3]。そしてシェディングによって生じる膜結合型の断片がさらに引き続いて膜内配列におけるγ切断をうけるI型膜貫通蛋白も多く知られており、APPファミリー分子の他にもNotchやCadherin、CD44、Neuregulin、ErbB4、Alcadein、Neuroliginなどがその切断を介して神経・グリア細胞の分化、神経可塑性や神経生存性に重要な役割を果たすことが示されている[4][5][6][7][8]。また一部の基質ではAβ様分泌ペプチドの産生が確認されている[9][10]。しかしその生理的機能は定かではなく、またAβ以外の分子が凝集能を示すことは報告されていない。また多くの場合、シェディングの役割は細胞表面膜に存在する基質の量を低下させることに寄与している。したがってAβが産生されるプロセスは比較的普遍的な膜タンパク質代謝の一つであり[11]、シェディングによって生じた膜結合型断片を分解する過程で生じた産物とも考えられる。
一方、γセクレターゼ切断によって放出される細胞質内領域が何らかの役割を果たしていることが多い。特に膜受容体型転写因子であるNotchは、近接する細胞に発現しているリガンドの結合を契機としてADAM10によりシェディングを受け、引き続きγセクレターゼによって転写活性化ドメインを含む細胞質内領域を放出し、遺伝子発現を調節している[12][13]。
Aβの凝集性と沈着様式
Aβの特徴はその凝集性の高さであり、緩衝液中に高濃度で存在するだけで凝集してアミロイド線維を形成する。凝集したAβは分解抵抗性を示す。人工合成ペプチドを用いた解析から、その線維形成過程は主にAβの一次配列とアミノ酸長に依存することが示されている。特に産生時のγセクレターゼによる切断部位の多様性によって生じる最C末端長の違いが、生理的条件下で生じうるAβの凝集性を変化させる要因である。Aβの主な分子種として、第40番目のアミノ酸であるValで終わるAβ40、第42番目のアミノ酸であるAlaで終わるAβ42が知られている。通常、神経細胞からはAβ40がAβ42に比して10倍近く多く産生される[14]。
このうちAβ42はin vitroで凝集性が高く[15]、AD患者脳においても初期から優位に蓄積することが知られている[16]。最近、Aβ43が更に凝集性が高い分子種であり、AD脳でも蓄積していることが示され、AβのC末端長の重要性が再確認されている[17]。また産生後に生じる最N末端の部分分解とピログルタミル化[18]も非常に疎水性が上がるため重要であると考えられている。そのためアルツハイマー病患者脳に老人斑として蓄積している最も主要なAβは、3番目のグルタミン酸がピログルタミル化し、最C末端が42番目のアラニンで終わっている分子種であると想定されている。
家族性アルツハイマー病とAβ
家族性アルツハイマー病(FAD)に連鎖する遺伝子変異(Alzheimer Disease & Frontotemporal Dementia Mutation Database)の多くはこのAβの産生量

β及びγセクレターゼによる切断に影響を与える遺伝子変異。
もしくは凝集性を高める性質を示し、アルツハイマー病におけるアミロイドカスケード仮説の強い根拠となっている。
総Aβ産生量を変化させる遺伝子変異
βセクレターゼ活性はBACE1と呼ばれる膜結合型アスパラギン酸プロテアーゼによって担われており、その切断が総Aβ産生量を規定している。βセクレターゼ切断部位近傍に存在するSwedish変異(KM670/671NL)[19]、Italian変異(A673V(Aβ配列としてA2V))[20]は、APPのBACE1に対する親和性を高め、総Aβ産生量を上昇させる。またβセクレターゼの切断部位にはAβ配列内にもう一つ存在し、β’切断部位と呼称されている。この切断はN末端が短いAβ産生につながるが、β’切断部位の変異であるLeuven変異(E682K(Aβ配列としてE11K))がβ’切断を抑制し、結果的に総Aβ産生量を増加させる効果を持つ[21]。
一方ごく最近、アイスランド国民の全ゲノムシーケンシング解析からアルツハイマー病および老化に伴う認知機能低下に対して防御的に作用するrare variantとしてAβ産生を40%低下させるIcelandic変異(A673T(Aβ配列としてA2T))が同定された[22]。この変異はβセクレターゼによる切断効率を低下させることが示されている。この変異はAβ産生量の変化がアルツハイマー病の発症リスクを規定していることを明確にしたと言える。
これまでにBACE1遺伝子変異は報告されていないが、アルツハイマー病患者脳や脳脊髄液中でBACE1タンパク質[23]や活性[24][25]の上昇が報告されている。すなわち、老化に伴うBACE1活性の変動が孤発性アルツハイマー病発症機序に影響を与えている可能性が示唆されている。また最近になり、神経細胞における主たるαセクレターゼであるADAM10の機能欠失型変異が見出され、非Aβ産生経路の抑制がアルツハイマー病を惹起することも示された[26]。
凝集性の高いAβ42の産生比率を変化させる遺伝子変異
APP配列内のAβ配列近傍に存在するFAD変異は、Aβ分子そのものに影響を与えないが、その産生量を変化させる。世界で初めて家族性アルツハイマー病に連鎖する遺伝子変異として見出されたのがそのような変異のひとつであるLondon変異(V717I)である[27]。長らくこのLondon変異が引き起こす生化学的変化については不明であったが、武田薬品工業株式会社の鈴木、尾高らがAβの最C末端の違いを認識する断端抗体を樹立し、その抗体を利用したサンドイッチELISA法が開発されたことによって、London変異が分泌AβのC末端長に影響を与えることが示された[28]。
同様にAβのC末側に存在するIranian変異(T714A)、Austrian変異(T714I)、German変異(V715A)、French変異(V715M)、Florida変異(I716V)、Iberian変異(I716F)、London変異(V717Iの他、L、F、G)、Australian変異(L723P)、Belgian変異(K724N)などは、いずれもγセクレターゼによる切断を変化させ、総Aβ産生量には大きな影響を与えずに特に凝集性の高いAβ42の産生比率(総Aβ産生量に対する)を上昇させる。またFlemish変異(A692G(Aβ配列としてA21G))はAβ産生量を増大させる。これはA21を含む領域がAPPに存在するγセクレターゼ活性を抑制するドメインであり、Flemish変異はその抑制効果を低下させるため、Aβ産生量を増加させると考えられている[29]。
一方で、ほとんどのFADはPresenilin 1もしくは2遺伝子上の点突然変異に連鎖する。Presenlinはγセクレターゼの活性中心サブユニットであり、ニカストリン、Aph-1、Pen-2と膜タンパク複合体として機能する[30]。その遺伝子変異はほぼ全てAβ42産生比率を上昇させる。γセクレターゼは特殊な切断様式をとる膜内配列切断アスパラギン酸プロテアーゼ[31]であり、Presenilin遺伝子のFAD変異がどのような影響を及ぼしているかは未だ定かではないが、何れにせよいずれの変異もγセクレターゼによる切断様式を変化させ、Aβ42の産生比率を特異的に増加させることでアルツハイマー病の発症過程を促進していると考えられている。
βセクレターゼに対するIcelandic変異のように、γセクレターゼによるAβ42産生を抑制する変異は未だ見出されていないが、アルツハイマー病に関連する遺伝学的予防因子PICALM[32]の発現量低下がγセクレターゼの細胞内輸送を変化させることでAβ42産生量を低下させることが報告されている。
Aβの凝集性を変化させる遺伝子変異
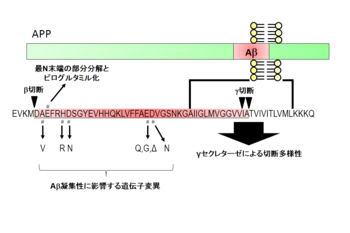
Aβ配列内部の変異は凝集性に影響を与える。
Aβ配列内にも多くのFAD変異が存在し、多くの場合はAβの凝集性に大きな影響を与える。Aβ配列のN末端側にある変異は、British変異(H677R(Aβ配列としてH6R))、Tottori変異(D678N(Aβ配列としてD7N))そしてItalian変異(A673V(Aβ配列としてA2V))である。British変異およびTottori変異は、いずれもAβアミロイド線維形成を亢進させる[33]。Italian変異については、βセクレターゼによる切断を亢進させると同時に凝集性を高める[34]。
一方、Aβ配列の中央部に位置する変異としては、Arctic変異(E693G(Aβ配列としてE22G))、Osaka変異(ΔE693(Aβ配列としてΔE22))、Iowa変異(D694N(Aβ配列としてD23N))が存在する。Dutch変異(E693Q(Aβ配列としてE22Q))はオランダ型遺伝性アミロイド性脳出血に連鎖する変異として発見された。Dutch変異、Arctic変異ともにin vitroでアミロイド線維形成能が高いこと[35]が示されている。加えて、Arctic変異はAβ線維形成過程の中間段階で生じるプロトフィブリルの形成を亢進・安定化することが観察されている[36]。Osaka変異は、2008年に本邦より報告された比較的新しい変異である。興味深いことに、この変異をもつAβはアミロイド線維を形成せずオリゴマーの形で留まり、シナプス毒性を示す[37]。
Aβの分解
生理的条件下ではAβはネプリライシンなどの酵素により分解されるため、脳内でのAβの半減期は30分程度である[38]。その他にもインスリン分解酵素や、プラスミン、エンドセリン変換酵素、カテプシン、KLK7、MMPなどがAβ分解酵素として同定されている。Aβはグリア細胞による貪食を受けることも知られている。さらに血管内皮細胞を介したトランスエンドサイトーシスによって排出される可能性も示唆されている。アルツハイマー病の遺伝学的リスク因子として最も強いApolipoprotein EはAβ分解システムに関与している[39][40]ことが示唆されている他、孤発性アルツハイマー病患者においてはAβクリアランス速度が有意に低下している[41]ことが示されており、Aβ分解・代謝経路の全容解明が待たれている。
脳内Aβ濃度を保つシステムと機能
脳内におけるAβ産生はBACE1発現量が最も高い神経細胞が主に担い[42]、その産生量は神経活動に依存している[43]。そのメカニズムとしてBACE1[44]やγセクレターゼ[45]、そしてαセクレターゼであるADAM10[46]の活性が神経活動に応じて変化することが示されている。
このような神経活動に依存したAβ産生亢進は、昏睡患者における意識レベルと脳脊髄液中Aβ量の相関[47]や、睡眠・覚醒と関連した脳内Aβ量の日周期変動[48]、さらに老人斑沈着を認める非認知症者における異常な脳活動の上昇[49]とも関連が示唆されている。その一方で高濃度のAβは神経細胞を異常興奮させること、一方で神経活動を低下させたり、神経細胞死を招くことが実験系で示されている。このような観点から、神経活動依存性に産生されるAβがフィードバック的に脳内における神経活動の制御に関わっているという可能性も提示されている。しかしAPPノックアウトマウスにおける神経可塑性異常については報告されておらず、Aβの生理的意義については不明である。
なおAPPの生理機能については、シナプス小胞の輸送や神経突起の伸長に関与していることが示唆されているが[50]、哺乳類においてはファミリー分子であるAPLP1、APLP2が相補的に機能している。そのためAPPノックアウトマウスで大きな異常は認められていないが、APP/APLP2ダブルノックアウトマウスでは脳の発生異常が報告されている。しかしAPLPファミリーとAPPではAβ部分の一次配列が全く異なっており、少なくともAβはAPP機能には必要ないと考えられる。
Aβを標的とした抗アルツハイマー病治療薬開発戦略
アミロイドカスケード仮説に基づき、Aβを標的とした抗アルツハイマー病戦略は根治療法として期待され、特にセクレターゼ活性制御によるAβ産生メカニズムの抑制、Aβ凝集阻害によるアミロイド形成抑制、そしてAβ除去を促進するアミロイド沈着の抑制を主たる薬効とする治療薬開発が推進されてきた。この中でセクレターゼ活性制御のうちγセクレターゼ阻害薬Semagacestatの治験は副作用を生じたため開発が中止された。現在ではAβ42産生のみを特異的に低下させるγセクレターゼ制御薬(モジュレーター)や、βセクレターゼ阻害薬の治験が精力的に進められている[51]。Aβ凝集阻害についてはscyllo-Inositolを用いた治験が行われたが、やはり副作用のため開発中止となった。Aβ除去を目的としたストラテジーについては、現在は特にAβに対する獲得免疫を利用した抗体やワクチンによる治療薬開発が進められている。またAβの凝集性を高めるピログルタミル化を担う酵素Glutaminyl Cyclaseも、新たな創薬戦略として注目されている[52]。
剖検脳
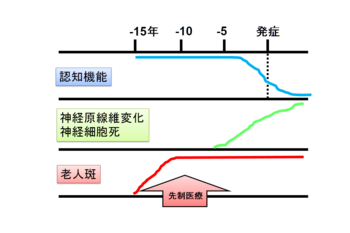
Aβ蓄積は15-20年以上前から開始していると推測されている。
において老人斑の疾患特異性が高いのに対して、神経原線維変化は様々な神経変性疾患において観察されること、そして非認知症健常者においても老人斑蓄積が認められることから、Aβ蓄積とタウ病変である神経原線維変化の関係については、長らく様々な議論がなされてきた。しかしほぼ全てのFAD遺伝子変異がAβ蓄積を亢進する一方で、Aβ産生を抑制する変異が認知機能低下に対する防御的変異として同定されたこと、またタウ遺伝子変異に起因し、老人斑蓄積を認めない前頭側頭葉変性症が見出され、Aβはアルツハイマー病を惹起する毒性分子であり、タウ病変はその下流で神経細胞死に直接関与するプロセスであると考えられるようになった。そしてモデルマウスを用いて、Aβ蓄積がタウ病変を亢進させる[53][54]ことや、脳脊髄液中のタウ濃度を上昇させる[55]ことが示された。
一方でこれまでに多くのAβに対する治療法開発が失敗に終わってきた。特にAβワクチン療法AN-1792の治験では、老人斑蓄積が消失している患者が確認されたにも関わらず認知機能の低下は抑制されておらず[56]、アミロイドカスケード仮説に基づいた抗Aβ療法に疑義が呈された。しかし近年の大規模臨床観察研究や、FAD変異キャリヤーのバイオマーカー解析などから、Aβ蓄積はアルツハイマー病発症から15-20年以上前に始まり、引き続いてタウ病変が惹起されること[57]、老人斑蓄積が確認される健常者やMCIがADを発症する確率が有意に高いことが明らかとなり[58][59]、Aβの蓄積が脳アミロイドーシスとしてのアルツハイマー病病変における最上流プロセスであることは間違いないと考えられている。そして抗Aβ抗体医薬の一つSolanezumabの治験においては、全体としてはエンドポイントが達成できなかったものの、mild-to-moderateに分類される、比較的早期のアルツハイマー病患者においては認知機能の低下が抑制されたと報告されている(Detailed Results of the Phase 3 Solanezumab EXPEDITION Studies)。そのような観点から、未発症期に個々人のAD発症リスクを正しく理解して抗Aβ療法を先制医療として開始することが正しいのではないかと考えられている。
参考文献
- ↑
Glenner, G.G., & Wong, C.W. (1984).
Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein. Biochemical and biophysical research communications, 120(3), 885-90. [PubMed:6375662] [WorldCat] [DOI] - ↑
De Strooper, B., Vassar, R., & Golde, T. (2010).
The secretases: enzymes with therapeutic potential in Alzheimer disease. Nature reviews. Neurology, 6(2), 99-107. [PubMed:20139999] [PMC] [WorldCat] [DOI] - ↑
Weber, S., & Saftig, P. (2012).
Ectodomain shedding and ADAMs in development. Development (Cambridge, England), 139(20), 3693-709. [PubMed:22991436] [WorldCat] [DOI] - ↑
Kenchappa, R.S., Zampieri, N., Chao, M.V., Barker, P.A., Teng, H.K., Hempstead, B.L., & Carter, B.D. (2006).
Ligand-dependent cleavage of the P75 neurotrophin receptor is necessary for NRIF nuclear translocation and apoptosis in sympathetic neurons. Neuron, 50(2), 219-32. [PubMed:16630834] [WorldCat] [DOI] - ↑
Watkins, T.A., Emery, B., Mulinyawe, S., & Barres, B.A. (2008).
Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron, 60(4), 555-69. [PubMed:19038214] [PMC] [WorldCat] [DOI] - ↑
Restituito, S., Khatri, L., Ninan, I., Mathews, P.M., Liu, X., Weinberg, R.J., & Ziff, E.B. (2011).
Synaptic autoregulation by metalloproteases and γ-secretase. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(34), 12083-93. [PubMed:21865451] [PMC] [WorldCat] [DOI] - ↑
Bai, G., & Pfaff, S.L. (2011).
Protease regulation: the Yin and Yang of neural development and disease. Neuron, 72(1), 9-21. [PubMed:21982365] [PMC] [WorldCat] [DOI] - ↑
Suzuki, K., Hayashi, Y., Nakahara, S., Kumazaki, H., Prox, J., Horiuchi, K., ..., & Iwatsubo, T. (2012).
Activity-dependent proteolytic cleavage of neuroligin-1. Neuron, 76(2), 410-22. [PubMed:23083742] [WorldCat] [DOI] - ↑
Yanagida, K., Okochi, M., Tagami, S., Nakayama, T., Kodama, T.S., Nishitomi, K., ..., & Takeda, M. (2009).
The 28-amino acid form of an APLP1-derived Abeta-like peptide is a surrogate marker for Abeta42 production in the central nervous system. EMBO molecular medicine, 1(4), 223-35. [PubMed:20049724] [PMC] [WorldCat] [DOI] - ↑
Hata, S., Fujishige, S., Araki, Y., Taniguchi, M., Urakami, K., Peskind, E., ..., & Suzuki, T. (2011).
Alternative processing of γ-secretase substrates in common forms of mild cognitive impairment and Alzheimer's disease: evidence for γ-secretase dysfunction. Annals of neurology, 69(6), 1026-31. [PubMed:21681798] [PMC] [WorldCat] [DOI] - ↑
Kopan, R., & Ilagan, M.X. (2004).
Gamma-secretase: proteasome of the membrane? Nature reviews. Molecular cell biology, 5(6), 499-504. [PubMed:15173829] [WorldCat] [DOI] - ↑
Kopan, R. (2012).
Notch signaling. Cold Spring Harbor perspectives in biology, 4(10). [PubMed:23028119] [PMC] [WorldCat] [DOI] - ↑
Jurisch-Yaksi, N., Sannerud, R., & Annaert, W. (2013).
A fast growing spectrum of biological functions of γ-secretase in development and disease. Biochimica et biophysica acta, 1828(12), 2815-27. [PubMed:24099003] [WorldCat] [DOI] - ↑
Asami-Odaka, A., Ishibashi, Y., Kikuchi, T., Kitada, C., & Suzuki, N. (1995).
Long amyloid beta-protein secreted from wild-type human neuroblastoma IMR-32 cells. Biochemistry, 34(32), 10272-8. [PubMed:7640283] [WorldCat] [DOI] - ↑
Jarrett, J.T., Berger, E.P., & Lansbury, P.T. (1993).
The carboxy terminus of the beta amyloid protein is critical for the seeding of amyloid formation: implications for the pathogenesis of Alzheimer's disease. Biochemistry, 32(18), 4693-7. [PubMed:8490014] [WorldCat] [DOI] - ↑
Iwatsubo, T., Odaka, A., Suzuki, N., Mizusawa, H., Nukina, N., & Ihara, Y. (1994).
Visualization of A beta 42(43) and A beta 40 in senile plaques with end-specific A beta monoclonals: evidence that an initially deposited species is A beta 42(43). Neuron, 13(1), 45-53. [PubMed:8043280] [WorldCat] [DOI] - ↑
Saito, T., Suemoto, T., Brouwers, N., Sleegers, K., Funamoto, S., Mihira, N., ..., & Saido, T.C. (2011).
Potent amyloidogenicity and pathogenicity of Aβ43. Nature neuroscience, 14(8), 1023-32. [PubMed:21725313] [WorldCat] [DOI] - ↑
Saido, T.C., Iwatsubo, T., Mann, D.M., Shimada, H., Ihara, Y., & Kawashima, S. (1995).
Dominant and differential deposition of distinct beta-amyloid peptide species, A beta N3(pE), in senile plaques. Neuron, 14(2), 457-66. [PubMed:7857653] [WorldCat] [DOI] - ↑
Mullan, M., Crawford, F., Axelman, K., Houlden, H., Lilius, L., Winblad, B., & Lannfelt, L. (1992).
A pathogenic mutation for probable Alzheimer's disease in the APP gene at the N-terminus of beta-amyloid. Nature genetics, 1(5), 345-7. [PubMed:1302033] [WorldCat] [DOI] - ↑
Di Fede, G., Catania, M., Morbin, M., Rossi, G., Suardi, S., Mazzoleni, G., ..., & Tagliavini, F. (2009).
A recessive mutation in the APP gene with dominant-negative effect on amyloidogenesis. Science (New York, N.Y.), 323(5920), 1473-7. [PubMed:19286555] [PMC] [WorldCat] [DOI] - ↑
Zhou, L., Brouwers, N., Benilova, I., Vandersteen, A., Mercken, M., Van Laere, K., ..., & De Strooper, B. (2011).
Amyloid precursor protein mutation E682K at the alternative β-secretase cleavage β'-site increases Aβ generation. EMBO molecular medicine, 3(5), 291-302. [PubMed:21500352] [PMC] [WorldCat] [DOI] - ↑
Jonsson, T., Atwal, J.K., Steinberg, S., Snaedal, J., Jonsson, P.V., Bjornsson, S., ..., & Stefansson, K. (2012).
A mutation in APP protects against Alzheimer's disease and age-related cognitive decline. Nature, 488(7409), 96-9. [PubMed:22801501] [WorldCat] [DOI] - ↑
Yang, L.B., Lindholm, K., Yan, R., Citron, M., Xia, W., Yang, X.L., ..., & Shen, Y. (2003).
Elevated beta-secretase expression and enzymatic activity detected in sporadic Alzheimer disease. Nature medicine, 9(1), 3-4. [PubMed:12514700] [WorldCat] [DOI] - ↑
Fukumoto, H., Cheung, B.S., Hyman, B.T., & Irizarry, M.C. (2002).
Beta-secretase protein and activity are increased in the neocortex in Alzheimer disease. Archives of neurology, 59(9), 1381-9. [PubMed:12223024] [WorldCat] [DOI] - ↑
Li, R., Lindholm, K., Yang, L.B., Yue, X., Citron, M., Yan, R., ..., & Shen, Y. (2004).
Amyloid beta peptide load is correlated with increased beta-secretase activity in sporadic Alzheimer's disease patients. Proceedings of the National Academy of Sciences of the United States of America, 101(10), 3632-7. [PubMed:14978286] [PMC] [WorldCat] [DOI] - ↑
Suh, J., Choi, S.H., Romano, D.M., Gannon, M.A., Lesinski, A.N., Kim, D.Y., & Tanzi, R.E. (2013).
ADAM10 missense mutations potentiate β-amyloid accumulation by impairing prodomain chaperone function. Neuron, 80(2), 385-401. [PubMed:24055016] [PMC] [WorldCat] [DOI] - ↑
Goate, A., Chartier-Harlin, M.C., Mullan, M., Brown, J., Crawford, F., Fidani, L., ..., & James, L. (1991).
Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer's disease. Nature, 349(6311), 704-6. [PubMed:1671712] [WorldCat] [DOI] - ↑
Suzuki, N., Cheung, T.T., Cai, X.D., Odaka, A., Otvos, L., Eckman, C., ..., & Younkin, S.G. (1994).
An increased percentage of long amyloid beta protein secreted by familial amyloid beta protein precursor (beta APP717) mutants. Science (New York, N.Y.), 264(5163), 1336-40. [PubMed:8191290] [WorldCat] [DOI] - ↑
Tian, Y., Bassit, B., Chau, D., & Li, Y.M. (2010).
An APP inhibitory domain containing the Flemish mutation residue modulates gamma-secretase activity for Abeta production. Nature structural & molecular biology, 17(2), 151-8. [PubMed:20062056] [WorldCat] [DOI] - ↑
Takasugi, N., Tomita, T., Hayashi, I., Tsuruoka, M., Niimura, M., Takahashi, Y., ..., & Iwatsubo, T. (2003).
The role of presenilin cofactors in the gamma-secretase complex. Nature, 422(6930), 438-41. [PubMed:12660785] [WorldCat] [DOI] - ↑
Tomita, T., & Iwatsubo, T. (2013).
Structural biology of presenilins and signal peptide peptidases. The Journal of biological chemistry, 288(21), 14673-80. [PubMed:23585568] [PMC] [WorldCat] [DOI] - ↑
Lambert, J.C., Ibrahim-Verbaas, C.A., Harold, D., Naj, A.C., Sims, R., Bellenguez, C., ..., & Amouyel, P. (2013).
Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease. Nature genetics, 45(12), 1452-8. [PubMed:24162737] [PMC] [WorldCat] [DOI] - ↑
Hori, Y., Hashimoto, T., Wakutani, Y., Urakami, K., Nakashima, K., Condron, M.M., ..., & Iwatsubo, T. (2007).
The Tottori (D7N) and English (H6R) familial Alzheimer disease mutations accelerate Abeta fibril formation without increasing protofibril formation. The Journal of biological chemistry, 282(7), 4916-23. [PubMed:17170111] [WorldCat] [DOI] - ↑
Di Fede, G., Catania, M., Morbin, M., Rossi, G., Suardi, S., Mazzoleni, G., ..., & Tagliavini, F. (2009).
A recessive mutation in the APP gene with dominant-negative effect on amyloidogenesis. Science (New York, N.Y.), 323(5920), 1473-7. [PubMed:19286555] [PMC] [WorldCat] [DOI] - ↑
Murakami, K., Irie, K., Morimoto, A., Ohigashi, H., Shindo, M., Nagao, M., ..., & Shirasawa, T. (2003).
Neurotoxicity and physicochemical properties of Abeta mutant peptides from cerebral amyloid angiopathy: implication for the pathogenesis of cerebral amyloid angiopathy and Alzheimer's disease. The Journal of biological chemistry, 278(46), 46179-87. [PubMed:12944403] [WorldCat] [DOI] - ↑
Nilsberth, C., Westlind-Danielsson, A., Eckman, C.B., Condron, M.M., Axelman, K., Forsell, C., ..., & Lannfelt, L. (2001).
The 'Arctic' APP mutation (E693G) causes Alzheimer's disease by enhanced Abeta protofibril formation. Nature neuroscience, 4(9), 887-93. [PubMed:11528419] [WorldCat] [DOI] - ↑
Tomiyama, T., Nagata, T., Shimada, H., Teraoka, R., Fukushima, A., Kanemitsu, H., ..., & Mori, H. (2008).
A new amyloid beta variant favoring oligomerization in Alzheimer's-type dementia. Annals of neurology, 63(3), 377-87. [PubMed:18300294] [WorldCat] [DOI] - ↑
Yamada, K., Yabuki, C., Seubert, P., Schenk, D., Hori, Y., Ohtsuki, S., ..., & Iwatsubo, T. (2009).
Abeta immunotherapy: intracerebral sequestration of Abeta by an anti-Abeta monoclonal antibody 266 with high affinity to soluble Abeta. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(36), 11393-8. [PubMed:19741145] [PMC] [WorldCat] [DOI] - ↑
Jiang, Q., Lee, C.Y., Mandrekar, S., Wilkinson, B., Cramer, P., Zelcer, N., ..., & Landreth, G.E. (2008).
ApoE promotes the proteolytic degradation of Abeta. Neuron, 58(5), 681-93. [PubMed:18549781] [PMC] [WorldCat] [DOI] - ↑
Castellano, J.M., Kim, J., Stewart, F.R., Jiang, H., DeMattos, R.B., Patterson, B.W., ..., & Holtzman, D.M. (2011).
Human apoE isoforms differentially regulate brain amyloid-β peptide clearance. Science translational medicine, 3(89), 89ra57. [PubMed:21715678] [PMC] [WorldCat] [DOI] - ↑
Mawuenyega, K.G., Sigurdson, W., Ovod, V., Munsell, L., Kasten, T., Morris, J.C., ..., & Bateman, R.J. (2010).
Decreased clearance of CNS beta-amyloid in Alzheimer's disease. Science (New York, N.Y.), 330(6012), 1774. [PubMed:21148344] [PMC] [WorldCat] [DOI] - ↑
Fukumoto, H., Tomita, T., Matsunaga, H., Ishibashi, Y., Saido, T.C., & Iwatsubo, T. (1999).
Primary cultures of neuronal and non-neuronal rat brain cells secrete similar proportions of amyloid beta peptides ending at A beta40 and A beta42. Neuroreport, 10(14), 2965-9. [PubMed:10549806] [WorldCat] [DOI] - ↑
Kamenetz, F., Tomita, T., Hsieh, H., Seabrook, G., Borchelt, D., Iwatsubo, T., ..., & Malinow, R. (2003).
APP processing and synaptic function. Neuron, 37(6), 925-37. [PubMed:12670422] [WorldCat] [DOI] - ↑
Castellano, J.M., Kim, J., Stewart, F.R., Jiang, H., DeMattos, R.B., Patterson, B.W., ..., & Holtzman, D.M. (2011).
Human apoE isoforms differentially regulate brain amyloid-β peptide clearance. Science translational medicine, 3(89), 89ra57. [PubMed:21715678] [PMC] [WorldCat] [DOI] - ↑
Dolev, I., Fogel, H., Milshtein, H., Berdichevsky, Y., Lipstein, N., Brose, N., ..., & Slutsky, I. (2013).
Spike bursts increase amyloid-β 40/42 ratio by inducing a presenilin-1 conformational change. Nature neuroscience, 16(5), 587-95. [PubMed:23563578] [WorldCat] [DOI] - ↑
Marcello, E., Saraceno, C., Musardo, S., Vara, H., de la Fuente, A.G., Pelucchi, S., ..., & Di Luca, M. (2013).
Endocytosis of synaptic ADAM10 in neuronal plasticity and Alzheimer's disease. The Journal of clinical investigation, 123(6), 2523-38. [PubMed:23676497] [PMC] [WorldCat] [DOI] - ↑
Brody, D.L., Magnoni, S., Schwetye, K.E., Spinner, M.L., Esparza, T.J., Stocchetti, N., ..., & Holtzman, D.M. (2008).
Amyloid-beta dynamics correlate with neurological status in the injured human brain. Science (New York, N.Y.), 321(5893), 1221-4. [PubMed:18755980] [PMC] [WorldCat] [DOI] - ↑
Kang, J.E., Lim, M.M., Bateman, R.J., Lee, J.J., Smyth, L.P., Cirrito, J.R., ..., & Holtzman, D.M. (2009).
Amyloid-beta dynamics are regulated by orexin and the sleep-wake cycle. Science (New York, N.Y.), 326(5955), 1005-7. [PubMed:19779148] [PMC] [WorldCat] [DOI] - ↑
Sperling, R.A., Laviolette, P.S., O'Keefe, K., O'Brien, J., Rentz, D.M., Pihlajamaki, M., ..., & Johnson, K.A. (2009).
Amyloid deposition is associated with impaired default network function in older persons without dementia. Neuron, 63(2), 178-88. [PubMed:19640477] [PMC] [WorldCat] [DOI] - ↑
Müller, U.C., & Zheng, H. (2012).
Physiological functions of APP family proteins. Cold Spring Harbor perspectives in medicine, 2(2), a006288. [PubMed:22355794] [PMC] [WorldCat] [DOI] - ↑
Tomita, T. (2009).
Secretase inhibitors and modulators for Alzheimer's disease treatment. Expert review of neurotherapeutics, 9(5), 661-79. [PubMed:19402777] [WorldCat] [DOI] - ↑
Schilling, S., Zeitschel, U., Hoffmann, T., Heiser, U., Francke, M., Kehlen, A., ..., & Rossner, S. (2008).
Glutaminyl cyclase inhibition attenuates pyroglutamate Abeta and Alzheimer's disease-like pathology. Nature medicine, 14(10), 1106-11. [PubMed:18836460] [WorldCat] [DOI] - ↑
Lewis, J., Dickson, D.W., Lin, W.L., Chisholm, L., Corral, A., Jones, G., ..., & McGowan, E. (2001).
Enhanced neurofibrillary degeneration in transgenic mice expressing mutant tau and APP. Science (New York, N.Y.), 293(5534), 1487-91. [PubMed:11520987] [WorldCat] [DOI] - ↑
Götz, J., Chen, F., van Dorpe, J., & Nitsch, R.M. (2001).
Formation of neurofibrillary tangles in P301l tau transgenic mice induced by Abeta 42 fibrils. Science (New York, N.Y.), 293(5534), 1491-5. [PubMed:11520988] [WorldCat] [DOI] - ↑
Maia, L.F., Kaeser, S.A., Reichwald, J., Hruscha, M., Martus, P., Staufenbiel, M., & Jucker, M. (2013).
Changes in amyloid-β and Tau in the cerebrospinal fluid of transgenic mice overexpressing amyloid precursor protein. Science translational medicine, 5(194), 194re2. [PubMed:23863834] [WorldCat] [DOI] - ↑
Nicoll, J.A., Wilkinson, D., Holmes, C., Steart, P., Markham, H., & Weller, R.O. (2003).
Neuropathology of human Alzheimer disease after immunization with amyloid-beta peptide: a case report. Nature medicine, 9(4), 448-52. [PubMed:12640446] [WorldCat] [DOI] - ↑
Bateman, R.J., Xiong, C., Benzinger, T.L., Fagan, A.M., Goate, A., Fox, N.C., ..., & Dominantly Inherited Alzheimer Network (2012).
Clinical and biomarker changes in dominantly inherited Alzheimer's disease. The New England journal of medicine, 367(9), 795-804. [PubMed:22784036] [PMC] [WorldCat] [DOI] - ↑
Okello, A., Koivunen, J., Edison, P., Archer, H.A., Turkheimer, F.E., Någren, K., ..., & Brooks, D.J. (2009).
Conversion of amyloid positive and negative MCI to AD over 3 years: an 11C-PIB PET study. Neurology, 73(10), 754-60. [PubMed:19587325] [PMC] [WorldCat] [DOI] - ↑
Reiman, E.M., Chen, K., Liu, X., Bandy, D., Yu, M., Lee, W., ..., & Caselli, R.J. (2009).
Fibrillar amyloid-beta burden in cognitively normal people at 3 levels of genetic risk for Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America, 106(16), 6820-5. [PubMed:19346482] [PMC] [WorldCat] [DOI]