「ニカストリン」の版間の差分
細 →分子機能 |
細編集の要約なし |
||
| 40行目: | 40行目: | ||
Shahら<ref name=Shah2005><pubmed>16096062</pubmed></ref> はさらに、DAPドメインが基質のN末端を認識し、γセクレターゼ複合体と基質との結合を仲介すること、すなわち細胞外領域の刈り込み(シェディング)を受けたタイプⅠ膜タンパク質を選別して基質として認識し、そのドッキングに働くことを示した。さらに、既知のアミノペプチダーゼ構造モデルに基づきGlu333が基質ドッキングのポケット構造の形成に与ると予想し、Glu333Ala変異体がγセクレターゼ切断を阻害することを示した。これに対して、Glu333は複合体の会合と成熟に関与するものの、γセクレターゼ切断には必要でないとする報告もある<ref name=Chavez-Gutierrez2008><pubmed>18502756</pubmed></ref><ref name=Dries2009><pubmed>19729449</pubmed></ref> 。 | Shahら<ref name=Shah2005><pubmed>16096062</pubmed></ref> はさらに、DAPドメインが基質のN末端を認識し、γセクレターゼ複合体と基質との結合を仲介すること、すなわち細胞外領域の刈り込み(シェディング)を受けたタイプⅠ膜タンパク質を選別して基質として認識し、そのドッキングに働くことを示した。さらに、既知のアミノペプチダーゼ構造モデルに基づきGlu333が基質ドッキングのポケット構造の形成に与ると予想し、Glu333Ala変異体がγセクレターゼ切断を阻害することを示した。これに対して、Glu333は複合体の会合と成熟に関与するものの、γセクレターゼ切断には必要でないとする報告もある<ref name=Chavez-Gutierrez2008><pubmed>18502756</pubmed></ref><ref name=Dries2009><pubmed>19729449</pubmed></ref> 。 | ||
基質とγセクレターゼ複合体との結合は膜貫通領域を介したものであり('''図2''')、ニカストリンの細胞外領域は、その立体構造を介し、細胞外ドメインの長いタイプⅠ膜タンパク質と複合体との結合を妨害するとの指摘もある<ref name=Bolduc2016><pubmed>26699478</pubmed></ref> 。等間隔に位置するCys残基については、C248S変異がγセクレターゼが不活性化する一方、C213S変異やC230S変異は[[Notch]]切断に影響せず[[APP]]切断のみを抑制するとされる<ref name=Pamren2011><pubmed>21768095</pubmed></ref> 。糖鎖付加については、ニカストリンの安定化と複合体への編入に必要だがγセクレターゼ活性には関与しないとする報告とともに、活発現性や基質指向性にも関与するとの報告も見られる<ref name=Moniruzzaman2018><pubmed>29787759</pubmed></ref> 。 | |||
一方で、ニカストリンがγセクレターゼ活性に必須でない可能性も指摘されている。ニカストリン欠失[[マウス]]の胎仔[[線維芽細胞]]でも、弱いながらγセクレターゼ活性が残存する他、プレセニリン単独でもγセクレターゼ活性をもつとされる。ただし、ニカストリンに特異的に結合する抗体短鎖可変領域はγセクレターゼ切断を明瞭に阻害することや<ref name=Hayashi2009><pubmed>19684016</pubmed></ref><ref name=Zhang2014><pubmed>25352592</pubmed></ref> 、ニカストリンを欠いた複合体は細胞内では不安定であることなどを合わせ、生理的機能に充分なγセクレターゼ活性の発現にはニカストリンが欠かせないと考えられる。 | 一方で、ニカストリンがγセクレターゼ活性に必須でない可能性も指摘されている。ニカストリン欠失[[マウス]]の胎仔[[線維芽細胞]]でも、弱いながらγセクレターゼ活性が残存する他、プレセニリン単独でもγセクレターゼ活性をもつとされる。ただし、ニカストリンに特異的に結合する抗体短鎖可変領域はγセクレターゼ切断を明瞭に阻害することや<ref name=Hayashi2009><pubmed>19684016</pubmed></ref><ref name=Zhang2014><pubmed>25352592</pubmed></ref> 、ニカストリンを欠いた複合体は細胞内では不安定であることなどを合わせ、生理的機能に充分なγセクレターゼ活性の発現にはニカストリンが欠かせないと考えられる。 | ||
2020年12月22日 (火) 12:40時点における版
西村 正樹
滋賀医科大学 神経難病研究センター
DOI:10.14931/bsd.9586 原稿受付日:2020年11月11日 原稿完成日:2020年12月22日
担当編集委員:山中 宏二(名古屋大学 環境医学研究所 病態神経科学)
英語名:nicastrin
ニカストリンは、γセクレターゼ複合体の構成タンパク質である。γセクレターゼは多くのタイプⅠ膜貫通型タンパク質を基質とする膜内アスパラギン酸プロテアーゼであり、アルツハイマー病の原因ペプチドであるアミロイドβ(amyloid-β; Aβ)の産生やNotchシグナル伝達過程において働くことが知られる。これに対応し、アルツハイマー病をはじめ、癌や皮膚疾患との関連を示す知見が蓄積されている。γセクレターゼ複合体は、ニカストリンに加え、プレセニリン(Presenilin-1 & Presenilin-2)、APH1 (anterior pharynx defective-1)、PEN2 (presenilin enhancer-2)によって構成される。
はじめに
ニカストリンは、家族性アルツハイマー病原因遺伝子プレセニリンの機能解析のなかで、2000年、プレセニリン1結合タンパク質として同定された[1] 。その報告の直前、プレセニリンがγセクレターゼ切断に関与することが報告され[2] 、それと合わせて、γセクレターゼの分子実体がプレセニリン複合体であることが明らかになった。この経緯から、ニカストリンは当初よりプレセニリン機能を補佐するとの位置付けで認識され、その命名もプレセニリン同定のもとになったイタリアの大家系がNicastro村落出身であったことに因んでいる。
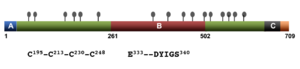
●:糖鎖付加が予想されるAsn残基、A: シグナル配列、B: DAPドメイン、C: 膜貫通ドメイン.
構造
一次構造
ニカストリン遺伝子(NCT)は染色体1q23にマップされる。
709アミノ酸残基から成るタイプⅠ膜貫通型糖タンパク質であり、アミノ(N)端側の大きな細胞外領域とカルボキシル(C)端の短い細胞内ドメインをもつ(図1)。細胞外領域には、ほぼ等間隔に配置する4つのCys残基がある他、種を越えて保存されたAsp-Tyr-Ile-Gly-Ser (DYIGS)配列があり、アミノペプチダーゼとの相同性からDAP (DYIGS and peptidase homologous)ドメインと呼ばれている[3] 。細胞性粘菌からヒトまで、相同分子の発現が知られる(酵母にはない)。少なくともヒトでは、他にファミリー分子などはないが、エクソン16(膜貫通領域に近い細胞外領域71アミノ酸に相当)を欠くスプライシング亜型が報告されている[4] 。
γセクレターゼ複合体形成
γセクレターゼ複合体の会合過程において、まずニカストリンがAPH-1と結合してヘテロ二量体を作る。次いで順次、プレセニリン、PEN-2が編入することによって活性型複合体が完成する。APH-1との結合には、膜貫通ドメインのN末端側領域が必須であり[5] 、さらに細胞外の膜近傍にあるSer632とTrp648が複合体編入に寄与する[6] 。一方、APH-1 側では第4および第5膜貫通ドメインのGly126とHis171 (残基番号はAPH-1aSによる)が結合に欠かせない。この結合に対し、Rer1はAPH-1と競合し複合体形成を阻害するとされる。ニカストリンはプレセニリンC末端とも直接結合するとされ、ニカストリンを欠く複合体は安定性を失う。活性型γセクレターゼ複合体会合は、トランス-ゴルジ-ネットワークにおいて完成する。
翻訳後修飾
翻訳後、分泌経路を輸送され、糖鎖付加を受けて成熟型となり安定化する。N-糖鎖付加が予想される16個のAsn残基のうち、少なくとも11個にはN-糖鎖が確認された[7] 。通常、γセクレターゼ複合体にはこの成熟型が組み込まれる。複合体の中で、糖鎖付加されるのはニカストリンだけであり、細胞外構造の大部分を占めるとともにカルネキシン(calnexin)やERGIC-53との結合を仲介する。また、APH-1とともにパルミトイル化を受けるが、これはタンパク質安定化と膜マイクロドメインdetergent-resistant membrane (DRM)への局在に寄与するとされ、このパルミトイル化を阻害したモデルマウスでは脳Aβ蓄積が減少する。この他、TNF-βはJNKによるニカストリンおよびプレセニリンのリン酸化を介してγセクレターゼ活性を亢進させる。一方、ニカストリンの分解はプロテアソームおよびライソゾーム経路により、前者にはE3ユビキチンリガーゼとしてシノヴィオリン(synoviolin)が関わる。
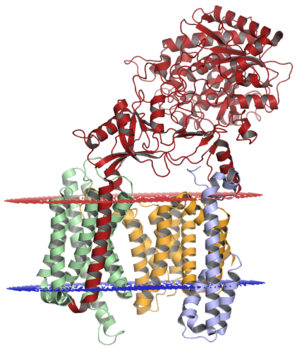
ニカストリンを赤で示す。文献[7]、Wikipediaより。
立体構造
タマホコリカビ属の細胞性粘菌Dictyostelium purpureumの相同分子を用いたX線結晶構造解析によると、ニカストリンの細胞外には大小2つの葉状構造(lobe)があり、大きい葉状構造は内部に荷電アミノ酸や極性アミノ酸が配置するポケットをもち、小さい葉状構造から延びる"ふた(lid)"で覆われている[8] 。続くクライオ電顕によるヒトγセクレターゼ複合体の結晶解析(図2)からは、上記に加え、ポケット構造の内部に4つのArgを含む荷電アミノ酸と極性アミノ酸が配置し、基質結合に与るとされるGlu333とTyr337もこの内部にあることが示された[7][9] 。基質結合に際して、大きい葉状構造がPhe287を軸に回転し"ふた"が開くと推測されている。この"ふた"自体は活性には必要ない[10] 。NMR解析からは、αヘリックス構造をとる膜貫通部に親水性パッチがあり、ここが膜貫通ドメイン同士の相互作用に関与する可能性や、構造をとらない細胞内ドメインのVal697からAla702は膜と結合することが指摘されている[11] 。
基質(APP-C83またはNotch-100)と結合したγセクレターゼ複合体の結晶構造解析では、ニカストリンはAPP-C83のN末端にあるLeu688/Val689と直接相互作用するとされ、Notch-100のN末端にある短いαヘリックスはニカストリンの親水性ポケットに入り込み、Gln1722がニカストリン側のTrp653インドール環に接するという[12][13] 。しかし、いずれの基質もプレセニリンとの相互作用が主である。
発現
ほとんどの臓器と細胞で発現している。中枢神経系でも広範な領域のニューロンにおいて、プレセニリンとの共存が確認されている。脳では出生直後に比較的高い発現レベルにあり、その後次第に減少して成熟個体レベルに到る[14] 。
分子機能
ニカストリンがγセクレターゼの切断様式や活性にどのように関与するかについては、充分なコンセンサスに到っておらず、未だ相反する見解が見られる。その中で、γセクレターゼ基質の認識とドッキングに働くとする説はよく知られる。上述のDAPドメインはアミノペプチダーゼとの相同性を示すが、ニカストリン自体はペプチダーゼ活性をもたない一方、DYIGS配列の欠失変異体は細胞のAβ産生を阻害するなど、γセクレターゼ切断への機能的関与が初期より指摘されていた[1] 。
Shahら[3] はさらに、DAPドメインが基質のN末端を認識し、γセクレターゼ複合体と基質との結合を仲介すること、すなわち細胞外領域の刈り込み(シェディング)を受けたタイプⅠ膜タンパク質を選別して基質として認識し、そのドッキングに働くことを示した。さらに、既知のアミノペプチダーゼ構造モデルに基づきGlu333が基質ドッキングのポケット構造の形成に与ると予想し、Glu333Ala変異体がγセクレターゼ切断を阻害することを示した。これに対して、Glu333は複合体の会合と成熟に関与するものの、γセクレターゼ切断には必要でないとする報告もある[15][16] 。
基質とγセクレターゼ複合体との結合は膜貫通領域を介したものであり(図2)、ニカストリンの細胞外領域は、その立体構造を介し、細胞外ドメインの長いタイプⅠ膜タンパク質と複合体との結合を妨害するとの指摘もある[17] 。等間隔に位置するCys残基については、C248S変異がγセクレターゼが不活性化する一方、C213S変異やC230S変異はNotch切断に影響せずAPP切断のみを抑制するとされる[18] 。糖鎖付加については、ニカストリンの安定化と複合体への編入に必要だがγセクレターゼ活性には関与しないとする報告とともに、活発現性や基質指向性にも関与するとの報告も見られる[19] 。
一方で、ニカストリンがγセクレターゼ活性に必須でない可能性も指摘されている。ニカストリン欠失マウスの胎仔線維芽細胞でも、弱いながらγセクレターゼ活性が残存する他、プレセニリン単独でもγセクレターゼ活性をもつとされる。ただし、ニカストリンに特異的に結合する抗体短鎖可変領域はγセクレターゼ切断を明瞭に阻害することや[20][21] 、ニカストリンを欠いた複合体は細胞内では不安定であることなどを合わせ、生理的機能に充分なγセクレターゼ活性の発現にはニカストリンが欠かせないと考えられる。
生理・病態における機能
アルツハイマー病
ニカストリン遺伝子変異による家族性アルツハイマー病家系は知られていない一方、単一塩基多型(single nucleotide polymorphism: SNP)を基に5つのハプロタイプが見出され、特定のハプロタイプ頻度が若年発症の家族性アルツハイマー病例において有意に高いことが示された[22] 。
また、プロモーター領域のSNP解析からも、アルツハイマー病との相関性が指摘されている。しかし、否定的な追試結果も見られる。さらに、11歳群と79歳群における認知機能テストから、このハプロタイプが生来の認知機能レベルと関連するものの、加齢に伴う認知機能低下とは相関しないとする報告もある[23] 。現在まで、コモンバリアントとの連関はコンセンサスに到っていない。一方で、Luptonら[24] は、レアバリアントであるAsn417Tyrがギリシャ人アルツハイマー病群で有意に高いことを報告している。ちなみに、この変異体の発現は細胞のAβ産生には変化を与えない[22] 。
体節形成、細胞分化、アポトーシスなど
ニカストリン欠失マウスは胎生致死であるが、加えてNotch1あるいはプレセニリンの欠失マウスに類似した体節形成不全などの表現型が確認されている[25] 。γセクレターゼの基質は多いため、それらに関連した多彩な表現型が認められ得る。例えば、マウスやショウジョウバエを用いた解析から、神経細胞やリンパ球の分化に必須であることが指摘されているが、これらはγセクレターゼがNotchシグナル伝達に不可欠であることで説明できる。
一方、γセクレターゼとは独立した機能は充分に認知されていないが、ニカストリン欠失マウスでは脳や心臓においてアポトーシス細胞が顕著に認められる所見をもとに、ニカストリンがp53の発現とリン酸化を阻害してp53経路を抑制し、γセクレターゼ活性とは無関係に細胞死を抑制する可能性が指摘されている[26] 。また、骨格筋においては、γセクレターゼ複合体とは異なるサイズの複合体形成(240ないし290 kDa)が示されている。
癌
乳癌、肝細胞癌、大腸癌などにおいて高発現が報告されており、各種の発癌や転移に関与することが示唆される。少なくとも一部には、Notchシグナルを介したメカニズムが推測される。
化膿性汗腺炎
hidradenitis suppurativa or acne inversa
常染色体優性遺伝を示す化膿性汗腺炎の家系に、欠失、挿入、置換、スプライシング異常をきたすニカストリン遺伝子変異が見出されている(総説[27] )。γセクレターゼ複合体の他の構成分子をコードする遺伝子の類似変異をもつ家系も知られることから、γセクレターゼの発現低下が原因と考えられる。ヘテロ欠失マウスでも類似した毛包閉塞を伴う皮膚病変がみられる。化膿性汗腺炎の家系におけるアルツハイマー病合併率については、報告によって結果が一致していない。
関連項目
参考文献
- ↑ 1.0 1.1
Yu, G., Nishimura, M., Arawaka, S., Levitan, D., Zhang, L., Tandon, A., ..., & St George-Hyslop, P. (2000).
Nicastrin modulates presenilin-mediated notch/glp-1 signal transduction and betaAPP processing. Nature, 407(6800), 48-54. [PubMed:10993067] [WorldCat] [DOI] - ↑
Wolfe, M.S., Xia, W., Ostaszewski, B.L., Diehl, T.S., Kimberly, W.T., & Selkoe, D.J. (1999).
Two transmembrane aspartates in presenilin-1 required for presenilin endoproteolysis and gamma-secretase activity. Nature, 398(6727), 513-7. [PubMed:10206644] [WorldCat] [DOI] - ↑ 3.0 3.1
Shah, S., Lee, S.F., Tabuchi, K., Hao, Y.H., Yu, C., LaPlant, Q., ..., & Yu, G. (2005).
Nicastrin functions as a gamma-secretase-substrate receptor. Cell, 122(3), 435-47. [PubMed:16096062] [WorldCat] [DOI] - ↑
Mitsuda, N., Yamagata, H.D., Zhong, W., Aoto, M., Akatsu, H., Uekawa, N., ..., & Miki, T. (2006).
A novel alternative splice variant of nicastrin and its implication in Alzheimer disease. Life sciences, 78(21), 2444-8. [PubMed:16303145] [WorldCat] [DOI] - ↑
Capell, A., Kaether, C., Edbauer, D., Shirotani, K., Merkl, S., Steiner, H., & Haass, C. (2003).
Nicastrin interacts with gamma-secretase complex components via the N-terminal part of its transmembrane domain. The Journal of biological chemistry, 278(52), 52519-23. [PubMed:14602727] [WorldCat] [DOI] - ↑
Walker, E.S., Martinez, M., Wang, J., & Goate, A. (2006).
Conserved residues in juxtamembrane region of the extracellular domain of nicastrin are essential for gamma-secretase complex formation. Journal of neurochemistry, 98(1), 300-9. [PubMed:16805816] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Bai, X.C., Yan, C., Yang, G., Lu, P., Ma, D., Sun, L., ..., & Shi, Y. (2015).
An atomic structure of human γ-secretase. Nature, 525(7568), 212-217. [PubMed:26280335] [PMC] [WorldCat] [DOI] - ↑
Xie, T., Yan, C., Zhou, R., Zhao, Y., Sun, L., Yang, G., ..., & Shi, Y. (2014).
Crystal structure of the γ-secretase component nicastrin. Proceedings of the National Academy of Sciences of the United States of America, 111(37), 13349-54. [PubMed:25197054] [PMC] [WorldCat] [DOI] - ↑
Lu, P., Bai, X.C., Ma, D., Xie, T., Yan, C., Sun, L., ..., & Shi, Y. (2014).
Three-dimensional structure of human γ-secretase. Nature, 512(7513), 166-170. [PubMed:25043039] [PMC] [WorldCat] [DOI] - ↑
Zhang, X., Sullivan, E., Scimeca, M., Wu, X., Li, Y.M., & Sisodia, S.S. (2016).
Evidence That the "Lid" Domain of Nicastrin Is Not Essential for Regulating γ-Secretase Activity. The Journal of biological chemistry, 291(13), 6748-53. [PubMed:26887941] [PMC] [WorldCat] [DOI] - ↑
Li, Y., Liew, L.S., Li, Q., & Kang, C. (2016).
Structure of the transmembrane domain of human nicastrin-a component of γ-secretase. Scientific reports, 6, 19522. [PubMed:26776682] [PMC] [WorldCat] [DOI] - ↑
Zhou, R., Yang, G., Guo, X., Zhou, Q., Lei, J., & Shi, Y. (2019).
Recognition of the amyloid precursor protein by human γ-secretase. Science (New York, N.Y.), 363(6428). [PubMed:30630874] [WorldCat] [DOI] - ↑
Yang, G., Zhou, R., Zhou, Q., Guo, X., Yan, C., Ke, M., ..., & Shi, Y. (2019).
Structural basis of Notch recognition by human γ-secretase. Nature, 565(7738), 192-197. [PubMed:30598546] [WorldCat] [DOI] - ↑
Uchihara, T., Sanjo, N., Nakamura, A., Han, K., Song, S.Y., St George-Hyslop, P., & Fraser, P.E. (2006).
Transient abundance of presenilin 1 fragments/nicastrin complex associated with synaptogenesis during development in rat cerebellum. Neurobiology of aging, 27(1), 88-97. [PubMed:16298244] [WorldCat] [DOI] - ↑
Chávez-Gutiérrez, L., Tolia, A., Maes, E., Li, T., Wong, P.C., & de Strooper, B. (2008).
Glu(332) in the Nicastrin ectodomain is essential for gamma-secretase complex maturation but not for its activity. The Journal of biological chemistry, 283(29), 20096-105. [PubMed:18502756] [WorldCat] [DOI] - ↑
Dries, D.R., Shah, S., Han, Y.H., Yu, C., Yu, S., Shearman, M.S., & Yu, G. (2009).
Glu-333 of nicastrin directly participates in gamma-secretase activity. The Journal of biological chemistry, 284(43), 29714-24. [PubMed:19729449] [PMC] [WorldCat] [DOI] - ↑
Bolduc, D.M., Montagna, D.R., Gu, Y., Selkoe, D.J., & Wolfe, M.S. (2016).
Nicastrin functions to sterically hinder γ-secretase-substrate interactions driven by substrate transmembrane domain. Proceedings of the National Academy of Sciences of the United States of America, 113(5), E509-18. [PubMed:26699478] [PMC] [WorldCat] [DOI] - ↑
Pamrén, A., Wanngren, J., Tjernberg, L.O., Winblad, B., Bhat, R., Näslund, J., & Karlström, H. (2011).
Mutations in nicastrin protein differentially affect amyloid beta-peptide production and Notch protein processing. The Journal of biological chemistry, 286(36), 31153-8. [PubMed:21768095] [PMC] [WorldCat] [DOI] - ↑
Moniruzzaman, M., Ishihara, S., Nobuhara, M., Higashide, H., & Funamoto, S. (2018).
Glycosylation status of nicastrin influences catalytic activity and substrate preference of γ-secretase. Biochemical and biophysical research communications, 502(1), 98-103. [PubMed:29787759] [WorldCat] [DOI] - ↑
Hayashi, I., Takatori, S., Urano, Y., Iwanari, H., Isoo, N., Osawa, S., ..., & Iwatsubo, T. (2009).
Single chain variable fragment against nicastrin inhibits the gamma-secretase activity. The Journal of biological chemistry, 284(41), 27838-47. [PubMed:19684016] [PMC] [WorldCat] [DOI] - ↑
Zhang, X., Hoey, R., Koide, A., Dolios, G., Paduch, M., Nguyen, P., ..., & Sisodia, S.S. (2014).
A synthetic antibody fragment targeting nicastrin affects assembly and trafficking of γ-secretase. The Journal of biological chemistry, 289(50), 34851-61. [PubMed:25352592] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1
Dermaut, B., Theuns, J., Sleegers, K., Hasegawa, H., Van den Broeck, M., Vennekens, K., ..., & Van Broeckhoven, C. (2002).
The gene encoding nicastrin, a major gamma-secretase component, modifies risk for familial early-onset Alzheimer disease in a Dutch population-based sample. American journal of human genetics, 70(6), 1568-74. [PubMed:11992262] [PMC] [WorldCat] [DOI] - ↑
Deary, I.J., Hamilton, G., Hayward, C., Whalley, L.J., Powell, J., Starr, J.M., & Lovestone, S. (2005).
Nicastrin gene polymorphisms, cognitive ability level and cognitive ageing. Neuroscience letters, 373(2), 110-4. [PubMed:15567563] [WorldCat] [DOI] - ↑
Lupton, M.K., Proitsi, P., Danillidou, M., Tsolaki, M., Hamilton, G., Wroe, R., ..., & Powell, J.F. (2011).
Deep sequencing of the Nicastrin gene in pooled DNA, the identification of genetic variants that affect risk of Alzheimer's disease. PloS one, 6(2), e17298. [PubMed:21364883] [PMC] [WorldCat] [DOI] - ↑
Li, T., Ma, G., Cai, H., Price, D.L., & Wong, P.C. (2003).
Nicastrin is required for assembly of presenilin/gamma-secretase complexes to mediate Notch signaling and for processing and trafficking of beta-amyloid precursor protein in mammals. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(8), 3272-7. [PubMed:12716934] [PMC] [WorldCat] - ↑
Pardossi-Piquard, R., Dunys, J., Giaime, E., Guillot-Sestier, M.V., St George-Hyslop, P., Checler, F., & Alves da Costa, C. (2009).
p53-dependent control of cell death by nicastrin: lack of requirement for presenilin-dependent gamma-secretase complex. Journal of neurochemistry, 109(1), 225-37. [PubMed:19187441] [WorldCat] [DOI] - ↑
Li, X., Jiang, L., Huang, Y., Ren, Z., Liang, X., & Wang, P. (2020).
A gene dysfunction module reveals the underlying pathogenesis of hidradenitis suppurativa: An update. The Australasian journal of dermatology, 61(1), e10-e14. [PubMed:31266094] [WorldCat] [DOI]