「エストロゲン」の版間の差分
| (同じ利用者による、間の4版が非表示) | |||
| 40行目: | 40行目: | ||
脳はエストロゲンを合成する一方、末梢で合成されたエストロゲンが脳に供給され得る。このような生体におけるエストロゲン、およびエストロゲン合成の基質であるテストステロンの動態は、川戸らの研究グループによって研究されている<ref name=Hojo2009><pubmed>19589866</pubmed></ref>。オスラットの海馬におけるテストステロン濃度は17 nM、17β-エストラジオール濃度は8 nMであった。精巣摘出した[[ラット]]を用い比較したところ、海馬内のテストステロンの8割は血中から供給され,2割は海馬内で合成されることが明らかとなった。一方、メスでは海馬の17β-エストラジオール(1 nM)は血中17β-エストラジオール(0.1~0.01 nM)より10倍以上も濃度が高く、また、メスでは血中から海馬に入る17β-エストラジオールの寄与は非常に低く,海馬内合成が主である。海馬における17β-エストラジオール量はオスの方がメスより8倍も多く、性腺や血中での量比とは逆転している。これらの知見から、テストステロンは[[血液脳関門]]を透過する一方、17β-エストラジオールの血液脳関門透過性は低いと考えられる。なお、脳においてニューロンおよびアストロサイトが主に17β-エストラジオールを合成すると考えてられており、[[オリゴデンドロサイト]]や[[ミクログリア]]などの細胞種の17β-エストラジオール合成への寄与は小さい<ref name=Brann2022><pubmed>36552208</pubmed></ref>。 | 脳はエストロゲンを合成する一方、末梢で合成されたエストロゲンが脳に供給され得る。このような生体におけるエストロゲン、およびエストロゲン合成の基質であるテストステロンの動態は、川戸らの研究グループによって研究されている<ref name=Hojo2009><pubmed>19589866</pubmed></ref>。オスラットの海馬におけるテストステロン濃度は17 nM、17β-エストラジオール濃度は8 nMであった。精巣摘出した[[ラット]]を用い比較したところ、海馬内のテストステロンの8割は血中から供給され,2割は海馬内で合成されることが明らかとなった。一方、メスでは海馬の17β-エストラジオール(1 nM)は血中17β-エストラジオール(0.1~0.01 nM)より10倍以上も濃度が高く、また、メスでは血中から海馬に入る17β-エストラジオールの寄与は非常に低く,海馬内合成が主である。海馬における17β-エストラジオール量はオスの方がメスより8倍も多く、性腺や血中での量比とは逆転している。これらの知見から、テストステロンは[[血液脳関門]]を透過する一方、17β-エストラジオールの血液脳関門透過性は低いと考えられる。なお、脳においてニューロンおよびアストロサイトが主に17β-エストラジオールを合成すると考えてられており、[[オリゴデンドロサイト]]や[[ミクログリア]]などの細胞種の17β-エストラジオール合成への寄与は小さい<ref name=Brann2022><pubmed>36552208</pubmed></ref>。 | ||
== 受容体 == | == 受容体 == | ||
ヒトおよびマウスにおけるエストロゲン受容体 (estrogen receptor; ER)として、核内受容体型の[[ER&alpha | ヒトおよびマウスにおけるエストロゲン受容体 (estrogen receptor; ER)として、核内受容体型の[[ER&alpha]];と[[ERβ]]、ならびに[[Gタンパク質共役受容体]][[GPR30[[ ([[G protein-coupled receptor 30]])が知られている。これらの受容体は卵巣や子宮といった生殖器官に加えて脳、心臓および肝臓など様々な組織に発現している。脳では、ニューロン、アストロサイト、ミクログリア、オリゴデンドロサイトなど、ほぼすべての細胞種で発現が認められている。 | ||
[[ファイル:Ishihara Estrogen Fig2.png|サムネイル|'''図4. ERα、ERβの1次構造'''<br>文献<ref name=Muramatsu2000><pubmed>10733896</pubmed></ref>より引用。]] | [[ファイル:Ishihara Estrogen Fig2.png|サムネイル|'''図4. ERα、ERβの1次構造'''<br>文献<ref name=Muramatsu2000><pubmed>10733896</pubmed></ref>より引用。]] | ||
=== 核内受容体ER === | === 核内受容体ER === | ||
核内受容体のERαとERβは細胞内に局在している。細胞内のエストロゲンがERに結合すると、ERはホモ二量体(αα, ββ)あるいはヘテロ二量体(αβ)を形成して活性化する。活性化したER二量体はZnフィンガーモチーフを介してDNAに結合して遺伝子の転写を促進する('''図4''')。ERが認識する主なDNA配列はGGTCAnnnTGACCであり、[[エストロゲン応答エレメント]] (estrogen response element; ERE)と呼ばれる。ERの標的遺伝子には[[サイクリンD1]] ([[CCND1]])や[[トレフォイル因子1]] ([[trefoil factor 1]]; [[TFF1]])、[[核内受容体相互作用タンパク質1]] ([[nuclear receptor interacting protein 1]]; [[NRIP1]])、[[growth regulation by estrogen in breast cancer 1]] ([[GREB1]])などが存在する<ref name=Eeckhoute2006><pubmed>16980581</pubmed></ref><ref name=Lin2004><pubmed>15345050</pubmed></ref>。CCND1は広く細胞の増殖を促進し、TFF1は乳がん細胞の浸潤<ref name=Prest2002><pubmed>11919164</pubmed></ref>、NRIP1は乳腺の発達<ref name=Lapierre2015><pubmed>26116758</pubmed></ref>、GREB1は乳がん細胞の増殖に関わる<ref name=Hodgkinson2018><pubmed>29973689</pubmed></ref>。エストロゲンは[[骨代謝]]にも重要であり、骨代謝過程においてエストロゲン依存的な制御を受けるタンパク質群も同定されている<ref name=Pastorelli2005><pubmed>16237733</pubmed></ref> | 核内受容体のERαとERβは細胞内に局在している。細胞内のエストロゲンがERに結合すると、ERはホモ二量体(αα, ββ)あるいはヘテロ二量体(αβ)を形成して活性化する。活性化したER二量体はZnフィンガーモチーフを介してDNAに結合して遺伝子の転写を促進する('''図4''')。ERが認識する主なDNA配列はGGTCAnnnTGACCであり、[[エストロゲン応答エレメント]] (estrogen response element; ERE)と呼ばれる。ERの標的遺伝子には[[サイクリンD1]] ([[CCND1]])や[[トレフォイル因子1]] ([[trefoil factor 1]]; [[TFF1]])、[[核内受容体相互作用タンパク質1]] ([[nuclear receptor interacting protein 1]]; [[NRIP1]])、[[growth regulation by estrogen in breast cancer 1]] ([[GREB1]])などが存在する<ref name=Eeckhoute2006><pubmed>16980581</pubmed></ref><ref name=Lin2004><pubmed>15345050</pubmed></ref>。CCND1は広く細胞の増殖を促進し、TFF1は乳がん細胞の浸潤<ref name=Prest2002><pubmed>11919164</pubmed></ref>、NRIP1は乳腺の発達<ref name=Lapierre2015><pubmed>26116758</pubmed></ref>、GREB1は乳がん細胞の増殖に関わる<ref name=Hodgkinson2018><pubmed>29973689</pubmed></ref>。エストロゲンは[[骨代謝]]にも重要であり、骨代謝過程においてエストロゲン依存的な制御を受けるタンパク質群も同定されている<ref name=Pastorelli2005><pubmed>16237733</pubmed></ref>。また、ERはSERMやNCoRをリクルートして転写のリプレッサーとしても機能することが報告されている<ref name=Huang2002><pubmed>12145334</pubmed></ref><ref name=Shang2000><pubmed>11136970</pubmed></ref>。 | ||
EREを介したER依存的な経路が[[古典的経路]] ([[classical pathway]])と称される一方で、[[非古典的経路]] ([[non-classical pathway]])もいくつか報告されている。[[セカンドメッセンジャー]]を介したリガンド非依存的なERの活性化や膜に局在するERを介したシグナル伝達、ERと他の[[転写因子]]、例えば、[[活性化タンパク質1]] ([[activator protein 1]] | EREを介したER依存的な経路が[[古典的経路]] ([[classical pathway]])と称される一方で、[[非古典的経路]] ([[non-classical pathway]])もいくつか報告されている。[[セカンドメッセンジャー]]を介したリガンド非依存的なERの活性化や膜に局在するERを介したシグナル伝達、ERと他の[[転写因子]]、例えば、[[活性化タンパク質1]] ([[activator protein 1]]([[AP-1]])や[[specificity protein 1]] ([[Sp1]])、[[核内因子κB]] ([[nuclear factor-κB]]; [[NF-κB]])との相互作用を介して、ERE非依存的に遺伝子発現を制御する経路が示されている<ref name=McDevitt2008><pubmed>18534740</pubmed></ref>。 | ||
=== Gタンパク質共役受容体GPR30 === | === Gタンパク質共役受容体GPR30 === | ||
Gタンパク質共役受容体である[[GPR30]]は[[細胞膜]]に局在し、17β-エストラジオールに対して高い親和性を示す。17β-エストラジオールに結合したGPR30は[[環状アデノシン一リン酸]] ([[cyclic adenosine monophosphate]]; [[cAMP]])や[[細胞外シグナル調節キナーゼ]] ([[extracellular signal-regulated kinase]]; [[ERK]])を介した[[細胞内情報伝達]]を制御することが示されている<ref name=Filardo2000><pubmed>11043579</pubmed></ref><ref name=Maggiolini2010><pubmed>19767412</pubmed></ref>。 | |||
== ニューロステロイドとしての機能 == | == ニューロステロイドとしての機能 == | ||
| 60行目: | 60行目: | ||
また、17β-エストラジオールと[[長期増強]]([[LTP]])との関連も報告されている。雄ラットの海馬スライスにレトロゾールを処置すると、海馬[[CA1]]領域のLTPの振幅が60%減少する一方、ベースラインには影響しない<ref name=Grassi2011><pubmed>21749911</pubmed></ref>。レトロゾールは、脳内でテストステロンを増加させる可能性があるが、Tozziらは、アンドロゲン受容体阻害薬が雄ラットから調製した海馬切片のLTPに影響を及ぼさないことを示している<ref name=Tozzi2019><pubmed>31866827</pubmed></ref>。従って、17β-エストラジオールは海馬CA1錐体細胞層に作用して、LTPに影響すると考えられる。 | また、17β-エストラジオールと[[長期増強]]([[LTP]])との関連も報告されている。雄ラットの海馬スライスにレトロゾールを処置すると、海馬[[CA1]]領域のLTPの振幅が60%減少する一方、ベースラインには影響しない<ref name=Grassi2011><pubmed>21749911</pubmed></ref>。レトロゾールは、脳内でテストステロンを増加させる可能性があるが、Tozziらは、アンドロゲン受容体阻害薬が雄ラットから調製した海馬切片のLTPに影響を及ぼさないことを示している<ref name=Tozzi2019><pubmed>31866827</pubmed></ref>。従って、17β-エストラジオールは海馬CA1錐体細胞層に作用して、LTPに影響すると考えられる。 | ||
遺伝子発現変化を伴わないnon-genomic signaling pathwaysおよび遺伝子発現変化を伴うgenomic signaling pathwaysの双方が17β-エストラジオールによるシナプスの構造形成や機能の調節に関わっている。Non-genomic signaling pathwaysにおいて、[[Ak strain transforming]] ([[Akt]])シグナル([[プロテインキナーゼB]])やERKシグナルを中心としたリン酸化シグナルが主要なメカニズムであると考えられている<ref name=Levenga2017><pubmed>29173281</pubmed></ref><ref name=Mao2016><pubmed>26567109</pubmed></ref><ref name=Sweatt2001><pubmed>11145972</pubmed></ref>。一方、17β-エストラジオールは[[サイクリックAMP応答配列結合タンパク質]] ([[cAMP responsive element binding protein]]; [[CREB]])の活性化を介して[[脳由来神経栄養因子]] ([[brain-derived neurotrophic factor]]; [[BDNF]])や[[ | 遺伝子発現変化を伴わないnon-genomic signaling pathwaysおよび遺伝子発現変化を伴うgenomic signaling pathwaysの双方が17β-エストラジオールによるシナプスの構造形成や機能の調節に関わっている。Non-genomic signaling pathwaysにおいて、[[Ak strain transforming]] ([[Akt]])シグナル([[プロテインキナーゼB]])やERKシグナルを中心としたリン酸化シグナルが主要なメカニズムであると考えられている<ref name=Levenga2017><pubmed>29173281</pubmed></ref><ref name=Mao2016><pubmed>26567109</pubmed></ref><ref name=Sweatt2001><pubmed>11145972</pubmed></ref>。一方、17β-エストラジオールは[[サイクリックAMP応答配列結合タンパク質]] ([[cAMP responsive element binding protein]]; [[CREB]])の活性化を介して[[脳由来神経栄養因子]] ([[brain-derived neurotrophic factor]]; [[BDNF]])や[[PDS-95]]の発現を増大させ、[[シナプス可塑性]]を調節することも示唆されている<ref name=Lu2019><pubmed>30728170</pubmed></ref>。 | ||
=== 認知機能 === | === 認知機能 === | ||
2025年3月30日 (日) 19:10時点における版
| エストロゲン | |
|---|---|
| Drug class | |
 Estradiol, the major estrogen sex hormone in humans and a widely used medication | |
| Class identifiers | |
| Use | Contraception, menopause, hypogonadism, transgender women, prostate cancer, breast cancer, others |
| ATC code | G03C |
| Biological target | Estrogen receptors (ERα, ERβ, mERs (e.g., GPER, others)) |
| External links | |
| MeSH | D004967 |
| Legal status | |
中根 達人、石原 康宏
広島大学 大学院統合生命科学研究科 生命医科学プログラム
DOI:10.14931/bsd.1023 原稿受付日:2025年3月24日 原稿完成日:2025年3月27日
担当編集委員:古屋敷 智之(神戸大学大学院医学研究科・医学部 薬理学分野)
英:estrogen, oestrogen 独:Estrogene, Östrogene 仏:estrogène, Œstrogène
エストロゲンは、エストロン、エストラジオール、エストリオールの3種類からなり、女性ホルモンと呼ばれる。女性生殖腺(卵巣)から分泌され、女性化や二次性徴に役割を果たすことが知られている。一方、最近、脳がエストロゲンの標的であること、さらには脳でエストロゲンが合成されることが明らかとなり、ニューロステロイドとしてのエストロゲンの作用解析が進んでいる。エストロゲンが、性行動や記憶、学習、神経保護に重要な役割を果たすことが明らかになりつつある。
Structures of major endogenous estrogens
水酸基の位置と数に注意。Wikipediaより。 |
エストロゲンとは
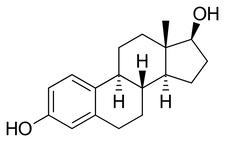
ステロイドホルモンのひとつであり、女性において盛んに分泌され、生殖器官の発達や維持に関与していることから女性ホルモンとして機能している。エストロン (E1)、17β-エストラジオール (E2)ならびにエストリオール (E3)の3種が主なエストロゲンである(図1)。中でも17β-エストラジオールが最も活性が強く、生体におけるエストロゲン活性の大半は17β-エストラジオールによって媒介される。合成は主に卵巣で行われるが、副腎や脂肪組織、精巣でも行われており、女性だけでなく男性においてもエストロゲンは合成されている。合成されたエストロゲンは分泌され、細胞に取り込まれ、核内受容体であるエストロゲン受容体(estrogen receptor; ER)に結合する。エストロゲンが結合したエストロゲン受容体は二量体を形成し、DNAに結合して特定の遺伝子の転写を活性化する。また、エストロゲンは抗酸化作用を有し、神経細胞において酸化ストレスやアポトーシスに対する保護作用を示すことが報告されており[1][2]、エストロゲンの生理作用は多岐にわたる。
典型的なニューロステロイドを太線の四角で示す。破線矢印は、ヒトにおけるback-door pathwayである。estrone-S, estrone sulfate; P4502D, シトクロームP450 2D4(ラット)あるいは2D6(ヒト); RDH, レチノールデヒドロゲナーゼ。文献[3]より引用。
合成
卵巣におけるエストロゲンの合成は、脳によって調節されている。視床下部から分泌された性腺刺激ホルモン放出ホルモン (gonadotropin-releasing hormone; GnRH)が下垂体前葉に作用し、性腺刺激ホルモン (gonadotropins)の分泌が促進される。そして、性腺刺激ホルモンである卵胞刺激ホルモン (follicle-stimulating hormone; FSH)と黄体形成ホルモン (luteinizing hormone; LH)が卵巣におけるエストロゲン合成を促進する。
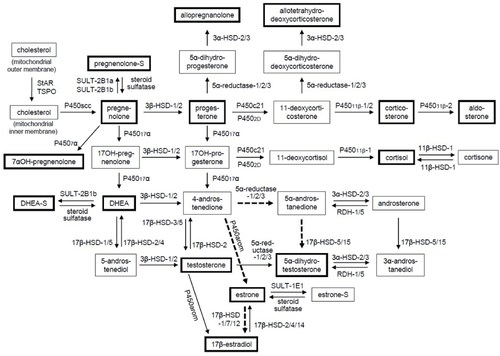
エストロゲンの合成経路を図2に示す。コレステロールを起点とした複数の経路が存在する[4]。コレステロールの側鎖が切断されて産生したプレグネノロンがプロゲステロンまたは17α-ヒドロキシプレグネノロンに変換され、17α-ヒドロキシプロゲステロンが合成される。そして、17α-ヒドロキシプロゲステロンからアンドロステンジオンが生成された後にエストロンが合成される。さらに、エストロンは17β-エストラジオールに変換される。また、シトクロムP450アロマターゼ(CYP19A1)を介した経路では、アンドロステンジオンからテストステロンに、テストステロンから17β-エストラジオールがそれぞれ合成される。その際、シトクロムP450アロマターゼは、3分子のNADPHと酸素を消費し、1分子の17β-エストラジオールを生成する[5]。最近、テストステロンを介さずに17β-エストラジオールが合成されるback-door pathwayも示されている(図2)。
未翻訳の第一エクソンにおける組織特異的なプロモーターが組織特異的な転写産物に寄与する。プロモーター1.fが脳特異的なプロモーターと考えられている。
脳における合成
脳においても、末梢と同様、17β-エストラジオールはシトクロムP450アロマターゼによってテストステロンから合成される。
副腎と生殖腺に存在するステロイドホルモン合成に関与する酵素のほとんどが脳でも発現している[6][7]。例えば、steroidogenic acute regulatory protein(StAR)、translocator protein(TSPO)、コレステロールモノオキシゲナーゼ (側鎖開裂) (cholesterol side-chain cleavage enzyme; シトクロムP450scc)、シトクロムP450 17α、シトクロムP450アロマターゼ、および3β-ヒドロキシ-Δ⁵-ステロイドデヒドロゲナーゼ (3β-hydroxy-Δ⁵-steroid dehydrogenase, 3β-HSD)と17β-ヒドロキシステロイドデヒドロゲナーゼ (17β-hydroxysteroid dehydrogenases, 17β-HSD)の複数のサブタイプがヒトおよびげっ歯類の脳で検出されている[6][7][8]。一方、転写産物の相対数は小さく、StAR ではウシ副腎の 1/100 ~ 1/200 程度、シトクロムP450sccでは 1/200,000 未満、シトクロムP450 17αおよび 3β-HSD では 1/10,000 ~ 1/20,000 程度である [9]。
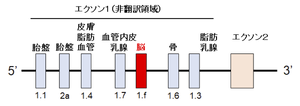
シトクロムP450アロマターゼは、ヒト15番染色体のq21.2領域に1つの遺伝子としてコードされている。生殖腺、骨、乳腺、脂肪、血管、皮膚、胎盤、脳など、多くの組織で発現しているが、スプライシングにより組織特異的な転写産物が生じる。mRNA非翻訳領域をコードする第一エクソンにおける組織特異的なプロモーターが、シトクロムP450アロマターゼの組織特異的な転写に寄与する。プロモーター1.fが脳特異的プロモーターであると考えられている(図3)。尚、すべての転写産物が同一のタンパク質に翻訳される。
脳はエストロゲンを合成する一方、末梢で合成されたエストロゲンが脳に供給され得る。このような生体におけるエストロゲン、およびエストロゲン合成の基質であるテストステロンの動態は、川戸らの研究グループによって研究されている[10]。オスラットの海馬におけるテストステロン濃度は17 nM、17β-エストラジオール濃度は8 nMであった。精巣摘出したラットを用い比較したところ、海馬内のテストステロンの8割は血中から供給され,2割は海馬内で合成されることが明らかとなった。一方、メスでは海馬の17β-エストラジオール(1 nM)は血中17β-エストラジオール(0.1~0.01 nM)より10倍以上も濃度が高く、また、メスでは血中から海馬に入る17β-エストラジオールの寄与は非常に低く,海馬内合成が主である。海馬における17β-エストラジオール量はオスの方がメスより8倍も多く、性腺や血中での量比とは逆転している。これらの知見から、テストステロンは血液脳関門を透過する一方、17β-エストラジオールの血液脳関門透過性は低いと考えられる。なお、脳においてニューロンおよびアストロサイトが主に17β-エストラジオールを合成すると考えてられており、オリゴデンドロサイトやミクログリアなどの細胞種の17β-エストラジオール合成への寄与は小さい[11]。
受容体
ヒトおよびマウスにおけるエストロゲン受容体 (estrogen receptor; ER)として、核内受容体型のERαとERβ、ならびにGタンパク質共役受容体[[GPR30[[ (G protein-coupled receptor 30)が知られている。これらの受容体は卵巣や子宮といった生殖器官に加えて脳、心臓および肝臓など様々な組織に発現している。脳では、ニューロン、アストロサイト、ミクログリア、オリゴデンドロサイトなど、ほぼすべての細胞種で発現が認められている。
文献[12]より引用。
核内受容体ER
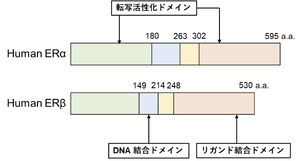
核内受容体のERαとERβは細胞内に局在している。細胞内のエストロゲンがERに結合すると、ERはホモ二量体(αα, ββ)あるいはヘテロ二量体(αβ)を形成して活性化する。活性化したER二量体はZnフィンガーモチーフを介してDNAに結合して遺伝子の転写を促進する(図4)。ERが認識する主なDNA配列はGGTCAnnnTGACCであり、エストロゲン応答エレメント (estrogen response element; ERE)と呼ばれる。ERの標的遺伝子にはサイクリンD1 (CCND1)やトレフォイル因子1 (trefoil factor 1; TFF1)、核内受容体相互作用タンパク質1 (nuclear receptor interacting protein 1; NRIP1)、growth regulation by estrogen in breast cancer 1 (GREB1)などが存在する[13][14]。CCND1は広く細胞の増殖を促進し、TFF1は乳がん細胞の浸潤[15]、NRIP1は乳腺の発達[16]、GREB1は乳がん細胞の増殖に関わる[17]。エストロゲンは骨代謝にも重要であり、骨代謝過程においてエストロゲン依存的な制御を受けるタンパク質群も同定されている[18]。また、ERはSERMやNCoRをリクルートして転写のリプレッサーとしても機能することが報告されている[19][20]。
EREを介したER依存的な経路が古典的経路 (classical pathway)と称される一方で、非古典的経路 (non-classical pathway)もいくつか報告されている。セカンドメッセンジャーを介したリガンド非依存的なERの活性化や膜に局在するERを介したシグナル伝達、ERと他の転写因子、例えば、活性化タンパク質1 (activator protein 1(AP-1)やspecificity protein 1 (Sp1)、核内因子κB (nuclear factor-κB; NF-κB)との相互作用を介して、ERE非依存的に遺伝子発現を制御する経路が示されている[21]。
Gタンパク質共役受容体GPR30
Gタンパク質共役受容体であるGPR30は細胞膜に局在し、17β-エストラジオールに対して高い親和性を示す。17β-エストラジオールに結合したGPR30は環状アデノシン一リン酸 (cyclic adenosine monophosphate; cAMP)や細胞外シグナル調節キナーゼ (extracellular signal-regulated kinase; ERK)を介した細胞内情報伝達を制御することが示されている[22][23]。
ニューロステロイドとしての機能
脳の性差と性行動
産まれてすぐに去勢したラットにエストロゲンを投与すると、雄の性行動が誘導される一方で、ゴナドトロピンの分泌と雌の性行動が抑制されることが示された[24]。この知見から、脳の性分化が、精巣由来のアンドロゲンが脳内でエストロゲンへ変換されることによって起こることが示唆された。シトクロムP450アロマターゼは性的二型核で高度に発現しており[25][26]、これら脳領域でテストステロンをエストロゲンに変換することによって、男性化や男性特有の性行動に寄与すると考えられている[27]。しかし、このメカニズムは鳥類やげっ歯類の研究結果を基に提唱されたものであり、ヒトなどの霊長類に拡張できるかについてはまだ議論がある。
シナプスの構造と機能
17β-エストラジオールは、シナプスの構造や機能の調節において重要な役割を果たしていると考えられている。Runeらの研究グループは、in vitroで培養したラット海馬切片をシトクロムP450アロマターゼ阻害薬であるレトロゾールで処置して17β-エストラジオールを減少させると、スパインやシナプスの密度が減少し、シナプス前タンパク質シナプトフィジンとシナプス後タンパク質スピノフィリンの発現が低下することを示した[28]。レトロゾール処置によるシナプトフィジンとスピノフィリンの減少は、メスマウスの海馬においても観察されている[29]。
また、17β-エストラジオールと長期増強(LTP)との関連も報告されている。雄ラットの海馬スライスにレトロゾールを処置すると、海馬CA1領域のLTPの振幅が60%減少する一方、ベースラインには影響しない[30]。レトロゾールは、脳内でテストステロンを増加させる可能性があるが、Tozziらは、アンドロゲン受容体阻害薬が雄ラットから調製した海馬切片のLTPに影響を及ぼさないことを示している[31]。従って、17β-エストラジオールは海馬CA1錐体細胞層に作用して、LTPに影響すると考えられる。
遺伝子発現変化を伴わないnon-genomic signaling pathwaysおよび遺伝子発現変化を伴うgenomic signaling pathwaysの双方が17β-エストラジオールによるシナプスの構造形成や機能の調節に関わっている。Non-genomic signaling pathwaysにおいて、Ak strain transforming (Akt)シグナル(プロテインキナーゼB)やERKシグナルを中心としたリン酸化シグナルが主要なメカニズムであると考えられている[32][33][34]。一方、17β-エストラジオールはサイクリックAMP応答配列結合タンパク質 (cAMP responsive element binding protein; CREB)の活性化を介して脳由来神経栄養因子 (brain-derived neurotrophic factor; BDNF)やPDS-95の発現を増大させ、シナプス可塑性を調節することも示唆されている[35]。
認知機能
1996年、Lancet誌に、閉経後の女性にエストロゲンを投与すると、アルツハイマー病発症のリスクが低下するとの論文が掲載され、エストロゲンと認知機能との関連性がとりわけ注目される契機となった[36]。また、乳がん患者におけるシトクロムP450アロマターゼ阻害剤治療に係る知見から、エストロゲンが言語および視覚学習/記憶、実行機能、処理速度に重要であることが示唆された[37][38][39][40]。また、シトクロムP450アロマターゼ阻害薬による記憶障害が可逆的であることも明らかとなった。げっ歯類を用いてより直接的な研究が実施されており、例えば、雄および雌のラットに 14日間レトロゾールを脳室内投与したところ、海馬17β-エストラジオール濃度が低下し、海馬錐体ニューロンの発火頻度が減少した。またこのとき、作業記憶と新規物体認識記憶にレトロゾール用量依存的な障害が生じた[41]。同様に、雄および雌のマウスにレトロゾールを投与すると、空間記憶障害が生じた[42]。さらに、レトロゾール投与により記憶の固定が損なわれたマウスに外因的にE2を補充すると、記憶が回復する[43]。これらの知見から、17β-エストラジオールは記憶や学習に役割を果たしていると考えらえている。
文献[44]を改変
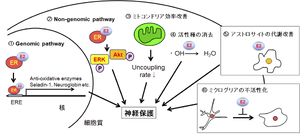
神経保護
エストロゲンは、アルツハイマー病やパーキンソン病、脳梗塞など、様々な要因により生じる神経障害に対して保護作用を有していることが知られている[45]。17β-エストラジオールによる神経保護メカニズムの概要を図5に示した。エストロゲンの神経保護メカニズムはgenomic signaling pathwaysとnon-genomic signaling pathwaysに大別される。
Genomic signaling pathways(図5①)に関与する、17β-エストラジオールによる神経保護を媒介する遺伝子群について表1に示した。17β-エストラジオールは酸化ストレスやアポトーシス、炎症に関連する遺伝子の発現を制御することにより神経保護作用を示す。
17β-エストラジオールによるnon-genomic signaling pathwaysを介した神経保護には、主にキナーゼ経路が関わると考えられている(図5②)。ERK経路の活性化や[46]Akt経路の活性化[47]、Wntシグナル伝達の調節[48]などがメカニズムである。
また、17β-エストラジオールはミトコンドリア効率の改善(図5③)[49]や活性酸素種(図5④)などの高反応性化学物質の直接消去も行う[50]。さらに、アストロサイトのグルタミン酸動態に干渉したり[51](図5⑤)、ミクログリアの炎症反応を抑制したりと[52](図5⑥)、多種多様なメカニズムにより神経保護に役割を果たす。
| 標的遺伝子(発現変化) | 作用 |
|---|---|
| スーパーオキシドジスムターゼ1 (SOD1) (↑) | 活性酸素種の除去 |
| スーパーオキシドジスムターゼ2 (SOD2)(↑) | 活性酸素種の除去 |
| グルタチオンペルオキシダーゼ (GPx) (↑) | 活性酸素種の除去 |
| カタラーゼ (↑) | 活性酸素種の除去 |
| 誘導型一酸化窒素合成酵素 (iNOS) (↓) | 反応性ラジカルの減少 |
| 神経型一酸化窒素合成酵素 (nNOS) (↓) | 反応性ラジカルの減少 |
| グルタチオン-S-トランスフェラーゼ (GST) (↑) | 活性酸素種由来反応性代謝物の除去 |
| NAD(P)Hキノンオキシドレダクターゼ1 (NQO1) (↑) | 活性酸素種由来反応性代謝物の除去 |
| セラジン-1 (↑) | 抗アポトーシス |
| ニューログロブリン (↑) | 抗アポトーシス、抗炎症 |
| インターロイキン-6 (↓) | 抗炎症 |
| インターフェロンガンマ誘導性タンパク質10 (IP-10 )(↓) | 抗炎症 |
| マトリックスメタロプロテイナーゼ-9 (MMP-9) (↓) | 抗炎症 |
| シトクロムc酸化酵素 (↑) | ミトコンドリア効率の増大 |
| Bax(↓) | 抗アポトーシス |
文献[44]より引用
関連項目
参考文献
- ↑
Ishihara, Y., Sakurai, H., Oguro, A., Tsuji, M., Vogel, C.F.A., & Yamazaki, T. (2019).
Retinoid X receptor-mediated neuroprotection via CYP19 upregulation and subsequent increases in estradiol synthesis. The Journal of steroid biochemistry and molecular biology, 193, 105421. [PubMed:31265900] [WorldCat] [DOI] - ↑
Sawada, H., Ibi, M., Kihara, T., Urushitani, M., Akaike, A., & Shimohama, S. (1998).
Estradiol protects mesencephalic dopaminergic neurons from oxidative stress-induced neuronal death. Journal of neuroscience research, 54(5), 707-19. [PubMed:9843162] [WorldCat] [DOI] - ↑ Yamazaki T., Ishihara Y. (2014).
Chapter 9 Neurosteroids: Regional Steroidogenesis. In: Hiroshi Yamazaki, editor. Fifty Years of Cytochrome P450 Research. Tokyo: Springer; 2014. p. 153 - 73. - ↑
Samavat, H., & Kurzer, M.S. (2015).
Estrogen metabolism and breast cancer. Cancer letters, 356(2 Pt A), 231-43. [PubMed:24784887] [PMC] [WorldCat] [DOI] - ↑
RYAN, K.J. (1959).
Biological aromatization of steroids. The Journal of biological chemistry, 234(2), 268-72. [PubMed:13630892] [WorldCat] - ↑ 6.0 6.1
Compagnone, N.A., & Mellon, S.H. (2000).
Neurosteroids: biosynthesis and function of these novel neuromodulators. Frontiers in neuroendocrinology, 21(1), 1-56. [PubMed:10662535] [WorldCat] [DOI] - ↑ 7.0 7.1
Do Rego, J.L., Seong, J.Y., Burel, D., Leprince, J., Luu-The, V., Tsutsui, K., ..., & Vaudry, H. (2009).
Neurosteroid biosynthesis: enzymatic pathways and neuroendocrine regulation by neurotransmitters and neuropeptides. Frontiers in neuroendocrinology, 30(3), 259-301. [PubMed:19505496] [WorldCat] [DOI] - ↑
Munetsuna, E., Hojo, Y., Hattori, M., Ishii, H., Kawato, S., Ishida, A., ..., & Yamazaki, T. (2009).
Retinoic acid stimulates 17beta-estradiol and testosterone synthesis in rat hippocampal slice cultures. Endocrinology, 150(9), 4260-9. [PubMed:19497980] [WorldCat] [DOI] - ↑
Yamazaki, T., Shimodaira, M., Kuwahara, H., Wakatsuki, H., Horiuchi, H., Matsuda, H., & Kominami, S. (2005).
Tributyltin disturbs bovine adrenal steroidogenesis by two modes of action. Steroids, 70(14), 913-21. [PubMed:16038956] [WorldCat] [DOI] - ↑
Hojo, Y., Higo, S., Ishii, H., Ooishi, Y., Mukai, H., Murakami, G., ..., & Kawato, S. (2009).
Comparison between hippocampus-synthesized and circulation-derived sex steroids in the hippocampus. Endocrinology, 150(11), 5106-12. [PubMed:19589866] [WorldCat] [DOI] - ↑
Brann, D.W., Lu, Y., Wang, J., Sareddy, G.R., Pratap, U.P., Zhang, Q., ..., & Vadlamudi, R.K. (2022).
Brain-Derived Estrogen and Neurological Disorders. Biology, 11(12). [PubMed:36552208] [PMC] [WorldCat] [DOI] - ↑
Muramatsu, M., & Inoue, S. (2000).
Estrogen receptors: how do they control reproductive and nonreproductive functions? Biochemical and biophysical research communications, 270(1), 1-10. [PubMed:10733896] [WorldCat] [DOI] - ↑
Eeckhoute, J., Carroll, J.S., Geistlinger, T.R., Torres-Arzayus, M.I., & Brown, M. (2006).
A cell-type-specific transcriptional network required for estrogen regulation of cyclin D1 and cell cycle progression in breast cancer. Genes & development, 20(18), 2513-26. [PubMed:16980581] [PMC] [WorldCat] [DOI] - ↑
Lin, C.Y., Ström, A., Vega, V.B., Kong, S.L., Yeo, A.L., Thomsen, J.S., ..., & Liu, E.T. (2004).
Discovery of estrogen receptor alpha target genes and response elements in breast tumor cells. Genome biology, 5(9), R66. [PubMed:15345050] [PMC] [WorldCat] [DOI] - ↑
Prest, S.J., May, F.E., & Westley, B.R. (2002).
The estrogen-regulated protein, TFF1, stimulates migration of human breast cancer cells. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 16(6), 592-4. [PubMed:11919164] [WorldCat] [DOI] - ↑
Lapierre, M., Docquier, A., Castet-Nicolas, A., Gitenay, D., Jalaguier, S., Teyssier, C., & Cavaillès, V. (2015).
The emerging role of the transcriptional coregulator RIP140 in solid tumors. Biochimica et biophysica acta, 1856(1), 144-50. [PubMed:26116758] [WorldCat] [DOI] - ↑
Hodgkinson, K., Forrest, L.A., Vuong, N., Garson, K., Djordjevic, B., & Vanderhyden, B.C. (2018).
GREB1 is an estrogen receptor-regulated tumour promoter that is frequently expressed in ovarian cancer. Oncogene, 37(44), 5873-5886. [PubMed:29973689] [PMC] [WorldCat] [DOI] - ↑
Pastorelli, R., Carpi, D., Airoldi, L., Chiabrando, C., Bagnati, R., Fanelli, R., ..., & Ohlsson, C. (2005).
Proteome analysis for the identification of in vivo estrogen-regulated proteins in bone. Proteomics, 5(18), 4936-45. [PubMed:16237733] [WorldCat] [DOI] - ↑
Huang, H.J., Norris, J.D., & McDonnell, D.P. (2002).
Identification of a negative regulatory surface within estrogen receptor alpha provides evidence in support of a role for corepressors in regulating cellular responses to agonists and antagonists. Molecular endocrinology (Baltimore, Md.), 16(8), 1778-92. [PubMed:12145334] [WorldCat] [DOI] - ↑
Shang, Y., Hu, X., DiRenzo, J., Lazar, M.A., & Brown, M. (2000).
Cofactor dynamics and sufficiency in estrogen receptor-regulated transcription. Cell, 103(6), 843-52. [PubMed:11136970] [WorldCat] [DOI] - ↑
McDevitt, M.A., Glidewell-Kenney, C., Jimenez, M.A., Ahearn, P.C., Weiss, J., Jameson, J.L., & Levine, J.E. (2008).
New insights into the classical and non-classical actions of estrogen: evidence from estrogen receptor knock-out and knock-in mice. Molecular and cellular endocrinology, 290(1-2), 24-30. [PubMed:18534740] [PMC] [WorldCat] [DOI] - ↑
Filardo, E.J., Quinn, J.A., Bland, K.I., & Frackelton, A.R. (2000).
Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptor homolog, GPR30, and occurs via trans-activation of the epidermal growth factor receptor through release of HB-EGF. Molecular endocrinology (Baltimore, Md.), 14(10), 1649-60. [PubMed:11043579] [WorldCat] [DOI] - ↑
Maggiolini, M., & Picard, D. (2010).
The unfolding stories of GPR30, a new membrane-bound estrogen receptor. The Journal of endocrinology, 204(2), 105-14. [PubMed:19767412] [WorldCat] [DOI] - ↑
Booth, J.E. (1977).
Sexual behaviour of neonatally castrated rats injected during infancy with oestrogen and dihydrotestosterone. The Journal of endocrinology, 72(2), 135-41. [PubMed:845532] [WorldCat] [DOI] - ↑
Sasano, H., Takashashi, K., Satoh, F., Nagura, H., & Harada, N. (1998).
Aromatase in the human central nervous system. Clinical endocrinology, 48(3), 325-9. [PubMed:9578823] [WorldCat] [DOI] - ↑
Selmanoff, M.K., Brodkin, L.D., Weiner, R.I., & Siiteri, P.K. (1977).
Aromatization and 5alpha-reduction of androgens in discrete hypothalamic and limbic regions of the male and female rat. Endocrinology, 101(3), 841-8. [PubMed:891467] [WorldCat] [DOI] - ↑
McCarthy, M.M. (2008).
Estradiol and the developing brain. Physiological reviews, 88(1), 91-124. [PubMed:18195084] [PMC] [WorldCat] [DOI] - ↑
Kretz, O., Fester, L., Wehrenberg, U., Zhou, L., Brauckmann, S., Zhao, S., ..., & Rune, G.M. (2004).
Hippocampal synapses depend on hippocampal estrogen synthesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(26), 5913-21. [PubMed:15229239] [PMC] [WorldCat] [DOI] - ↑
Zhou, L., Fester, L., von Blittersdorff, B., Hassu, B., Nogens, H., Prange-Kiel, J., ..., & Rune, G.M. (2010).
Aromatase inhibitors induce spine synapse loss in the hippocampus of ovariectomized mice. Endocrinology, 151(3), 1153-60. [PubMed:20097718] [WorldCat] [DOI] - ↑
Grassi, S., Tozzi, A., Costa, C., Tantucci, M., Colcelli, E., Scarduzio, M., ..., & Pettorossi, V.E. (2011).
Neural 17β-estradiol facilitates long-term potentiation in the hippocampal CA1 region. Neuroscience, 192, 67-73. [PubMed:21749911] [WorldCat] [DOI] - ↑
Tozzi, A., Durante, V., Manca, P., Di Mauro, M., Blasi, J., Grassi, S., ..., & Pettorossi, V.E. (2019).
Bidirectional Synaptic Plasticity Is Driven by Sex Neurosteroids Targeting Estrogen and Androgen Receptors in Hippocampal CA1 Pyramidal Neurons. Frontiers in cellular neuroscience, 13, 534. [PubMed:31866827] [PMC] [WorldCat] [DOI] - ↑
Levenga, J., Wong, H., Milstead, R.A., Keller, B.N., LaPlante, L.E., & Hoeffer, C.A. (2017).
AKT isoforms have distinct hippocampal expression and roles in synaptic plasticity. eLife, 6. [PubMed:29173281] [PMC] [WorldCat] [DOI] - ↑
Mao, L.M., & Wang, J.Q. (2016).
Synaptically Localized Mitogen-Activated Protein Kinases: Local Substrates and Regulation. Molecular neurobiology, 53(9), 6309-6315. [PubMed:26567109] [PMC] [WorldCat] [DOI] - ↑
Sweatt, J.D. (2001).
The neuronal MAP kinase cascade: a biochemical signal integration system subserving synaptic plasticity and memory. Journal of neurochemistry, 76(1), 1-10. [PubMed:11145972] [WorldCat] [DOI] - ↑
Lu, Y., Sareddy, G.R., Wang, J., Wang, R., Li, Y., Dong, Y., ..., & Brann, D.W. (2019).
Neuron-Derived Estrogen Regulates Synaptic Plasticity and Memory. The Journal of neuroscience : the official journal of the Society for Neuroscience, 39(15), 2792-2809. [PubMed:30728170] [PMC] [WorldCat] [DOI] - ↑
Tang, M.X., Jacobs, D., Stern, Y., Marder, K., Schofield, P., Gurland, B., ..., & Mayeux, R. (1996).
Effect of oestrogen during menopause on risk and age at onset of Alzheimer's disease. Lancet (London, England), 348(9025), 429-32. [PubMed:8709781] [WorldCat] [DOI] - ↑
Bender, C.M., Sereika, S.M., Brufsky, A.M., Ryan, C.M., Vogel, V.G., Rastogi, P., ..., & Berga, S.L. (2007).
Memory impairments with adjuvant anastrozole versus tamoxifen in women with early-stage breast cancer. Menopause (New York, N.Y.), 14(6), 995-8. [PubMed:17898668] [PMC] [WorldCat] [DOI] - ↑
Phillips, K.A., Aldridge, J., Ribi, K., Sun, Z., Thompson, A., Harvey, V., ..., & Bernhard, J. (2011).
Cognitive function in postmenopausal breast cancer patients one year after completing adjuvant endocrine therapy with letrozole and/or tamoxifen in the BIG 1-98 trial. Breast cancer research and treatment, 126(1), 221-6. [PubMed:21046229] [PMC] [WorldCat] [DOI] - ↑
Rocha-Cadman, X., Massie, M.J., & Du Hamel, K. (2012).
Aromatase inhibitors and mood disturbances. Palliative & supportive care, 10(3), 225-7. [PubMed:22677000] [PMC] [WorldCat] [DOI] - ↑
Underwood, E.A., Rochon, P.A., Moineddin, R., Lee, P.E., Wu, W., Pritchard, K.I., & Tierney, M.C. (2018).
Cognitive sequelae of endocrine therapy in women treated for breast cancer: a meta-analysis. Breast cancer research and treatment, 168(2), 299-310. [PubMed:29264751] [WorldCat] [DOI] - ↑
Marbouti, L., Zahmatkesh, M., Riahi, E., & Sadr, S.S. (2020).
Inhibition of brain 17β-estradiol synthesis by letrozole induces cognitive decline in male and female rats. Neurobiology of learning and memory, 175, 107300. [PubMed:32882397] [WorldCat] [DOI] - ↑
Zhao, J., Bian, C., Liu, M., Zhao, Y., Sun, T., Xing, F., & Zhang, J. (2018).
Orchiectomy and letrozole differentially regulate synaptic plasticity and spatial memory in a manner that is mediated by SRC-1 in the hippocampus of male mice. The Journal of steroid biochemistry and molecular biology, 178, 354-368. [PubMed:29452160] [WorldCat] [DOI] - ↑
Tuscher, J.J., Szinte, J.S., Starrett, J.R., Krentzel, A.A., Fortress, A.M., Remage-Healey, L., & Frick, K.M. (2016).
Inhibition of local estrogen synthesis in the hippocampus impairs hippocampal memory consolidation in ovariectomized female mice. Hormones and behavior, 83, 60-67. [PubMed:27178577] [PMC] [WorldCat] [DOI] - ↑ 44.0 44.1
Ishihara, Y., Takemoto, T., Ishida, A., & Yamazaki, T. (2015).
Protective actions of 17β-estradiol and progesterone on oxidative neuronal injury induced by organometallic compounds. Oxidative medicine and cellular longevity, 2015, 343706. [PubMed:25815107] [PMC] [WorldCat] [DOI] - ↑
Brann, D.W., Dhandapani, K., Wakade, C., Mahesh, V.B., & Khan, M.M. (2007).
Neurotrophic and neuroprotective actions of estrogen: basic mechanisms and clinical implications. Steroids, 72(5), 381-405. [PubMed:17379265] [PMC] [WorldCat] [DOI] - ↑
Mize, A.L., Shapiro, R.A., & Dorsa, D.M. (2003).
Estrogen receptor-mediated neuroprotection from oxidative stress requires activation of the mitogen-activated protein kinase pathway. Endocrinology, 144(1), 306-12. [PubMed:12488359] [WorldCat] [DOI] - ↑
Zhang, Q.G., Raz, L., Wang, R., Han, D., De Sevilla, L., Yang, F., ..., & Brann, D.W. (2009).
Estrogen attenuates ischemic oxidative damage via an estrogen receptor alpha-mediated inhibition of NADPH oxidase activation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(44), 13823-36. [PubMed:19889994] [PMC] [WorldCat] [DOI] - ↑
Quintanilla, R.A., Muñoz, F.J., Metcalfe, M.J., Hitschfeld, M., Olivares, G., Godoy, J.A., & Inestrosa, N.C. (2005).
Trolox and 17beta-estradiol protect against amyloid beta-peptide neurotoxicity by a mechanism that involves modulation of the Wnt signaling pathway. The Journal of biological chemistry, 280(12), 11615-25. [PubMed:15659394] [WorldCat] [DOI] - ↑
Jones, T.T., & Brewer, G.J. (2009).
Critical age-related loss of cofactors of neuron cytochrome C oxidase reversed by estrogen. Experimental neurology, 215(2), 212-9. [PubMed:18930048] [PMC] [WorldCat] [DOI] - ↑
Behl, C., Skutella, T., Lezoualc'h, F., Post, A., Widmann, M., Newton, C.J., & Holsboer, F. (1997).
Neuroprotection against oxidative stress by estrogens: structure-activity relationship. Molecular pharmacology, 51(4), 535-41. [PubMed:9106616] [WorldCat] - ↑
Acaz-Fonseca, E., Sanchez-Gonzalez, R., Azcoitia, I., Arevalo, M.A., & Garcia-Segura, L.M. (2014).
Role of astrocytes in the neuroprotective actions of 17β-estradiol and selective estrogen receptor modulators. Molecular and cellular endocrinology, 389(1-2), 48-57. [PubMed:24444786] [WorldCat] [DOI] - ↑
Bruce-Keller, A.J., Keeling, J.L., Keller, J.N., Huang, F.F., Camondola, S., & Mattson, M.P. (2000).
Antiinflammatory effects of estrogen on microglial activation. Endocrinology, 141(10), 3646-56. [PubMed:11014219] [WorldCat] [DOI]
