「セロトニン・ノルアドレナリン再取り込み阻害薬」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の2版が非表示) | |||
| 1行目: | 1行目: | ||
永安 一樹 | |||
大阪大学大学院薬学研究科 | |||
神経回路創薬学プロジェクト | |||
(selective serotonin noradrenaline reuptake inhibitor, SNRI) | |||
{{box|text= セロトニン・ノルアドレナリン再取り込み阻害薬は抗うつ薬の一群であり、従来の三環系抗うつ薬と比較してアセチルコリン受容体などに対する親和性をほとんど示さず、セロトニンおよびノルアドレナリンの再取り込みを選択的に阻害することを特徴とする。セロトニン再取り込みを選択的に阻害する選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)とは異なり、線維筋痛症など難治性疼痛に対する治療薬としても用いられている。セロトニンなどのモノアミンの再取り込みによる不活性化を阻害することで、シナプス間隙におけるセロトニン、ノルアドレナリンおよび(前頭葉においては)ドーパミンの濃度を上昇させることで、薬効を発揮していると考えられている。本邦ではミルナシプラン、デュロキセチンおよびベンラファキシンの3剤が臨床使用されている(2025年4月時点)。}} | {{box|text= セロトニン・ノルアドレナリン再取り込み阻害薬は抗うつ薬の一群であり、従来の三環系抗うつ薬と比較してアセチルコリン受容体などに対する親和性をほとんど示さず、セロトニンおよびノルアドレナリンの再取り込みを選択的に阻害することを特徴とする。セロトニン再取り込みを選択的に阻害する選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)とは異なり、線維筋痛症など難治性疼痛に対する治療薬としても用いられている。セロトニンなどのモノアミンの再取り込みによる不活性化を阻害することで、シナプス間隙におけるセロトニン、ノルアドレナリンおよび(前頭葉においては)ドーパミンの濃度を上昇させることで、薬効を発揮していると考えられている。本邦ではミルナシプラン、デュロキセチンおよびベンラファキシンの3剤が臨床使用されている(2025年4月時点)。}} | ||
== 歴史的経緯 == | == 歴史的経緯 == | ||
1960年代に開発された[[イミプラミン]]などの[[三環系抗うつ薬]]は、その薬効に寄与すると考えられている[[セロトニン]]・[[ノルアドレナリン]]再取り込み阻害による[[神経伝達]]促進作用に加えて、様々な副作用の原因となる[[ムスカリン型アセチルコリン受容体]]阻害作用、[[ヒスタミン]][[H1受容体]]阻害作用、[[アドレナリン]][[α1受容体]]阻害作用などを有している。上記受容体の阻害作用は、[[口渇]]、[[便秘]]、[[眼]]のかすみ、[[鎮静]]など様々な副作用の原因となることから、三環系抗うつ薬の忍容性は高くなく、治療効果と副作用のバランスを取ることが難しく十分な用量で使用することが困難であった<ref>'''Briley M. (1998).'''<br>Specific serotonin and noradrenaline reuptake inhibitors (SNRIs). A review of their pharmacology, clinical efficacy and tolerability. Hum Psychopharmacol Clin Exp. 13(2):99-111. [https://doi.org/10.1002/(SICI)1099-1077(199803)13:2<99::AID-HUP954>3.0.CO;2-2 [DOI<nowiki>]</nowiki>]</ref>。このような背景の下、副作用の原因となる様々な受容体の阻害作用を有さず、薬効に寄与するセロトニン・ノルアドレナリン神経伝達を選択的に促進する化合物が探索された結果、セロトニン神経伝達を選択的に促進する選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)や、セロトニンおよびノルアドレナリン神経伝達を選択的に促進するセロトニン・ノルアドレナリン再取り込み阻害薬(selective serotonin noradrenaline reuptake inhibitor, SNRI)が開発された。以上のように、三環系抗うつ薬もセロトニン・ノルアドレナリン再取り込みを阻害するが、上述の歴史的経緯から、SNRIあるいはSSRIに分類されることは一般にはない。 | 1960年代に開発された[[イミプラミン]]などの[[三環系抗うつ薬]]は、その薬効に寄与すると考えられている[[セロトニン]]・[[ノルアドレナリン]]再取り込み阻害による[[神経伝達]]促進作用に加えて、様々な副作用の原因となる[[ムスカリン型アセチルコリン受容体]]阻害作用、[[ヒスタミン]][[H1受容体]]阻害作用、[[アドレナリン]][[α1受容体]]阻害作用などを有している。上記受容体の阻害作用は、[[口渇]]、[[便秘]]、[[眼]]のかすみ、[[鎮静]]など様々な副作用の原因となることから、三環系抗うつ薬の忍容性は高くなく、治療効果と副作用のバランスを取ることが難しく十分な用量で使用することが困難であった<ref>'''Briley M. (1998).'''<br>Specific serotonin and noradrenaline reuptake inhibitors (SNRIs). A review of their pharmacology, clinical efficacy and tolerability. Hum Psychopharmacol Clin Exp. 13(2):99-111. [https://doi.org/10.1002/(SICI)1099-1077(199803)13:2<99::AID-HUP954>3.0.CO;2-2 [DOI<nowiki>]</nowiki>]</ref>[1]。このような背景の下、副作用の原因となる様々な受容体の阻害作用を有さず、薬効に寄与するセロトニン・ノルアドレナリン神経伝達を選択的に促進する化合物が探索された結果、セロトニン神経伝達を選択的に促進する選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)や、セロトニンおよびノルアドレナリン神経伝達を選択的に促進するセロトニン・ノルアドレナリン再取り込み阻害薬(selective serotonin noradrenaline reuptake inhibitor, SNRI)が開発された。以上のように、三環系抗うつ薬もセロトニン・ノルアドレナリン再取り込みを阻害するが、上述の歴史的経緯から、SNRIあるいはSSRIに分類されることは一般にはない。 | ||
== 作用機序 == | == 作用機序 == | ||
SNRIは主にセロトニン神経に発現する[[セロトニントランスポーター]]([[serotonin transporter]], [[SERT]])およびノルアドレナリン神経に発現する[[ノルアドレナリントランスポーター]]([[norepinephrine transporter]], [[NET]])に結合し、その機能を阻害する<ref name=Vaishnavi2004><pubmed>14744476</pubmed></ref>。SERTはシナプス間隙に遊離されたセロトニンを、NETはノルアドレナリンをそれぞれシナプス前部に再取り込みすることで、それら神経伝達物質の作用を終止させる<ref name=Xu2000><pubmed>10769386</pubmed></ref><ref name=Mathews2004><pubmed>15589347</pubmed></ref><ref name=Shen2004><pubmed>15226739</pubmed></ref>。またNETは[[ドーパミン]]に対しても高い親和性を示すことから、[[ドーパミントランスポーター]]の発現が低い[[前頭葉]]においてはドーパミンの再取り込みも担っている<ref name=Moron2002><pubmed>11784783</pubmed></ref>。健常動物における[[マイクロダイアリシス法]]を用いた検討から、SNRIによるSERTおよびNETの阻害が、様々な脳部位におけるセロトニン、ノルアドレナリン細胞外濃度の速やかな上昇をもたらすことが明らかになっている<ref name=Moret1997><pubmed>9231743</pubmed></ref><ref name=Tsutsui-Kimura2017><pubmed>28694090</pubmed></ref>。また、NETのドーパミンに対する高い親和性と一致して、SNRIは前頭葉におけるドーパミン細胞外濃度を速やかに上昇させることも報告されている<ref name=Kihara1995><pubmed>7815331</pubmed></ref>。一方で、三環系抗うつ薬やSSRIなどの他の抗うつ薬と同様にSNRIの薬効発現には数週間以上の期間を必要とするなど、セロトニンやノルアドレナリン細胞外濃度上昇と抗うつ作用の間の関係については未だ不明な点が多い。 | SNRIは主にセロトニン神経に発現する[[セロトニントランスポーター]]([[serotonin transporter]], [[SERT]])およびノルアドレナリン神経に発現する[[ノルアドレナリントランスポーター]]([[norepinephrine transporter]], [[NET]])に結合し、その機能を阻害する<ref name=Vaishnavi2004><pubmed>14744476</pubmed></ref>[2]。SERTはシナプス間隙に遊離されたセロトニンを、NETはノルアドレナリンをそれぞれシナプス前部に再取り込みすることで、それら神経伝達物質の作用を終止させる<ref name=Xu2000><pubmed>10769386</pubmed></ref><ref name=Mathews2004><pubmed>15589347</pubmed></ref><ref name=Shen2004><pubmed>15226739</pubmed></ref>[3-5]。またNETは[[ドーパミン]]に対しても高い親和性を示すことから、[[ドーパミントランスポーター]]の発現が低い[[前頭葉]]においてはドーパミンの再取り込みも担っている<ref name=Moron2002><pubmed>11784783</pubmed></ref>[6]。健常動物における[[マイクロダイアリシス法]]を用いた検討から、SNRIによるSERTおよびNETの阻害が、様々な脳部位におけるセロトニン、ノルアドレナリン細胞外濃度の速やかな上昇をもたらすことが明らかになっている<ref name=Moret1997><pubmed>9231743</pubmed></ref><ref name=Tsutsui-Kimura2017><pubmed>28694090</pubmed></ref>[7,8]。また、NETのドーパミンに対する高い親和性と一致して、SNRIは前頭葉におけるドーパミン細胞外濃度を速やかに上昇させることも報告されている<ref name=Kihara1995><pubmed>7815331</pubmed></ref>[9]。一方で、三環系抗うつ薬やSSRIなどの他の抗うつ薬と同様にSNRIの薬効発現には数週間以上の期間を必要とするなど、セロトニンやノルアドレナリン細胞外濃度上昇と抗うつ作用の間の関係については未だ不明な点が多い。 | ||
[[ファイル:Nagayasu SNRI Fig1.png|サムネイル|'''図. 本邦で使用されているSNRIの化学構造''']] | [[ファイル:Nagayasu SNRI Fig1.png|サムネイル|'''図. 本邦で使用されているSNRIの化学構造''']] | ||
== 現在使用されているSNRI == | == 現在使用されているSNRI == | ||
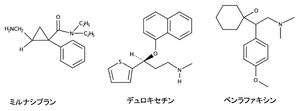
本邦では[[ミルナシプラン]]、[[デュロキセチン]]、[[ベンラファキシン]]の3剤が臨床使用されているが<ref>'''伊豆津 宏二, 今井 靖, 桑名 正隆, 寺田 智祐 (2025).'''<br>今日の治療薬2025. ''南江堂.''</ref>('''図''')、海外ではベンラファキシンの活性代謝物である[[デスベンラファキシン]]([[desvenlafaxine]])およびミルナシプランのレボ体である[[レボミルナシプラン]]([[levomilnacipran]])も臨床使用されている<ref name=Semba>'''仙波 純一 松浦 雅人 太田 克也 (監訳) (2023).'''<br>ストール精神薬理学エセンシャルズ第5版. ''メディカル・サイエンス・インターナショナル''</ref>。いずれのSNRIもSERTに対する高い親和性を示すが、NETに対する阻害作用は'''表'''に示す通り多様である。ミルナシプランはNETへの親和性が相対的に高い一方で、ベンラファキシンはSERTへの選択性が相対的に高い。またデュロキセチンは両者の中間の性質を示し、SERTおよびNETを同程度に阻害する。 | 本邦では[[ミルナシプラン]]、[[デュロキセチン]]、[[ベンラファキシン]]の3剤が臨床使用されているが<ref>'''伊豆津 宏二, 今井 靖, 桑名 正隆, 寺田 智祐 (2025).'''<br>今日の治療薬2025. ''南江堂.''</ref>[10]('''図''')、海外ではベンラファキシンの活性代謝物である[[デスベンラファキシン]]([[desvenlafaxine]])およびミルナシプランのレボ体である[[レボミルナシプラン]]([[levomilnacipran]])も臨床使用されている<ref name=Semba>'''仙波 純一 松浦 雅人 太田 克也 (監訳) (2023).'''<br>ストール精神薬理学エセンシャルズ第5版. ''メディカル・サイエンス・インターナショナル''</ref>[11]。いずれのSNRIもSERTに対する高い親和性を示すが、NETに対する阻害作用は'''表'''に示す通り多様である。ミルナシプランはNETへの親和性が相対的に高い一方で、ベンラファキシンはSERTへの選択性が相対的に高い。またデュロキセチンは両者の中間の性質を示し、SERTおよびNETを同程度に阻害する。 | ||
{| class="wikitable" | {| class="wikitable" | ||
|+表. SNRIのSERTおよびNETに対する阻害作用 (pIC50) | |+表. SNRIのSERTおよびNETに対する阻害作用 (pIC50) | ||
| 36行目: | 34行目: | ||
| 7.3 || 6.3 || <ref><pubmed>16675639</pubmed></ref> | | 7.3 || 6.3 || <ref><pubmed>16675639</pubmed></ref> | ||
|} | |} | ||
[[陽電子放出断層撮影法]]([[PET]])を用いた生体内におけるトランスポーターの[[占拠率]]は、ミルナシプランで40%(SERT、NETともに)<ref name=Nogami2013><pubmed>23067569</pubmed></ref>、デュロキセチンで30-40%(NET)<ref name=Moriguchi2017><pubmed>29016875</pubmed></ref>、80%(SERT)<ref name=Sorensen2022><pubmed>34548628</pubmed></ref>と報告されている。一方で、ベンラファキシンは、低-中用量では有意なNET結合を示さず、SERTに対する高い占拠率(80%)を示す<ref name=Sorensen2022 />。中-高用量ではNETに対する結合を示す(40%)<ref name=Arakawa2019><pubmed>30649319</pubmed></ref>ことから、低用量ではSSRIとして中-高用量ではSNRIとして作用すると考えられる。興味深いことに、ベンラファキシンを高用量で用いることで、その抗うつ効果が増強されることが示唆されている。SERT占拠率が80%を超えて上昇しても臨床効果は増強されないことが示唆されていることと併せて考えると、高用量のベンラファキシンによるノルアドレナリン神経伝達の促進作用がより高い薬効に寄与している可能性が考えられる<ref name=Furukawa2019><pubmed>31178367</pubmed></ref>。一方で、SSRIと比べてSNRIの方が寛解率が高いかについては未だ結論は出ていない<ref name=Semba />。 | [[陽電子放出断層撮影法]]([[PET]])を用いた生体内におけるトランスポーターの[[占拠率]]は、ミルナシプランで40%(SERT、NETともに)<ref name=Nogami2013><pubmed>23067569</pubmed></ref> [12]、デュロキセチンで30-40%(NET)<ref name=Moriguchi2017><pubmed>29016875</pubmed></ref>[13]、80%(SERT)<ref name=Sorensen2022><pubmed>34548628</pubmed></ref>[14]と報告されている。一方で、ベンラファキシンは、低-中用量では有意なNET結合を示さず、SERTに対する高い占拠率(80%)を示す<ref name=Sorensen2022 /> [14]。中-高用量ではNETに対する結合を示す(40%)<ref name=Arakawa2019><pubmed>30649319</pubmed></ref>[15]ことから、低用量ではSSRIとして中-高用量ではSNRIとして作用すると考えられる。興味深いことに、ベンラファキシンを高用量で用いることで、その抗うつ効果が増強されることが示唆されている。SERT占拠率が80%を超えて上昇しても臨床効果は増強されないことが示唆されていることと併せて考えると、高用量のベンラファキシンによるノルアドレナリン神経伝達の促進作用がより高い薬効に寄与している可能性が考えられる<ref name=Furukawa2019><pubmed>31178367</pubmed></ref>[16]。一方で、SSRIと比べてSNRIの方が寛解率が高いかについては未だ結論は出ていない<ref name=Semba /> [11]。 | ||
SNRIのうちミルナシプラン、デュロキセチンおよびベンラファキシンは抗うつ薬として本邦で承認されているが、デュロキセチンのみが[[線維筋痛症]]等の疼痛も適応症として承認されている。また米国ではミルナシプランも線維筋痛症に対して承認されている。SERTのみを阻害するSSRIおよびSNRIの中でもNETへの作用が弱いベンラファキシンは[[疼痛]]に対する有効性を示す証拠は現時点ではないことから、抗うつ薬の疼痛に対する治療効果は主にノルアドレナリン神経伝達の促進を介していると考えられている。内因性の疼痛抑制システムである下行性疼痛抑制路はセロトニン神経伝達・ノルアドレナリン神経伝達の両者をその構成要素とするが、難治性疼痛等の病態下ではノルアドレナリン神経伝達促進の鎮痛効果が強く表出するのかもしれない。 | SNRIのうちミルナシプラン、デュロキセチンおよびベンラファキシンは抗うつ薬として本邦で承認されているが、デュロキセチンのみが[[線維筋痛症]]等の疼痛も適応症として承認されている。また米国ではミルナシプランも線維筋痛症に対して承認されている。SERTのみを阻害するSSRIおよびSNRIの中でもNETへの作用が弱いベンラファキシンは[[疼痛]]に対する有効性を示す証拠は現時点ではないことから、抗うつ薬の疼痛に対する治療効果は主にノルアドレナリン神経伝達の促進を介していると考えられている。内因性の疼痛抑制システムである下行性疼痛抑制路はセロトニン神経伝達・ノルアドレナリン神経伝達の両者をその構成要素とするが、難治性疼痛等の病態下ではノルアドレナリン神経伝達促進の鎮痛効果が強く表出するのかもしれない。 | ||
== 薬物相互作用 == | == 薬物相互作用 == | ||
抗うつ薬をはじめとする精神疾患治療薬の多くは長期間の服用を必要とすることから、不活性体への[[代謝]]阻害などの併用薬との相互作用の可能性について注意が必要である。ベンラファキシンは[[CYP2D6]]により活性代謝物のデスベンラファキシンに代謝されるほか、一部は活性の弱いN-デスメチルベンラファキシン(N-desmethylvenlafaxine)に[[CYP3A4]]により代謝されることから、[[シメチジン]]などCYP3A4阻害作用を示す薬と併用するとその作用が意図せず増強される可能性がある<ref>イフェクサーSRカプセルインタビューフォーム</ref>。デュロキセチンは血漿タンパク質との結合率が極めて高く(97-99%)<ref> サインバルタカプセル添付文書</ref>、[[ワルファリン]] | 抗うつ薬をはじめとする精神疾患治療薬の多くは長期間の服用を必要とすることから、不活性体への[[代謝]]阻害などの併用薬との相互作用の可能性について注意が必要である。ベンラファキシンは[[CYP2D6]]により活性代謝物のデスベンラファキシンに代謝されるほか、一部は活性の弱いN-デスメチルベンラファキシン(N-desmethylvenlafaxine)に[[CYP3A4]]により代謝されることから、[[シメチジン]]などCYP3A4阻害作用を示す薬と併用するとその作用が意図せず増強される可能性がある<ref>イフェクサーSRカプセルインタビューフォーム</ref>[17]。デュロキセチンは血漿タンパク質との結合率が極めて高く(97-99%)<ref> サインバルタカプセル添付文書</ref>[18]、[[ワルファリン]]等の血漿タンパク質結合率が高い薬剤と併用することで、血漿タンパク質結合の拮抗によりその作用が増強される可能性がある。またCYP2D6の阻害作用を有することから、CYP2D6により主に代謝される薬剤(アミトリプチリン、イミプラミン、ペルフェナジンなど)の血中濃度を上昇させる可能性がある。 | ||
==関連項目== | ==関連項目== | ||
2025年4月13日 (日) 16:35時点における版
永安 一樹 大阪大学大学院薬学研究科 神経回路創薬学プロジェクト
(selective serotonin noradrenaline reuptake inhibitor, SNRI)
セロトニン・ノルアドレナリン再取り込み阻害薬は抗うつ薬の一群であり、従来の三環系抗うつ薬と比較してアセチルコリン受容体などに対する親和性をほとんど示さず、セロトニンおよびノルアドレナリンの再取り込みを選択的に阻害することを特徴とする。セロトニン再取り込みを選択的に阻害する選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)とは異なり、線維筋痛症など難治性疼痛に対する治療薬としても用いられている。セロトニンなどのモノアミンの再取り込みによる不活性化を阻害することで、シナプス間隙におけるセロトニン、ノルアドレナリンおよび(前頭葉においては)ドーパミンの濃度を上昇させることで、薬効を発揮していると考えられている。本邦ではミルナシプラン、デュロキセチンおよびベンラファキシンの3剤が臨床使用されている(2025年4月時点)。
歴史的経緯
1960年代に開発されたイミプラミンなどの三環系抗うつ薬は、その薬効に寄与すると考えられているセロトニン・ノルアドレナリン再取り込み阻害による神経伝達促進作用に加えて、様々な副作用の原因となるムスカリン型アセチルコリン受容体阻害作用、ヒスタミンH1受容体阻害作用、アドレナリンα1受容体阻害作用などを有している。上記受容体の阻害作用は、口渇、便秘、眼のかすみ、鎮静など様々な副作用の原因となることから、三環系抗うつ薬の忍容性は高くなく、治療効果と副作用のバランスを取ることが難しく十分な用量で使用することが困難であった[1][1]。このような背景の下、副作用の原因となる様々な受容体の阻害作用を有さず、薬効に寄与するセロトニン・ノルアドレナリン神経伝達を選択的に促進する化合物が探索された結果、セロトニン神経伝達を選択的に促進する選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)や、セロトニンおよびノルアドレナリン神経伝達を選択的に促進するセロトニン・ノルアドレナリン再取り込み阻害薬(selective serotonin noradrenaline reuptake inhibitor, SNRI)が開発された。以上のように、三環系抗うつ薬もセロトニン・ノルアドレナリン再取り込みを阻害するが、上述の歴史的経緯から、SNRIあるいはSSRIに分類されることは一般にはない。
作用機序
SNRIは主にセロトニン神経に発現するセロトニントランスポーター(serotonin transporter, SERT)およびノルアドレナリン神経に発現するノルアドレナリントランスポーター(norepinephrine transporter, NET)に結合し、その機能を阻害する[2][2]。SERTはシナプス間隙に遊離されたセロトニンを、NETはノルアドレナリンをそれぞれシナプス前部に再取り込みすることで、それら神経伝達物質の作用を終止させる[3][4][5][3-5]。またNETはドーパミンに対しても高い親和性を示すことから、ドーパミントランスポーターの発現が低い前頭葉においてはドーパミンの再取り込みも担っている[6][6]。健常動物におけるマイクロダイアリシス法を用いた検討から、SNRIによるSERTおよびNETの阻害が、様々な脳部位におけるセロトニン、ノルアドレナリン細胞外濃度の速やかな上昇をもたらすことが明らかになっている[7][8][7,8]。また、NETのドーパミンに対する高い親和性と一致して、SNRIは前頭葉におけるドーパミン細胞外濃度を速やかに上昇させることも報告されている[9][9]。一方で、三環系抗うつ薬やSSRIなどの他の抗うつ薬と同様にSNRIの薬効発現には数週間以上の期間を必要とするなど、セロトニンやノルアドレナリン細胞外濃度上昇と抗うつ作用の間の関係については未だ不明な点が多い。
現在使用されているSNRI
本邦ではミルナシプラン、デュロキセチン、ベンラファキシンの3剤が臨床使用されているが[10][10](図)、海外ではベンラファキシンの活性代謝物であるデスベンラファキシン(desvenlafaxine)およびミルナシプランのレボ体であるレボミルナシプラン(levomilnacipran)も臨床使用されている[11][11]。いずれのSNRIもSERTに対する高い親和性を示すが、NETに対する阻害作用は表に示す通り多様である。ミルナシプランはNETへの親和性が相対的に高い一方で、ベンラファキシンはSERTへの選択性が相対的に高い。またデュロキセチンは両者の中間の性質を示し、SERTおよびNETを同程度に阻害する。
| SERT | NET | 出典 | |
|---|---|---|---|
| ミルナシプラン | 7.3 | 9.1 | [12] |
| レボミルナシプラン | 7.7 | 8 | [13] |
| デュロキセチン | 8.5 | 8.4 | [14] |
| ベンラファキシン | 7.6 | 6.3 | [14] |
| デスベンラファキシン | 7.3 | 6.3 | [15] |
陽電子放出断層撮影法(PET)を用いた生体内におけるトランスポーターの占拠率は、ミルナシプランで40%(SERT、NETともに)[16] [12]、デュロキセチンで30-40%(NET)[17][13]、80%(SERT)[18][14]と報告されている。一方で、ベンラファキシンは、低-中用量では有意なNET結合を示さず、SERTに対する高い占拠率(80%)を示す[18] [14]。中-高用量ではNETに対する結合を示す(40%)[19][15]ことから、低用量ではSSRIとして中-高用量ではSNRIとして作用すると考えられる。興味深いことに、ベンラファキシンを高用量で用いることで、その抗うつ効果が増強されることが示唆されている。SERT占拠率が80%を超えて上昇しても臨床効果は増強されないことが示唆されていることと併せて考えると、高用量のベンラファキシンによるノルアドレナリン神経伝達の促進作用がより高い薬効に寄与している可能性が考えられる[20][16]。一方で、SSRIと比べてSNRIの方が寛解率が高いかについては未だ結論は出ていない[11] [11]。
SNRIのうちミルナシプラン、デュロキセチンおよびベンラファキシンは抗うつ薬として本邦で承認されているが、デュロキセチンのみが線維筋痛症等の疼痛も適応症として承認されている。また米国ではミルナシプランも線維筋痛症に対して承認されている。SERTのみを阻害するSSRIおよびSNRIの中でもNETへの作用が弱いベンラファキシンは疼痛に対する有効性を示す証拠は現時点ではないことから、抗うつ薬の疼痛に対する治療効果は主にノルアドレナリン神経伝達の促進を介していると考えられている。内因性の疼痛抑制システムである下行性疼痛抑制路はセロトニン神経伝達・ノルアドレナリン神経伝達の両者をその構成要素とするが、難治性疼痛等の病態下ではノルアドレナリン神経伝達促進の鎮痛効果が強く表出するのかもしれない。
薬物相互作用
抗うつ薬をはじめとする精神疾患治療薬の多くは長期間の服用を必要とすることから、不活性体への代謝阻害などの併用薬との相互作用の可能性について注意が必要である。ベンラファキシンはCYP2D6により活性代謝物のデスベンラファキシンに代謝されるほか、一部は活性の弱いN-デスメチルベンラファキシン(N-desmethylvenlafaxine)にCYP3A4により代謝されることから、シメチジンなどCYP3A4阻害作用を示す薬と併用するとその作用が意図せず増強される可能性がある[21][17]。デュロキセチンは血漿タンパク質との結合率が極めて高く(97-99%)[22][18]、ワルファリン等の血漿タンパク質結合率が高い薬剤と併用することで、血漿タンパク質結合の拮抗によりその作用が増強される可能性がある。またCYP2D6の阻害作用を有することから、CYP2D6により主に代謝される薬剤(アミトリプチリン、イミプラミン、ペルフェナジンなど)の血中濃度を上昇させる可能性がある。
関連項目
参考文献
- ↑ Briley M. (1998).
Specific serotonin and noradrenaline reuptake inhibitors (SNRIs). A review of their pharmacology, clinical efficacy and tolerability. Hum Psychopharmacol Clin Exp. 13(2):99-111. <99::AID-HUP954>3.0.CO;2-2 [DOI] - ↑
Xu, F., Gainetdinov, R.R., Wetsel, W.C., Jones, S.R., Bohn, L.M., Miller, G.W., ..., & Caron, M.G. (2000).
Mice lacking the norepinephrine transporter are supersensitive to psychostimulants. Nature neuroscience, 3(5), 465-71. [PubMed:10769386] [WorldCat] [DOI] - ↑
Mathews, T.A., Fedele, D.E., Coppelli, F.M., Avila, A.M., Murphy, D.L., & Andrews, A.M. (2004).
Gene dose-dependent alterations in extraneuronal serotonin but not dopamine in mice with reduced serotonin transporter expression. Journal of neuroscience methods, 140(1-2), 169-81. [PubMed:15589347] [WorldCat] [DOI] - ↑
Shen, H.W., Hagino, Y., Kobayashi, H., Shinohara-Tanaka, K., Ikeda, K., Yamamoto, H., ..., & Sora, I. (2004).
Regional differences in extracellular dopamine and serotonin assessed by in vivo microdialysis in mice lacking dopamine and/or serotonin transporters. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 29(10), 1790-9. [PubMed:15226739] [WorldCat] [DOI] - ↑
Morón, J.A., Brockington, A., Wise, R.A., Rocha, B.A., & Hope, B.T. (2002).
Dopamine uptake through the norepinephrine transporter in brain regions with low levels of the dopamine transporter: evidence from knock-out mouse lines. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(2), 389-95. [PubMed:11784783] [PMC] [WorldCat] [DOI] - ↑
Moret, C., & Briley, M. (1997).
Effects of milnacipran and pindolol on extracellular noradrenaline and serotonin levels in guinea pig hypothalamus. Journal of neurochemistry, 69(2), 815-22. [PubMed:9231743] [WorldCat] [DOI] - ↑
Tsutsui-Kimura, I., Ohmura, Y., Yoshida, T., & Yoshioka, M. (2017).
Milnacipran affects mouse impulsive, aggressive, and depressive-like behaviors in a distinct dose-dependent manner. Journal of pharmacological sciences, 134(3), 181-189. [PubMed:28694090] [WorldCat] [DOI] - ↑
Kihara, T., & Ikeda, M. (1995).
Effects of duloxetine, a new serotonin and norepinephrine uptake inhibitor, on extracellular monoamine levels in rat frontal cortex. The Journal of pharmacology and experimental therapeutics, 272(1), 177-83. [PubMed:7815331] [WorldCat] - ↑ 伊豆津 宏二, 今井 靖, 桑名 正隆, 寺田 智祐 (2025).
今日の治療薬2025. 南江堂. - ↑ 11.0 11.1 仙波 純一 松浦 雅人 太田 克也 (監訳) (2023).
ストール精神薬理学エセンシャルズ第5版. メディカル・サイエンス・インターナショナル - ↑
Van Orden, L.J., Van Dyke, P.M., Saito, D.R., Church, T.J., Chang, R., Smith, J.A., ..., & Stangeland, E.L. (2013).
A novel class of 3-(phenoxy-phenyl-methyl)-pyrrolidines as potent and balanced norepinephrine and serotonin reuptake inhibitors: synthesis and structure-activity relationships. Bioorganic & medicinal chemistry letters, 23(5), 1456-61. [PubMed:23347683] [WorldCat] [DOI] - ↑
Auclair, A.L., Martel, J.C., Assié, M.B., Bardin, L., Heusler, P., Cussac, D., ..., & Depoortère, R. (2013).
Levomilnacipran (F2695), a norepinephrine-preferring SNRI: profile in vitro and in models of depression and anxiety. Neuropharmacology, 70, 338-47. [PubMed:23499664] [WorldCat] [DOI] - ↑ 14.0 14.1
Sabatucci, J.P., Mahaney, P.E., Leiter, J., Johnston, G., Burroughs, K., Cosmi, S., ..., & Trybulski, E. (2010).
Heterocyclic cycloalkanol ethylamines as norepinephrine reuptake inhibitors. Bioorganic & medicinal chemistry letters, 20(9), 2809-12. [PubMed:20378347] [WorldCat] [DOI] - ↑
Deecher, D.C., Beyer, C.E., Johnston, G., Bray, J., Shah, S., Abou-Gharbia, M., & Andree, T.H. (2006).
Desvenlafaxine succinate: A new serotonin and norepinephrine reuptake inhibitor. The Journal of pharmacology and experimental therapeutics, 318(2), 657-65. [PubMed:16675639] [WorldCat] [DOI] - ↑
Nogami, T., Takano, H., Arakawa, R., Ichimiya, T., Fujiwara, H., Kimura, Y., ..., & Suhara, T. (2013).
Occupancy of serotonin and norepinephrine transporter by milnacipran in patients with major depressive disorder: a positron emission tomography study with [(11)C]DASB and (S,S)-[(18)F]FMeNER-D(2). The international journal of neuropsychopharmacology, 16(5), 937-43. [PubMed:23067569] [WorldCat] [DOI] - ↑
Moriguchi, S., Takano, H., Kimura, Y., Nagashima, T., Takahata, K., Kubota, M., ..., & Suhara, T. (2017).
Occupancy of Norepinephrine Transporter by Duloxetine in Human Brains Measured by Positron Emission Tomography with (S,S)-[18F]FMeNER-D2. The international journal of neuropsychopharmacology, 20(12), 957-962. [PubMed:29016875] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Sørensen, A., Ruhé, H.G., & Munkholm, K. (2022).
The relationship between dose and serotonin transporter occupancy of antidepressants-a systematic review. Molecular psychiatry, 27(1), 192-201. [PubMed:34548628] [PMC] [WorldCat] [DOI] - ↑
Arakawa, R., Stenkrona, P., Takano, A., Svensson, J., Andersson, M., Nag, S., ..., & Lundberg, J. (2019).
Venlafaxine ER Blocks the Norepinephrine Transporter in the Brain of Patients with Major Depressive Disorder: a PET Study Using [18F]FMeNER-D2. The international journal of neuropsychopharmacology, 22(4), 278-285. [PubMed:30649319] [PMC] [WorldCat] [DOI] - ↑
Furukawa, T.A., Cipriani, A., Cowen, P.J., Leucht, S., Egger, M., & Salanti, G. (2019).
Optimal dose of selective serotonin reuptake inhibitors, venlafaxine, and mirtazapine in major depression: a systematic review and dose-response meta-analysis. The lancet. Psychiatry, 6(7), 601-609. [PubMed:31178367] [PMC] [WorldCat] [DOI] - ↑ イフェクサーSRカプセルインタビューフォーム
- ↑ サインバルタカプセル添付文書