「スリングショット」の版間の差分
細 →細胞内局在 |
細編集の要約なし |
||
| (同じ利用者による、間の7版が非表示) | |||
| 12行目: | 12行目: | ||
== スリングショットとは == | == スリングショットとは == | ||
最初、[[ショウジョウバエ]]の翅の毛や背の[[剛毛]]の形態異常の変異体の原因遺伝子として同定された。変異体では剛毛の先が二股に分かれるY字型の形状をもつことからslingshotと名付けられた<ref name=Niwa2002><pubmed>11832213</pubmed></ref> | 最初、[[ショウジョウバエ]]の翅の毛や背の[[剛毛]]の形態異常の変異体の原因遺伝子として同定された。変異体では剛毛の先が二股に分かれるY字型の形状をもつことからslingshotと名付けられた<ref name=Niwa2002><pubmed>11832213</pubmed></ref>。この遺伝子は、二重特異性[[ホスファターゼ]] (dual-specificity phosphatase)に属する[[タンパク質脱リン酸化酵素]]をコードしていた。また、剛毛の形態異常は[[アクチン]]細胞骨格の制御因子の変異に起因する例が知られており、slingshot変異細胞ではアクチンの過重合がみられることから、SSHの基質の候補としてアクチン線維の切断・脱重合因子であり、脱リン酸化によって活性化されるコフィリンが推測された。その可能性は[[哺乳類]]の培養細胞を用いて検討され、コフィリンがSSHの基質であることが明らかにされた<ref name=Niwa2002 />。ショウジョウバエにおけるssh遺伝子の機能不全は、毛だけではなく、[[上皮]]組織、[[個眼]]などでアクチンの過重合を伴う形態異常を示す。コフィリンのリン酸化酵素である[[LIMドメイン含有キナーゼ]] ([[LIMキナーゼ]], [[LIMK]])を過剰発現させてもアクチンの過重合が生じるが、LIMKとSSHを共発現させると過重合がなくなることから、SSHはコフィリン脱リン酸化酵素であることが支持された<ref name=Niwa200 />。 | ||
[[ファイル:Ohashi LIMK Fig1.png|サムネイル|'''図1. コフィリンのリン酸化・脱リン酸化によるアクチン骨格のダイナミクス制御]] | [[ファイル:Ohashi LIMK Fig1.png|サムネイル|'''図1. コフィリンのリン酸化・脱リン酸化によるアクチン骨格のダイナミクス制御]] | ||
コフィリンは、哺乳類では[[非筋肉型コフィリン]](別名[[n-cofilin]]、[[cofilin-1]])、[[筋肉型コフィリン]](別名[[m-cofilin]]、[[cofilin-2]])、[[Actin depolymerizing factor]]([[ADF]])(別名[[デストリン]] | コフィリンは、哺乳類では[[非筋肉型コフィリン]](別名[[n-cofilin]]、[[cofilin-1]])、[[筋肉型コフィリン]](別名[[m-cofilin]]、[[cofilin-2]])、[[Actin depolymerizing factor]]([[ADF]])(別名[[デストリン]]([[destrin]]))の3種類が存在し、同様の機能をもち、同様のリン酸化制御を受ける<ref name=Mizuno2013><pubmed>23153585</pubmed></ref>。本項ではこれらを総称してコフィリンと表記する。ショウジョウバエではssh遺伝子は1種類であるが、哺乳類では類似した3種類の遺伝子が存在している(ssh1, ssh2, ssh3)。それら全て、コフィリンに対する脱リン酸化活性を有する。 | ||
コフィリンは、主にLIMキナーゼによる3番目のセリン残基のリン酸化により不活性化されるが、SSHによって脱リン酸化されると再活性化される('''図1''' | コフィリンは、主にLIMキナーゼによる3番目のセリン残基のリン酸化により不活性化されるが、SSHによって脱リン酸化されると再活性化される('''図1''')。コフィリンのリン酸化と脱リン酸化による活性制御は、アクチン骨格の再構築を制御し、細胞の形態や機能発現に重要な役割を担っていると考えられ、LIMKとSSHは多様なシグナル伝達経路によって活性が制御されている。SSHにおいても、結合タンパク質や[[リン酸化]]修飾による調節を受けており、細胞の形態・機能発現や様々な疾患に関与することが明らかにされている<ref name=Mizuno2013></ref> <ref name=Ohashi2015><pubmed>25864508</pubmed></ref>[2][3]。 | ||
[[ファイル:Ohashi SSH Fig2.png|サムネイル|'''図2. SSHファミリーの構造と機能制御に関与する部位'''<br>リン酸化を受けるセリン残基、アクチン線維との結合部位、リン酸化コフィリン認識部位、SQSTM1/p62結合部位をSSH1に示す。 A: Aドメイン、B: Bドメイン、P: ホスファターゼドメイン、S: セリンリッチドメイン]] | [[ファイル:Ohashi SSH Fig2.png|サムネイル|'''図2. SSHファミリーの構造と機能制御に関与する部位'''<br>リン酸化を受けるセリン残基、アクチン線維との結合部位、リン酸化コフィリン認識部位、SQSTM1/p62結合部位をSSH1に示す。 A: Aドメイン、B: Bドメイン、P: ホスファターゼドメイン、S: セリンリッチドメイン]] | ||
== サブファミリーと構造 == | == サブファミリーと構造 == | ||
SSHは、哺乳類で類似した3種類のSSH1, SSH2, | SSHは、哺乳類で類似した3種類のSSH1, SSH2, SSH3が存在しファミリーを形成している。各々、スプライシングバリアントが存在し、一番長い転写産物をSSH1L, SSH2L, SSH3Lと区別する場合があるが[1]、本項ではこれら一番長いものをSSH1, SSH2, SSH3と表記する。それらはN末端側にA, Bと名付けられたファミリー間で保存された領域があり、続いてホスファターゼドメインを持つ('''図2''')。ホスファターゼドメインは、リン酸化されたチロシン残基とセリン/スレオニン残基の両方を脱リン酸化する二重特異性脱リン酸化酵素に類似した配列を有している。SSH1がコフィリンに対する脱リン酸化活性を発揮するためにはN末端のA,Bドメインが必要である<ref name=Kurita2008><pubmed>18809681</pubmed></ref> [4]。ホスファターゼドメインに続くC末端側は、SSH1, SSH2とSSH3では異なり、SSH1とSSH2はC末端付近にリン酸化修飾を受けるセリンに富む短い領域が存在するが、SSH3はそれらに比べてC末端領域は短く、セリンに富む短い領域は存在しない<ref name=Mizuno2013></ref> [2]。 | ||
SSH1は、ホスファターゼドメインのC末端の近くにオートファジーの受容体タンパク質であるSQSTM1/p62タンパク質が結合する領域が存在する<ref name=Fang2021><pubmed>33044112</pubmed></ref>[5]。また、SSH1とSSH2はアクチン線維に結合し、SSH1の分子内に少なくとも3箇所のアクチン線維と結合するモチーフを持つ(図2) <ref name=Kurita2008></ref>[4]。SSH3はアクチン線維との結合能は持たない<ref name=Ohta2003><pubmed>14531860</pubmed></ref>[6]。SSH1とSSH2は、N末端Aドメインが触媒部位をブロックして活性抑制に働く部位であり、それに続くBドメインがコフィリンを結合して基質特異性を決めている領域であることが示されている(図2) <ref name=Yang2018><pubmed>30154244</pubmed></ref>。また、アクチン線維がSSH2のAドメインに結合して、その活性抑制を解除することが示されている(図2) <ref name=Yang2018></ref>[7]。 | |||
== 遺伝子、オーソログ 種間の保存性 == | == 遺伝子、オーソログ 種間の保存性 == | ||
ヒトの3種類のssh1, ssh2, ssh3遺伝子は、各々、染色体上の12q24.11, 17q11.2, 11q13. | ヒトの3種類のssh1, ssh2, ssh3遺伝子は、各々、染色体上の12q24.11, 17q11.2, 11q13.2に位置する。ショウジョウバエではssh遺伝子は一つである。SSHとそのカウンターパートであるLIMKは後生生物から出現する。limkとssh遺伝子はショウジョウバエやウニには存在するが、酵母や線虫には存在しない。酵母や線虫などではコフィリンのリン酸化制御が行われているかは不明である。基質であるコフィリンは真核生物に広く存在し、その生存に必須であるが、そのリン酸化制御は必須ではなく、進化の過程で後生生物以後に獲得されたアクチン骨格の制御機構であると考えられる<ref name=Mizuno2013></ref> <ref name=Ohashi2015></ref> [2][3]。 | ||
== 組織発現分布 == | == 組織発現分布 == | ||
SSH1, SSH2, SSH3は全ての組織に発現している。その中で、SSH1は臓器や組織間での差があまりなく、SSH2は神経組織に比較的高く発現している。SSH3は上皮組織に高い発現が見られる<ref name=Ohta2003><pubmed>14531860</pubmed></ref><ref name=Kousaka2008><pubmed>18442045</pubmed></ref>。これらの発現パターンから、3つのSSHは、コフィリンの活性化を促す相互補完的な働きをしているとともに、組織、細胞特異的な機能を持つことが推測される。 | SSH1, SSH2, SSH3は全ての組織に発現している。その中で、SSH1は臓器や組織間での差があまりなく、SSH2は神経組織に比較的高く発現している。SSH3は上皮組織に高い発現が見られる<ref name=Ohta2003><pubmed>14531860</pubmed></ref><ref name=Kousaka2008><pubmed>18442045</pubmed></ref>[6][8]。これらの発現パターンから、3つのSSHは、コフィリンの活性化を促す相互補完的な働きをしているとともに、組織、細胞特異的な機能を持つことが推測される。 | ||
== 細胞内局在 == | == 細胞内局在 == | ||
SSH1とSSH2はアクチン線維との結合部位が3箇所存在し、細胞内のアクチン骨格、接着斑と共局在する(図2) <ref name=Yamamoto2006><pubmed>16513117</pubmed></ref>[9]。また、SSH1は細胞移動時のラメリポディアに局在する<ref name=Kurita2008></ref> <ref name=Ohta2003></ref><ref name=Nagata-Ohashi2004><pubmed>15159416</pubmed></ref><ref name=Takahashi2017><pubmed>27865840</pubmed></ref> [4][6][10][11]。また、SSH1は、938番目と978番目のセリン残基のリン酸化依存的に14-3-3タンパク質と結合することでアクチン線維から解離し、細胞質に隔離されることが示されている<ref name=Nagata-Ohashi2004></ref> [10]。SSH3は、アクチン線維への結合能を持たず、HeLa細胞に人為的に発現させた場合、細胞質と細胞の辺縁に局在する<ref name=Ohta2003></ref> [6]。SSH2は、精子の先体の形成過程に関与し、円形精子細胞のアクロソーム領域に集積することが示されている<ref name=Xu2023><pubmed> 36942942</pubmed></ref> [12]。 | |||
== 基質 == | == 基質 == | ||
SSH1, SSH2, SSH3は全て、アクチン切断・脱重合因子であるコフィリンの3番目のセリンを脱リン酸化して活性化する。SSH3のコフィリン脱リン酸化活性はSSH1, SSH2に比べて著しく弱い。SSHファミリーは、他にも脱リン酸化するタンパク質が明らかにされている<ref name=Mizuno2013></ref>。SSH1は、LIMK1のキナーゼドメインの活性化ループの508番目のスレオニンを脱リン酸化し、LIMK1の活性を抑制する働きを持つ<ref name=Soosairajah2005><pubmed>15660133</pubmed></ref> | SSH1, SSH2, SSH3は全て、アクチン切断・脱重合因子であるコフィリンの3番目のセリンを脱リン酸化して活性化する。SSH3のコフィリン脱リン酸化活性はSSH1, SSH2に比べて著しく弱い。SSHファミリーは、他にも脱リン酸化するタンパク質が明らかにされている<ref name=Mizuno2013></ref> [2]。SSH1は、LIMK1のキナーゼドメインの活性化ループの508番目のスレオニンを脱リン酸化し、LIMK1の活性を抑制する働きを持つ<ref name=Soosairajah2005><pubmed>15660133</pubmed></ref> [13]。SSH1は、F-アクチンに結合して活性化するため<ref name=Nagata-Ohashi2004></ref> [10]、LIMK1の活性化によるコフィリンのリン酸化に伴うアクチン重合の促進に対し、アクチンの重合度に合わせてコフィリンを活性化するとともにLIMK1の活性を抑制するフィードバック制御機構であると考えられる。 | ||
SSH1は、他にアクチン結合タンパク質の一つであるCoronin-1Bを脱リン酸化する<ref name=Cai2007><pubmed>17350576</pubmed></ref> [14]。Coronin-1Bは、ラメリポディアにおいてArp2/3複合体に結合してアクチン重合核形成を阻害するが、プロテインキナーゼC (PKC)によって2番目のセリン残基がリン酸化されると、その働きが低下する。SSH1は、このリン酸化されたCoronin-1Bを脱リン酸化・活性化することでArp2/3による過剰な核形成を制限して、単量体アクチンの枯渇を防ぎ、ラメリポディアにおけるアクチンターンオーバーを適切に保ち、その形成と維持に寄与していると考えられる<ref name=Cai2007><pubmed>17350576</pubmed></ref> [14]。 | |||
Coronin-1BはSSH1と結合し、SSH1をラメリポディアに局在化させることでラメリポディアにおけるコフィリンの活性化にも関与している<ref name=Cai2007><pubmed>17350576</pubmed></ref>。しかし、コフィリンをin vitroで脱リン酸化する条件では、SSH1はCoronin-1Bを脱リン酸化しないとの報告もある<ref name=Kurita2008></ref>。 | Coronin-1BはSSH1と結合し、SSH1をラメリポディアに局在化させることでラメリポディアにおけるコフィリンの活性化にも関与している<ref name=Cai2007><pubmed>17350576</pubmed></ref> [14]。しかし、コフィリンをin vitroで脱リン酸化する条件では、SSH1はCoronin-1Bを脱リン酸化しないとの報告もある<ref name=Kurita2008></ref> [4]。 | ||
また、アルツハイマー病におけるミトコンドリアの損傷による酸化ストレス応答にSSH1が関与することが見出され、SSH1はオートファゴソームの受容体として働くSQSTM1/p62の402番目のセリン残基を脱リン酸化し、損傷ミトコンドリアの除去やNrf2による酸化ストレス応答を抑制することが示されている<ref name=Fang2021></ref> [5](神経疾患との関連の項参照)。 | |||
== 活性制御因子 == | == 活性制御因子 == | ||
細胞応答におけるコフィリンのリン酸化の変動の解析やSSH1に対するプロテオミクス解析などから複数のSSHの制御因子や結合因子が同定されている('''表1''')。その中でSSH1とSSH2の主要な制御機構を記す。 | |||
{| class="wikitable" | {| class="wikitable" | ||
| 51行目: | 51行目: | ||
| アクチン線維 || 結合 || コフィリンに対するホスファターゼ活性の活性化 | | アクチン線維 || 結合 || コフィリンに対するホスファターゼ活性の活性化 | ||
|- | |- | ||
| | | カルシニューリン(PP2B) || 脱リン酸化 (pSer-937, pSer-978)|| 14-3-3タンパク質の解離によるアクチン線維への結合阻害解除 | ||
|- | |- | ||
| | | ビンキュリン || 結合 || 機械刺激依存的なコフィリンの脱リン酸化の促進 | ||
|- | |- | ||
! 不活性化因子 !! 作用 !! 機能 | ! 不活性化因子 !! 作用 !! 機能 | ||
| 59行目: | 59行目: | ||
| 14-3-3タンパク質 || リン酸化依存的結合 (pSer-937, pSer-978)|| アクチン線維からの解離によるホスファターゼ活性の不活性化 | | 14-3-3タンパク質 || リン酸化依存的結合 (pSer-937, pSer-978)|| アクチン線維からの解離によるホスファターゼ活性の不活性化 | ||
|- | |- | ||
| | | GSK3 || リン酸化 (Ser-21, Ser-25, Ser-32, Ser-35)|| コフィリンに対するホスファターゼ活性の不活性化 | ||
|- | |- | ||
| | | PAK4 || リン酸化 (N末領域) || コフィリンに対するホスファターゼ活性の不活性化 | ||
|- | |- | ||
| | | PKD1, PKD2 || リン酸化 (Ser-937, Ser-978)|| 14-3-3タンパク質の結合促進によるアクチン線維からの解離 | ||
|- | |- | ||
! その他 !! 作用 !! 機能 | ! その他 !! 作用 !! 機能 | ||
|- | |- | ||
| | | β-アレスチン || 結合 || SSH1のスパインへの局在化 | ||
|- | |- | ||
| | | IRS-4 || 結合 || PI3キナーゼに依存したコフィリンの脱リン酸化に寄与 | ||
|- | |- | ||
| | | NOD1 || 結合 || 細菌の感染による免疫応答 | ||
|- | |- | ||
| | | RanBP9 || 結合 || ミトコンドリアへのコフィリンの輸送、SSH1の分解の抑制による安定化 | ||
|- | |- | ||
| SQSTM1/p62 || 結合 || 酸化ストレス応答の抑制 | | SQSTM1/p62 || 結合 || 酸化ストレス応答の抑制 | ||
|} | |} | ||
=== アクチン線維との結合による活性化 === | === アクチン線維との結合による活性化 === | ||
SSH1は、N末端のAドメインがアクチン線維に結合することで1200倍以上活性化する<ref name=Kurita2008></ref><ref name=Nagata-Ohashi2004></ref> | SSH1は、N末端のAドメインがアクチン線維に結合することで1200倍以上活性化する<ref name=Kurita2008></ref><ref name=Nagata-Ohashi2004></ref> [4][10]。SSH1, SSH2において、N末端のAドメインからBドメインにかけては酵素活性部位に対して自己阻害領域として働き、アクチン線維がAドメインと相互作用することによってその阻害が解除されることが示されている<ref name=Kurita2008></ref><ref name=Yang2018></ref><ref name=Takahashi2017></ref> [4][7][11]。 | ||
=== リン酸化による不活性化 === | === リン酸化による不活性化 === | ||
SSH1は、リン酸化によってその局在と活性が制御されることが示されている。SSH1は、C末端領域の937番目と978番目のセリン残基がリン酸化されると、それらのリン酸化に依存して14-3-3タンパク質が結合する。結合した14-3-3タンパク質は、SSH1をアクチン線維から解離させ、細胞質へと移行させ、活性を抑制することが示された<ref name=Nagata-Ohashi2004></ref> | SSH1は、リン酸化によってその局在と活性が制御されることが示されている。SSH1は、C末端領域の937番目と978番目のセリン残基がリン酸化されると、それらのリン酸化に依存して14-3-3タンパク質が結合する。結合した14-3-3タンパク質は、SSH1をアクチン線維から解離させ、細胞質へと移行させ、活性を抑制することが示された<ref name=Nagata-Ohashi2004></ref> [10]。この937、978番目のセリンをリン酸化するリン酸化酵素として、プロテインキナーゼD1とD2 (PKD1, PKD2)が同定されている<ref name=Eiseler2009><pubmed>19329994</pubmed></ref><ref name=Peterburs2009><pubmed>19567672</pubmed></ref> [15][16]。また、PKD1は、SSH1の脱リン酸化酵素の活性中心近傍の402番目のセリン残基をリン酸化し、酵素活性を直接阻害することが示された<ref name=Spratley2011><pubmed>21832093</pubmed></ref> [17]。その他に、GSK3がSSH2のN末端のAドメイン内の21番目、25番目、32番目、35番目のセリン残基をリン酸化し、コフィリンに対する脱リン酸化活性を抑制すること<ref name=Tang2011><pubmed>22172670</pubmed></ref> [18]、PAK4がSSH1のN末端領域をリン酸化することでコフィリンに対する脱リン酸化活性を抑制することが示された<ref name=Soosairajah2005><pubmed>15660133</pubmed></ref> [13]。 | ||
=== 脱リン酸化による活性化 === | === 脱リン酸化による活性化 === | ||
SSH1の脱リン酸化による活性制御も明らかにされている。ヒト線維芽細胞に対するカルシウムイオノフォアの添加やATP、ヒスタミンの刺激による細胞内カルシウム濃度の上昇により、SSH1がカルモジュリン依存性脱リン酸化酵素であるカルシニューリンによって脱リン酸化され、コフィリンに対する脱リン酸化活性が促進されることが示された<ref name=Wang2005><pubmed>15671020</pubmed></ref> [19]。虚血を模した神経細胞に対するストレス応答やドーパミン刺激によるコフィリンの脱リン酸化においても、カルシニューリンによるSSH1の活性化が関与することを示唆する報告がある<ref name=Yuen2010><pubmed>20442266</pubmed></ref><ref name=Madineni2016><pubmed>25526862</pubmed></ref> [20][21]。 | |||
== 脳神経系における機能 == | == 脳神経系における機能 == | ||
コフィリンのリン酸化・脱リン酸化は、アクチン骨格の動的状態を制御する重要な反応であり、細胞の形態、運動性など様々な細胞応答に関与する。SSH1, SSH2, | コフィリンのリン酸化・脱リン酸化は、アクチン骨格の動的状態を制御する重要な反応であり、細胞の形態、運動性など様々な細胞応答に関与する。SSH1, SSH2, SSH3はLIMK1, LIMK2とともに脳神経にも発現しており、これらによるコフィリンのアクチン脱重合活性の正と負の制御によって神経突起の伸展・退縮やスパインの形成に関与する。 | ||
=== 神経突起の伸展、退縮 === | === 神経突起の伸展、退縮 === | ||
トリ後根神経節(DRG)細胞の神経突起やラット副腎髄質褐色腫由来のPC12細胞に対するNGFによる神経突起形成において、LIMK1やSSH1、SSH2の発現抑制はどちらも突起伸展を抑制する。また、LIMK1の過剰発現はコフィリンの過度の不活性化により伸展が抑制される<ref name=Endo2003><pubmed>12684437</pubmed></ref><ref name=Endo2007><pubmed>17360713</pubmed></ref> [22][23]。また、マウスDRG細胞に対するセマフォリンによる成長円錐の退縮や大脳皮質細胞に対するミエリン由来のNogo-66による神経突起の退縮の過程では、刺激直後にコフィリンはリン酸化が促進され、その後、SSH1による脱リン酸化が促進することが示されている<ref name=Aizawa2001><pubmed>11276226</pubmed></ref><ref name=Hsieh2006><pubmed>16421320</pubmed></ref> [24][25]。アフリカツメガエルの胚の脊髄神経細胞の初代培養において、培養後初期の4〜8時間ではBMP7の濃度勾配によって神経突起伸展が誘引されるが、一晩培養後の細胞ではBMP7の濃度勾配に対して反発が起こる。初期の突起伸展の誘引はLIMK1に依存しており、一晩培養後の反発への変換にはTRPチャネル依存的なカルシウム流入によるカルシニューリンの活性化、それに続くSSH1の活性化が必要であることが明らかにされた<ref name=Wen2007><pubmed>17606869</pubmed></ref> [26]。微小管関連蛋白質であるneuron navigator 2 (NAV2)のショウジョウバエのホモログであるSickieは、アクチン線維が豊富なキノコ体の神経軸索に局在してRac依存的な軸索の伸長に寄与する。遺伝学的な解析により、SickieはRacの下流で(Pakを介さずに)SSHによるコフィリンの脱リン酸化を促進し、軸索の伸長に寄与することが示された<ref name=Abe2014><pubmed>25411210</pubmed></ref> [27]。一方、RacはPakを介してLIMKを活性化し、コフィリンのリン酸化を促進する働きもある。sickieの変異体ではRacによるSSHの活性化が抑制され、LIMKの活性化だけが促進されるため、コフィリンの過剰なリン酸化が起こり、そのためアクチン線維のダイナミクスが低下し、軸索の伸長が阻害されると考えられる[27]。つまり、LIMKによるコフィリンのリン酸化(不活性化)とSSHによるコフィリンの脱リン酸化(活性化)の両方が軸索の伸長におけるアクチン線維のダイナミクスの制御に必要であり、LIMKとSSHの活性の適切なバランスと時空間的な制御が神経突起の伸長と退縮を決定する要因となっていると考えられる<ref name=Mizuno2013></ref><ref name=Abe2014><pubmed>25411210</pubmed></ref> [2][27]。 | |||
=== スパイン形態の制御 === | === スパイン形態の制御 === | ||
海馬スライス培養を用いた解析から長期抑制(LTD)の誘導によってスパイン後膜が細長く縮小する形態変化が見出されるが、これに対し、コフィリンのN末端のリン酸化ペプチドを細胞に導入してSSHの活性を抑制するとその形態変化が抑制されることが示された<ref name=Zhou2004><pubmed>15572107</pubmed></ref>[28]。また、大脳皮質神経細胞や皮質のスライス培養におけるAMPA受容体を介した興奮性シナプス後電流(excitatory postsynaptic current; EPSC)や長期増強(LTP)の発生にSSH1が必要であることが示された<ref name=Yuen2010><pubmed>20442266</pubmed></ref><ref name=Gu2010><pubmed>20835250</pubmed></ref> [29][20]。その分子機構として、SSH1はコフィリンの活性化によるアクチン骨格の再構築を介してAMPA受容体をスパインへ輸送することに寄与することが示されている<ref name=Yuen2010><pubmed>20442266</pubmed></ref><ref name=Gu2010><pubmed>20835250</pubmed></ref> [20][29]。エフリンAはチロシンキナーゼ型受容体のEph Aを介して樹状突起のスパインを細長い形態へと変化させることが見出され、その過程は、Eph Aからのシグナルがカルシニューリンを介したSSH1の活性化とコフィリンの活性化によって引き起こされることが示された<ref name=Zhou2012><pubmed>22282498</pubmed></ref> [30]。また、NMDAの刺激により海馬神経細胞の樹状突起の成熟したマッシュルーム様の形態をしたスパインが縮小するが、これにはβ-アレスチン-2がコフィリンと結合してスパインへコフィリンを輸送することが必要であること、β-アレスチン-2とともにスパインへ移行したSSH1は、コフィリンを脱リン酸化してスパインのリモデリングに寄与することが示された<ref name=Pontrello2012><pubmed> 22308427</pubmed></ref> [31]。 | |||
== 神経細胞以外の細胞応答 == | == 神経細胞以外の細胞応答 == | ||
3種類のSSHについて遺伝子欠損マウスが作製され、細胞機能の解析に用いられている。うちssh3遺伝子の欠損マウスは正常に発生し、生殖能力にも影響は見られていない<ref name=Kousaka2008></ref>。 | 3種類のSSHについて遺伝子欠損マウスが作製され、細胞機能の解析に用いられている。うちssh3遺伝子の欠損マウスは正常に発生し、生殖能力にも影響は見られていない<ref name=Kousaka2008></ref> [8]。 | ||
=== 細胞分裂 === | === 細胞分裂 === | ||
細胞分裂の進行において、コフィリンのリン酸化による活性制御が重要な働きを持つことが示されている。コフィリンは、M期前期・中期に高いレベルでリン酸化されており、終期、分裂期に脱リン酸化される。コフィリンのリン酸化レベルの変化に相関して、LIMK1のリン酸化活性は前期・中期で高く、終期・分裂期では低く、SSH1の脱リン酸化活性は前期・中期で低く、終期・分裂期に高くなる<ref name=Kaji2003><pubmed>12807904</pubmed></ref>[32]。SSH1の働きを抑制すると分裂溝のアクチン線維の収縮が阻害され、分裂の失敗による多核細胞の増加が引き起こされる。SSH1は、前期・中期には高度にリン酸化されており、また、終期・細胞質分裂期には脱リン酸化される。SSH1は終期・細胞質分裂期には収縮環とミッドボディーに局在する。これらを総合すると、SSH1は、M期前期・中期にはリン酸化により活性が抑制されており、終期・細胞質分裂期には脱リン酸化されアクチン線維との結合によって活性化され、コフィリンの脱リン酸化によるアクチン骨格の動態を活発化することで細胞分裂の遂行に寄与すると考えられる<ref name=Kaji2003><pubmed>12807904</pubmed></ref> [32]。 | |||
=== 減数分裂 === | === 減数分裂 === | ||
アフリカツメガエルの未熟な卵母細胞は、第一減数分裂前期で停止しており、コフィリンが高度にリン酸化されている。減数分裂が進行する上で、SSHによるコフィリンの脱リン酸化が必要である。その過程で、SSHは、C末端付近が高度にリン酸化され、アクチン線維との親和性を上昇させることでコフィリンの脱リン酸化・活性化を促進し、減数分裂の進行、紡錘体の形成に寄与することが示された<ref name=Iwase2013><pubmed>23615437</pubmed></ref> [33]。前項でSSH1のC末端領域のリン酸化はSSH1を不活性化することを記述したが、アフリカツメガエルのSSHのC末端側の配列は、哺乳類のSSH1, SSH2と相同性が低く、異なる制御を受けていると考えられる<ref name=Iwase2013><pubmed>23615437</pubmed></ref> [33]。 | |||
=== 細胞遊走 === | === 細胞遊走 === | ||
ヒト急性T細胞性白血病細胞株Jurkat細胞に対するSDF-1刺激による細胞遊走では、最初に一過的に全方位にラメリポディアが形成され、その後、徐々にラメリポディアの形成部位が限定され一方向に収束し、細胞は移動極性を獲得して一方向に移動するようになる。この過程で、コフィリンは、刺激後、一過的にリン酸レベルが上昇し、その後、刺激前のレベルまで低下し、その過程はラメリポディア形成の変化と対応する。LIMK1とSSH1の発現抑制の解析から、LIMK1はラメリポディアの突出に必要であり、SSH1はラメリポディアの退縮に必要であるとともに、ラメリポディアの形成部位を一方向に限定する移動極性の形成に必要であることが示された<ref name=Nishita2005><pubmed>16230460</pubmed></ref> [34]。 | |||
=== 精子形成 === | === 精子形成 === | ||
SSH2の遺伝子欠損マウスは、精子の先体反応に必要なアクロソームの形成異常により精子形成が不全となりオスの不妊になることが明らかにされた<ref name=Xu2023><pubmed> 36942942</pubmed></ref> [12]。SSH2欠損によるアクロソームの形成不全は、ゴルジ体からの前アクロソーム小胞の移動と融合が停止してしまうことが原因であり、この過程でSSH2によるコフィリンの活性化を介したアクチン骨格の再構築が必要であることが示唆された<ref name=Xu2023><pubmed> 36942942</pubmed></ref> [12]。 | |||
=== 心臓の発生 === | === 心臓の発生 === | ||
ゼブラフィッシュをモデルとした機械刺激応答による心臓の形態形成の制御において、その過程に必要であるビンキュリンの結合タンパク質としてSSH1が同定された<ref name=Fukuda2019><pubmed>31495694</pubmed></ref> [35]。SSH1は、細胞への機械的力負荷に依存してN末端領域でビンキュリンと直接結合し、コフィリンを活性化することが示され、この経路は心筋細胞内の整列したサルコメアの形成に必要であることが示された<ref name=Fukuda2019><pubmed>31495694</pubmed></ref> [35]。 | |||
=== 血管=== | === 血管=== | ||
ssh1遺伝子の欠損マウスは正常に生まれ表現型に異常は見られないが、アンジオテンシン投与による高血圧の誘導における血管のリモデリングにおいて線維化を悪化させることが示された。この知見から、SSH1は血管の炎症時のTGF-βシグナルを抑制し、過剰な線維化を防止する働きがあることが示唆された<ref name=Williams2019><pubmed>30291325</pubmed></ref> [36]。 | |||
== 疾患との関わり == | == 疾患との関わり == | ||
=== アルツハイマー病 === | === アルツハイマー病 === | ||
病初期の神経細胞傷害に関わる酸化ストレスにおいて、SSH1は複数の過程に関与し増悪因子として機能することが示されている。原因因子の一つであるアミロイドβオリゴマー(Aβオリゴマー)は、神経細胞に対してインテグリン依存的にSSH1を活性化し、コフィリンを脱リン酸化する。脱リン酸化されたコフィリンはアミロイド前駆体タンパク質やインテグリンの取り込みを促進する機能を持つRan-binding protein 9 (RanBP9)とともにミトコンドリアに移行し、活性酸素種(ROS)の産生を誘導する。その酸化ストレスによってコフィリンのシステイン残基が酸化され、ジスルフィド結合を形成して多量体化してアクチン線維との凝集体であるアクチンロッドを形成し、神経細胞の傷害を引き起こすことが示されている<ref name=Woo2015><pubmed>25741591</pubmed></ref> [38]。また、RanBP9は、SSH1の分解を抑制して安定化に働くことでAβオリゴマーによるコフィリンの活性化に寄与していることが示された<ref name=Woo2015><pubmed>25741591</pubmed></ref> [38]。 | |||
これとは別に、SSH1は、オートファジーの隔離膜にユビキチン化されたミトコンドリアなどを結合する受容体として働くSQSTM1/p62に結合し、SQSTM1/p62の活性に必要な402番目のセリン残基のリン酸基を脱リン酸化し、傷ついたミトコンドリアのオートファジーによる除去(マイトファジー)を抑制することが明らかにされた<ref name=Fang2021></ref> [5]。さらに、SSH1は、ホスファターゼドメインよりC末端側でSQSTM1/p62と結合し(図2)、その脱リン酸化活性に依存せずにマイトファジーを抑制することで細胞内のROSの増加を引き起こし、神経細胞の傷害を増悪化することが示された<ref name=Cazzaro2023b><pubmed>36637427</pubmed></ref> [39]。 | |||
また、病初期に起こる酸化的障害に対して、転写因子Nrf2が保護的に働くが、SQSTM1/p62は、Nrf2の分解を促進するKeap1と競合的に結合し、Nrf2の分解を抑制して、その細胞防御機能を強化する。SSH1は、SQSTM1/p62に結合して、Keap1のNrf2への結合を促進することでNrf2の分解を促進し、酸化的な細胞障害に対する保護機能を減弱させることが示された。 | |||
これらのアルツハイマー病の原因となる現象はSSH1の発現抑制や遺伝子欠損によって回復することが示されている<ref name= | これらのアルツハイマー病の原因となる現象はSSH1の発現抑制や遺伝子欠損によって回復することが示されている<ref name=Cazzaro2023></ref> [37]。 | ||
一方、γセクレターゼによるアミロイドβの生成によってSSH1の活性が抑制され、コフィリンのリン酸化が亢進し、神経細胞の傷害を引き起こしているとの報告がある<ref name=Barone2014><pubmed>25315299</pubmed></ref> [40]。この矛盾する結果は、解析した対象個体の年齢の違いによると説明されているが詳細は不明である<ref name=Barone2014><pubmed>25315299</pubmed></ref> [40]。 | |||
=== 癌 === | === 癌 === | ||
複数種類の癌において、癌の悪性化とSSHの関連性が報告されている<ref name=Gao2021><pubmed>33964330</pubmed></ref> | 複数種類の癌において、癌の悪性化とSSHの関連性が報告されている<ref name=Gao2021><pubmed>33964330</pubmed></ref> [41]。いずれもSSHの発現の上昇と癌の悪性化が相関している。LIMK1の発現の上昇も癌の悪性化と相関しており、LIMKとSSHによるコフィリンの活性制御のバランスの変化が癌細胞の運動性や浸潤能を亢進し、癌の悪性化をもたらすのではないかと考えられる。SSH1とSSH2においては、乳癌<ref name=Chen2017><pubmed>29029503</pubmed></ref> [42]、膵臓癌、大腸癌、胃癌、膀胱尿路上皮癌、肝癌との関連が示されている<ref name=Gao2021><pubmed>33964330</pubmed></ref> [41]。SSH3においては膵臓癌<ref name=Wang2015><pubmed>25684665</pubmed></ref><ref name=Yang2024><pubmed>38726290</pubmed></ref> [43][44]、転移性前立腺癌<ref name=Muller2018><pubmed>29248718</pubmed></ref> [45]、大腸癌<ref name=Hu2019><pubmed> 31218112</pubmed></ref><ref name=Song2020><pubmed>32020663</pubmed></ref> [46][47]との関連が示されている。また、腸膜上皮細胞の細胞層を肝癌細胞が頂端側から基底側に浸潤するモデル系において、SSH1はその浸潤に必要であることが示されている<ref name=Horita2008><pubmed>18171679</pubmed></ref> [48]。 | ||
== 関連用語 == | == 関連用語 == | ||
2025年7月5日 (土) 00:13時点における版
大橋 一正、水野 健作
東北大学 大学院生命科学研究科 分子化学生物学専攻
DOI:10.14931/bsd.11095 原稿受付日:2025年6月19日 原稿完成日:2025年6月23日
担当編集委員:古屋敷 智之(東京科学大学大学院 医歯学総合研究科 薬理学分野)
英:Slingshot
英略語:SSH
スリングショット(SSH)は、二重特異性ホスファターゼ(Dual-specificity phosphatase)に属するタンパク質脱リン酸化酵素で、ヒトでは類似した構造を持つ3種類のSSH1, SSH2, SSH3が存在し、サブファミリーを形成している。これらのSSHは全て、アクチン線維の切断・脱重合因子であるコフィリンを基質とし、その3番目のリン酸化されたセリン残基を脱リン酸化する。コフィリンは、細胞内アクチン線維を切断・脱重合することで単量体アクチンの生成とアクチン骨格のダイナミクスを生み出す細胞の生存に必須のタンパク質である。コフィリンは、主にLIMキナーゼ(LIMK)によって3番目のセリン残基がリン酸化されると不活性化し、SSHによって脱リン酸化されると再活性化される。SSHとLIMKは、アクチン線維の重合と脱重合のバランスを制御することから、神経細胞を含む様々な細胞の形態や機能に関与し、多様なシグナル伝達経路によって活性が制御されている。その機能の欠損や異常は、アルツハイマー病や癌の悪性化に関わることが示唆されている。
スリングショットとは
最初、ショウジョウバエの翅の毛や背の剛毛の形態異常の変異体の原因遺伝子として同定された。変異体では剛毛の先が二股に分かれるY字型の形状をもつことからslingshotと名付けられた[1]。この遺伝子は、二重特異性ホスファターゼ (dual-specificity phosphatase)に属するタンパク質脱リン酸化酵素をコードしていた。また、剛毛の形態異常はアクチン細胞骨格の制御因子の変異に起因する例が知られており、slingshot変異細胞ではアクチンの過重合がみられることから、SSHの基質の候補としてアクチン線維の切断・脱重合因子であり、脱リン酸化によって活性化されるコフィリンが推測された。その可能性は哺乳類の培養細胞を用いて検討され、コフィリンがSSHの基質であることが明らかにされた[1]。ショウジョウバエにおけるssh遺伝子の機能不全は、毛だけではなく、上皮組織、個眼などでアクチンの過重合を伴う形態異常を示す。コフィリンのリン酸化酵素であるLIMドメイン含有キナーゼ (LIMキナーゼ, LIMK)を過剰発現させてもアクチンの過重合が生じるが、LIMKとSSHを共発現させると過重合がなくなることから、SSHはコフィリン脱リン酸化酵素であることが支持された[2]。
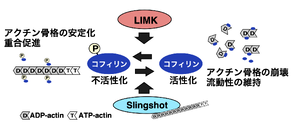
コフィリンは、哺乳類では非筋肉型コフィリン(別名n-cofilin、cofilin-1)、筋肉型コフィリン(別名m-cofilin、cofilin-2)、Actin depolymerizing factor(ADF)(別名デストリン(destrin))の3種類が存在し、同様の機能をもち、同様のリン酸化制御を受ける[3]。本項ではこれらを総称してコフィリンと表記する。ショウジョウバエではssh遺伝子は1種類であるが、哺乳類では類似した3種類の遺伝子が存在している(ssh1, ssh2, ssh3)。それら全て、コフィリンに対する脱リン酸化活性を有する。
コフィリンは、主にLIMキナーゼによる3番目のセリン残基のリン酸化により不活性化されるが、SSHによって脱リン酸化されると再活性化される(図1)。コフィリンのリン酸化と脱リン酸化による活性制御は、アクチン骨格の再構築を制御し、細胞の形態や機能発現に重要な役割を担っていると考えられ、LIMKとSSHは多様なシグナル伝達経路によって活性が制御されている。SSHにおいても、結合タンパク質やリン酸化修飾による調節を受けており、細胞の形態・機能発現や様々な疾患に関与することが明らかにされている[3] [4][2][3]。
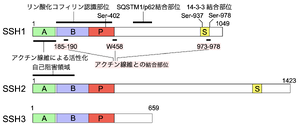
リン酸化を受けるセリン残基、アクチン線維との結合部位、リン酸化コフィリン認識部位、SQSTM1/p62結合部位をSSH1に示す。 A: Aドメイン、B: Bドメイン、P: ホスファターゼドメイン、S: セリンリッチドメイン
サブファミリーと構造
SSHは、哺乳類で類似した3種類のSSH1, SSH2, SSH3が存在しファミリーを形成している。各々、スプライシングバリアントが存在し、一番長い転写産物をSSH1L, SSH2L, SSH3Lと区別する場合があるが[1]、本項ではこれら一番長いものをSSH1, SSH2, SSH3と表記する。それらはN末端側にA, Bと名付けられたファミリー間で保存された領域があり、続いてホスファターゼドメインを持つ(図2)。ホスファターゼドメインは、リン酸化されたチロシン残基とセリン/スレオニン残基の両方を脱リン酸化する二重特異性脱リン酸化酵素に類似した配列を有している。SSH1がコフィリンに対する脱リン酸化活性を発揮するためにはN末端のA,Bドメインが必要である[5] [4]。ホスファターゼドメインに続くC末端側は、SSH1, SSH2とSSH3では異なり、SSH1とSSH2はC末端付近にリン酸化修飾を受けるセリンに富む短い領域が存在するが、SSH3はそれらに比べてC末端領域は短く、セリンに富む短い領域は存在しない[3] [2]。
SSH1は、ホスファターゼドメインのC末端の近くにオートファジーの受容体タンパク質であるSQSTM1/p62タンパク質が結合する領域が存在する[6][5]。また、SSH1とSSH2はアクチン線維に結合し、SSH1の分子内に少なくとも3箇所のアクチン線維と結合するモチーフを持つ(図2) [5][4]。SSH3はアクチン線維との結合能は持たない[7][6]。SSH1とSSH2は、N末端Aドメインが触媒部位をブロックして活性抑制に働く部位であり、それに続くBドメインがコフィリンを結合して基質特異性を決めている領域であることが示されている(図2) [8]。また、アクチン線維がSSH2のAドメインに結合して、その活性抑制を解除することが示されている(図2) [8][7]。
遺伝子、オーソログ 種間の保存性
ヒトの3種類のssh1, ssh2, ssh3遺伝子は、各々、染色体上の12q24.11, 17q11.2, 11q13.2に位置する。ショウジョウバエではssh遺伝子は一つである。SSHとそのカウンターパートであるLIMKは後生生物から出現する。limkとssh遺伝子はショウジョウバエやウニには存在するが、酵母や線虫には存在しない。酵母や線虫などではコフィリンのリン酸化制御が行われているかは不明である。基質であるコフィリンは真核生物に広く存在し、その生存に必須であるが、そのリン酸化制御は必須ではなく、進化の過程で後生生物以後に獲得されたアクチン骨格の制御機構であると考えられる[3] [4] [2][3]。
組織発現分布
SSH1, SSH2, SSH3は全ての組織に発現している。その中で、SSH1は臓器や組織間での差があまりなく、SSH2は神経組織に比較的高く発現している。SSH3は上皮組織に高い発現が見られる[7][9][6][8]。これらの発現パターンから、3つのSSHは、コフィリンの活性化を促す相互補完的な働きをしているとともに、組織、細胞特異的な機能を持つことが推測される。
細胞内局在
SSH1とSSH2はアクチン線維との結合部位が3箇所存在し、細胞内のアクチン骨格、接着斑と共局在する(図2) [10][9]。また、SSH1は細胞移動時のラメリポディアに局在する[5] [7][11][12] [4][6][10][11]。また、SSH1は、938番目と978番目のセリン残基のリン酸化依存的に14-3-3タンパク質と結合することでアクチン線維から解離し、細胞質に隔離されることが示されている[11] [10]。SSH3は、アクチン線維への結合能を持たず、HeLa細胞に人為的に発現させた場合、細胞質と細胞の辺縁に局在する[7] [6]。SSH2は、精子の先体の形成過程に関与し、円形精子細胞のアクロソーム領域に集積することが示されている[13] [12]。
基質
SSH1, SSH2, SSH3は全て、アクチン切断・脱重合因子であるコフィリンの3番目のセリンを脱リン酸化して活性化する。SSH3のコフィリン脱リン酸化活性はSSH1, SSH2に比べて著しく弱い。SSHファミリーは、他にも脱リン酸化するタンパク質が明らかにされている[3] [2]。SSH1は、LIMK1のキナーゼドメインの活性化ループの508番目のスレオニンを脱リン酸化し、LIMK1の活性を抑制する働きを持つ[14] [13]。SSH1は、F-アクチンに結合して活性化するため[11] [10]、LIMK1の活性化によるコフィリンのリン酸化に伴うアクチン重合の促進に対し、アクチンの重合度に合わせてコフィリンを活性化するとともにLIMK1の活性を抑制するフィードバック制御機構であると考えられる。
SSH1は、他にアクチン結合タンパク質の一つであるCoronin-1Bを脱リン酸化する[15] [14]。Coronin-1Bは、ラメリポディアにおいてArp2/3複合体に結合してアクチン重合核形成を阻害するが、プロテインキナーゼC (PKC)によって2番目のセリン残基がリン酸化されると、その働きが低下する。SSH1は、このリン酸化されたCoronin-1Bを脱リン酸化・活性化することでArp2/3による過剰な核形成を制限して、単量体アクチンの枯渇を防ぎ、ラメリポディアにおけるアクチンターンオーバーを適切に保ち、その形成と維持に寄与していると考えられる[15] [14]。
Coronin-1BはSSH1と結合し、SSH1をラメリポディアに局在化させることでラメリポディアにおけるコフィリンの活性化にも関与している[15] [14]。しかし、コフィリンをin vitroで脱リン酸化する条件では、SSH1はCoronin-1Bを脱リン酸化しないとの報告もある[5] [4]。
また、アルツハイマー病におけるミトコンドリアの損傷による酸化ストレス応答にSSH1が関与することが見出され、SSH1はオートファゴソームの受容体として働くSQSTM1/p62の402番目のセリン残基を脱リン酸化し、損傷ミトコンドリアの除去やNrf2による酸化ストレス応答を抑制することが示されている[6] [5](神経疾患との関連の項参照)。
活性制御因子
細胞応答におけるコフィリンのリン酸化の変動の解析やSSH1に対するプロテオミクス解析などから複数のSSHの制御因子や結合因子が同定されている(表1)。その中でSSH1とSSH2の主要な制御機構を記す。
| 活性化因子 | 作用 | 機能 |
|---|---|---|
| アクチン線維 | 結合 | コフィリンに対するホスファターゼ活性の活性化 |
| カルシニューリン(PP2B) | 脱リン酸化 (pSer-937, pSer-978) | 14-3-3タンパク質の解離によるアクチン線維への結合阻害解除 |
| ビンキュリン | 結合 | 機械刺激依存的なコフィリンの脱リン酸化の促進 |
| 不活性化因子 | 作用 | 機能 |
| 14-3-3タンパク質 | リン酸化依存的結合 (pSer-937, pSer-978) | アクチン線維からの解離によるホスファターゼ活性の不活性化 |
| GSK3 | リン酸化 (Ser-21, Ser-25, Ser-32, Ser-35) | コフィリンに対するホスファターゼ活性の不活性化 |
| PAK4 | リン酸化 (N末領域) | コフィリンに対するホスファターゼ活性の不活性化 |
| PKD1, PKD2 | リン酸化 (Ser-937, Ser-978) | 14-3-3タンパク質の結合促進によるアクチン線維からの解離 |
| その他 | 作用 | 機能 |
| β-アレスチン | 結合 | SSH1のスパインへの局在化 |
| IRS-4 | 結合 | PI3キナーゼに依存したコフィリンの脱リン酸化に寄与 |
| NOD1 | 結合 | 細菌の感染による免疫応答 |
| RanBP9 | 結合 | ミトコンドリアへのコフィリンの輸送、SSH1の分解の抑制による安定化 |
| SQSTM1/p62 | 結合 | 酸化ストレス応答の抑制 |
アクチン線維との結合による活性化
SSH1は、N末端のAドメインがアクチン線維に結合することで1200倍以上活性化する[5][11] [4][10]。SSH1, SSH2において、N末端のAドメインからBドメインにかけては酵素活性部位に対して自己阻害領域として働き、アクチン線維がAドメインと相互作用することによってその阻害が解除されることが示されている[5][8][12] [4][7][11]。
リン酸化による不活性化
SSH1は、リン酸化によってその局在と活性が制御されることが示されている。SSH1は、C末端領域の937番目と978番目のセリン残基がリン酸化されると、それらのリン酸化に依存して14-3-3タンパク質が結合する。結合した14-3-3タンパク質は、SSH1をアクチン線維から解離させ、細胞質へと移行させ、活性を抑制することが示された[11] [10]。この937、978番目のセリンをリン酸化するリン酸化酵素として、プロテインキナーゼD1とD2 (PKD1, PKD2)が同定されている[16][17] [15][16]。また、PKD1は、SSH1の脱リン酸化酵素の活性中心近傍の402番目のセリン残基をリン酸化し、酵素活性を直接阻害することが示された[18] [17]。その他に、GSK3がSSH2のN末端のAドメイン内の21番目、25番目、32番目、35番目のセリン残基をリン酸化し、コフィリンに対する脱リン酸化活性を抑制すること[19] [18]、PAK4がSSH1のN末端領域をリン酸化することでコフィリンに対する脱リン酸化活性を抑制することが示された[14] [13]。
脱リン酸化による活性化
SSH1の脱リン酸化による活性制御も明らかにされている。ヒト線維芽細胞に対するカルシウムイオノフォアの添加やATP、ヒスタミンの刺激による細胞内カルシウム濃度の上昇により、SSH1がカルモジュリン依存性脱リン酸化酵素であるカルシニューリンによって脱リン酸化され、コフィリンに対する脱リン酸化活性が促進されることが示された[20] [19]。虚血を模した神経細胞に対するストレス応答やドーパミン刺激によるコフィリンの脱リン酸化においても、カルシニューリンによるSSH1の活性化が関与することを示唆する報告がある[21][22] [20][21]。
脳神経系における機能
コフィリンのリン酸化・脱リン酸化は、アクチン骨格の動的状態を制御する重要な反応であり、細胞の形態、運動性など様々な細胞応答に関与する。SSH1, SSH2, SSH3はLIMK1, LIMK2とともに脳神経にも発現しており、これらによるコフィリンのアクチン脱重合活性の正と負の制御によって神経突起の伸展・退縮やスパインの形成に関与する。
神経突起の伸展、退縮
トリ後根神経節(DRG)細胞の神経突起やラット副腎髄質褐色腫由来のPC12細胞に対するNGFによる神経突起形成において、LIMK1やSSH1、SSH2の発現抑制はどちらも突起伸展を抑制する。また、LIMK1の過剰発現はコフィリンの過度の不活性化により伸展が抑制される[23][24] [22][23]。また、マウスDRG細胞に対するセマフォリンによる成長円錐の退縮や大脳皮質細胞に対するミエリン由来のNogo-66による神経突起の退縮の過程では、刺激直後にコフィリンはリン酸化が促進され、その後、SSH1による脱リン酸化が促進することが示されている[25][26] [24][25]。アフリカツメガエルの胚の脊髄神経細胞の初代培養において、培養後初期の4〜8時間ではBMP7の濃度勾配によって神経突起伸展が誘引されるが、一晩培養後の細胞ではBMP7の濃度勾配に対して反発が起こる。初期の突起伸展の誘引はLIMK1に依存しており、一晩培養後の反発への変換にはTRPチャネル依存的なカルシウム流入によるカルシニューリンの活性化、それに続くSSH1の活性化が必要であることが明らかにされた[27] [26]。微小管関連蛋白質であるneuron navigator 2 (NAV2)のショウジョウバエのホモログであるSickieは、アクチン線維が豊富なキノコ体の神経軸索に局在してRac依存的な軸索の伸長に寄与する。遺伝学的な解析により、SickieはRacの下流で(Pakを介さずに)SSHによるコフィリンの脱リン酸化を促進し、軸索の伸長に寄与することが示された[28] [27]。一方、RacはPakを介してLIMKを活性化し、コフィリンのリン酸化を促進する働きもある。sickieの変異体ではRacによるSSHの活性化が抑制され、LIMKの活性化だけが促進されるため、コフィリンの過剰なリン酸化が起こり、そのためアクチン線維のダイナミクスが低下し、軸索の伸長が阻害されると考えられる[27]。つまり、LIMKによるコフィリンのリン酸化(不活性化)とSSHによるコフィリンの脱リン酸化(活性化)の両方が軸索の伸長におけるアクチン線維のダイナミクスの制御に必要であり、LIMKとSSHの活性の適切なバランスと時空間的な制御が神経突起の伸長と退縮を決定する要因となっていると考えられる[3][28] [2][27]。
スパイン形態の制御
海馬スライス培養を用いた解析から長期抑制(LTD)の誘導によってスパイン後膜が細長く縮小する形態変化が見出されるが、これに対し、コフィリンのN末端のリン酸化ペプチドを細胞に導入してSSHの活性を抑制するとその形態変化が抑制されることが示された[29][28]。また、大脳皮質神経細胞や皮質のスライス培養におけるAMPA受容体を介した興奮性シナプス後電流(excitatory postsynaptic current; EPSC)や長期増強(LTP)の発生にSSH1が必要であることが示された[21][30] [29][20]。その分子機構として、SSH1はコフィリンの活性化によるアクチン骨格の再構築を介してAMPA受容体をスパインへ輸送することに寄与することが示されている[21][30] [20][29]。エフリンAはチロシンキナーゼ型受容体のEph Aを介して樹状突起のスパインを細長い形態へと変化させることが見出され、その過程は、Eph Aからのシグナルがカルシニューリンを介したSSH1の活性化とコフィリンの活性化によって引き起こされることが示された[31] [30]。また、NMDAの刺激により海馬神経細胞の樹状突起の成熟したマッシュルーム様の形態をしたスパインが縮小するが、これにはβ-アレスチン-2がコフィリンと結合してスパインへコフィリンを輸送することが必要であること、β-アレスチン-2とともにスパインへ移行したSSH1は、コフィリンを脱リン酸化してスパインのリモデリングに寄与することが示された[32] [31]。
神経細胞以外の細胞応答
3種類のSSHについて遺伝子欠損マウスが作製され、細胞機能の解析に用いられている。うちssh3遺伝子の欠損マウスは正常に発生し、生殖能力にも影響は見られていない[9] [8]。
細胞分裂
細胞分裂の進行において、コフィリンのリン酸化による活性制御が重要な働きを持つことが示されている。コフィリンは、M期前期・中期に高いレベルでリン酸化されており、終期、分裂期に脱リン酸化される。コフィリンのリン酸化レベルの変化に相関して、LIMK1のリン酸化活性は前期・中期で高く、終期・分裂期では低く、SSH1の脱リン酸化活性は前期・中期で低く、終期・分裂期に高くなる[33][32]。SSH1の働きを抑制すると分裂溝のアクチン線維の収縮が阻害され、分裂の失敗による多核細胞の増加が引き起こされる。SSH1は、前期・中期には高度にリン酸化されており、また、終期・細胞質分裂期には脱リン酸化される。SSH1は終期・細胞質分裂期には収縮環とミッドボディーに局在する。これらを総合すると、SSH1は、M期前期・中期にはリン酸化により活性が抑制されており、終期・細胞質分裂期には脱リン酸化されアクチン線維との結合によって活性化され、コフィリンの脱リン酸化によるアクチン骨格の動態を活発化することで細胞分裂の遂行に寄与すると考えられる[33] [32]。
減数分裂
アフリカツメガエルの未熟な卵母細胞は、第一減数分裂前期で停止しており、コフィリンが高度にリン酸化されている。減数分裂が進行する上で、SSHによるコフィリンの脱リン酸化が必要である。その過程で、SSHは、C末端付近が高度にリン酸化され、アクチン線維との親和性を上昇させることでコフィリンの脱リン酸化・活性化を促進し、減数分裂の進行、紡錘体の形成に寄与することが示された[34] [33]。前項でSSH1のC末端領域のリン酸化はSSH1を不活性化することを記述したが、アフリカツメガエルのSSHのC末端側の配列は、哺乳類のSSH1, SSH2と相同性が低く、異なる制御を受けていると考えられる[34] [33]。
細胞遊走
ヒト急性T細胞性白血病細胞株Jurkat細胞に対するSDF-1刺激による細胞遊走では、最初に一過的に全方位にラメリポディアが形成され、その後、徐々にラメリポディアの形成部位が限定され一方向に収束し、細胞は移動極性を獲得して一方向に移動するようになる。この過程で、コフィリンは、刺激後、一過的にリン酸レベルが上昇し、その後、刺激前のレベルまで低下し、その過程はラメリポディア形成の変化と対応する。LIMK1とSSH1の発現抑制の解析から、LIMK1はラメリポディアの突出に必要であり、SSH1はラメリポディアの退縮に必要であるとともに、ラメリポディアの形成部位を一方向に限定する移動極性の形成に必要であることが示された[35] [34]。
精子形成
SSH2の遺伝子欠損マウスは、精子の先体反応に必要なアクロソームの形成異常により精子形成が不全となりオスの不妊になることが明らかにされた[13] [12]。SSH2欠損によるアクロソームの形成不全は、ゴルジ体からの前アクロソーム小胞の移動と融合が停止してしまうことが原因であり、この過程でSSH2によるコフィリンの活性化を介したアクチン骨格の再構築が必要であることが示唆された[13] [12]。
心臓の発生
ゼブラフィッシュをモデルとした機械刺激応答による心臓の形態形成の制御において、その過程に必要であるビンキュリンの結合タンパク質としてSSH1が同定された[36] [35]。SSH1は、細胞への機械的力負荷に依存してN末端領域でビンキュリンと直接結合し、コフィリンを活性化することが示され、この経路は心筋細胞内の整列したサルコメアの形成に必要であることが示された[36] [35]。
血管
ssh1遺伝子の欠損マウスは正常に生まれ表現型に異常は見られないが、アンジオテンシン投与による高血圧の誘導における血管のリモデリングにおいて線維化を悪化させることが示された。この知見から、SSH1は血管の炎症時のTGF-βシグナルを抑制し、過剰な線維化を防止する働きがあることが示唆された[37] [36]。
疾患との関わり
アルツハイマー病
病初期の神経細胞傷害に関わる酸化ストレスにおいて、SSH1は複数の過程に関与し増悪因子として機能することが示されている。原因因子の一つであるアミロイドβオリゴマー(Aβオリゴマー)は、神経細胞に対してインテグリン依存的にSSH1を活性化し、コフィリンを脱リン酸化する。脱リン酸化されたコフィリンはアミロイド前駆体タンパク質やインテグリンの取り込みを促進する機能を持つRan-binding protein 9 (RanBP9)とともにミトコンドリアに移行し、活性酸素種(ROS)の産生を誘導する。その酸化ストレスによってコフィリンのシステイン残基が酸化され、ジスルフィド結合を形成して多量体化してアクチン線維との凝集体であるアクチンロッドを形成し、神経細胞の傷害を引き起こすことが示されている[38] [38]。また、RanBP9は、SSH1の分解を抑制して安定化に働くことでAβオリゴマーによるコフィリンの活性化に寄与していることが示された[38] [38]。
これとは別に、SSH1は、オートファジーの隔離膜にユビキチン化されたミトコンドリアなどを結合する受容体として働くSQSTM1/p62に結合し、SQSTM1/p62の活性に必要な402番目のセリン残基のリン酸基を脱リン酸化し、傷ついたミトコンドリアのオートファジーによる除去(マイトファジー)を抑制することが明らかにされた[6] [5]。さらに、SSH1は、ホスファターゼドメインよりC末端側でSQSTM1/p62と結合し(図2)、その脱リン酸化活性に依存せずにマイトファジーを抑制することで細胞内のROSの増加を引き起こし、神経細胞の傷害を増悪化することが示された[39] [39]。
また、病初期に起こる酸化的障害に対して、転写因子Nrf2が保護的に働くが、SQSTM1/p62は、Nrf2の分解を促進するKeap1と競合的に結合し、Nrf2の分解を抑制して、その細胞防御機能を強化する。SSH1は、SQSTM1/p62に結合して、Keap1のNrf2への結合を促進することでNrf2の分解を促進し、酸化的な細胞障害に対する保護機能を減弱させることが示された。
これらのアルツハイマー病の原因となる現象はSSH1の発現抑制や遺伝子欠損によって回復することが示されている[40] [37]。
一方、γセクレターゼによるアミロイドβの生成によってSSH1の活性が抑制され、コフィリンのリン酸化が亢進し、神経細胞の傷害を引き起こしているとの報告がある[41] [40]。この矛盾する結果は、解析した対象個体の年齢の違いによると説明されているが詳細は不明である[41] [40]。
癌
複数種類の癌において、癌の悪性化とSSHの関連性が報告されている[42] [41]。いずれもSSHの発現の上昇と癌の悪性化が相関している。LIMK1の発現の上昇も癌の悪性化と相関しており、LIMKとSSHによるコフィリンの活性制御のバランスの変化が癌細胞の運動性や浸潤能を亢進し、癌の悪性化をもたらすのではないかと考えられる。SSH1とSSH2においては、乳癌[43] [42]、膵臓癌、大腸癌、胃癌、膀胱尿路上皮癌、肝癌との関連が示されている[42] [41]。SSH3においては膵臓癌[44][45] [43][44]、転移性前立腺癌[46] [45]、大腸癌[47][48] [46][47]との関連が示されている。また、腸膜上皮細胞の細胞層を肝癌細胞が頂端側から基底側に浸潤するモデル系において、SSH1はその浸潤に必要であることが示されている[49] [48]。
関連用語
参考文献
- ↑ 1.0 1.1
Niwa, R., Nagata-Ohashi, K., Takeichi, M., Mizuno, K., & Uemura, T. (2002).
Control of actin reorganization by Slingshot, a family of phosphatases that dephosphorylate ADF/cofilin. Cell, 108(2), 233-46. [PubMed:11832213] [WorldCat] [DOI] - ↑ 引用エラー: 無効な
<ref>タグです。「Niwa200」という名前の注釈に対するテキストが指定されていません - ↑ 3.0 3.1 3.2 3.3 3.4 3.5
Mizuno, K. (2013).
Signaling mechanisms and functional roles of cofilin phosphorylation and dephosphorylation. Cellular signalling, 25(2), 457-69. [PubMed:23153585] [WorldCat] [DOI] - ↑ 4.0 4.1
Ohashi, K. (2015).
Roles of cofilin in development and its mechanisms of regulation. Development, growth & differentiation, 57(4), 275-90. [PubMed:25864508] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5
Kurita, S., Watanabe, Y., Gunji, E., Ohashi, K., & Mizuno, K. (2008).
Molecular dissection of the mechanisms of substrate recognition and F-actin-mediated activation of cofilin-phosphatase Slingshot-1. The Journal of biological chemistry, 283(47), 32542-52. [PubMed:18809681] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Fang, C., Woo, J.A., Liu, T., Zhao, X., Cazzaro, S., Yan, Y., ..., & Kang, D.E. (2021).
SSH1 impedes SQSTM1/p62 flux and MAPT/Tau clearance independent of CFL (cofilin) activation. Autophagy, 17(9), 2144-2165. [PubMed:33044112] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3
Ohta, Y., Kousaka, K., Nagata-Ohashi, K., Ohashi, K., Muramoto, A., Shima, Y., ..., & Mizuno, K. (2003).
Differential activities, subcellular distribution and tissue expression patterns of three members of Slingshot family phosphatases that dephosphorylate cofilin. Genes to cells : devoted to molecular & cellular mechanisms, 8(10), 811-24. [PubMed:14531860] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Yang, D., Xiao, P., Li, Q., Fu, X., Pan, C., Lu, D., ..., & Sun, J. (2018).
Allosteric modulation of the catalytic VYD loop in Slingshot by its N-terminal domain underlies both Slingshot auto-inhibition and activation. The Journal of biological chemistry, 293(42), 16226-16241. [PubMed:30154244] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Kousaka, K., Kiyonari, H., Oshima, N., Nagafuchi, A., Shima, Y., Chisaka, O., & Uemura, T. (2008).
Slingshot-3 dephosphorylates ADF/cofilin but is dispensable for mouse development. Genesis (New York, N.Y. : 2000), 46(5), 246-55. [PubMed:18442045] [WorldCat] [DOI] - ↑
Yamamoto, M., Nagata-Ohashi, K., Ohta, Y., Ohashi, K., & Mizuno, K. (2006).
Identification of multiple actin-binding sites in cofilin-phosphatase Slingshot-1L. FEBS letters, 580(7), 1789-94. [PubMed:16513117] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2 11.3 11.4
Nagata-Ohashi, K., Ohta, Y., Goto, K., Chiba, S., Mori, R., Nishita, M., ..., & Mizuno, K. (2004).
A pathway of neuregulin-induced activation of cofilin-phosphatase Slingshot and cofilin in lamellipodia. The Journal of cell biology, 165(4), 465-71. [PubMed:15159416] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Takahashi, K., Okabe, H., Kanno, S.I., Nagai, T., & Mizuno, K. (2017).
A pleckstrin homology-like domain is critical for F-actin binding and cofilin-phosphatase activity of Slingshot-1. Biochemical and biophysical research communications, 482(4), 686-692. [PubMed:27865840] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Xu, K., Su, X., Fang, K., Lv, Y., Huang, T., Li, M., ..., & Liu, H. (2023).
The Slingshot phosphatase 2 is required for acrosome biogenesis during spermatogenesis in mice. eLife, 12. [PubMed:36942942] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Soosairajah, J., Maiti, S., Wiggan, O., Sarmiere, P., Moussi, N., Sarcevic, B., ..., & Bernard, O. (2005).
Interplay between components of a novel LIM kinase-slingshot phosphatase complex regulates cofilin. The EMBO journal, 24(3), 473-86. [PubMed:15660133] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
Cai, L., Marshall, T.W., Uetrecht, A.C., Schafer, D.A., & Bear, J.E. (2007).
Coronin 1B coordinates Arp2/3 complex and cofilin activities at the leading edge. Cell, 128(5), 915-29. [PubMed:17350576] [PMC] [WorldCat] [DOI] - ↑
Eiseler, T., Döppler, H., Yan, I.K., Kitatani, K., Mizuno, K., & Storz, P. (2009).
Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology, 11(5), 545-56. [PubMed:19329994] [PMC] [WorldCat] [DOI] - ↑
Peterburs, P., Heering, J., Link, G., Pfizenmaier, K., Olayioye, M.A., & Hausser, A. (2009).
Protein kinase D regulates cell migration by direct phosphorylation of the cofilin phosphatase slingshot 1 like. Cancer research, 69(14), 5634-8. [PubMed:19567672] [WorldCat] [DOI] - ↑
Spratley, S.J., Bastea, L.I., Döppler, H., Mizuno, K., & Storz, P. (2011).
Protein kinase D regulates cofilin activity through p21-activated kinase 4. The Journal of biological chemistry, 286(39), 34254-61. [PubMed:21832093] [PMC] [WorldCat] [DOI] - ↑
Tang, W., Zhang, Y., Xu, W., Harden, T.K., Sondek, J., Sun, L., ..., & Wu, D. (2011).
A PLCβ/PI3Kγ-GSK3 signaling pathway regulates cofilin phosphatase slingshot2 and neutrophil polarization and chemotaxis. Developmental cell, 21(6), 1038-50. [PubMed:22172670] [PMC] [WorldCat] [DOI] - ↑
Wang, Y., Shibasaki, F., & Mizuno, K. (2005).
Calcium signal-induced cofilin dephosphorylation is mediated by Slingshot via calcineurin. The Journal of biological chemistry, 280(13), 12683-9. [PubMed:15671020] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2
Yuen, E.Y., Liu, W., Kafri, T., van Praag, H., & Yan, Z. (2010).
Regulation of AMPA receptor channels and synaptic plasticity by cofilin phosphatase Slingshot in cortical neurons. The Journal of physiology, 588(Pt 13), 2361-71. [PubMed:20442266] [PMC] [WorldCat] [DOI] - ↑
Madineni, A., Alhadidi, Q., & Shah, Z.A. (2016).
Cofilin Inhibition Restores Neuronal Cell Death in Oxygen-Glucose Deprivation Model of Ischemia. Molecular neurobiology, 53(2), 867-878. [PubMed:25526862] [PMC] [WorldCat] [DOI] - ↑
Endo, M., Ohashi, K., Sasaki, Y., Goshima, Y., Niwa, R., Uemura, T., & Mizuno, K. (2003).
Control of growth cone motility and morphology by LIM kinase and Slingshot via phosphorylation and dephosphorylation of cofilin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(7), 2527-37. [PubMed:12684437] [PMC] [WorldCat] [DOI] - ↑
Endo, M., Ohashi, K., & Mizuno, K. (2007).
LIM kinase and slingshot are critical for neurite extension. The Journal of biological chemistry, 282(18), 13692-702. [PubMed:17360713] [WorldCat] [DOI] - ↑
Aizawa, H., Wakatsuki, S., Ishii, A., Moriyama, K., Sasaki, Y., Ohashi, K., ..., & Yahara, I. (2001).
Phosphorylation of cofilin by LIM-kinase is necessary for semaphorin 3A-induced growth cone collapse. Nature neuroscience, 4(4), 367-73. [PubMed:11276226] [WorldCat] [DOI] - ↑
Hsieh, S.H., Ferraro, G.B., & Fournier, A.E. (2006).
Myelin-associated inhibitors regulate cofilin phosphorylation and neuronal inhibition through LIM kinase and Slingshot phosphatase. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(3), 1006-15. [PubMed:16421320] [PMC] [WorldCat] [DOI] - ↑
Wen, Z., Han, L., Bamburg, J.R., Shim, S., Ming, G.L., & Zheng, J.Q. (2007).
BMP gradients steer nerve growth cones by a balancing act of LIM kinase and Slingshot phosphatase on ADF/cofilin. The Journal of cell biology, 178(1), 107-19. [PubMed:17606869] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1
Abe, T., Yamazaki, D., Murakami, S., Hiroi, M., Nitta, Y., Maeyama, Y., & Tabata, T. (2014).
The NAV2 homolog Sickie regulates F-actin-mediated axonal growth in Drosophila mushroom body neurons via the non-canonical Rac-Cofilin pathway. Development (Cambridge, England), 141(24), 4716-28. [PubMed:25411210] [WorldCat] [DOI] - ↑
Zhou, Q., Homma, K.J., & Poo, M.M. (2004).
Shrinkage of dendritic spines associated with long-term depression of hippocampal synapses. Neuron, 44(5), 749-57. [PubMed:15572107] [WorldCat] [DOI] - ↑ 30.0 30.1
Gu, J., Lee, C.W., Fan, Y., Komlos, D., Tang, X., Sun, C., ..., & Zheng, J.Q. (2010).
ADF/cofilin-mediated actin dynamics regulate AMPA receptor trafficking during synaptic plasticity. Nature neuroscience, 13(10), 1208-15. [PubMed:20835250] [PMC] [WorldCat] [DOI] - ↑
Zhou, L., Jones, E.V., & Murai, K.K. (2012).
EphA signaling promotes actin-based dendritic spine remodeling through slingshot phosphatase. The Journal of biological chemistry, 287(12), 9346-59. [PubMed:22282498] [PMC] [WorldCat] [DOI] - ↑
Pontrello, C.G., Sun, M.Y., Lin, A., Fiacco, T.A., DeFea, K.A., & Ethell, I.M. (2012).
Cofilin under control of β-arrestin-2 in NMDA-dependent dendritic spine plasticity, long-term depression (LTD), and learning. Proceedings of the National Academy of Sciences of the United States of America, 109(7), E442-51. [PubMed:22308427] [PMC] [WorldCat] [DOI] - ↑ 33.0 33.1
Kaji, N., Ohashi, K., Shuin, M., Niwa, R., Uemura, T., & Mizuno, K. (2003).
Cell cycle-associated changes in Slingshot phosphatase activity and roles in cytokinesis in animal cells. The Journal of biological chemistry, 278(35), 33450-5. [PubMed:12807904] [WorldCat] [DOI] - ↑ 34.0 34.1
Iwase, S., Sato, R., De Bock, P.J., Gevaert, K., Fujiki, S., Tawada, T., ..., & Abe, H. (2013).
Activation of ADF/cofilin by phosphorylation-regulated Slingshot phosphatase is required for the meiotic spindle assembly in Xenopus laevis oocytes. Molecular biology of the cell, 24(12), 1933-46. [PubMed:23615437] [PMC] [WorldCat] [DOI] - ↑
Nishita, M., Tomizawa, C., Yamamoto, M., Horita, Y., Ohashi, K., & Mizuno, K. (2005).
Spatial and temporal regulation of cofilin activity by LIM kinase and Slingshot is critical for directional cell migration. The Journal of cell biology, 171(2), 349-59. [PubMed:16230460] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1
Fukuda, R., Gunawan, F., Ramadass, R., Beisaw, A., Konzer, A., Mullapudi, S.T., ..., & Stainier, D.Y.R. (2019).
Mechanical Forces Regulate Cardiomyocyte Myofilament Maturation via the VCL-SSH1-CFL Axis. Developmental cell, 51(1), 62-77.e5. [PubMed:31495694] [WorldCat] [DOI] - ↑
Williams, H.C., Ma, J., Weiss, D., Lassègue, B., Sutliff, R.L., & San Martín, A. (2019).
The cofilin phosphatase slingshot homolog 1 restrains angiotensin II-induced vascular hypertrophy and fibrosis in vivo. Laboratory investigation; a journal of technical methods and pathology, 99(3), 399-410. [PubMed:30291325] [PMC] [WorldCat] [DOI] - ↑ 38.0 38.1
Woo, J.A., Boggess, T., Uhlar, C., Wang, X., Khan, H., Cappos, G., ..., & Kang, D.E. (2015).
RanBP9 at the intersection between cofilin and Aβ pathologies: rescue of neurodegenerative changes by RanBP9 reduction. Cell death & disease, 6(3), 1676. [PubMed:25741591] [PMC] [WorldCat] [DOI] - ↑
Cazzaro, S., Zhao, X., Zhao, V.K., Kim, Y.K., & Woo, J.A. (2023).
Slingshot homolog-1 amplifies mitochondrial abnormalities by distinctly impairing health and clearance of mitochondria. Human molecular genetics, 32(10), 1660-1672. [PubMed:36637427] [PMC] [WorldCat] [DOI] - ↑ 引用エラー: 無効な
<ref>タグです。「Cazzaro2023」という名前の注釈に対するテキストが指定されていません - ↑ 41.0 41.1
Barone, E., Mosser, S., & Fraering, P.C. (2014).
Inactivation of brain Cofilin-1 by age, Alzheimer's disease and γ-secretase. Biochimica et biophysica acta, 1842(12 Pt A), 2500-9. [PubMed:25315299] [WorldCat] [DOI] - ↑ 42.0 42.1
Gao, P.P., Qi, X.W., Sun, N., Sun, Y.Y., Zhang, Y., Tan, X.N., ..., & Zhang, Y. (2021).
The emerging roles of dual-specificity phosphatases and their specific characteristics in human cancer. Biochimica et biophysica acta. Reviews on cancer, 1876(1), 188562. [PubMed:33964330] [WorldCat] [DOI] - ↑
Chen, C., Maimaiti, Y., Zhijun, S., Zeming, L., Yawen, G., Pan, Y., & Tao, H. (2017).
Slingshot-1L, a cofilin phosphatase, induces primary breast cancer metastasis. Oncotarget, 8(39), 66195-66203. [PubMed:29029503] [PMC] [WorldCat] [DOI] - ↑
Wang, Y., Kuramitsu, Y., Kitagawa, T., Baron, B., Yoshino, S., Maehara, S., ..., & Nakamura, K. (2015).
Cofilin-phosphatase slingshot-1L (SSH1L) is over-expressed in pancreatic cancer (PC) and contributes to tumor cell migration. Cancer letters, 360(2), 171-6. [PubMed:25684665] [WorldCat] [DOI] - ↑
Yang, C., Quan, G., Zhang, S., & Jiang, J. (2024).
SSH3 promotes pancreatic cancer proliferation and migration by activating the notch signaling pathway. American journal of cancer research, 14(4), 1815-1830. [PubMed:38726290] [PMC] [WorldCat] [DOI] - ↑
Müller, A.K., Föll, M., Heckelmann, B., Kiefer, S., Werner, M., Schilling, O., ..., & Drendel, V. (2018).
Proteomic Characterization of Prostate Cancer to Distinguish Nonmetastasizing and Metastasizing Primary Tumors and Lymph Node Metastases. Neoplasia (New York, N.Y.), 20(2), 140-151. [PubMed:29248718] [PMC] [WorldCat] [DOI] - ↑
Hu, Y.H., Lu, Y.X., Zhang, Z.Y., Zhang, J.M., Zhang, W.J., Zheng, L., ..., & Li, X.N. (2019).
SSH3 facilitates colorectal cancer cell invasion and metastasis by affecting signaling cascades involving LIMK1/Rac1. American journal of cancer research, 9(5), 1061-1073. [PubMed:31218112] [PMC] [WorldCat] - ↑
Song, X., Xie, D., Xia, X., Tan, F., Pei, Q., Li, Y., ..., & Pei, H. (2020).
Role of SSH1 in colorectal cancer prognosis and tumor progression. Journal of gastroenterology and hepatology, 35(7), 1180-1188. [PubMed:32020663] [WorldCat] [DOI] - ↑
Horita, Y., Ohashi, K., Mukai, M., Inoue, M., & Mizuno, K. (2008).
Suppression of the invasive capacity of rat ascites hepatoma cells by knockdown of Slingshot or LIM kinase. The Journal of biological chemistry, 283(10), 6013-21. [PubMed:18171679] [WorldCat] [DOI]