「内因性オピオイド」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
{{box|text= 内因性オピオイドは、 前駆体として生成されるペプチド群(POMC由来のβ-エンドルフィン、プロエンケファリン A由来のMet‑、Leu‑エンケファリン、プロダイノルフィン由来のダイノルフィンなど)が酵素的プロセシングを経て産生される神経ペプチドであり、それらはμ、δ、κのGタンパク質共役型オピオイド受容体に選択的に結合する。生理活性としては鎮痛・報酬・ストレス応答の調節などに関与し、受容体選択性はたとえばエンケファリンがδ受容体に、β‑エンドルフィンとエンケファリンがμ受容体に強い親和性を示す一方、ダイノルフィンはκ受容体への作用が特徴である。受容体の発現分布として、μ受容体は中枢神経系全域および侵害受容線維に広く分布し、δ受容体は海馬・扁桃体・基底核・視床下部などの皮質・辺縁系領域に豊富に存在することが明らかになっている。}} | |||
{{box|text= 内因性オピオイドは、 前駆体として生成されるペプチド群(POMC由来のβ- | |||
== 発見 == | == 発見 == | ||
[[モルヒネ]]を始めとする[[麻薬性鎮痛薬]] ([[narcotics]]) は微量で[[がん性疼痛]]のような強力な痛みを抑制することやその作用点が主に脳にあることから、脳内にモルヒネ鎮痛作用を担う、いわゆる薬物受容体が存在することが推定されていた。1972年前後に世界における数グループより、トリチウム標識モルヒネ類似化合物([[ | [[モルヒネ]]を始めとする[[麻薬性鎮痛薬]] ([[narcotics]]) は微量で[[がん性疼痛]]のような強力な痛みを抑制することやその作用点が主に脳にあることから、脳内にモルヒネ鎮痛作用を担う、いわゆる薬物受容体が存在することが推定されていた。1972年前後に世界における数グループより、トリチウム標識モルヒネ類似化合物([[opiates]])である<sup>3</sup>H-[[レボルファノール]]が脳組織からの[[細胞膜]]に特異的に結合すること、その結合に[[立体異性体特異性]]が存在すること、薬理作用がモルヒネ誘導体である[[ナロキソン]]により競合的に拮抗されることが報告され、「[[オピエート受容体]] ([[opiate receptor]])」の存在が認識されてきた<ref name=Goldstein1971><pubmed>5288759</pubmed></ref><ref name=Pert1973><pubmed>4687585</pubmed></ref>。 | ||
これに端を発し、その受容体に結合する内因性モルヒネ様物質の探索に乗り出し、Hughes、Kosterlitzのグループが初めてMet-エンケファリン(Tyr-Gly-Gly-Phe-Met)とLeu-エンケファリン (Tyr-Gly-Gly-Phe-Leu)というペプチドを発見した<ref name=Hughes1975><pubmed>1207728</pubmed></ref>。この研究はペプチドが脳における特定の感覚機能を司るという新しい概念として注目され、さらに数々な脳機能をつかさどる神経ペプチド発見へとつながった。 | |||
その後β-リポトロピンの部分ペプチドにMet-エンケファリン配列を含むβ-エンドルフィンが発見され同様なオピエート様作用を有することが報告された<ref name=Li1976><pubmed>1063395</pubmed></ref>。この時点でオピエートと内因性のモルヒネ様ペプチドを総称してオピオイドと呼ばれるようになった。その後次々とMet-エンケファリンやLeu-エンケファリン配列を含むペプチドが発見され、これらを総称してエンドルフィン類と呼ぶことが提唱された。 | |||
[[ファイル:Ueda Opiate Fig1.png|サムネイル|3種の内因性オピオイドペプチド前駆体<br>文献<ref name=Kakidani1982><pubmed>6123953</pubmed></ref><ref name=Nakanishi1979><pubmed>221818</pubmed></ref><ref name=Noda1982><pubmed>6276759</pubmed></ref><ref name=Kakitani2015>'''柿谷 均 (2015).'''<br> 伝説の生化学者 沼 正作物語 ぶっちぎりのアセチルコリン受容体。化学 70(8), 22-27</ref>などより編集部作成]] | |||
==前駆体 == | ==前駆体 == | ||
米国Udenfriends<ref name=Gubler1982><pubmed>6173760</pubmed></ref>や京都大学沼正作・中西重忠ら<ref name=Kakidani1982><pubmed>6123953</pubmed></ref><ref name=Nakanishi1979><pubmed>221818</pubmed></ref><ref name=Noda1982><pubmed>6276759</pubmed></ref>のグループにより数々のエンドルフィン類が3つの前駆タンパク質よりプロセシングされて生成されることが明らかとなった(図1)。そのプロセシングはアルギニンやリジンといった塩基性アミノ酸が2個連続した部分で選択的に酵素的切断されると言う仕組みによることが明らかにされ、それ以来多くの神経ペプチドのタンパク質前駆体からのプロセシング機構の基礎を築いた。 | |||
3つの前駆体とは、プレプロオピオメラノコルチン (POMC), プロエンケファリン Aとプロダイノルフィン (プロエンケファリン B)である。特にPOMCはβ-エンドルフィンに加えてストレス関連の神経内分泌ホルモンであるACTH、γMSH、αMSHなどの共通前駆体であることが注目を集めた。プロエンケファリン AにはMet-エンケファリン (ME)、Leu-エンケファリン (LE)のほかME-Arg-Gly-Leu (Octapeptide)やME-Arg-Phe (Heptapeptide)が含まれ、プロダイノルフィン (プロエンケファリン B)にはダイノルフィン <ref name=Kakidani1982><pubmed>6123953</pubmed></ref>、α-ネオエンドルフィン<ref name=Kangawa1981><pubmed>7247946</pubmed></ref>、Leumorphin<ref name=Nakao1983><pubmed>6689399</pubmed></ref>などが含まれる。 | |||
{| class="wikitable" | {| class="wikitable" style="width:80%" | ||
|+ 表1. 内因性オピオイドペプチドとその受容体(Wikipediaより編集部作成) | |+ 表1. 内因性オピオイドペプチドとその受容体(Wikipediaより編集部作成) | ||
|- | |- | ||
! scope="col" | | ! scope="col" | オピオイドペプチド | ||
! scope="col" | [[アミノ酸配列]] | ! scope="col" | [[アミノ酸配列]] | ||
! scope="col" | | ! scope="col" | [[オピオイド受容体]] 標的 | ||
! scope="col" | 参考文献 | ! scope="col" | 参考文献 | ||
|- | |- | ||
! scope="col" colspan=" | ! scope="col" colspan="1" | [[エンケファリン]] | ||
! scope="col" colspan="3" | | |||
|- | |- | ||
| [[Leu-エンケファリン]] || YGGFL || [[δ-オピオイド受容体]]<sup>†</sup>、[[μ-オピオイド受容体]]<sup>†</sup> || <ref name="Endogenous opioid families - 2012 review"><pubmed>22300099</pubmed></ref><ref name="IUPHAR Opioid receptors - Introduction">{{cite web | title=Opioid receptors: Introduction | url=http://www.guidetopharmacology.org/GRAC/FamilyIntroductionForward?familyId=50 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | vauthors = Toll L, Caló G, Cox BM, Chavkin C, Christie MJ, Civelli O, Connor M, Devi LA, Evans C, Henderson G, Höllt V, Kieffer B, Kitchen I, Kreek MJ, Liu-Chen LY, Meunier JC, Portoghese PS, Shippenberg TS, Simon EJ, Traynor JR, Ueda H, Wong YH | access-date = 20 October 2017 | date=10 August 2015 }}</ref><ref name="IUPHAR - δ-opioid receptor" /> | | [[Leu-エンケファリン]] || YGGFL || [[δ-オピオイド受容体]]<sup>†</sup>、[[μ-オピオイド受容体]]<sup>†</sup> || <ref name="Endogenous opioid families - 2012 review"><pubmed>22300099</pubmed></ref><ref name="IUPHAR Opioid receptors - Introduction">{{cite web | title=Opioid receptors: Introduction | url=http://www.guidetopharmacology.org/GRAC/FamilyIntroductionForward?familyId=50 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | vauthors = Toll L, Caló G, Cox BM, Chavkin C, Christie MJ, Civelli O, Connor M, Devi LA, Evans C, Henderson G, Höllt V, Kieffer B, Kitchen I, Kreek MJ, Liu-Chen LY, Meunier JC, Portoghese PS, Shippenberg TS, Simon EJ, Traynor JR, Ueda H, Wong YH | access-date = 20 October 2017 | date=10 August 2015 }}</ref><ref name="IUPHAR - δ-opioid receptor" /> | ||
|- | |- | ||
| [[Met-エンケファリン]] || YGGFM || δ-オピオイド受容体<sup>†</sup> | | [[Met-エンケファリン]] || YGGFM || [[δ-オピオイド受容体]]<sup>†</sup>、[[μ-オピオイド受容体]]<sup>†</sup> || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /><ref name="IUPHAR - δ-opioid receptor" /> | ||
|- | |- | ||
| [[メトルファミド]] | | [[メトルファミド]] || YGGFMRRV-NH<sub>2</sub> || [[δ-オピオイド受容体]]、[[μ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /> | ||
|- | |- | ||
| [[ペプチドE]] || YGGFMRRVGRPEWWMDYQKRYGGFL || μ- | | [[ペプチドE]] || YGGFMRRVGRPEWWMDYQKRYGGFL || [[μ-オピオイド受容体]]、[[κ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /> | ||
|- | |- | ||
! scope="col" colspan=" | ! scope="col" colspan="1" | [[エンドルフィン]] | ||
! scope="col" colspan="3" | | |||
|- | |- | ||
| [[α-エンドルフィン]] || YGGFMTSEKSQTPLVT || μ- | | [[α-エンドルフィン]] || YGGFMTSEKSQTPLVT || [[μ-オピオイド受容体]]、他のオピオイド受容体への親和性は不明 || <ref name="Endogenous opioid families - 2012 review" /> | ||
|- | |- | ||
| [[β-エンドルフィン]]|| YGGFMTSEKSQTPLVTLFKNAIIKNAYKKGE || μ-オピオイド受容体<sup>†‡</sup> | | [[β-エンドルフィン]] || YGGFMTSEKSQTPLVTLFKNAIIKNAYKKGE || [[μ-オピオイド受容体]]<sup>†‡</sup>、[[δ-オピオイド受容体]]<sup>†</sup> || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /><ref name="IUPHAR - δ-opioid receptor">{{cite web | title=δ receptor|url=http://www.guidetopharmacology.org/GRAC/ObjectDisplayForward?objectId=317 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 28 December 2017 | date=15 May 2017 | quote = Principal endogenous agonists (Human) [are]<br />β-endorphin (POMC, P01189), [Leu]enkephalin (PENK, P01210), [Met]enkephalin (PENK, P01210)}}</ref><ref name="IUPHAR - μ-opioid receptor">{{cite web | title=μ receptor|url=http://www.guidetopharmacology.org/GRAC/ObjectDisplayForward?objectId=319 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 28 December 2017 | date=15 March 2017 | quote = Comments: β-Endorphin is the highest potency endogenous ligand ...<br />Morphine occurs endogenously ([[#Poeaknapo|Poeaknapo et. al. 2004]]) ...<br />Principal endogenous agonists (Human) [are]<br />β-endorphin (POMC, P01189), [Met]enkephalin (PENK, P01210), [Leu]enkephalin (PENK, P01210)}}</ref><ref><pubmed>15383669</pubmed></ref> | ||
|- | |- | ||
| [[γ-エンドルフィン]] || YGGFMTSEKSQTPLVTL || μ- | | [[γ-エンドルフィン]] || YGGFMTSEKSQTPLVTL || [[μ-オピオイド受容体]]、他のオピオイド受容体への親和性は不明 || <ref name="Endogenous opioid families - 2012 review" /> | ||
|- | |- | ||
! scope="col" colspan=" | ! scope="col" colspan="1" | [[ダイノルフィン]] | ||
! scope="col" colspan="3" | | |||
|- | |- | ||
| [[ダイノルフィンA]] || YGGFLRRIRPKLKWDNQ || κ-オピオイド受容体<sup>†‡</sup> || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /><ref name="IUPHAR - κ-opioid receptor" /> | | [[ダイノルフィンA]] || YGGFLRRIRPKLKWDNQ || [[κ-オピオイド受容体]]<sup>†‡</sup> || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /><ref name="IUPHAR - κ-opioid receptor" /> | ||
|- | |- | ||
| [[ダイノルフィンA1–8|ダイノルフィンA<sub>1–8</sub>]] || YGGFLRRI || κ- | | [[ダイノルフィンA1–8|ダイノルフィンA<sub>1–8</sub>]] || YGGFLRRI || [[κ-オピオイド受容体]]、[[μ-オピオイド受容体]]([[δ-オピオイド受容体]]に対して部分アゴニスト) || <ref name="HMDB Dynorphin A 1-8">{{cite encyclopedia | title=Dynorphin A 1–8 | url=http://www.hmdb.ca/metabolites/HMDB0012933 | encyclopedia=HMDB Version 4.0 | publisher=Human Metabolome Database | access-date=20 October 2017 | date=27 September 2017 | quote = Dynorphin A (1–8) is a fraction of Dynorphin A with only Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile peptide chain.}}</ref><ref name="IUPHAR - Dynorphin A-(1-8) - Biological activity">{{cite web | title=Dynorphin A-(1–8): Biological activity | url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=biology&ligandId=1621 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 20 October 2017 }}</ref> | ||
|- | |- | ||
| [[ダイノルフィンB]] || YGGFLRRQFKVVT || κ-オピオイド受容体 || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | | [[ダイノルフィンB]] || YGGFLRRQFKVVT || [[κ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | ||
|- | |- | ||
| [[ビッグダイノルフィン]] || YGGFLRRIRPKLKWDNQKRYGGFLRRQFKVVT || κ-オピオイド受容体<sup>†‡</sup> || <ref name="IUPHAR - κ-opioid receptor">{{cite web | title=κ receptor|url=http://www.guidetopharmacology.org/GRAC/ObjectDisplayForward?objectId=318 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 28 December 2017 | date=21 February 2017}}</ref><ref name="IUPHAR - Big dynorphin - Biological activity">{{cite web | title=Big dynorphin: Biological activity|url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=biology&ligandId=3669 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 20 October 2017}}.</ref><ref name="IUPHAR - Big dynorphin - Structure">{{cite web | title=Big dynorphin: Structure – Peptide Sequence | url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=structure&ligandId=3669 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 20 October 2017}}</ref> | | [[ビッグダイノルフィン]] || YGGFLRRIRPKLKWDNQKRYGGFLRRQFKVVT || [[κ-オピオイド受容体]]<sup>†‡</sup> || <ref name="IUPHAR - κ-opioid receptor">{{cite web | title=κ receptor|url=http://www.guidetopharmacology.org/GRAC/ObjectDisplayForward?objectId=318 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 28 December 2017 | date=21 February 2017 | quote = Comments: Dynorphin A and big dynorphin are the highest potency endogenous ligands ...<br />Principal endogenous agonists (Human) [are]<br />big dynorphin (PDYN, P01213), dynorphin A (PDYN, P01213)}}</ref><ref name="IUPHAR - Big dynorphin - Biological activity">{{cite web | title=Big dynorphin: Biological activity|url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=biology&ligandId=3669 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 20 October 2017 | quote = Principal endogenous agonists at κ receptor}}.</ref><ref name="IUPHAR - Big dynorphin - Structure">{{cite web | title=Big dynorphin: Structure – Peptide Sequence | url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=structure&ligandId=3669 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 20 October 2017 | quote = Peptide sequence<br />YGGFLRRIRPKLKWDNQKRYGGFLRRQFKVVT}}</ref> | ||
|- | |- | ||
| [[ロイモルフィン]] || YGGFLRRQFKVVTRSQEDPNAYYEELFDV || κ-オピオイド受容体 || <ref name="Dynorphins 2009 review"><pubmed>19481570</pubmed></ref><ref name="PubChem - Leumorphin"><pubmed>6149506</pubmed></ref><ref name="Leumorphin primary 2"><pubmed>7908725</pubmed></ref> | | [[ロイモルフィン]] || YGGFLRRQFKVVTRSQEDPNAYYEELFDV || [[κ-オピオイド受容体]] || <ref name="Dynorphins 2009 review"><pubmed>19481570</pubmed></ref><ref name="PubChem - Leumorphin"><pubmed>6149506</pubmed></ref><ref name="Leumorphin primary 2"><pubmed>7908725</pubmed></ref> | ||
|- | |- | ||
| [[α-ネオエンドルフィン]] || YGGFLRKYPK || κ-オピオイド受容体 || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | | [[α-ネオエンドルフィン]] || YGGFLRKYPK || [[κ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | ||
|- | |- | ||
| [[β-ネオエンドルフィン]] || YGGFLRKYP || κ-オピオイド受容体 || <ref name="Endogenous opioid families - 2012 review" /> | | [[β-ネオエンドルフィン]] || YGGFLRKYP || [[κ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /> | ||
|- | |- | ||
! scope="col" colspan=" | ! scope="col" colspan="1" | [[ノシセプチン]] | ||
! scope="col" colspan="3" | | |||
|- | |- | ||
| [[ノシセプチン]] || FGGFTGARKSARKLANQ || [[ノシセプチン受容体]]<sup>†‡</sup> || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /><ref name="IUPHAR - nociceptin receptor">{{cite web | title=NOP receptor|url=http://www.guidetopharmacology.org/GRAC/ObjectDisplayForward?objectId=320 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 28 December 2017 | date=18 August 2017}}</ref> | | [[ノシセプチン]] || FGGFTGARKSARKLANQ || [[ノシセプチン受容体]]<sup>†‡</sup> || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /><ref name="IUPHAR - nociceptin receptor">{{cite web | title=NOP receptor|url=http://www.guidetopharmacology.org/GRAC/ObjectDisplayForward?objectId=320 | work= IUPHAR/BPS Guide to PHARMACOLOGY | publisher=International Union of Basic and Clinical Pharmacology | access-date= 28 December 2017 | date=18 August 2017 | quote = Natural/Endogenous Ligands<br />nociceptin/orphanin FQ}}</ref> | ||
|- | |- | ||
! scope="col" colspan=" | ! scope="col" colspan="1" | [[エンドモルフィン]] | ||
! scope="col" colspan="3" | | |||
|- | |- | ||
| [[エンドモルフィン-1]] || YPWF-NH<sub>2</sub> || μ-オピオイド受容体 || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | | [[エンドモルフィン-1]] || YPWF-NH<sub>2</sub> || [[μ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | ||
|- | |- | ||
| [[エンドモルフィン-2]] || YPFF-NH<sub>2</sub> || μ-オピオイド受容体 || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | | [[エンドモルフィン-2]] || YPFF-NH<sub>2</sub> || [[μ-オピオイド受容体]] || <ref name="Endogenous opioid families - 2012 review" /><ref name="IUPHAR Opioid receptors - Introduction" /> | ||
|- | |- | ||
! scope="col" colspan="4" style="text-align:left" | <sup>†</sup> この記号は、そのペプチドがヒトにおいて当該受容体の主要な内因性アゴニストであることを示す。<br /><sup>‡</sup> この記号は、そのペプチドがヒトにおいて当該受容体に対して最も高い既知の[[効力 (薬理学)|効力]]を持つ内因性リガンドであることを示す。 | ! scope="col" colspan="4" style="text-align:left" | <sup>†</sup> この記号は、そのペプチドがヒトにおいて当該受容体の主要な内因性アゴニストであることを示す。<br /><sup>‡</sup> この記号は、そのペプチドがヒトにおいて当該受容体に対して最も高い既知の[[効力 (薬理学)|効力]]を持つ内因性リガンドであることを示す。 | ||
|} | |} | ||
== 非古典的オピオイド様ペプチド== | == 非古典的オピオイド様ペプチド== | ||
オピオイドペプチドあるいはエンドルフィン類はチロシンで始まるエンケファリンのペプチド配列を有するものとして総称されるが、それ以外にもオピオイド様作用を有するペプチドは数多く発見されている。 | オピオイドペプチドあるいはエンドルフィン類はチロシンで始まるエンケファリンのペプチド配列を有するものとして総称されるが、それ以外にもオピオイド様作用を有するペプチドは数多く発見されている。 | ||
1979年にウシ脳から発見されたキョートロフィン(kyotorphin)はチロシン-アルギニンというジペプチドでMet-エンケファリン遊離作用によるオピオイド性鎮痛効果を示し<ref name=Takagi1979><pubmed>228202</pubmed></ref><ref name=Ueda2021><pubmed>35047919</pubmed></ref>、オピオイド受容体結合阻害活性を有する乳成分由来のカソモルフィン (casomorphin)<ref name=Kaminski2007><pubmed>17666771</pubmed></ref>とヘモグロビン由来のヘモルフィン (hemorphin)<ref name=Brantl1986><pubmed>3743640</pubmed></ref>、スクリーニングで見いだされたエンドモルフィン-1と2 (endomorphin-1/2<ref name=Zadina1997><pubmed>9087409</pubmed></ref>などがある。 | |||
キョートロフィンは前駆タンパク質からのプロセシングでは無く2つのアミノ酸から合成されるという仕組みが報告されている<ref name=Tsukahara2018><pubmed>29289698</pubmed></ref><ref name=Ueda2021><pubmed>35047919</pubmed></ref><ref name=Ueda1987><pubmed>3597366</pubmed></ref>。エンドモルフィン-1と2はそれぞれTyr-Pro-Trp-Phe-NH<sub>2</sub> とTyr-Pro-Trp-Phe-NH<sub>2</sub>という配列でμ受容体に高い親和性を示すことが明らかになっているが前駆タンパク質に関しては現時点ではまだ不明である。 | |||
一方、1994年オピオイド受容体のホモロジースクリーニングから[[opioid receptor-like 1]] ([[ORL-1]])が発見され<ref name=Mollereau1994><pubmed>8137918</pubmed></ref>、次いで1995年には米国とフランスの研究者が別々にORL- | 一方、1994年オピオイド受容体のホモロジースクリーニングから[[opioid receptor-like 1]] ([[ORL-1]])が発見され<ref name=Mollereau1994><pubmed>8137918</pubmed></ref>、次いで1995年には米国とフランスの研究者が別々にORL-1アゴニストを発見し、それぞれOrphanin FQあるいはノシセプチンと名付けた<ref name=Meunier1995><pubmed>7566152</pubmed></ref><ref name=Reinscheid1995><pubmed>7481766</pubmed></ref>。この研究はOrphan受容体をもとに内在性リガンドを発見したいわゆる「逆転薬理学」の先駆けである。このペプチドはエンドルフィン類と同様な前駆タンパク質<ref name=Meunier1995><pubmed>7566152</pubmed></ref>も明らかにされている。 | ||
== 生体内分布 == | == 生体内分布 == | ||
In situ hybridizationもしくは免疫組織化学研究により3種のオピオイドペプチド自身あるいはその前駆タンパク質の脳内分布が報告されている<ref name=Hentges2009><pubmed>19864580</pubmed></ref><ref name=LeMerrer2009><pubmed>19789384</pubmed></ref><ref name=Maegawa2022><pubmed>35937204</pubmed></ref><ref name=Simonin1998><pubmed>9463367</pubmed></ref>。POMCは脳下垂体や視床下部に高発現し、プロエンケファリン は脳内に広く分布するが特に線条体に高発現する。ダイノルフィンについては、脳内に広く発現している。高発現領域については触れられていないが、皮質、線条体、側坐核、扁桃体で重要な働きをしているとの報告がある。これら前駆タンパク質の共存はあまりよく知られていないが、ダイノルフィンやエンケファリンは線条体でサブスタンスPと共存することなどが知られている<ref name=Anderson1990><pubmed>1693632</pubmed></ref>。脳以外では副腎髄質にProエンケファリン前駆体やそれに由来するエンケファリン含有ペプチドが高濃度存在する<ref name=Udenfriend1983><pubmed>6340606</pubmed></ref>。 | |||
==受容体特異性と生理機能・疾患との関連性 == | ==受容体特異性と生理機能・疾患との関連性 == | ||
β- | β-エンドルフィンは主にμ受容体アゴニストとして機能しモルヒネ様鎮痛効果と類似することが報告されている<ref name=Tseng1976><pubmed>958477</pubmed></ref>。IUPHAR (Guide to Pharmacology)によるとβ-エンドルフィンやMet-エンケファリンはμ受容体発現細胞においてpKi=9.0前後の高親和性を示し、δ受容体に対してはLeu-エンケファリンの方がMet-エンケファリンより高親和性を示す。エンケファリンは鎮痛効果や精神調節作用との関連で報告されている。<ref name=Ragnauth2001><pubmed>11172058</pubmed></ref><ref name=Urca1977><pubmed>867056</pubmed></ref>。 | ||
κ受容体についてはダイノルフィンがβ-エンドルフィンやエンケファリン類と比べて圧倒的に高い親和性を示し、その機能は精神作用との関連で報告されている<ref name=Zhang1985><pubmed>2860611</pubmed></ref>。Nociceptin/ORF-1はORL-1に対して高い親和性を示しORL-1受容体拮抗薬を使った薬理作用実験などから疼痛制御やアンチオピオイド作用など、多様な薬理作用が報告されている<ref name=Mogil1996><pubmed>8930999</pubmed></ref>。 | |||
生理機能・疾患との関連性は'''表2'''のとおりである。 | 生理機能・疾患との関連性は'''表2'''のとおりである。 | ||
| 109行目: | 98行目: | ||
| rowspan="10" | 生理作用 || βエンドルフィン || 鎮痛作用 || <ref name=Tseng1976><pubmed>958477</pubmed></ref> | | rowspan="10" | 生理作用 || βエンドルフィン || 鎮痛作用 || <ref name=Tseng1976><pubmed>958477</pubmed></ref> | ||
|- | |- | ||
| βエンドルフィン || | | βエンドルフィン || 免疫調節効果 || <ref name=Chiappelli1992><pubmed>1534974</pubmed></ref> | ||
|- | |- | ||
| βエンドルフィン || | | βエンドルフィン || 報酬効果 || <ref name=Roth-Deri2008><pubmed>18602444</pubmed></ref> | ||
|- | |- | ||
| エンケファリン || 鎮痛作用 || <ref name=Urca1977><pubmed>867056</pubmed></ref> | | エンケファリン || 鎮痛作用 || <ref name=Urca1977><pubmed>867056</pubmed></ref> | ||
| 119行目: | 108行目: | ||
| エンケファリン || 報酬効果 || <ref name=Belluzzi1977><pubmed>193035</pubmed></ref> | | エンケファリン || 報酬効果 || <ref name=Belluzzi1977><pubmed>193035</pubmed></ref> | ||
|- | |- | ||
| エンケファリン || | | エンケファリン || 抗不安作用 || <ref name=Ragnauth2001><pubmed>11172058</pubmed></ref> | ||
|- | |- | ||
| ダイノルフィン || 鎮痛作用 || <ref name=Kaneko1983><pubmed>6141507</pubmed></ref> | | ダイノルフィン || 鎮痛作用 || <ref name=Kaneko1983><pubmed>6141507</pubmed></ref> | ||
| 127行目: | 116行目: | ||
| ノシセプチン || 不安、抑うつ作用 || <ref name=Gavioli2013><pubmed>23711793</pubmed></ref> | | ノシセプチン || 不安、抑うつ作用 || <ref name=Gavioli2013><pubmed>23711793</pubmed></ref> | ||
|- | |- | ||
| rowspan="9" | 疾患 || βエンドルフィン || | | rowspan="9" | 疾患 || βエンドルフィン || アルコール依存症 || <ref name=Giugliano1987><pubmed>2958673</pubmed></ref><ref name=Zalewska-Kaszubska2005><pubmed>15752586</pubmed></ref> | ||
|- | |- | ||
| βエンドルフィン || | | βエンドルフィン || 肥満症 || <ref name=Sulkava1985><pubmed>3159972</pubmed></ref> | ||
|- | |- | ||
| βエンドルフィン || | | βエンドルフィン || アルツハイマー病 || <ref name=Baker1997><pubmed>9373885</pubmed></ref><ref name=Tordjman1997><pubmed>9315980</pubmed></ref> | ||
|- | |- | ||
| βエンドルフィン || | | βエンドルフィン || 自閉症 || | ||
|- | |- | ||
| βエンドルフィン || | | βエンドルフィン || PTSD || | ||
|- | |- | ||
| エンケファリン || | | エンケファリン || パーキンソン病 || <ref name=Samadi2006><pubmed>16908075</pubmed></ref> | ||
|- | |- | ||
| ダイノルフィン || | | ダイノルフィン || 掻痒症 || <ref name=Kardon2014><pubmed>24726382</pubmed></ref> | ||
|- | |- | ||
| ダイノルフィン || | | ダイノルフィン || 統合失調症 || <ref name=Zhang1985><pubmed>2860611</pubmed></ref> | ||
|- | |- | ||
| ノシセプチン || | | ノシセプチン || うつ病 || <ref name=Gavioli2013><pubmed>23711793</pubmed></ref> | ||
|} | |} | ||
== 参考文献 == | == 参考文献 == | ||
2025年8月14日 (木) 18:08時点における版
内因性オピオイドは、 前駆体として生成されるペプチド群(POMC由来のβ-エンドルフィン、プロエンケファリン A由来のMet‑、Leu‑エンケファリン、プロダイノルフィン由来のダイノルフィンなど)が酵素的プロセシングを経て産生される神経ペプチドであり、それらはμ、δ、κのGタンパク質共役型オピオイド受容体に選択的に結合する。生理活性としては鎮痛・報酬・ストレス応答の調節などに関与し、受容体選択性はたとえばエンケファリンがδ受容体に、β‑エンドルフィンとエンケファリンがμ受容体に強い親和性を示す一方、ダイノルフィンはκ受容体への作用が特徴である。受容体の発現分布として、μ受容体は中枢神経系全域および侵害受容線維に広く分布し、δ受容体は海馬・扁桃体・基底核・視床下部などの皮質・辺縁系領域に豊富に存在することが明らかになっている。
発見
モルヒネを始めとする麻薬性鎮痛薬 (narcotics) は微量でがん性疼痛のような強力な痛みを抑制することやその作用点が主に脳にあることから、脳内にモルヒネ鎮痛作用を担う、いわゆる薬物受容体が存在することが推定されていた。1972年前後に世界における数グループより、トリチウム標識モルヒネ類似化合物(opiates)である3H-レボルファノールが脳組織からの細胞膜に特異的に結合すること、その結合に立体異性体特異性が存在すること、薬理作用がモルヒネ誘導体であるナロキソンにより競合的に拮抗されることが報告され、「オピエート受容体 (opiate receptor)」の存在が認識されてきた[1][2]。
これに端を発し、その受容体に結合する内因性モルヒネ様物質の探索に乗り出し、Hughes、Kosterlitzのグループが初めてMet-エンケファリン(Tyr-Gly-Gly-Phe-Met)とLeu-エンケファリン (Tyr-Gly-Gly-Phe-Leu)というペプチドを発見した[3]。この研究はペプチドが脳における特定の感覚機能を司るという新しい概念として注目され、さらに数々な脳機能をつかさどる神経ペプチド発見へとつながった。
その後β-リポトロピンの部分ペプチドにMet-エンケファリン配列を含むβ-エンドルフィンが発見され同様なオピエート様作用を有することが報告された[4]。この時点でオピエートと内因性のモルヒネ様ペプチドを総称してオピオイドと呼ばれるようになった。その後次々とMet-エンケファリンやLeu-エンケファリン配列を含むペプチドが発見され、これらを総称してエンドルフィン類と呼ぶことが提唱された。
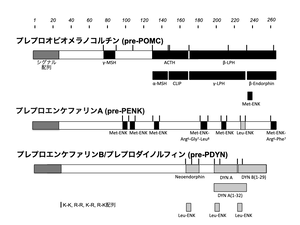
文献[5][6][7][8]などより編集部作成
前駆体
米国Udenfriends[9]や京都大学沼正作・中西重忠ら[5][6][7]のグループにより数々のエンドルフィン類が3つの前駆タンパク質よりプロセシングされて生成されることが明らかとなった(図1)。そのプロセシングはアルギニンやリジンといった塩基性アミノ酸が2個連続した部分で選択的に酵素的切断されると言う仕組みによることが明らかにされ、それ以来多くの神経ペプチドのタンパク質前駆体からのプロセシング機構の基礎を築いた。
3つの前駆体とは、プレプロオピオメラノコルチン (POMC), プロエンケファリン Aとプロダイノルフィン (プロエンケファリン B)である。特にPOMCはβ-エンドルフィンに加えてストレス関連の神経内分泌ホルモンであるACTH、γMSH、αMSHなどの共通前駆体であることが注目を集めた。プロエンケファリン AにはMet-エンケファリン (ME)、Leu-エンケファリン (LE)のほかME-Arg-Gly-Leu (Octapeptide)やME-Arg-Phe (Heptapeptide)が含まれ、プロダイノルフィン (プロエンケファリン B)にはダイノルフィン [5]、α-ネオエンドルフィン[10]、Leumorphin[11]などが含まれる。
非古典的オピオイド様ペプチド
オピオイドペプチドあるいはエンドルフィン類はチロシンで始まるエンケファリンのペプチド配列を有するものとして総称されるが、それ以外にもオピオイド様作用を有するペプチドは数多く発見されている。
1979年にウシ脳から発見されたキョートロフィン(kyotorphin)はチロシン-アルギニンというジペプチドでMet-エンケファリン遊離作用によるオピオイド性鎮痛効果を示し[26][27]、オピオイド受容体結合阻害活性を有する乳成分由来のカソモルフィン (casomorphin)[28]とヘモグロビン由来のヘモルフィン (hemorphin)[29]、スクリーニングで見いだされたエンドモルフィン-1と2 (endomorphin-1/2[30]などがある。
キョートロフィンは前駆タンパク質からのプロセシングでは無く2つのアミノ酸から合成されるという仕組みが報告されている[31][27][32]。エンドモルフィン-1と2はそれぞれTyr-Pro-Trp-Phe-NH2 とTyr-Pro-Trp-Phe-NH2という配列でμ受容体に高い親和性を示すことが明らかになっているが前駆タンパク質に関しては現時点ではまだ不明である。
一方、1994年オピオイド受容体のホモロジースクリーニングからopioid receptor-like 1 (ORL-1)が発見され[33]、次いで1995年には米国とフランスの研究者が別々にORL-1アゴニストを発見し、それぞれOrphanin FQあるいはノシセプチンと名付けた[34][35]。この研究はOrphan受容体をもとに内在性リガンドを発見したいわゆる「逆転薬理学」の先駆けである。このペプチドはエンドルフィン類と同様な前駆タンパク質[34]も明らかにされている。
生体内分布
In situ hybridizationもしくは免疫組織化学研究により3種のオピオイドペプチド自身あるいはその前駆タンパク質の脳内分布が報告されている[36][37][38][39]。POMCは脳下垂体や視床下部に高発現し、プロエンケファリン は脳内に広く分布するが特に線条体に高発現する。ダイノルフィンについては、脳内に広く発現している。高発現領域については触れられていないが、皮質、線条体、側坐核、扁桃体で重要な働きをしているとの報告がある。これら前駆タンパク質の共存はあまりよく知られていないが、ダイノルフィンやエンケファリンは線条体でサブスタンスPと共存することなどが知られている[40]。脳以外では副腎髄質にProエンケファリン前駆体やそれに由来するエンケファリン含有ペプチドが高濃度存在する[41]。
受容体特異性と生理機能・疾患との関連性
β-エンドルフィンは主にμ受容体アゴニストとして機能しモルヒネ様鎮痛効果と類似することが報告されている[42]。IUPHAR (Guide to Pharmacology)によるとβ-エンドルフィンやMet-エンケファリンはμ受容体発現細胞においてpKi=9.0前後の高親和性を示し、δ受容体に対してはLeu-エンケファリンの方がMet-エンケファリンより高親和性を示す。エンケファリンは鎮痛効果や精神調節作用との関連で報告されている。[43][44]。
κ受容体についてはダイノルフィンがβ-エンドルフィンやエンケファリン類と比べて圧倒的に高い親和性を示し、その機能は精神作用との関連で報告されている[45]。Nociceptin/ORF-1はORL-1に対して高い親和性を示しORL-1受容体拮抗薬を使った薬理作用実験などから疼痛制御やアンチオピオイド作用など、多様な薬理作用が報告されている[46]。
生理機能・疾患との関連性は表2のとおりである。
| カテゴリ | ペプチド | 生理作用/疾患 | 参考文献 |
|---|---|---|---|
| 生理作用 | βエンドルフィン | 鎮痛作用 | [42] |
| βエンドルフィン | 免疫調節効果 | [47] | |
| βエンドルフィン | 報酬効果 | [48] | |
| エンケファリン | 鎮痛作用 | [44] | |
| エンケファリン | 免疫調節効果 | [49] | |
| エンケファリン | 報酬効果 | [50] | |
| エンケファリン | 抗不安作用 | [43] | |
| ダイノルフィン | 鎮痛作用 | [51] | |
| ノシセプチン | 疼痛誘発作用 | [34] | |
| ノシセプチン | 不安、抑うつ作用 | [52] | |
| 疾患 | βエンドルフィン | アルコール依存症 | [53][54] |
| βエンドルフィン | 肥満症 | [55] | |
| βエンドルフィン | アルツハイマー病 | [56][57] | |
| βエンドルフィン | 自閉症 | ||
| βエンドルフィン | PTSD | ||
| エンケファリン | パーキンソン病 | [58] | |
| ダイノルフィン | 掻痒症 | [59] | |
| ダイノルフィン | 統合失調症 | [45] | |
| ノシセプチン | うつ病 | [52] |
参考文献
- ↑
Goldstein, A., Lowney, L.I., & Pal, B.K. (1971).
Stereospecific and nonspecific interactions of the morphine congener levorphanol in subcellular fractions of mouse brain. Proceedings of the National Academy of Sciences of the United States of America, 68(8), 1742-7. [PubMed:5288759] [PMC] [WorldCat] [DOI] - ↑
Pert, C.B., & Snyder, S.H. (1973).
Opiate receptor: demonstration in nervous tissue. Science (New York, N.Y.), 179(4077), 1011-4. [PubMed:4687585] [WorldCat] [DOI] - ↑
Hughes, J., Smith, T.W., Kosterlitz, H.W., Fothergill, L.A., Morgan, B.A., & Morris, H.R. (1975).
Identification of two related pentapeptides from the brain with potent opiate agonist activity. Nature, 258(5536), 577-80. [PubMed:1207728] [WorldCat] [DOI] - ↑
Li, C.H., & Chung, D. (1976).
Isolation and structure of an untriakontapeptide with opiate activity from camel pituitary glands. Proceedings of the National Academy of Sciences of the United States of America, 73(4), 1145-8. [PubMed:1063395] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Kakidani, H., Furutani, Y., Takahashi, H., Noda, M., Morimoto, Y., Hirose, T., ..., & Numa, S. (1982).
Cloning and sequence analysis of cDNA for porcine beta-neo-endorphin/dynorphin precursor. Nature, 298(5871), 245-9. [PubMed:6123953] [WorldCat] [DOI] - ↑ 6.0 6.1
Nakanishi, S., Inoue, A., Kita, T., Nakamura, M., Chang, A.C., Cohen, S.N., & Numa, S. (1979).
Nucleotide sequence of cloned cDNA for bovine corticotropin-beta-lipotropin precursor. Nature, 278(5703), 423-7. [PubMed:221818] [WorldCat] [DOI] - ↑ 7.0 7.1
Noda, M., Furutani, Y., Takahashi, H., Toyosato, M., Hirose, T., Inayama, S., ..., & Numa, S. (1982).
Cloning and sequence analysis of cDNA for bovine adrenal preproenkephalin. Nature, 295(5846), 202-6. [PubMed:6276759] [WorldCat] [DOI] - ↑ 柿谷 均 (2015).
伝説の生化学者 沼 正作物語 ぶっちぎりのアセチルコリン受容体。化学 70(8), 22-27 - ↑
Gubler, U., Seeburg, P., Hoffman, B.J., Gage, L.P., & Udenfriend, S. (1982).
Molecular cloning establishes proenkephalin as precursor of enkephalin-containing peptides. Nature, 295(5846), 206-8. [PubMed:6173760] [WorldCat] [DOI] - ↑
Kangawa, K., Minamino, N., Chino, N., Sakakibara, S., & Matsuo, H. (1981).
The complete amino acid sequence of alpha-neo-endorphin. Biochemical and biophysical research communications, 99(3), 871-8. [PubMed:7247946] [WorldCat] [DOI] - ↑
Nakao, K., Suda, M., Sakamoto, M., Yoshimasa, T., Morii, N., Ikeda, Y., ..., & Imura, H. (1983).
Leumorphin is a novel endogenous opioid peptide derived from preproenkephalin B. Biochemical and biophysical research communications, 117(3), 695-701. [PubMed:6689399] [WorldCat] [DOI] - ↑ 12.00 12.01 12.02 12.03 12.04 12.05 12.06 12.07 12.08 12.09 12.10 12.11 12.12 12.13
Li, Y., Lefever, M.R., Muthu, D., Bidlack, J.M., Bilsky, E.J., & Polt, R. (2012).
Opioid glycopeptide analgesics derived from endogenous enkephalins and endorphins. Future medicinal chemistry, 4(2), 205-26. [PubMed:22300099] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3 13.4 13.5 13.6 13.7 13.8 Toll L, Caló G, Cox BM, Chavkin C, Christie MJ, Civelli O, Connor M, Devi LA, Evans C, Henderson G, Höllt V, Kieffer B, Kitchen I, Kreek MJ, Liu-Chen LY, Meunier JC, Portoghese PS, Shippenberg TS, Simon EJ, Traynor JR, Ueda H, Wong YH (10 August 2015). "Opioid receptors: Introduction". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. Retrieved 20 October 2017.
- ↑ 14.0 14.1 14.2 "δ receptor". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. 15 May 2017. Retrieved 28 December 2017.
Principal endogenous agonists (Human) [are]
β-endorphin (POMC, P01189), [Leu]enkephalin (PENK, P01210), [Met]enkephalin (PENK, P01210) - ↑ "μ receptor". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. 15 March 2017. Retrieved 28 December 2017.
Comments: β-Endorphin is the highest potency endogenous ligand ...
Morphine occurs endogenously (Poeaknapo et. al. 2004) ...
Principal endogenous agonists (Human) [are]
β-endorphin (POMC, P01189), [Met]enkephalin (PENK, P01210), [Leu]enkephalin (PENK, P01210) - ↑
Poeaknapo, C., Schmidt, J., Brandsch, M., Dräger, B., & Zenk, M.H. (2004).
Endogenous formation of morphine in human cells. Proceedings of the National Academy of Sciences of the United States of America, 101(39), 14091-6. [PubMed:15383669] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 "κ receptor". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. 21 February 2017. Retrieved 28 December 2017.
Comments: Dynorphin A and big dynorphin are the highest potency endogenous ligands ...
Principal endogenous agonists (Human) [are]
big dynorphin (PDYN, P01213), dynorphin A (PDYN, P01213) - ↑ "Dynorphin A 1–8". HMDB Version 4.0. Human Metabolome Database. 27 September 2017. Retrieved 20 October 2017.
Dynorphin A (1–8) is a fraction of Dynorphin A with only Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile peptide chain.
- ↑ "Dynorphin A-(1–8): Biological activity". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. Retrieved 20 October 2017.
- ↑ "Big dynorphin: Biological activity". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. Retrieved 20 October 2017.
Principal endogenous agonists at κ receptor
. - ↑ "Big dynorphin: Structure – Peptide Sequence". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. Retrieved 20 October 2017.
Peptide sequence
YGGFLRRIRPKLKWDNQKRYGGFLRRQFKVVT - ↑
Schwarzer, C. (2009).
30 years of dynorphins--new insights on their functions in neuropsychiatric diseases. Pharmacology & therapeutics, 123(3), 353-70. [PubMed:19481570] [PMC] [WorldCat] [DOI] - ↑
Suda, M., Nakao, K., Yoshimasa, T., Sakamoto, M., Morii, N., Ikeda, Y., ..., & Imura, H. (1984).
Human leumorphin is a potent, kappa opioid receptor agonist. Neuroscience letters, 50(1-3), 49-52. [PubMed:6149506] [WorldCat] [DOI] - ↑
Inenaga, K., Nagatomo, T., Nakao, K., Yanaihara, N., & Yamashita, H. (1994).
Kappa-selective agonists decrease postsynaptic potentials and calcium components of action potentials in the supraoptic nucleus of rat hypothalamus in vitro. Neuroscience, 58(2), 331-40. [PubMed:7908725] [WorldCat] [DOI] - ↑ "NOP receptor". IUPHAR/BPS Guide to PHARMACOLOGY. International Union of Basic and Clinical Pharmacology. 18 August 2017. Retrieved 28 December 2017.
Natural/Endogenous Ligands
nociceptin/orphanin FQ - ↑
Takagi, H., Shiomi, H., Ueda, H., & Amano, H. (1979).
A novel analgesic dipeptide from bovine brain is a possible Met-enkephalin releaser. Nature, 282(5737), 410-2. [PubMed:228202] [WorldCat] [DOI] - ↑ 27.0 27.1
Ueda, H. (2021).
Review of Kyotorphin Research: A Mysterious Opioid Analgesic Dipeptide and Its Molecular, Physiological, and Pharmacological Characteristics. Frontiers in medical technology, 3, 662697. [PubMed:35047919] [PMC] [WorldCat] [DOI] - ↑
Kamiński, S., Cieslińska, A., & Kostyra, E. (2007).
Polymorphism of bovine beta-casein and its potential effect on human health. Journal of applied genetics, 48(3), 189-98. [PubMed:17666771] [WorldCat] [DOI] - ↑
Brantl, V., Gramsch, C., Lottspeich, F., Mertz, R., Jaeger, K.H., & Herz, A. (1986).
Novel opioid peptides derived from hemoglobin: hemorphins. European journal of pharmacology, 125(2), 309-10. [PubMed:3743640] [WorldCat] [DOI] - ↑
Zadina, J.E., Hackler, L., Ge, L.J., & Kastin, A.J. (1997).
A potent and selective endogenous agonist for the mu-opiate receptor. Nature, 386(6624), 499-502. [PubMed:9087409] [WorldCat] [DOI] - ↑
Tsukahara, T., Yamagishi, S., Neyama, H., & Ueda, H. (2018).
Tyrosyl-tRNA synthetase: A potential kyotorphin synthetase in mammals. Peptides, 101, 60-68. [PubMed:29289698] [WorldCat] [DOI] - ↑
Ueda, H., Yoshihara, Y., Fukushima, N., Shiomi, H., Nakamura, A., & Takagi, H. (1987).
Kyotorphin (tyrosine-arginine) synthetase in rat brain synaptosomes. The Journal of biological chemistry, 262(17), 8165-73. [PubMed:3597366] [WorldCat] - ↑
Mollereau, C., Parmentier, M., Mailleux, P., Butour, J.L., Moisand, C., Chalon, P., ..., & Meunier, J.C. (1994).
ORL1, a novel member of the opioid receptor family. Cloning, functional expression and localization. FEBS letters, 341(1), 33-8. [PubMed:8137918] [WorldCat] [DOI] - ↑ 34.0 34.1 34.2
Meunier, J.C., Mollereau, C., Toll, L., Suaudeau, C., Moisand, C., Alvinerie, P., ..., & Monsarrat, B. (1995).
Isolation and structure of the endogenous agonist of opioid receptor-like ORL1 receptor. Nature, 377(6549), 532-5. [PubMed:7566152] [WorldCat] [DOI] - ↑
Reinscheid, R.K., Nothacker, H.P., Bourson, A., Ardati, A., Henningsen, R.A., Bunzow, J.R., ..., & Civelli, O. (1995).
Orphanin FQ: a neuropeptide that activates an opioidlike G protein-coupled receptor. Science (New York, N.Y.), 270(5237), 792-4. [PubMed:7481766] [WorldCat] [DOI] - ↑
Hentges, S.T., Otero-Corchon, V., Pennock, R.L., King, C.M., & Low, M.J. (2009).
Proopiomelanocortin expression in both GABA and glutamate neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(43), 13684-90. [PubMed:19864580] [PMC] [WorldCat] [DOI] - ↑
Le Merrer, J., Becker, J.A., Befort, K., & Kieffer, B.L. (2009).
Reward processing by the opioid system in the brain. Physiological reviews, 89(4), 1379-412. [PubMed:19789384] [PMC] [WorldCat] [DOI] - ↑
Maegawa, A., Murata, K., Kuroda, K., Fujieda, S., & Fukazawa, Y. (2022).
Cellular Profiles of Prodynorphin and Preproenkephalin mRNA-Expressing Neurons in the Anterior Olfactory Tubercle of Mice. Frontiers in neural circuits, 16, 908964. [PubMed:35937204] [PMC] [WorldCat] [DOI] - ↑
Simonin, F., Valverde, O., Smadja, C., Slowe, S., Kitchen, I., Dierich, A., ..., & Kieffer, B.L. (1998).
Disruption of the kappa-opioid receptor gene in mice enhances sensitivity to chemical visceral pain, impairs pharmacological actions of the selective kappa-agonist U-50,488H and attenuates morphine withdrawal. The EMBO journal, 17(4), 886-97. [PubMed:9463367] [PMC] [WorldCat] [DOI] - ↑
Anderson, K.D., & Reiner, A. (1990).
Extensive co-occurrence of substance P and dynorphin in striatal projection neurons: an evolutionarily conserved feature of basal ganglia organization. The Journal of comparative neurology, 295(3), 339-69. [PubMed:1693632] [WorldCat] [DOI] - ↑
Udenfriend, S., & Kilpatrick, D.L. (1983).
Biochemistry of the enkephalins and enkephalin-containing peptides. Archives of biochemistry and biophysics, 221(2), 309-23. [PubMed:6340606] [WorldCat] [DOI] - ↑ 42.0 42.1
Tseng, L.F., Loh, H.H., & Li, C.H. (1976).
Beta-Endorphin as a potent analgesic by intravenous injection. Nature, 263(5574), 239-40. [PubMed:958477] [WorldCat] [DOI] - ↑ 43.0 43.1
Ragnauth, A., Schuller, A., Morgan, M., Chan, J., Ogawa, S., Pintar, J., ..., & Pfaff, D.W. (2001).
Female preproenkephalin-knockout mice display altered emotional responses. Proceedings of the National Academy of Sciences of the United States of America, 98(4), 1958-63. [PubMed:11172058] [PMC] [WorldCat] [DOI] - ↑ 44.0 44.1
Urca, G., Frenk, H., Liebeskind, J.C., & Taylor, A.N. (1977).
Morphine and enkephalin: analgesic and epileptic properties. Science (New York, N.Y.), 197(4298), 83-6. [PubMed:867056] [WorldCat] [DOI] - ↑ 45.0 45.1
Zhang, A.Z., Zhou, G.Z., Xi, G.F., Gu, N.F., Xia, Z.Y., Yao, J.L., ..., & Potkin, S. (1985).
Lower CSF level of dynorphin(1-8) immunoreactivity in schizophrenic patients. Neuropeptides, 5(4-6), 553-6. [PubMed:2860611] [WorldCat] [DOI] - ↑
Mogil, J.S., Grisel, J.E., Reinscheid, R.K., Civelli, O., Belknap, J.K., & Grandy, D.K. (1996).
Orphanin FQ is a functional anti-opioid peptide. Neuroscience, 75(2), 333-7. [PubMed:8930999] [WorldCat] [DOI] - ↑
Chiappelli, F., Kavelaars, A., & Heijnen, C.J. (1992).
Beta-endorphin effects on membrane transduction in human lymphocytes. Annals of the New York Academy of Sciences, 650, 211-7. [PubMed:1534974] [WorldCat] [DOI] - ↑
Roth-Deri, I., Green-Sadan, T., & Yadid, G. (2008).
Beta-endorphin and drug-induced reward and reinforcement. Progress in neurobiology, 86(1), 1-21. [PubMed:18602444] [WorldCat] [DOI] - ↑
Wybran, J., Appelboom, T., Famaey, J.P., & Govaerts, A. (1979).
Suggestive evidence for receptors for morphine and methionine-enkephalin on normal human blood T lymphocytes. Journal of immunology (Baltimore, Md. : 1950), 123(3), 1068-70. [PubMed:224107] [WorldCat] - ↑
Belluzzi, J.D., & Stein, L. (1977).
Enkephalin may mediate euphoria and drive-reduction reward. Nature, 266(5602), 556-8. [PubMed:193035] [WorldCat] [DOI] - ↑
Kaneko, T., Nakazawa, T., Ikeda, M., Yamatsu, K., Iwama, T., Wada, T., ..., & Takagi, H. (1983).
Sites of analgesic action of dynorphin. Life sciences, 33 Suppl 1, 661-4. [PubMed:6141507] [WorldCat] [DOI] - ↑ 52.0 52.1
Gavioli, E.C., & Calo', G. (2013).
Nociceptin/orphanin FQ receptor antagonists as innovative antidepressant drugs. Pharmacology & therapeutics, 140(1), 10-25. [PubMed:23711793] [WorldCat] [DOI] - ↑
Giugliano, D., Salvatore, T., Cozzolino, D., Ceriello, A., Torella, R., & D'Onofrio, F. (1987).
Sensitivity to beta-endorphin as a cause of human obesity. Metabolism: clinical and experimental, 36(10), 974-8. [PubMed:2958673] [WorldCat] [DOI] - ↑
Zalewska-Kaszubska, J., & Czarnecka, E. (2005).
Deficit in beta-endorphin peptide and tendency to alcohol abuse. Peptides, 26(4), 701-5. [PubMed:15752586] [WorldCat] [DOI] - ↑
Sulkava, R., Erkinjuntti, T., & Laatikainen, T. (1985).
CSF beta-endorphin and beta-lipotropin in Alzheimer's disease and multi-infarct dementia. Neurology, 35(7), 1057-8. [PubMed:3159972] [WorldCat] [DOI] - ↑
Baker, D.G., West, S.A., Orth, D.N., Hill, K.K., Nicholson, W.E., Ekhator, N.N., ..., & Geracioti, T.D. (1997).
Cerebrospinal fluid and plasma beta-endorphin in combat veterans with post-traumatic stress disorder. Psychoneuroendocrinology, 22(7), 517-29. [PubMed:9373885] [WorldCat] [DOI] - ↑
Tordjman, S., Anderson, G.M., McBride, P.A., Hertzig, M.E., Snow, M.E., Hall, L.M., ..., & Cohen, D.J. (1997).
Plasma beta-endorphin, adrenocorticotropin hormone, and cortisol in autism. Journal of child psychology and psychiatry, and allied disciplines, 38(6), 705-15. [PubMed:9315980] [WorldCat] [DOI] - ↑
Samadi, P., Bédard, P.J., & Rouillard, C. (2006).
Opioids and motor complications in Parkinson's disease. Trends in pharmacological sciences, 27(10), 512-7. [PubMed:16908075] [WorldCat] [DOI] - ↑
Kardon, A.P., Polgár, E., Hachisuka, J., Snyder, L.M., Cameron, D., Savage, S., ..., & Ross, S.E. (2014).
Dynorphin acts as a neuromodulator to inhibit itch in the dorsal horn of the spinal cord. Neuron, 82(3), 573-86. [PubMed:24726382] [PMC] [WorldCat] [DOI]