細胞内カルシウムストア
三上 義礼
東邦大学医学部医学科生理学講座統合生理学分野
大久保 洋平
東京大学 / 医学(系)研究科(研究院)
DOI:10.14931/bsd.7107 原稿受付日:2016年5月6日 原稿完成日:2016年6月15日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名: intracellular calcium store
カルシウムイオンは重要な細胞内情報伝達物質の一つであり、さまざまな生理機能の制御や疾患のプロセスに関与している。細胞内小器官の一部は、カルシウムイオンをその内腔に貯蔵し一定の条件下でカルシウムイオンを細胞質に放出する機能を有している。カルシウムイオン貯蔵庫および供給源としてカルシウムシグナルに関与する細胞内小器官を、細胞内カルシウムストアと総称する。本稿ではこの細胞内カルシウムストアについて、その代表的な存在である小胞体とミトコンドリアの機能について解説する。
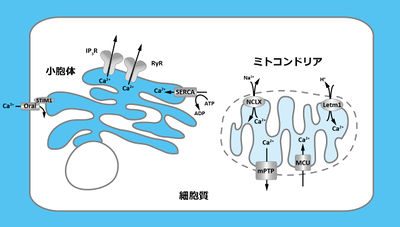
細胞内カルシウムシグナル
カルシウムイオンはさまざまな細胞機能を調節するセカンドメッセンジャーである。神経伝達物質の放出、シナプス可塑性の誘導などの生理機能に関わる一方で、細胞死をはじめとする病態にも関与している。
細胞質のカルシウムイオン濃度は、刺激を受けていない静止状態では数十nM程度に保たれており、刺激に応じて数百nMから数十µMに渡る幅広い濃度範囲で変化する。さらに、カルシウムウェーブやカルシウムオシレーションといった、細胞内カルシウムイオン濃度の複雑な時空間動態が観察される。
細胞内カルシウムストアはカルシウムイオンの取り込みと放出を通じて、カルシウムシグナルの形成を担う。
小胞体
小胞体はさまざまな機能を有する細胞内小器官であるが、滑面小胞体は細胞内カルシウムストアとして中心的な役割を担う。小胞体はカルシウムイオン取り込み機構により細胞質からカルシウムイオンを除去する。小胞体内腔のカルシウムイオン濃度は約1 mM程度に保たれており、細胞質との間で大きな濃度勾配を示す。この濃度勾配に従い、小胞体膜上のカルシウムイオンチャネルが開くと細胞質に向かってカルシウムイオンが放出される。
小胞体へのカルシウムイオン取り込み
小胞体内腔へのカルシウムイオン取り込みを担うカルシウムイオンポンプは、筋小胞体/小胞体カルシウムATPアーゼ(sarco/endoplasmic reticulum Ca2+-ATPase; SERCA)である。SERCAは小胞体膜に局在し、ATPを分解することによってカルシウムイオンを濃度勾配に逆らい取り込む[1]。SERCAの活性は細胞質カルシウムイオンの除去によるカルシウムシグナル形成のみならず、小胞体内腔の高いカルシウムイオン濃度の維持に不可欠である。
実際にタプシガルギンなどのSERCA阻害薬を処置することで、小胞体内腔のカルシウムイオン濃度が大きく減少する(カルシウムイオン枯渇)。カルシウムイオン枯渇により、小胞体膜上のSTIM1を介して細胞膜のカルシウムイオンチャネルOraiが活性化される(容量依存性カルシウムイオン流入)。これは小胞体内腔のカルシウムイオン濃度を維持するための恒常性機構であると期待される[2]。
小胞体からのカルシウムイオン放出
小胞体内腔からカルシウムイオンを放出するのは、イノシトール三リン酸受容体(inositol triphosphate receptor; IP3R)とリアノジン受容体(ryanodine receptor; RyR)という二種類のカルシウムイオンチャネルである。
イノシトール三リン酸受容体
イノシトール三リン酸が結合することによって活性化され、また細胞質カルシウムイオンによっても活性化される。約2700アミノ酸からなる巨大分子で、IP3R1、IP3R2、IP3R3の3つのサブタイプが存在する[3]。IP3R1は主に神経細胞に発現しており、特に小脳のプルキンエ細胞に豊富に存在する[4]。IP3R2は主にアストロサイトに豊富に発現している[5]。
リアノジン受容体
細胞質カルシウムイオンによって活性化される。また、一酸化窒素により活性化される機構も報告されている[6]。約5000アミノ酸からなる巨大分子で、RyR1、RyR2、RyR3の3つのサブタイプがある。RyR1は骨格筋や小脳プルキンエ細胞、RyR2は心筋や脳、膵臓に、RyR3は平滑筋や脳などに優位に発現が見られる[7]。
小胞体の細胞内カルシウムストアとしての意義
細胞内カルシウムストアとしての小胞体機能の著名例として、骨格筋や心筋における興奮収縮連関が挙げられるが、中枢神経系においても多様な機能を担っている [8] [9]。疾患との関係に着目すると、脊髄小脳変性症15型(SCA15)ではIP3R1遺伝子に欠失やミスセンス変異が見つかっている[10] [11]。小胞体を細胞膜に近接させることでリアノジン受容体機能に関与するジャンクトフィリン3については、ハンチントン病類縁疾患2型において当該遺伝子でのトリプレット伸長が報告されている[12]。
また、一酸化窒素によって活性化されたRyR1を通じたカルシウムイオン放出が脳虚血時等の神経細胞死に関与することも示されている[6]。
ミトコンドリア
ミトコンドリアはATP合成などを担う細胞内小器官であるが、カルシウムイオンの取り込みおよび放出機構を有しており、細胞内カルシウムストアとしても機能する。
ミトコンドリアへのカルシウムイオン取り込み
ミトコンドリアへのカルシウムイオンの取り込みを主に担っているのは、ミトコンドリア内膜上に存在する、ミトコンドリアカルシウムユニポーター(mitochondrial calcium uniporter; MCU)と呼ばれるカルシウムイオンチャネルである[13] [14]。ミトコンドリアカルシウムユニポーターは細胞質カルシウムイオン濃度上昇に依存して開口し、ミトコンドリアマトリックス内外の大きな電位差に従い、細胞質からカルシウムイオンを流入させる。ミトコンドリアカルシウムユニポーターの開口を制御するタンパク質も近年報告されている[15] [16]。
また、カルシウムイオントランスポーターとしてLetm1が同定されている[17]。マトリックスへのカルシウムイオン取り込みとプロトン汲み出しを共役するCa2+/H+アンチポーターであると考えられる。
ミトコンドリアからのカルシウムイオン放出
ミトコンドリアからカルシウムイオンを放出する分子として、ミトコンドリア内膜に存在するNa+/Ca2+アンチポーター(Na+/Ca2+ exchanger; NCLX)が挙げられる[18]。また、生理的条件下では開口しないものの、過剰なカルシウムイオン濃度上昇やアポトーシス誘発因子Baxなどによって開く、ミトコンドリア膜透過性遷移孔(mitochondrial permeability transition pore; mPTP)というチャネル状の構造体が存在する。開口するとミトコンドリア内膜および外膜の透過性が大きく亢進し、カルシウムイオンを含むさまざまな物質が漏出する。
ミトコンドリアの細胞内カルシウムストアとしての意義
カルシウムイオンの取り込みと放出を通じて、カルシウムウェーブやカルシウムオシレーションの形成に寄与している[19] [20]。また、mPTPはカルシウムイオンとともにシトクロムCを放出させ、カスパーゼ経路を介した細胞死を引き起こす[21]。
ミトコンドリアはmitofusin2などの因子を介して、小胞体と近接して局在する[22]。これにより、小胞体から放出されたカルシウムイオンがミトコンドリアに効率的に取り込まれる[23]。このような小胞体とミトコンドリアの連関は、局所的なATP合成の活性化などを促す役割があると考えられる[24]。
その他の細胞内カルシウムストア
ゴルジ体は内腔のカルシウムイオン濃度がmMオーダーとされる報告もあり、細胞内カルシウムストアとして働いている可能性がある[25]。イノシトール三リン酸依存的な経路を介してカルシウムイオンを放出すると考えられているが、さらなる研究が必要である[26]。
関連項目
参考文献
- ↑
Yu, X., Carroll, S., Rigaud, J.L., & Inesi, G. (1993).
H+ countertransport and electrogenicity of the sarcoplasmic reticulum Ca2+ pump in reconstituted proteoliposomes. Biophysical journal, 64(4), 1232-42. [PubMed:8388268] [PMC] [WorldCat] [DOI] - ↑
Soboloff, J., Rothberg, B.S., Madesh, M., & Gill, D.L. (2012).
STIM proteins: dynamic calcium signal transducers. Nature reviews. Molecular cell biology, 13(9), 549-65. [PubMed:22914293] [PMC] [WorldCat] [DOI] - ↑
Foskett, J.K., White, C., Cheung, K.H., & Mak, D.O. (2007).
Inositol trisphosphate receptor Ca2+ release channels. Physiological reviews, 87(2), 593-658. [PubMed:17429043] [PMC] [WorldCat] [DOI] - ↑
Yamada, N., Makino, Y., Clark, R.A., Pearson, D.W., Mattei, M.G., Guénet, J.L., ..., & Furuichi, T. (1994).
Human inositol 1,4,5-trisphosphate type-1 receptor, InsP3R1: structure, function, regulation of expression and chromosomal localization. The Biochemical journal, 302 ( Pt 3), 781-90. [PubMed:7945203] [PMC] [WorldCat] [DOI] - ↑
Petravicz, J., Fiacco, T.A., & McCarthy, K.D. (2008).
Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(19), 4967-73. [PubMed:18463250] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Kakizawa, S., Yamazawa, T., Chen, Y., Ito, A., Murayama, T., Oyamada, H., ..., & Iino, M. (2012).
Nitric oxide-induced calcium release via ryanodine receptors regulates neuronal function. The EMBO journal, 31(2), 417-28. [PubMed:22036948] [PMC] [WorldCat] [DOI] - ↑
Giannini, G., Conti, A., Mammarella, S., Scrobogna, M., & Sorrentino, V. (1995).
The ryanodine receptor/calcium channel genes are widely and differentially expressed in murine brain and peripheral tissues. The Journal of cell biology, 128(5), 893-904. [PubMed:7876312] [PMC] [WorldCat] [DOI] - ↑
Berridge, M.J. (1998).
Neuronal calcium signaling. Neuron, 21(1), 13-26. [PubMed:9697848] [WorldCat] [DOI] - ↑
Verkhratsky, A. (2005).
Physiology and pathophysiology of the calcium store in the endoplasmic reticulum of neurons. Physiological reviews, 85(1), 201-79. [PubMed:15618481] [WorldCat] [DOI] - ↑
Hara, K., Shiga, A., Nozaki, H., Mitsui, J., Takahashi, Y., Ishiguro, H., ..., & Onodera, O. (2008).
Total deletion and a missense mutation of ITPR1 in Japanese SCA15 families. Neurology, 71(8), 547-51. [PubMed:18579805] [WorldCat] [DOI] - ↑
Knight, M.A., Kennerson, M.L., Anney, R.J., Matsuura, T., Nicholson, G.A., Salimi-Tari, P., ..., & Forrest, S.M. (2003).
Spinocerebellar ataxia type 15 (sca15) maps to 3p24.2-3pter: exclusion of the ITPR1 gene, the human orthologue of an ataxic mouse mutant. Neurobiology of disease, 13(2), 147-57. [PubMed:12828938] [WorldCat] - ↑
Holmes, S.E., O'Hearn, E., Rosenblatt, A., Callahan, C., Hwang, H.S., Ingersoll-Ashworth, R.G., ..., & Margolis, R.L. (2001).
A repeat expansion in the gene encoding junctophilin-3 is associated with Huntington disease-like 2. Nature genetics, 29(4), 377-8. [PubMed:11694876] [WorldCat] [DOI] - ↑
Baughman, J.M., Perocchi, F., Girgis, H.S., Plovanich, M., Belcher-Timme, C.A., Sancak, Y., ..., & Mootha, V.K. (2011).
Integrative genomics identifies MCU as an essential component of the mitochondrial calcium uniporter. Nature, 476(7360), 341-5. [PubMed:21685886] [PMC] [WorldCat] [DOI] - ↑
De Stefani, D., Raffaello, A., Teardo, E., Szabò, I., & Rizzuto, R. (2011).
A forty-kilodalton protein of the inner membrane is the mitochondrial calcium uniporter. Nature, 476(7360), 336-40. [PubMed:21685888] [PMC] [WorldCat] [DOI] - ↑
Mallilankaraman, K., Doonan, P., Cárdenas, C., Chandramoorthy, H.C., Müller, M., Miller, R., ..., & Madesh, M. (2012).
MICU1 is an essential gatekeeper for MCU-mediated mitochondrial Ca(2+) uptake that regulates cell survival. Cell, 151(3), 630-44. [PubMed:23101630] [PMC] [WorldCat] [DOI] - ↑
Sancak, Y., Markhard, A.L., Kitami, T., Kovács-Bogdán, E., Kamer, K.J., Udeshi, N.D., ..., & Mootha, V.K. (2013).
EMRE is an essential component of the mitochondrial calcium uniporter complex. Science (New York, N.Y.), 342(6164), 1379-82. [PubMed:24231807] [PMC] [WorldCat] [DOI] - ↑
Jiang, D., Zhao, L., & Clapham, D.E. (2009).
Genome-wide RNAi screen identifies Letm1 as a mitochondrial Ca2+/H+ antiporter. Science (New York, N.Y.), 326(5949), 144-7. [PubMed:19797662] [PMC] [WorldCat] [DOI] - ↑
Palty, R., Silverman, W.F., Hershfinkel, M., Caporale, T., Sensi, S.L., Parnis, J., ..., & Sekler, I. (2010).
NCLX is an essential component of mitochondrial Na+/Ca2+ exchange. Proceedings of the National Academy of Sciences of the United States of America, 107(1), 436-41. [PubMed:20018762] [PMC] [WorldCat] [DOI] - ↑
Ishii, K., Hirose, K., & Iino, M. (2006).
Ca2+ shuttling between endoplasmic reticulum and mitochondria underlying Ca2+ oscillations. EMBO reports, 7(4), 390-6. [PubMed:16415789] [PMC] [WorldCat] [DOI] - ↑
Jouaville, L.S., Ichas, F., Holmuhamedov, E.L., Camacho, P., & Lechleiter, J.D. (1995).
Synchronization of calcium waves by mitochondrial substrates in Xenopus laevis oocytes. Nature, 377(6548), 438-41. [PubMed:7566122] [WorldCat] [DOI] - ↑
Crompton, M. (1999).
The mitochondrial permeability transition pore and its role in cell death. The Biochemical journal, 341 ( Pt 2), 233-49. [PubMed:10393078] [PMC] [WorldCat] - ↑
de Brito, O.M., & Scorrano, L. (2008).
Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature, 456(7222), 605-10. [PubMed:19052620] [WorldCat] [DOI] - ↑
Rizzuto, R., Pinton, P., Carrington, W., Fay, F.S., Fogarty, K.E., Lifshitz, L.M., ..., & Pozzan, T. (1998).
Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science (New York, N.Y.), 280(5370), 1763-6. [PubMed:9624056] [WorldCat] [DOI] - ↑
Cárdenas, C., Miller, R.A., Smith, I., Bui, T., Molgó, J., Müller, M., ..., & Foskett, J.K. (2010).
Essential regulation of cell bioenergetics by constitutive InsP3 receptor Ca2+ transfer to mitochondria. Cell, 142(2), 270-83. [PubMed:20655468] [PMC] [WorldCat] [DOI] - ↑
Chandra, S., Fewtrell, C., Millard, P.J., Sandison, D.R., Webb, W.W., & Morrison, G.H. (1994).
Imaging of total intracellular calcium and calcium influx and efflux in individual resting and stimulated tumor mast cells using ion microscopy. The Journal of biological chemistry, 269(21), 15186-94. [PubMed:8195154] [WorldCat] - ↑
Pinton, P., Pozzan, T., & Rizzuto, R. (1998).
The Golgi apparatus is an inositol 1,4,5-trisphosphate-sensitive Ca2+ store, with functional properties distinct from those of the endoplasmic reticulum. The EMBO journal, 17(18), 5298-308. [PubMed:9736609] [PMC] [WorldCat] [DOI]