Na+/K+-ATPアーゼ
阿部一啓
北海道大学大学院理学研究院
DOI:10.14931/bsd.10927 原稿受付日:2025年3月29日 原稿完成日:2025年4月3日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英:Sodium-potassium ATPase, Na+, K+-ATPase 独:Natrium-Kalium-ATPase 仏:ATPase sodium-potassium
同義語:Na+, K+-ATPアーゼ、ナトリウムポンプ
ナトリウムカリウムATPアーゼ (Na+, K+-ATPアーゼ)は、一分子のATP加水分解と共役して、3つのNa+を細胞外に、2つのK+を細胞内に輸送する能動輸送体である。この働きによって神経細胞でのNa+, K+濃度勾配や膜電位が形成されることから、神経活動にとって不可欠の分子である。また、その異常は疾病と密接にかかわる。
ナトリウムカリウムATPアーゼとは
ほとんどの細胞では、低いCa2+濃度、低いNa+濃度、高いK+濃度そして中性pHが維持されている。多くのエネルギーが、細胞膜を隔てたNa+とK+の濃度勾配として蓄えられ、これは様々な輸送基質(糖、神経伝達物質、アミノ酸、代謝産物)や他のイオンの二次輸送の駆動力として用いられる。また、Na+とK+の濃度勾配は細胞外シグナルや膜電位に応答して、選択的カチオンチャネルが開くことによる迅速なシグナル伝達にも利用される。このような細胞膜を隔てたNa+, K+の濃度勾配はNa+, K+-ATPアーゼによって形成される。
Na+,K+-ATPアーゼの発見は神経科学の発展の歴史と密接にかかわっている。1950年代には、イカの巨大軸索を材料として、のちにNa+,K+-ATPアーゼ を発見することになるJens Christian SkouやRobert Postを含む多くの研究者がマサチューセッツ州のWoods Holeで研究していた。当時、Na+が神経軸索の発火に必須であることが知られていた。Skouは出身地デンマークに戻った後、カニの爪の組織から神経細胞を単離、そのホモジェネートから分画した膜画分にNa+とK+に依存したATP加水分解活性を同定し、これが神経細胞からNa+を積極的に押し出す酵素に必須であると予測される多くの特徴を示していると結論づけた[1]。同じ年、Postはヒトの赤血球に能動輸送されるK+イオン2個に対して、3個のNa+が排出されることを報告した[2]。その後にPostはSkouがカニの神経で観察したようなATP加水分解活性が赤血球膜にも存在し、最も決定的な証拠として、両方の酵素が強心配糖体ウワバインによって阻害されることを示した[3]。
このような一連の研究によって同定されたNa+,K+-ATPアーゼは、細胞におけるNa+, K+輸送系の一部であることが確認され、その発見に対してSkouは1997年にノーベル化学賞を授与された[4]。
Na+,K+-ATPアーゼは、ATP加水分解の際にその末端リン酸が活性中心に転移した自己リン酸化中間体を形成する[5]。この特徴的ATP加水分解機構が、のちにP-type ATPアーゼと呼ばれる能動輸送体ファミリーの由来である[6][7]。
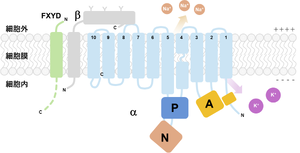
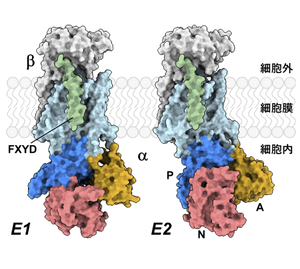
構造
Na+,K+-ATPアーゼは、ATP加水分解とカチオンの結合を担うα-サブユニットと、タンパク質の折り畳みや膜輸送に関わるβ-サブユニットが1:1で会合したヘテロダイマーが最小機能単位である[8]。これに加え、組織/細胞によって特異的に発現するFXYDファミリータンパク質(FXYD2はγ-サブユニットとも呼ばれる)が会合することで、カチオンに対する親和性や比活性が調節されることが知られている(図1)[9][10]。2007年にはK+が結合した初めての結晶構造が[11]、2012年にはNa+が結合した結晶構造が報告され[12]、この分子の作動機構は構造レベルで理解されている(図2)[13][14][15][16][17]。
α-サブユニット
触媒機能を担う。カチオン結合部位が存在する10本の膜貫通ヘリックスと、ATPの加水分解に関わる3つの細胞質ドメイン―ATPを結合するNucleotide-binding domain、自己リン酸化を受けるPhosphorylation domain、脱リン酸化とカチオンのゲーティングの共役に重要なActuator domain― によって構成されている。
β-サブユニット
機能的な複合体形成に必須である。一回膜貫通タンパク質で、細胞内に短いN末端と、細胞外に大きなドメインを持つ。このサブユニットが無いと複合体は小胞体を出て細胞膜にターゲットされない[18]。また、細胞外ドメインには複数のN型糖鎖付加部位が存在し、これらの変異によって頂端/側底膜での発現パターンが変化することが報告されている[19]。
FXYDファミリータンパク質
Na+,K+-ATPアーゼ の最小機能単位はαβ複合体であるが、第三のサブユニットとしてFXYDファミリーがその機能を調節することが知られている。FXYDは、一回膜タンパク質で、N末端側の細胞外部分に共通のPFxYDモチーフを持つことが由来である。哺乳類は7種類のFXYDを発現しており、それらの多くはNa+,K+-ATPアーゼのカチオンに対する親和性やVmaxを調節する[20]。
サブファミリー
P型ATPアーゼは、カチオンから脂質にわたる広範な輸送基質を、よく保存されたATP加水分解機構によって能働輸送する膜タンパク質の一群である。初めて同定されたNa+,K+-ATPアーゼに続き、近縁のH+,K+-ATPアーゼ[21] やCa2+-ATPアーゼ[22] が次々と同定され、いまでは配列相同性や輸送基質の種類によってP1~P5までのサブタイプとして分類される大きなファミリーを形成している[6][7]。
この中でNa+,K+-ATPアーゼ はP2Cタイプに分類される。ヒトのNa+,K+-ATPアーゼはα-サブユニットについて4つ(α1 ~ α4、ATP1A1 ~ ATP1A4)、β-サブユニットでは3つ(β1 ~ β3、ATP1B1 ~ ATP1B3)のアイソフォームが存在し、その組み合わせによってαβ複合体に多様な機能をもたらしている。これに加え哺乳類では7つのFXYD(FXYD1 ~ FXYD7)が組織特異的に発現し、複合体の性質を適切に調節していると考えられている。α-サブユニットのアイソフォームは高い相同性を持ち、α1 ~ α3の間では約87%、α4では少し低い78%のアミノ酸が同一である。それぞれのアイソフォームは異なる反応速度論的な性質を有し、例えばα1はK+に対する親和性が比較的高く、一方でα3はNa+に対する親和性が低い。これに加え、β-サブユニットやFXYDが発現部位や機能を調節することで、細胞はその機能に適したNa+,K+-ATPアーゼ 複合体を利用している[23]。
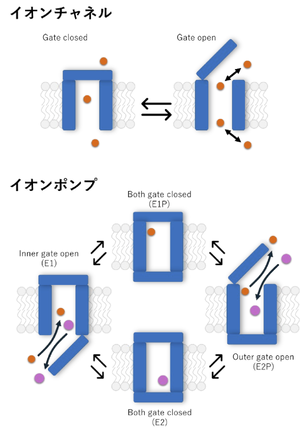
文献[24]より改変。
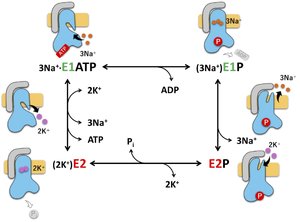
Post-Albers機構。
機能
分子機能
イオンチャネルは熱力学的にdownhillな受動輸送を仲介し、それ故1秒間に数千万個に相当する非常に速いイオンの透過が可能である。これとは対照的にイオンポンプは、熱力学的にuphillな能動輸送体であり、ATPによるエネルギーの入力を必要とする、1秒間に数十回程度の遅い輸送反応を仲介する。
原理的にイオンチャネルはゲートが1つあれば、その開閉を制御することでイオンの透過を制御できる。実際には多くのイオンチャネルが2つのゲート(電位依存的に開くactivation gateとそれとは独立なinactivation gate)を持ち、これらが両方開いた時にのみイオンが流れる。イオンポンプも同様にイオン選択経路とみなすことができるが、この経路へのアクセスは、開閉する少なくとも2つのゲートによって制御され、これらは決して同時に開くことはないという制限が必要である。ゲートは交互に開閉し、輸送されるイオンは一方のゲートが開いている間に膜の片側から経路に入り、最初のゲートが閉じた後、もう一方のゲートが開いている間に膜の反対側から出ることができる。
このような形式論によれば、ポンプとチャネルを区別するのは、2つ目のゲートが開く際の1つ目のゲートが閉じるタイミングであるということに気が付く。しかしながら、拡散によるdownhillなイオンの流れは、ポンプのuphillな輸送に比べて桁違いに速いので、例えばイオンポンプの1サイクルにかかる時間の0.001%程度の短い時間であっても両方のゲートが開いた状態が存在すると、イオンポンプによる能動輸送の努力は水泡と帰す。このような2つのゲート間の連携の断絶は、細胞にとって破滅的な影響を及ぼすので、イオンポンプは内向きと外向きの2つのゲートが両方とも閉じた状態、輸送基質を「閉塞」するステップを安全装置として備えている(図3)[24]。
多くの反応速度論的解析によって、Na+, K+-ATPアーゼのカチオン輸送機構は生化学的によく理解されている。最初にWayne Albersによって提案され[25]、後にPostによって修正された[26]、Na+, K+-ATPアーゼの輸送反応モデルはPost-Albers機構と呼ばれ(図4)、Na+, K+-ATPアーゼだけでなく多くのP型ATPアーゼに対しほぼ共通して適応される。
これらの能動輸送酵素(Enzyme)は内向きでNa+に高い親和性を示すE1状態と、外向きでK+に対して高親和性のE2状態(これらに加えてそれぞれがリン酸化されたE1P、E2P状態)をサイクルすることによって、2種類のカチオンを交互に輸送する。細胞内に向けてゲートを開いたE1に対して細胞内からNa+が結合することで[3Na+・E1]、ATPの加水分解が誘発され、ATPの末端のリン酸がPドメインに普遍的に保存されたDKTGT配列中のアスパラギン酸残基に転移したリン酸化中間体E1Pを形成する[(3Na+)E1P]。このときNa+はカチオン結合サイトに閉塞され、細胞内からも細胞外からもアクセスできない状態になる。E1Pが自発的にE2Pへと変換される過程で、細胞外へのゲートが開き、カチオン結合サイトのNa+に対する親和性が低下することで3つのNa+が細胞外へと排出される。Na+排出後のE2Pの空になったカチオン結合サイトは、K+に対して高い親和性を示す状態になっており、ここに細胞外から2つのK+が結合することで、細胞外のゲートが閉じ、これが細胞内ドメインに伝わることで脱リン酸化が誘発され、K+を閉塞したE2へと移行する[(2K+)E2]。E2は自発的にE1へと変換され、この過程でK+が細胞内に遊離し、再びNa+が結合することでサイクルが繰り返される。
一連の反応は、P型ATPアーゼとして初めて結晶構造が報告されたCa2+-ATPアーゼ[13]や、Na+, K+-ATPアーゼ[11][12]、近縁のH+,K+-ATPアーゼ[27]をはじめとして、多くのP-type ATPアーゼの構造機能解析によって分子レベルで良く理解されている。
生体機能
多くの臓器では、Na+とK+の濃度勾配がそれらの機能にとって重要であり、性質の異なるアイソフォームの組織分布はそれぞれの部位での適切なカチオン濃度勾配の形成に寄与すると考えられている。
α1-サブユニット
すべての細胞に普遍的に存在する。特に腎臓で高発現しており、遠位尿細管では細胞あたり5000万個のNa+,K+-ATPアーゼが存在すると推定されている[28]。これは、ナトリウム勾配が、血液中の老廃物の濾過、グルコースとアミノ酸の再吸収、電解質の調節、pHの維持といった腎臓の主な機能に利用されているからである。腎臓や多くの上皮細胞において、α1は基底膜に分布することで、尿からのNa+や、間接的に水の再吸収に寄与するが[18]、脈絡叢の上皮細胞では逆に頂端膜に発現し、中枢神経系の脳脊髄液に間接的に水分を供給しながら低レベルのK+濃度を維持する役割を担うことが知られている[29][30]。
α2-サブユニット
骨格筋や心筋、平滑筋をはじめ脳(とくにアストロサイトなどのグリア細胞)でも高い発現を示す。心臓ではα2はβ2と会合しT管膜に特異的に分布する。また、α2は収縮組織のNa+/Ca2+交換体の近傍に局在し、間接的に心筋内でのCa2+レベルの調節に寄与している。グリア細胞で提唱されている役割と同様に、α2β2複合体の高い電位感受性と低いK+親和性は、長く続く心筋活動電位発生の間にNa+,K+-ATPアーゼ活性を確実に利用できるようにするためであると提唱されている[31]。
α3-サブユニット
脳で発現し、主に神経細胞の樹状突起やスパインに分布している[32][33]。神経活動中、樹状突起やスパインのNa+濃度は劇的に上昇する可能性があり、100 mMに達するという試算もある[34]。このような高濃度の細胞内Na+のクリアランスは、主にα3が担うと考えられている。これは、他のアイソフォームのNa+に対する親和性が約10 mMであるのに対し、α3は25~50 mMと比較的低いという性質が根拠とされ、α3は高強度のニューロン発火に対して最適化されていると考えられている[35][36]。
α4-サブユニット
精巣の雄性生殖細胞に特異的に発現しているα4は、精子形成の減数分裂時にアップレギュレートされ、成熟精子において最も高い発現を示す。主に精子鞭毛に局在し、膜電位や細胞内Ca2+レベルの維持に必要な細胞内の低いNa+濃度維持にとって重要である。これらの作用により、α4は精子の運動性と過活性化に必須である[37]。精子にはα1も発現するが、α4をノックアウトするとオスだけが重度の無精子症のために完全に不妊となる[38]。
疾患との関わり
神経細胞でのNa+, K+濃度勾配の形成を司るという性質から、アイソフォームの変異が神経疾患の患者から見つかっている。
α1-サブユニット
初期胚発生において必須であるため、それほど多くの疾病関連変異は報告されていない。シャルコー・マリー・トゥース病(Charcot-Marie-Tooth(CMT2))軸索性感覚運動ニューロパチーでは、7つの推定病原性変異が発見されたが、これらは比較的活性に影響が少ない置換であると考えられている[39]。副腎のアルドステロン産生腺由来の腫瘍細胞の一部では、α1の体細胞変異がアルドステロンの過剰産生を引き起こし、これが高血圧に繋がる。これらの変異体の内で機能解析が行われたものは、ATPアーゼ活性の低下、細胞脱分極、またわずかな内向き漏洩電流を示した[40]。
最近カロリンスカのグループから報告された治療困難な悪性小児てんかんの患者から見つかったα1の変異(W931R)は、Na+, K+-ATPアーゼを非特異的なカチオンチャネルへと転換することが卵母細胞での測定によって示唆されている[41]。W931はNa+結合サイトの1つ(site III)を間接的に補強しており[42]、ここの異常によってチャネルの経路が出来たと考察される。
α2-サブユニット
家族性片頭痛Familial Hemiplegic Migraine(FHM)を引き起こす変異として、Ca2+チャネル(FHM1)とNa+チャネル(FHM3)の他に、80以上のα2への機能喪失型変異(FHM2)が報告されている[43]。
α3-サブユニット
機能欠損変異が、急性発症ジストニア・パーキンソニズム(Rapid-onset Dystonia Parkinsonism, RDP)[44]や、小児交代性片麻痺(Alternating Hemiplegia of Childhood, AHC)[45]、CAPOS症候群(小脳失調、反射消失、凹足、視神経萎縮、感音性難聴症候群)(cerebellar ataxia, areflexia, pes cavus, optic atrophy and sensorineural hearing loss syndrom)[46]を引き起こすことが示された。これらの症状は、個体の遺伝的背景もその発症に重要であるとされる。現在80近い疾患関連変異が報告されているが、急性発症ジストニア・パーキンソニズムは変異が広範囲に及ぶのに対し、CAPOS症候群ではカチオン結合に直接関わるE818Kが共通であり、小児交代性片麻痺の大部分は同様にカチオン結合に重要なD801NとE815Kの2つの変異によって占められている[23]。
関連項目
参考文献
- ↑
SKOU, J.C. (1957).
The influence of some cations on an adenosine triphosphatase from peripheral nerves. Biochimica et biophysica acta, 23(2), 394-401. [PubMed:13412736] [WorldCat] [DOI] - ↑
POST, R.L., & JOLLY, P.C. (1957).
The linkage of sodium, potassium, and ammonium active transport across the human erythrocyte membrane. Biochimica et biophysica acta, 25(1), 118-28. [PubMed:13445725] [WorldCat] [DOI] - ↑
POST, R.L., MERRITT, C.R., KINSOLVING, C.R., & ALBRIGHT, C.D. (1960).
Membrane adenosine triphosphatase as a participant in the active transport of sodium and potassium in the human erythrocyte. The Journal of biological chemistry, 235, 1796-802. [PubMed:14434402] [WorldCat] - ↑
Skou, J.C. (1998).
Nobel Lecture. The identification of the sodium pump. Bioscience reports, 18(4), 155-69. [PubMed:9877230] [WorldCat] [DOI] - ↑
Post, R.L., & Kume, S. (1973).
Evidence for an aspartyl phosphate residue at the active site of sodium and potassium ion transport adenosine triphosphatase. The Journal of biological chemistry, 248(20), 6993-7000. [PubMed:4270326] [WorldCat] - ↑ 6.0 6.1
Axelsen, K.B., & Palmgren, M.G. (1998).
Evolution of substrate specificities in the P-type ATPase superfamily. Journal of molecular evolution, 46(1), 84-101. [PubMed:9419228] [WorldCat] [DOI] - ↑ 7.0 7.1
Palmgren, M. (2023).
P-type ATPases: Many more enigmas left to solve. The Journal of biological chemistry, 299(11), 105352. [PubMed:37838176] [PMC] [WorldCat] [DOI] - ↑
Jørgensen, P.L., & Andersen, J.P. (1988).
Structural basis for E1-E2 conformational transitions in Na,K-pump and Ca-pump proteins. The Journal of membrane biology, 103(2), 95-120. [PubMed:3054114] [WorldCat] [DOI] - ↑
Kuster, B., Shainskaya, A., Pu, H.X., Goldshleger, R., Blostein, R., Mann, M., & Karlish, S.J. (2000).
A new variant of the gamma subunit of renal Na,K-ATPase. Identification by mass spectrometry, antibody binding, and expression in cultured cells. The Journal of biological chemistry, 275(24), 18441-6. [PubMed:10748024] [WorldCat] [DOI] - ↑
Sweadner, K.J., & Rael, E. (2000).
The FXYD gene family of small ion transport regulators or channels: cDNA sequence, protein signature sequence, and expression. Genomics, 68(1), 41-56. [PubMed:10950925] [WorldCat] [DOI] - ↑ 11.0 11.1
Morth, J.P., Pedersen, B.P., Toustrup-Jensen, M.S., Sørensen, T.L., Petersen, J., Andersen, J.P., ..., & Nissen, P. (2007).
Crystal structure of the sodium-potassium pump. Nature, 450(7172), 1043-9. [PubMed:18075585] [WorldCat] [DOI] - ↑ 12.0 12.1
Kanai, R., Ogawa, H., Vilsen, B., Cornelius, F., & Toyoshima, C. (2013).
Crystal structure of a Na+-bound Na+,K+-ATPase preceding the E1P state. Nature, 502(7470), 201-6. [PubMed:24089211] [WorldCat] [DOI] - ↑ 13.0 13.1
Toyoshima, C., Nakasako, M., Nomura, H., & Ogawa, H. (2000).
Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 A resolution. Nature, 405(6787), 647-55. [PubMed:10864315] [WorldCat] [DOI] - ↑
Toyoshima, C., Norimatsu, Y., Iwasawa, S., Tsuda, T., & Ogawa, H. (2007).
How processing of aspartylphosphate is coupled to lumenal gating of the ion pathway in the calcium pump. Proceedings of the National Academy of Sciences of the United States of America, 104(50), 19831-6. [PubMed:18077416] [PMC] [WorldCat] [DOI] - ↑
Palmgren, M.G., & Nissen, P. (2011).
P-type ATPases. Annual review of biophysics, 40, 243-66. [PubMed:21351879] [WorldCat] [DOI] - ↑
Jorgensen, P.L., Hakansson, K.O., & Karlish, S.J. (2003).
Structure and mechanism of Na,K-ATPase: functional sites and their interactions. Annual review of physiology, 65, 817-49. [PubMed:12524462] [WorldCat] [DOI] - ↑
Dyla, M., Kjærgaard, M., Poulsen, H., & Nissen, P. (2020).
Structure and Mechanism of P-Type ATPase Ion Pumps. Annual review of biochemistry, 89, 583-603. [PubMed:31874046] [WorldCat] [DOI] - ↑ 18.0 18.1
Caplan, M.J., Anderson, H.C., Palade, G.E., & Jamieson, J.D. (1986).
Intracellular sorting and polarized cell surface delivery of (Na+,K+)ATPase, an endogenous component of MDCK cell basolateral plasma membranes. Cell, 46(4), 623-31. [PubMed:3015421] [WorldCat] [DOI] - ↑
Vagin, O., Turdikulova, S., & Sachs, G. (2005).
Recombinant addition of N-glycosylation sites to the basolateral Na,K-ATPase beta1 subunit results in its clustering in caveolae and apical sorting in HGT-1 cells. The Journal of biological chemistry, 280(52), 43159-67. [PubMed:16230337] [WorldCat] [DOI] - ↑
Geering, K. (2005).
Function of FXYD proteins, regulators of Na, K-ATPase. Journal of bioenergetics and biomembranes, 37(6), 387-92. [PubMed:16691470] [WorldCat] [DOI] - ↑
Ganser, A.L., & Forte, J.G. (1973).
K + -stimulated ATPase in purified microsomes of bullfrog oxyntic cells. Biochimica et biophysica acta, 307(1), 169-80. [PubMed:4351147] [WorldCat] [DOI] - ↑
Bastide, F., Meissner, G., Fleischer, S., & Post, R.L. (1973).
Similarity of the active site of phosphorylation of the adenosine triphosphatase from transport of sodium and potassium ions in kidney to that for transport of calcium ions in the sarcoplasmic reticulum of muscle. The Journal of biological chemistry, 248(24), 8385-91. [PubMed:4357737] [WorldCat] - ↑ 23.0 23.1
Clausen, M.V., Hilbers, F., & Poulsen, H. (2017).
The Structure and Function of the Na,K-ATPase Isoforms in Health and Disease. Frontiers in physiology, 8, 371. [PubMed:28634454] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1
Gadsby, D.C. (2009).
Ion channels versus ion pumps: the principal difference, in principle. Nature reviews. Molecular cell biology, 10(5), 344-52. [PubMed:19339978] [PMC] [WorldCat] [DOI] - ↑
Albers, R.W. (1967).
Biochemical aspects of active transport. Annual review of biochemistry, 36, 727-56. [PubMed:18257736] [WorldCat] [DOI] - ↑
Caplan, M.J., Anderson, H.C., Palade, G.E., & Jamieson, J.D. (1986).
Intracellular sorting and polarized cell surface delivery of (Na+,K+)ATPase, an endogenous component of MDCK cell basolateral plasma membranes. Cell, 46(4), 623-31. [PubMed:3015421] [WorldCat] [DOI] - ↑
Abe, K., Irie, K., Nakanishi, H., Suzuki, H., & Fujiyoshi, Y. (2018).
Crystal structures of the gastric proton pump. Nature, 556(7700), 214-218. [PubMed:29618813] [WorldCat] [DOI] - ↑
El Mernissi, G., & Doucet, A. (1984).
Quantitation of [3H]ouabain binding and turnover of Na-K-ATPase along the rabbit nephron. The American journal of physiology, 247(1 Pt 2), F158-67. [PubMed:6331200] [WorldCat] [DOI] - ↑
Gundersen, D., Orlowski, J., & Rodriguez-Boulan, E. (1991).
Apical polarity of Na,K-ATPase in retinal pigment epithelium is linked to a reversal of the ankyrin-fodrin submembrane cytoskeleton. The Journal of cell biology, 112(5), 863-72. [PubMed:1847929] [PMC] [WorldCat] [DOI] - ↑
Brown, P.D., Davies, S.L., Speake, T., & Millar, I.D. (2004).
Molecular mechanisms of cerebrospinal fluid production. Neuroscience, 129(4), 957-70. [PubMed:15561411] [PMC] [WorldCat] [DOI] - ↑
Habeck, M., Tokhtaeva, E., Nadav, Y., Ben Zeev, E., Ferris, S.P., Kaufman, R.J., ..., & Karlish, S.J. (2016).
Selective Assembly of Na,K-ATPase α2β2 Heterodimers in the Heart: DISTINCT FUNCTIONAL PROPERTIES AND ISOFORM-SELECTIVE INHIBITORS. The Journal of biological chemistry, 291(44), 23159-23174. [PubMed:27624940] [PMC] [WorldCat] [DOI] - ↑
Bøttger, P., Tracz, Z., Heuck, A., Nissen, P., Romero-Ramos, M., & Lykke-Hartmann, K. (2011).
Distribution of Na/K-ATPase alpha 3 isoform, a sodium-potassium P-type pump associated with rapid-onset of dystonia parkinsonism (RDP) in the adult mouse brain. The Journal of comparative neurology, 519(2), 376-404. [PubMed:21165980] [WorldCat] [DOI] - ↑
Blom, H., Bernhem, K., & Brismar, H. (2016).
Sodium pump organization in dendritic spines. Neurophotonics, 3(4), 041803. [PubMed:27175374] [PMC] [WorldCat] [DOI] - ↑
Rose, C.R., & Konnerth, A. (2001).
NMDA receptor-mediated Na+ signals in spines and dendrites. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(12), 4207-14. [PubMed:11404406] [PMC] [WorldCat] [DOI] - ↑
Blanco, G., & Mercer, R.W. (1998).
Isozymes of the Na-K-ATPase: heterogeneity in structure, diversity in function. The American journal of physiology, 275(5), F633-50. [PubMed:9815123] [WorldCat] [DOI] - ↑
Crambert, G., Hasler, U., Beggah, A.T., Yu, C., Modyanov, N.N., Horisberger, J.D., ..., & Geering, K. (2000).
Transport and pharmacological properties of nine different human Na, K-ATPase isozymes. The Journal of biological chemistry, 275(3), 1976-86. [PubMed:10636900] [WorldCat] [DOI] - ↑
Blanco, G., Melton, R.J., Sánchez, G., & Mercer, R.W. (1999).
Functional characterization of a testes-specific alpha-subunit isoform of the sodium/potassium adenosinetriphosphatase. Biochemistry, 38(41), 13661-9. [PubMed:10521273] [WorldCat] [DOI] - ↑
Jimenez, T., McDermott, J.P., Sánchez, G., & Blanco, G. (2011).
Na,K-ATPase alpha4 isoform is essential for sperm fertility. Proceedings of the National Academy of Sciences of the United States of America, 108(2), 644-9. [PubMed:21187400] [PMC] [WorldCat] [DOI] - ↑
Lassuthova, P., Rebelo, A.P., Ravenscroft, G., Lamont, P.J., Davis, M.R., Manganelli, F., ..., & Zuchner, S. (2018).
Mutations in ATP1A1 Cause Dominant Charcot-Marie-Tooth Type 2. American journal of human genetics, 102(3), 505-514. [PubMed:29499166] [PMC] [WorldCat] [DOI] - ↑
Kopec, W., Loubet, B., Poulsen, H., & Khandelia, H. (2014).
Molecular mechanism of Na(+),K(+)-ATPase malfunction in mutations characteristic of adrenal hypertension. Biochemistry, 53(4), 746-54. [PubMed:24428543] [WorldCat] [DOI] - ↑
Ygberg, S., Akkuratov, E.E., Howard, R.J., Taylan, F., Jans, D.C., Mahato, D.R., ..., & Aperia, A. (2021).
A missense mutation converts the Na+,K+-ATPase into an ion channel and causes therapy-resistant epilepsy. The Journal of biological chemistry, 297(6), 101355. [PubMed:34717959] [PMC] [WorldCat] [DOI] - ↑
Clausen, M.V., Hilbers, F., & Poulsen, H. (2017).
The Structure and Function of the Na,K-ATPase Isoforms in Health and Disease. Frontiers in physiology, 8, 371. [PubMed:28634454] [PMC] [WorldCat] [DOI] - ↑
Bøttger, P., Doğanlı, C., & Lykke-Hartmann, K. (2012).
Migraine- and dystonia-related disease-mutations of Na+/K+-ATPases: relevance of behavioral studies in mice to disease symptoms and neurological manifestations in humans. Neuroscience and biobehavioral reviews, 36(2), 855-71. [PubMed:22067897] [WorldCat] [DOI] - ↑
de Carvalho Aguiar, P., Sweadner, K.J., Penniston, J.T., Zaremba, J., Liu, L., Caton, M., ..., & Ozelius, L.J. (2004).
Mutations in the Na+/K+ -ATPase alpha3 gene ATP1A3 are associated with rapid-onset dystonia parkinsonism. Neuron, 43(2), 169-75. [PubMed:15260953] [WorldCat] [DOI] - ↑
Heinzen, E.L., Swoboda, K.J., Hitomi, Y., Gurrieri, F., Nicole, S., de Vries, B., ..., & Goldstein, D.B. (2012).
De novo mutations in ATP1A3 cause alternating hemiplegia of childhood. Nature genetics, 44(9), 1030-4. [PubMed:22842232] [PMC] [WorldCat] [DOI] - ↑
Demos, M.K., van Karnebeek, C.D., Ross, C.J., Adam, S., Shen, Y., Zhan, S.H., ..., & FORGE Canada Consortium (2014).
A novel recurrent mutation in ATP1A3 causes CAPOS syndrome. Orphanet journal of rare diseases, 9, 15. [PubMed:24468074] [PMC] [WorldCat] [DOI]