視床下部
犬束 歩
自治医科大学 生理学講座 神経脳生理学部門
山中 章弘
名古屋大学 環境医学研究所 ストレス受容・応答研究部門
DOI:10.14931/bsd.1033 原稿受付日:2012年5月25日 原稿完成日:2019年2月4日
担当編集委員:渡辺 雅彦 (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)
羅:hypothalamus 英:hypothalamus 独:Hypothalamus 仏:hypothalamus
視床下部とは、間脳に位置し、内分泌や自律機能の調節を行う総合中枢である。ヒトの場合は脳重量のわずか0.3%、4g程度の小さな組織であるが、多くの神経核から構成されており、体温調節やストレス応答、摂食行動や睡眠覚醒など多様な生理機能を協調して管理している。中脳以下の自律機能を司る中枢が呼吸や血液循環、発汗といった個別の自律機能を調節するのに対し、視床下部は交感神経・副交感神経機能や内分泌を統合的に調節することで、生体の恒常性維持に重要な役割を果たしている。系統発生的には古い脳領域であり、摂食行動、性行動、攻撃行動、睡眠といった本能行動の中枢である。
構造
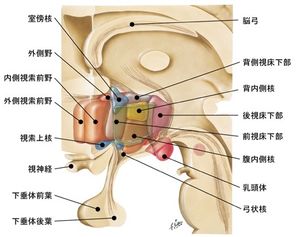
NetterのAtlas of Neuroanatomy and Neurophysiologyより改変して転載(転載許可取得済)
視床下部は第三脳室と接している視床下部脳室周囲層、その外側の視床下部内側野、最も外側に位置する視床下部外側野の3つの領域に大別される(図2)。視床下部は下垂体門脈系と呼ばれる血管系を介して下垂体前葉とつながっている。下垂体前葉は甲状腺、副腎皮質、性腺といった下位の内分泌腺を刺激するホルモンを分泌する上位の内分泌器官であるが、視床下部で産生されるホルモンは下垂体門脈を経由してこの下垂体前葉からのホルモン分泌を調節している。下垂体後葉には、視床下部から軸索が投射しており、バソプレシンとオキシトシンを放出している。また、視床下部には血液脳関門が無い領域が存在し、血液に含まれる生理活性分子の濃度変化をモニタリングするのに役立っている。以下、視床下部に存在する多くの神経核のうち、主なものを記す。 視床下部にある多くの神経核の複雑な位置関係を捉えるのは難しい。立体感覚を掴むためにはAllen brain atlasのBrain Explorer等の利用をお薦めする。
弓状核
Arcuate nucleus: ARC
視床下部と下垂体をつなげる漏斗と呼ばれる部位に存在する弓状核(別名を漏斗核)は下垂体前葉を介してホルモン調節を行っている。弓状核は下垂体前葉からのホルモン分泌を促進させる各種の放出ホルモン(成長ホルモン放出ホルモン、甲状腺刺激ホルモン放出ホルモン、性腺刺激ホルモン放出ホルモン、あるいは、分泌を抑制する各種の放出抑制ホルモン(成長ホルモン抑制ホルモン、プロラクチン抑制ホルモン)を合成している。
また、弓状核は摂食行動とも関連が深い。弓状核にはプロオピオメラノコルチン(Pro-opiomelanocortin: POMC)を発現しているニューロン(POMCニューロン)、およびニューロペプチドY(Neuropeptide Y: NPY)とアグーチ関連ペプチド(Agouti-related peptide: AgRP)の両方を発現しているニューロン(NPY/AgRPニューロン)がそれぞれ存在している。POMCから生じるメラノコルチンは食欲抑制ペプチドとして知られ、摂食亢進ペプチドとして知られるNPYやAgRPと互いに拮抗するように摂食行動を調節している。また、コカイン・アンフェタミン調節転写産物(Cocaine and amphetamine related transcript: CART)と呼ばれる摂食抑制ペプチドも、弓状核においてはPOMCと共局在している。NPY/AgRPニューロンが活性化するとNPYの分泌によって直接的に摂食行動を誘導するだけではなく、メラノコルチン受容体に対するアンタゴニストであるAgRPを介して、間接的にも摂食行動を促進する。脂肪組織で産出される摂食抑制ホルモンであるレプチンは、弓状核のPOMCニューロンを活性化することで食欲の抑制を行い[1]、胃で産出される摂食亢進ホルモンであるグレリンは弓状核のNPY/AgRPニューロンを活性化することで食欲を亢進させる作用がある[2]。
視床下部室傍核
Paraventricular nucleus: PVN
視床下部前方の背側、第三脳室壁の近くにある明瞭な神経核。室傍核の内側部に位置する小細胞性領域にはストレスホルモンとも呼ばれる副腎皮質刺激ホルモン放出ホルモン(Corticotropin-releasing hormone: CRH)を分泌するニューロンの細胞体が存在する。視床下部から放出されるCRHは下垂体前葉における副腎皮質刺激ホルモン(Adrenocorticotropic hormone: ACTH)産生細胞を刺激し、ACTHやβ-リポトロピンの産生と放出とが促される。ACTHは血液循環によって運ばれたのち、副腎皮質を刺激し、副腎皮質ホルモンである糖質コルチコイド(ヒトでは主にコルチゾール)の産生と分泌とを高める。このコルチゾールが循環器機能やエネルギー代謝を高め、ストレスに対する全身の防御にはたらく。ヒトを含めた哺乳動物ではストレスに対する防御システムとして内分泌系および自律神経系が重要な役割を担っており、視床下部-下垂体-副腎皮質(HPA軸)の一連のホルモン伝達系はストレス応答の重要な経路となっている[3]。室傍核の外側部に位置する大細胞性領域には、オキシトシンやバソプレシンを分泌する神経細胞が存在する。これらの細胞の軸索は下垂体後葉へと投射して血管へと内分泌するだけでなく、脳内の多くの領域に投射して社会行動の調節にも係って関わっている。
視交叉上核
Suprachiasmatic nucleus: SCN
視床下部の底部、視交叉のすぐ上に位置する一対の神経核。視交叉上核は体内時計の中枢としてよく知られている[4]。視交叉上核を破壊された動物では、規則正しい睡眠・覚醒リズムが消失してしまう。視交叉上核の細胞は、体内から取り出され外界からの刺激がない状態で培養されても、自律的に概日リズムを刻み続けることができる[5]。同時に、視交叉上核は明暗の情報を目から受け取ることで体内時計を外界と同調させている。この場合、通常の視覚に関わる視細胞ではなく、光感受性物質であるメラノプシンを発現する一部の網膜神経節細胞が視交叉上核へと情報を伝えている[6]。視交叉上核はこの受け取った情報を他の情報と統合して処理したのち、松果体へ伝えている[7]。松果体ではこの情報に応答して睡眠を調節するホルモンであるメラトニンを分泌する。メラトニン分泌は光で抑制されるため、昼行性動物では夜間に高く昼間に低い。
詳細は視交叉上核のページを参照。
視索上核
Supraoptic nucleus: SON
視索上核には、神経ホルモンであるバソプレシン、およびオキシトシンを産生するニューロンの細胞体がそれぞれ存在し、そこから延びる軸索は下垂体 後葉に投射して毛細血管に分泌している。視索上核と室傍核に局在するオキシトシンニューロンからのオキシトシンは、分娩時の子宮筋収縮や授乳時の乳汁射出に重要である。バソプレシンは、腎集合管に作用して水の再吸収を促進し、抗利尿ホルモンとしてはたらいている。
乳頭体
Mammillary body: MB
視床下部の後部に位置する乳頭体は海馬から脳弓を介して入力を受け、視床前核と帯状回を介して海馬に出力を返している。 この回路は古典的にはパペッツ回路と呼ばれ、情動と記憶の形成に関与していることが提唱された。
結節乳頭体核
Tuberomammillary nucleus: TMN
乳頭体の外殻に位置する結節乳頭体核はヒスタミン神経系の起始核であり、覚醒中枢の一つと考えられている。ここからヒスタミン作動性ニューロンは脳内のほぼ全域にわたる幅広い領域に投射しており、ヒスタミン作動性ニューロンが活性化すると覚醒レベルが高まる[8]。風邪薬として用いられる第一世代のヒスタミンH1受容体阻害薬の服用が眠気をもたらすのは、このヒスタミンによる覚醒系が抑制されるからである。
背内側核
Dorsomedial hypothalamic nucleus: DMN
腹内側核の背側、室傍核の腹側に位置し、小型または中型の細胞から構成されている。視交叉上核の主要な投射先であり、概日リズムに合わせたコルチコイド分泌とそれに付随した覚醒、運動などに関与していることが知られている[9]。また、背内側核の神経細胞はオレキシンニューロンに直接投射しており[10]、摂食行動[11]や体温調節[12]との関連が報告されている。
腹内側核
Ventromedial hypothalamic nucleus: VMN
腹内側核は視床下部の中で大きく明瞭な核であり、小型または中型の細胞から構成されている。満腹中枢としての機能は1940年代に行われた腹内側核の除去が動物に肥満をもたらすという様々な実験結果から提唱されたものであり、1970年代に肥満をもたらしているのは室傍核など腹内側核の周辺組織の受けた損傷であるというGoldらによる異論[13]があったものの、現在でも摂食行動と体重維持を制御しているものと考えられている[14]。
また、最近では腹内側核の神経細胞を光遺伝学的手法により活性化させると、攻撃行動あるいは性行動が引き起こされるという報告がなされている[15]。攻撃行動の際に活性化している神経細胞群は生殖行動の際には抑制されており、二つの行動を切り替えるスイッチとしてはたらいている可能性がある。
外側野
Lateral hypothalamic area: LHA
視床下部の外側野と呼ばれる領域には、特定の神経核が存在せず、オレキシンおよびメラニン凝集ホルモン(MCH)と呼ばれる神経ペプチドを産生する神経細胞群がそれぞれ存在している。外側野の局所破壊実験によって摂食行動が抑制されることから、摂食中枢として知られていた。オレキシンニューロンとMCHニューロンは全く異なる神経群であるが、いずれも脳全体に軸索を投射している[16] [17]。オレキシンニューロンは、睡眠・覚醒や摂食、代謝など多様な生理機能を調節している[18]。睡眠覚醒障害のひとつであり、覚醒を維持できずにどのような状態でも眠りに落ちてしまう病気であるナルコレプシーは、オレキシンニューロンが特異的に脱落することによって生じることが明らかになっている。メラニン凝集ホルモンは魚類、両生類ではその名の通り体色調節に関わっているが、哺乳類では主に摂食や睡眠への関与が報告されている[19] [20]。
機能
視床下部は体温調節、摂食行動、睡眠・覚醒、ストレス応答、生殖行動など非常に多岐にわたる行動を調節している。こうした調節は単独で機能しているわけではなく、相互に関係する複数の行動を、バランスを取って促進・抑制することで全体的なモードを規定している。例えば、ストレス応答の際は生存確率を高めるために代謝レベルを高めるが、その際には体温や血圧を上昇させ、睡眠や生殖行動を抑制するような統合的な調節が行われている。以下に代表的な機能について記す。
体温の調節
動物は外的環境に左右されず内的環境を維持できるが、鳥類や哺乳類では体温調節もそれに含まれる。外気温が変化しても体内温度を一定に保つことは行動上の制限を大きく広げ、生存に有利に働くものと思われる。視床下部の視索前野には温度感受性の神経細胞が存在して体温調節の中枢を構成しており、視床下部背内側核もその調節に関与していることが知られている[21]。体温は概日リズムや性周期、摂食行動などによっても変動する。
関連する情報は、体温調節の神経回路のページを参照。
体液恒常性の調節
体液恒常性を維持するうえで、抗利尿ホルモンであるバソプレシンは腎臓における水の再吸収の程度を決定し、血液の浸透圧を制御する重要な因子である。視床下部にはバソプレシンを産生する神経細胞が存在し、その軸索は下垂体後葉に投射している。下垂体後葉から血管内に分泌されたバソプレシンは腎集合管にはたらきかけ、水チャネルであるアクアポリンの細胞膜への局在をもたらすことで腎臓での水の再吸収量を増やし[22]、利尿を妨げる効果をもたらす。視床下部の一部には血液脳関門が無い部分があり、血液浸透圧をモニターする浸透圧受容器として機能している。また、体液恒常性を調節する脳弓下器官と視床下部の室傍核との間には神経連絡が存在する。
関連する情報は、脳弓下器官のページを参照。
摂食行動と代謝の調節
多くの動物にとって生存にかかわる最も大きな問題は飢えである。エネルギーを適切に管理するため、視床下部は摂食行動と代謝レベルを調節している。エネルギーに余裕があるときには糖質から脂肪への変換を行い、エネルギーが欠乏しているときには脂肪やタンパク質を分解するという一連の代謝システムは視床下部の自律神経と内分泌をコントロールする機能によって管理されている。この機能に関しては、弓状核が、腹内側核、外側野[23]、背内側核、室傍核などと協調してはたらいている[24]。
関連する情報は、摂食制御の神経回路のページを参照。
性周期・生殖行動の調節
ほ乳動物の生殖は視床下部、下垂体、そして性腺の各組織が相互にシグナル伝達を行うことで調節されている。例えば、ヒトの女性において、月経を含む性周期は下垂体前葉から放出される卵胞刺激ホルモン(Follicle stimulating hormone: FSH)と黄体形成ホルモン(Luteinizing hormone: LH)によって調節されているが、これらは視床下部から放出される性腺刺激ホルモン放出ホルモン(gonadotropin releasing hormone, GnRH)によっても制御されている[25]。また、生殖行動は腹内側核、背内側核や視索前野といった領域にも管理されている[26]。生殖行動はエネルギー代謝、胎児への血液供給を含めた循環器系、体温調節などのシステムと協調している。
関連する情報は、性行動の神経回路および養育行動の神経回路のページを参照。
ストレス応答の調節
動物が攻撃を受けた時には覚醒水準や代謝を高め、闘争や逃走にリソースを集中する必要が生じる。こうしたストレス応答に際しては心理的ストレスも身体的ストレスも共に視床下部室傍核に伝えられる。この室傍核から下垂体、そして副腎へと伝えられるシグナル伝達はストレス応答にとって非常に重要であり、この回路は視床下部-下垂体-副腎系 (Hypothalamic-pituitary-adrenal axis, HPA axis)と呼ばれている。視床下部の室傍核からストレスホルモンとも呼ばれる副腎皮質刺激ホルモン放出ホルモン(CRH)が放出され、それによって刺激された下垂体前葉から副腎皮質刺激ホルモン(ACTH)が産生・放出され、それによって刺激された副腎皮質は副腎皮質ホルモンとして知られる糖質コルチコイドの分泌を高める。このコルチゾールが循環器機能やエネルギー代謝を高め、ストレスに対して全身の防御反応を引き起こす[27]。ストレスは睡眠や性行動を抑制するはたらきをもつ。
関連する情報は、ストレスのページを参照。
睡眠・覚醒の調節
視床下部が睡眠・覚醒を司っていることは古くから知られており、嗜眠性脳炎の研究などから視床下部の前方部には睡眠中枢が、後方部には覚醒中枢が存在することが提起された。視床下部前方部に存在する腹外側視索前野(Ventrolateral preoptic nucleus: VLPO)におけるGABA作動性ニューロンが睡眠中枢として中心的な役割を果たしており、腹外側視索前野の神経細胞は睡眠時に活動を増加させることで睡眠の開始と維持を行っている[28]。一方、視床下部後方部に存在する結節乳頭体核(Tuberomammillary nucleus: TMN)はヒスタミン作動性ニューロンの起始核であり、覚醒中枢の一つと考えられている。ヒスタミン作動性ニューロンはここから脳内のほとんどの領域に軸索を投射しており、ヒスタミン作動性ニューロンの活動が高まると覚醒レベルが上昇する。腹外側視索前野と結節乳頭体核は互いに軸索を投射してその活動を抑制し合っており、結節乳頭体核から腹外側視索前野への抑制が優位になると覚醒が、腹外側視索前野から結節乳頭体核への抑制が優位になると睡眠が開始されることで迅速な睡眠・覚醒の相転移が行われている(フリップ・フロップ説)[29]。視床下部のオレキシンニューロンは、結節乳頭体核などの覚醒中枢に密に投射し、これを活性化させることで覚醒を維持するのに寄与していると考えられている。睡眠には視床下部以外にも脳幹のモノアミン作動性ニューロンなど関与する脳領域は多い。
関連する情報は、睡眠のページを参照のこと。
最近の知見について
このように視床下部は多くの生理的に重要な役割を複合的に果たしているが、その神経回路の機能に関してはいまだに不明な点が多い。形態学的に分類、記載されてきた神経核であるが、細胞に発現しているペプチドの染色結果などにより、同じ種類の神経細胞が複数の領域にまたがって存在していたり、一つの神経核の中でも多数の異なる種類の神経細胞が共存していたりすることが分かっている。そのため、行動を制御する機能単位としての神経回路を解析するためには電気刺激等の古典的な手法では限界があった。
近年、特異的な細胞の標識、活動記録、活動操作の3つの面で大きな進歩が見られる。視床下部の機能解析を困難としている一つの要因は入出力の複雑さである。逆行性感染するウイルスベクターは、従来困難であった特定の神経細胞に入力している神経細胞を遺伝学的に標識することを可能とした[30]。また、チャネルロドプシン[31]やハロロドプシンン[32]といった光活性化タンパク質を用いたオプトジェネティクスや、改変型GPCRを用いたケモジェネティクスは、自由行動下における特定神経の活動操作を可能とした[33][34]。こうした活動操作は多様な生理機能を調節する視床下部の機能解析に高い因果関係を持ち込むうえで極めて重要なツールとなっている。
さらに、脳深部までグリンレンズを挿入し、頭上に固定した超小型顕微鏡によって、自由行動下における単一細胞レベルの活動記録も視床下部で行うことも可能となっている。例えば、腹内側核のエストロゲン受容体発現細胞が、性行動によって同性あるいは異性の他個体との接触時の応答をどのように変化させるか単一細胞レベルで調べることもできる[35]。こうした技術面の進歩によって、視床下部の自由行動下における生理機能が解明されていくことが期待されている。
関連項目
参考文献
- ↑
Cowley, M.A., Smart, J.L., Rubinstein, M., Cerdán, M.G., Diano, S., Horvath, T.L., ..., & Low, M.J. (2001).
Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature, 411(6836), 480-4. [PubMed:11373681] [WorldCat] [DOI] - ↑
Nakazato, M., Murakami, N., Date, Y., Kojima, M., Matsuo, H., Kangawa, K., & Matsukura, S. (2001).
A role for ghrelin in the central regulation of feeding. Nature, 409(6817), 194-8. [PubMed:11196643] [WorldCat] [DOI] - ↑
Tasker, J.G., & Herman, J.P. (2011).
Mechanisms of rapid glucocorticoid feedback inhibition of the hypothalamic-pituitary-adrenal axis. Stress (Amsterdam, Netherlands), 14(4), 398-406. [PubMed:21663538] [PMC] [WorldCat] [DOI] - ↑
Welsh, D.K., Takahashi, J.S., & Kay, S.A. (2010).
Suprachiasmatic nucleus: cell autonomy and network properties. Annual review of physiology, 72, 551-77. [PubMed:20148688] [PMC] [WorldCat] [DOI] - ↑
Welsh, D.K., Logothetis, D.E., Meister, M., & Reppert, S.M. (1995).
Individual neurons dissociated from rat suprachiasmatic nucleus express independently phased circadian firing rhythms. Neuron, 14(4), 697-706. [PubMed:7718233] [WorldCat] [DOI] - ↑
Hattar, S., Liao, H.W., Takao, M., Berson, D.M., & Yau, K.W. (2002).
Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity. Science (New York, N.Y.), 295(5557), 1065-70. [PubMed:11834834] [PMC] [WorldCat] [DOI] - ↑
Morin, L.P., & Allen, C.N. (2006).
The circadian visual system, 2005. Brain research reviews, 51(1), 1-60. [PubMed:16337005] [WorldCat] [DOI] - ↑
Jones, B.E. (2003).
Arousal systems. Frontiers in bioscience : a journal and virtual library, 8, s438-51. [PubMed:12700104] [WorldCat] [DOI] - ↑
Chou, T.C., Scammell, T.E., Gooley, J.J., Gaus, S.E., Saper, C.B., & Lu, J. (2003).
Critical role of dorsomedial hypothalamic nucleus in a wide range of behavioral circadian rhythms. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(33), 10691-702. [PubMed:14627654] [PMC] [WorldCat] - ↑
Sakurai, T., Nagata, R., Yamanaka, A., Kawamura, H., Tsujino, N., Muraki, Y., ..., & Yanagisawa, M. (2005).
Input of orexin/hypocretin neurons revealed by a genetically encoded tracer in mice. Neuron, 46(2), 297-308. [PubMed:15848807] [WorldCat] [DOI] - ↑
Bellinger, L.L., & Bernardis, L.L. (2002).
The dorsomedial hypothalamic nucleus and its role in ingestive behavior and body weight regulation: lessons learned from lesioning studies. Physiology & behavior, 76(3), 431-42. [PubMed:12117580] [WorldCat] [DOI] - ↑
Dimicco, J.A., & Zaretsky, D.V. (2007).
The dorsomedial hypothalamus: a new player in thermoregulation. American journal of physiology. Regulatory, integrative and comparative physiology, 292(1), R47-63. [PubMed:16959861] [WorldCat] [DOI] - ↑
Gold, R.M. (1973).
Hypothalamic obesity: the myth of the ventromedial nucleus. Science (New York, N.Y.), 182(4111), 488-90. [PubMed:4795550] [WorldCat] [DOI] - ↑
King, B.M. (2006).
The rise, fall, and resurrection of the ventromedial hypothalamus in the regulation of feeding behavior and body weight. Physiology & behavior, 87(2), 221-44. [PubMed:16412483] [WorldCat] [DOI] - ↑
Lin, D., Boyle, M.P., Dollar, P., Lee, H., Lein, E.S., Perona, P., & Anderson, D.J. (2011).
Functional identification of an aggression locus in the mouse hypothalamus. Nature, 470(7333), 221-6. [PubMed:21307935] [PMC] [WorldCat] [DOI] - ↑
Inutsuka, A., & Yamanaka, A. (2013).
The physiological role of orexin/hypocretin neurons in the regulation of sleep/wakefulness and neuroendocrine functions. Frontiers in endocrinology, 4, 18. [PubMed:23508038] [PMC] [WorldCat] [DOI] - ↑
Sakurai, T. (2014).
The role of orexin in motivated behaviours. Nature reviews. Neuroscience, 15(11), 719-31. [PubMed:25301357] [WorldCat] [DOI] - ↑
Inutsuka, A., & Yamanaka, A. (2013).
The physiological role of orexin/hypocretin neurons in the regulation of sleep/wakefulness and neuroendocrine functions. Frontiers in endocrinology, 4, 18. [PubMed:23508038] [PMC] [WorldCat] [DOI] - ↑
Jego, S., Glasgow, S.D., Herrera, C.G., Ekstrand, M., Reed, S.J., Boyce, R., ..., & Adamantidis, A.R. (2013).
Optogenetic identification of a rapid eye movement sleep modulatory circuit in the hypothalamus. Nature neuroscience, 16(11), 1637-43. [PubMed:24056699] [PMC] [WorldCat] [DOI] - ↑
Tsunematsu, T., Ueno, T., Tabuchi, S., Inutsuka, A., Tanaka, K.F., Hasuwa, H., ..., & Yamanaka, A. (2014).
Optogenetic manipulation of activity and temporally controlled cell-specific ablation reveal a role for MCH neurons in sleep/wake regulation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(20), 6896-909. [PubMed:24828644] [PMC] [WorldCat] [DOI] - ↑
Nakamura, K. (2011).
Central circuitries for body temperature regulation and fever. American journal of physiology. Regulatory, integrative and comparative physiology, 301(5), R1207-28. [PubMed:21900642] [WorldCat] [DOI] - ↑
Nielsen, S., Chou, C.L., Marples, D., Christensen, E.I., Kishore, B.K., & Knepper, M.A. (1995).
Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channels to plasma membrane. Proceedings of the National Academy of Sciences of the United States of America, 92(4), 1013-7. [PubMed:7532304] [PMC] [WorldCat] [DOI] - ↑
Yamanaka, A., Beuckmann, C.T., Willie, J.T., Hara, J., Tsujino, N., Mieda, M., ..., & Sakurai, T. (2003).
Hypothalamic orexin neurons regulate arousal according to energy balance in mice. Neuron, 38(5), 701-13. [PubMed:12797956] [WorldCat] [DOI] - ↑
Morton, G.J., Cummings, D.E., Baskin, D.G., Barsh, G.S., & Schwartz, M.W. (2006).
Central nervous system control of food intake and body weight. Nature, 443(7109), 289-95. [PubMed:16988703] [WorldCat] [DOI] - ↑
Krsmanovic, L.Z., Hu, L., Leung, P.K., Feng, H., & Catt, K.J. (2009).
The hypothalamic GnRH pulse generator: multiple regulatory mechanisms. Trends in endocrinology and metabolism: TEM, 20(8), 402-8. [PubMed:19740674] [PMC] [WorldCat] [DOI] - ↑
Simerly, R.B. (2002).
Wired for reproduction: organization and development of sexually dimorphic circuits in the mammalian forebrain. Annual review of neuroscience, 25, 507-36. [PubMed:12052919] [WorldCat] [DOI] - ↑
Tasker, J.G., & Herman, J.P. (2011).
Mechanisms of rapid glucocorticoid feedback inhibition of the hypothalamic-pituitary-adrenal axis. Stress (Amsterdam, Netherlands), 14(4), 398-406. [PubMed:21663538] [PMC] [WorldCat] [DOI] - ↑
Gaus, S.E., Strecker, R.E., Tate, B.A., Parker, R.A., & Saper, C.B. (2002).
Ventrolateral preoptic nucleus contains sleep-active, galaninergic neurons in multiple mammalian species. Neuroscience, 115(1), 285-94. [PubMed:12401341] [WorldCat] [DOI] - ↑
Saper, C.B., Scammell, T.E., & Lu, J. (2005).
Hypothalamic regulation of sleep and circadian rhythms. Nature, 437(7063), 1257-63. [PubMed:16251950] [WorldCat] [DOI] - ↑
Jennings, J.H., Rizzi, G., Stamatakis, A.M., Ung, R.L., & Stuber, G.D. (2013).
The inhibitory circuit architecture of the lateral hypothalamus orchestrates feeding. Science (New York, N.Y.), 341(6153), 1517-21. [PubMed:24072922] [PMC] [WorldCat] [DOI] - ↑
Adamantidis, A.R., Zhang, F., Aravanis, A.M., Deisseroth, K., & de Lecea, L. (2007).
Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature, 450(7168), 420-4. [PubMed:17943086] [PMC] [WorldCat] [DOI] - ↑
Tsunematsu, T., Kilduff, T.S., Boyden, E.S., Takahashi, S., Tominaga, M., & Yamanaka, A. (2011).
Acute optogenetic silencing of orexin/hypocretin neurons induces slow-wave sleep in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(29), 10529-39. [PubMed:21775598] [PMC] [WorldCat] [DOI] - ↑
Adamantidis, A.R., Zhang, F., Aravanis, A.M., Deisseroth, K., & de Lecea, L. (2007).
Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature, 450(7168), 420-4. [PubMed:17943086] [PMC] [WorldCat] [DOI] - ↑
Krashes, M.J., Koda, S., Ye, C., Rogan, S.C., Adams, A.C., Cusher, D.S., ..., & Lowell, B.B. (2011).
Rapid, reversible activation of AgRP neurons drives feeding behavior in mice. The Journal of clinical investigation, 121(4), 1424-8. [PubMed:21364278] [PMC] [WorldCat] [DOI] - ↑
Remedios, R., Kennedy, A., Zelikowsky, M., Grewe, B.F., Schnitzer, M.J., & Anderson, D.J. (2017).
Social behaviour shapes hypothalamic neural ensemble representations of conspecific sex. Nature, 550(7676), 388-392. [PubMed:29052632] [PMC] [WorldCat] [DOI]