「核内受容体」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
{{Pfam_box | {{Pfam_box | ||
| Symbol = zf-C4 | | Symbol = zf-C4 | ||
| 29行目: | 16行目: | ||
}} | }} | ||
英語名:nuclear receptor 英略語:NR 独:Kernrezeptoren 仏:récepteur nucléaire | |||
[[ | 核内受容体は、[[ステロイド]]や[[甲状腺ホルモン]]、[[レチノイド]]、[[ビタミンD]]などの受容体であり、主に、リガンドが結合すると[[細胞質]]から[[核]]内へ移行して[[転写調節因子]]としてはたらく<ref name="ref1">'''Alberts B, Johnson A, Lewis J, Raff M.'''<br>Molecular Biology of the Cell, 5th Edition, <br>pp889-891, ''Garland Science'', New York, 2008.</ref>。リガンドの不明な核内受容体、リガンド結合とは別のしくみで活性が調節される核内受容体もある<ref name="ref2"><pubmed>16892386</pubmed></ref>。ヒトで48の遺伝子にコードされており、[[wikipedia:ja:代謝|代謝]]、[[wikipedia:ja:恒常性|恒常性]]、[[wikipedia:ja:分化|分化]]、[[wikipedia:ja:成長|成長]]、[[wikipedia:ja:発生|発生]]、[[wikipedia:ja:老化|老化]]、[[wikipedia:ja:生殖|生殖]]などの機能を担う。 | ||
== 研究の歴史、背景== | == 研究の歴史、背景== | ||
*1985年 [[ヒト]] | *1985年 [[ヒト]][[GR]]のクローニング<ref name="ref2" /> | ||
*1986年 ヒト[[ | *1986年 ヒト[[ERα]]のクローニング | ||
*[[wikipedia:ja:ウイルス|ウイルス]][[wikipedia:ja:ガン遺伝子|ガン遺伝子]]の[[v-erbA]]と[[wikipedia:ja:ホルモン|ホルモン]][[受容体]]とに、相同性のあることがわかった。 | *[[wikipedia:ja:ウイルス|ウイルス]][[wikipedia:ja:ガン遺伝子|ガン遺伝子]]の[[v-erbA]]と[[wikipedia:ja:ホルモン|ホルモン]][[受容体]]とに、相同性のあることがわかった。 | ||
*1986年 [[TR]] | *1986年 [[TR]]がv-erbAであることが明らかにされた。 | ||
*その後、 | *その後、[[MR]], [[PR]], [[AR]], 脂溶性[[wikipedia:ja:ビタミンA|ビタミンA]], Dの受容体のクローニングが相次いだ。配列相同性からオーファン核内受容体が多くクローニングされた。 | ||
*PXR(1998年)やPNR (1999年) | *PXR(1998年)やPNR (1999年)が、遺伝子情報(ESTデータベース)をもとに発見された最後のNRメンバーとなった。 | ||
*2001年 [[wikipedia:ja:ヒトゲノム|ヒトゲノム]] | *2001年 [[wikipedia:ja:ヒトゲノム|ヒトゲノム]]が明らかにされ、核内受容体はヒトでは48遺伝子、[[マウス]]では49遺伝子にコードされることがわかった。 | ||
== 構造 == | == 構造 == | ||
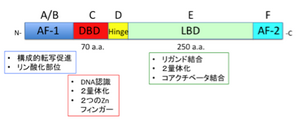
[[Image:核内受容体1.png|thumb|300px|<b>図1. 核内受容体の基本構造</b><ref name="ref2" /><ref name="ref3"><pubmed>18023286</pubmed></ref>]] | |||
== | [[Image:核内受容体2.png|thumb|300px|<b>図2. 核内受容体の2量体化とDNA結合配列の3つのパターン</b><ref name="ref3" /><br>ホモダイマー化したGRなどホルモン受容体は、[[wikipedia:ja:パリンドローム|パリンドローム]](回文配列)状に並んだ2つのホルモン応答エレメント(HRE)に結合する。ヘテロダイマー化したRXRと他の核内受容体(XR)は、同方向に並んだ(ダイレクトリピート)2つのHREに結合する。ERRなどオーファン受容体は、モノマーのまま1つのHRE(ハーフサイト)に結合する。]] | ||
N末端にAF-1領域 (かつてA/Bドメインと呼ばれた)があり、リガンド非依存的に転写活性化作用をもつ。AF-1は、核内受容体間で多様性に富む領域である。中央部にDNA結合領域 (DBD) (C) があり、2つのジンクフィンガーモチーフ(70アミノ酸)から成る。DBDは、受容体間のホモロジーが高い。C末端側にリガンド結合領域 (LBD) (E)(250アミノ酸)をもつ。LBDのC末端 (F領域) にあるαヘリックスをAF-2ヘリックスといい、受容体の活性調節に関係がある。構造の特殊なNRとして、A/B領域を欠くもの(HNF4g)、A/B, C領域を欠くもの(SHP)がある。D領域はヒンジ領域で、DBDとLBDの連結部位である。 | |||
核内受容体は通常2量体、ホモダイマー(ステロイド受容体)あるいはヘテロダイマー(RXRとPPARs, LXR, FXRなど)を形成して転写調節を行う(図2)。単量体でDNAに結合するもの(ERR, LRH1, SF1, NGFIB)もある。HNF4sやNGFIBは、リガンド結合とは無関係に活性化されており、これらはオーファン核内受容体と呼ばれる。 | |||
== 核内受容体スーパーファミリー == | |||
===分子系統樹に基づく分類=== | ===分子系統樹に基づく分類=== | ||
分子系統樹から7つのサブファミリー(NR0〜6)に分類され、個々の慣用名に対応する正式名がある<ref name="ref4"><pubmed>10219237</pubmed></ref>(表1)。サブファミリー0 (NR0)は、DNA結合領域(DBD, C領域)またはリガンド結合領域(LBD, E領域) | 分子系統樹から7つのサブファミリー(NR0〜6)に分類され、個々の慣用名に対応する正式名がある<ref name="ref4"><pubmed>10219237</pubmed></ref>(表1)。サブファミリー0 (NR0)は、DNA結合領域(DBD, C領域)またはリガンド結合領域(LBD, E領域)の一方しか持たないもので、例えばSHPはLBDしか持たずNR0B2と呼ばれる。各サブファミリーはさらにA, B,,,のグループに分けられ、1つのグループはパラログによって構成される。例えば、甲状腺ホルモン受容体 (TR) はサブファミリー1グループA (NR1A)で、TRαはNR1A1, TRβはNR1A2となる。また、例えばNR5A1a (=SF1)とNR5A1b(ELP)とは、同じ遺伝子から[[wikipedia:ja:スプライシング|スプライシング]]の違いによってできた異なったアイソフォームである。 | ||
{|cellspacing="1" cellpadding="1" border="1" | {|cellspacing="1" cellpadding="1" border="1" | ||
| 67行目: | 58行目: | ||
| rowspan="2" | A | | rowspan="2" | A | ||
| rowspan="2" | 甲状腺ホルモン受容体 | | rowspan="2" | 甲状腺ホルモン受容体 | ||
| | | NR1A1 | ||
| | | TRa | ||
| | | 甲状腺ホルモン受容体α | ||
| | | THRA | ||
| rowspan="2" | 甲状腺ホルモン | | rowspan="2" | 甲状腺ホルモン | ||
|- | |- | ||
| | | NR1A2 | ||
| | | TRb | ||
| | | 甲状腺ホルモン受容体β | ||
| | | THRB | ||
|- | |- | ||
| rowspan="3" | B | | rowspan="3" | B | ||
| rowspan="3" | | | rowspan="3" | レチノイン酸受容体 | ||
| | | NR1B1 | ||
| | | RARa | ||
| | | レチノイン酸受容体α | ||
| | | RARA | ||
| rowspan="3" | ビタミンA関連化合物 | | rowspan="3" | ビタミンA関連化合物 | ||
|- | |- | ||
| | | NR1B2 | ||
| | | RARb | ||
| | | レチノイン酸受容体β | ||
| | | RARB | ||
|- | |- | ||
| | | NR1B3 | ||
| | | RARg | ||
| | | レチノイン酸受容体γ | ||
| | | RARG | ||
|- | |- | ||
| rowspan="3" | C | | rowspan="3" | C | ||
| rowspan="3" | [[ペルオキシソーム増殖因子活性化受容体]] | | rowspan="3" | [[ペルオキシソーム増殖因子活性化受容体]] | ||
| | | NR1C1 | ||
| | | PPARa | ||
| | | ペルオキシソーム増殖因子活性化受容体α | ||
| | | PPARA | ||
| rowspan="3" | 脂肪酸、[[プロスタグランジン]] | | rowspan="3" | 脂肪酸、[[プロスタグランジン]] | ||
|- | |- | ||
| | | NR1C2 | ||
| | | PPARb/d | ||
| | | ペルオキシソーム増殖因子活性化受容体βδ | ||
| | | PPARD | ||
|- | |- | ||
| | | NR1C3 | ||
| | | PPARg | ||
| | | ペルオキシソーム増殖因子活性化受容体γ | ||
| | | PPARG | ||
|- | |- | ||
| rowspan="2" | D | | rowspan="2" | D | ||
| rowspan="2" | [[Rev-ErbA]] | | rowspan="2" | [[Rev-ErbA]] | ||
| | | NR1D1 | ||
| | | Rev-ErbAa | ||
| | | Rev-ErbA-alpha | ||
| NR1D1 | | NR1D1 | ||
| rowspan="2" | [[ヘム]] | | rowspan="2" | [[ヘム]] | ||
|- | |- | ||
| | | NR1D2 | ||
| | | Rev-ErbAb | ||
| | | Rev-ErbA-beta | ||
| NR1D2 | | NR1D2 | ||
|- | |- | ||
| rowspan="3" | F | | rowspan="3" | F | ||
| rowspan="3" | [[RAR関連オーファン受容体]] | | rowspan="3" | [[RAR関連オーファン受容体]] | ||
| | | NR1F1 | ||
| | | RORa | ||
| | | RAR関連オーファン受容体α | ||
| | | RORA | ||
| rowspan="3" | [[コレステロール]] | | rowspan="3" | [[コレステロール]]、ATRA | ||
|- | |- | ||
| | | NR1F2 | ||
| | | RORb | ||
| | | RAR関連オーファン受容体β | ||
| | | RORB | ||
|- | |- | ||
| | | NR1F3 | ||
| | | RORg, RORC | ||
| | | RAR関連オーファン受容体γ | ||
| | | RORC | ||
|- | |- | ||
| rowspan="3" | H | | rowspan="3" | H | ||
| rowspan="3" | [[肝X受容体型]] | | rowspan="3" | [[肝X受容体型]] | ||
| | | NR1H3 | ||
| | | LXRa | ||
| | | 肝X受容体α | ||
| NR1H3 | | NR1H3 | ||
| rowspan="3" | oxysteroids | | rowspan="3" | oxysteroids | ||
|- | |- | ||
| | | NR1H2 | ||
| | | LXRb | ||
| | | 肝X受容体β | ||
| NR1H2 | | NR1H2 | ||
|- | |- | ||
| | | NR1H4 | ||
| | | FXR | ||
| [[ファルネソイドX受容体]] | | [[ファルネソイドX受容体]] | ||
| NR1H4 | | NR1H4 | ||
|- | |- | ||
| rowspan="3" | I | | rowspan="3" | I | ||
| rowspan="3" |[[ | | rowspan="3" |[[ビタミンD受容体型]] | ||
| | | NR1I1 | ||
| | | VDR | ||
| ビタミンD受容体 | | ビタミンD受容体 | ||
| VDR | | VDR | ||
| ビタミンD | | ビタミンD | ||
|- | |- | ||
| | | NR1I2 | ||
| | | PXR | ||
| [[プレグナンX受容体]] | | [[プレグナンX受容体]] | ||
| NR1I2 | | NR1I2 | ||
| 生体異物 | | 生体異物 | ||
|- | |- | ||
| | | NR1I3 | ||
| | | CAR | ||
| [[構成的アンドロスタン受容体]] | | [[構成的アンドロスタン受容体]] | ||
| NR1I3 | | NR1I3 | ||
| 187行目: | 178行目: | ||
| style="background-color:#d3d3d3" rowspan="2" | A | | style="background-color:#d3d3d3" rowspan="2" | A | ||
| style="background-color:#d3d3d3" rowspan="2" | [[肝細胞核因子4]] | | style="background-color:#d3d3d3" rowspan="2" | [[肝細胞核因子4]] | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2A1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | HNF4a | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | 肝細胞核因子4α | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | HNF4A | ||
| style="background-color:#d3d3d3" rowspan="2" | [[脂肪酸]] | | style="background-color:#d3d3d3" rowspan="2" | [[脂肪酸]] | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2A2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | HNF4g | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | 肝細胞核因子4γ | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | HNF4G | ||
|- | |- | ||
| style="background-color:#d3d3d3" rowspan="3" | B | | style="background-color:#d3d3d3" rowspan="3" | B | ||
| style="background-color:#d3d3d3" rowspan="3" | [[レチノイドX受容体]] | | style="background-color:#d3d3d3" rowspan="3" | [[レチノイドX受容体]] | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2B1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | RXRa | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | レチノイドX受容体α | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | RXRA | ||
| style="background-color:#d3d3d3" rowspan="3" | [[レチノイド]] | | style="background-color:#d3d3d3" rowspan="3" | [[レチノイド]] | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2B2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | RXRb | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | レチノイドX受容体β | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | RXRB | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2B3 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | RXRg | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | レチノイドX受容体γ | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | RXRG | ||
|- | |- | ||
| style="background-color:#d3d3d3" rowspan="2" | C | | style="background-color:#d3d3d3" rowspan="2" | C | ||
| style="background-color:#d3d3d3" rowspan="2" | [[Testicular receptor]] | | style="background-color:#d3d3d3" rowspan="2" | [[Testicular receptor]] | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2C1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | TR2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | Testicular receptor 2 | ||
| style="background-color:#d3d3d3" | NR2C1 | | style="background-color:#d3d3d3" | NR2C1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2C2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | TR4 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | Testicular receptor 4 | ||
| style="background-color:#d3d3d3" | NR2C2 | | style="background-color:#d3d3d3" | NR2C2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
| 232行目: | 223行目: | ||
| style="background-color:#d3d3d3" rowspan="2" | E | | style="background-color:#d3d3d3" rowspan="2" | E | ||
| style="background-color:#d3d3d3" rowspan="2" | [[TLX]]/[[PNR]] | | style="background-color:#d3d3d3" rowspan="2" | [[TLX]]/[[PNR]] | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2E1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | TLX | ||
| style="background-color:#d3d3d3" | [[Drosophila tailless遺伝子ホモログ]] | | style="background-color:#d3d3d3" | [[Drosophila tailless遺伝子ホモログ]] | ||
| style="background-color:#d3d3d3" | NR2E1 | | style="background-color:#d3d3d3" | NR2E1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2E3 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | PNR | ||
| style="background-color:#d3d3d3" | [[光受容細胞特異的核内受容体]] | | style="background-color:#d3d3d3" | [[光受容細胞特異的核内受容体]] | ||
| style="background-color:#d3d3d3" | NR2E3 | | style="background-color:#d3d3d3" | NR2E3 | ||
| 246行目: | 237行目: | ||
| style="background-color:#d3d3d3" rowspan="3" | F | | style="background-color:#d3d3d3" rowspan="3" | F | ||
| style="background-color:#d3d3d3" rowspan="3" | [[COUP]]/[[EAR]] | | style="background-color:#d3d3d3" rowspan="3" | [[COUP]]/[[EAR]] | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2F1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | COUP-TFI | ||
| style="background-color:#d3d3d3" | [[ | | style="background-color:#d3d3d3" | [[トリ卵白アルブミン上流プロモータ転写因子]]I | ||
| style="background-color:#d3d3d3" | NR2F1 | | style="background-color:#d3d3d3" | NR2F1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2F2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | COUP-TFII | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | トリ卵白アルブミン上流プロモータ転写因子II | ||
| style="background-color:#d3d3d3" | NR2F2 | | style="background-color:#d3d3d3" | NR2F2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR2F6 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | EAR-2, COUP-TFIII | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | V-erbA-related | ||
| style="background-color:#d3d3d3" | NR2F6 | | style="background-color:#d3d3d3" | NR2F6 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| rowspan="9" | 3 | | rowspan="9" | 3 | ||
| rowspan="9" | | | rowspan="9" | エストロゲン受容体型 | ||
| rowspan="2" | A | | rowspan="2" | A | ||
| rowspan="2" | エストロゲン受容体 | | rowspan="2" | [[エストロゲン受容体]] | ||
| | | NR3A1 | ||
| | | ERa | ||
| | | エストロゲン受容体α | ||
| | | ESR1 | ||
| rowspan="2" | [[エストロゲン]] | | rowspan="2" | [[エストロゲン]] | ||
|- | |- | ||
| | | NR3A2 | ||
| | | ERb | ||
| | | エストロゲン受容体β | ||
| | | ESR2 | ||
|- | |- | ||
| rowspan="3" | B | | rowspan="3" | B | ||
| rowspan="3" | [[エストロゲン関連受容体]] | | rowspan="3" | [[エストロゲン関連受容体]] | ||
| | | NR3B1 | ||
| | | ERRa | ||
| | | エストロゲン関連受容体α | ||
| | | ESRRA | ||
| | | | ||
|- | |- | ||
| | | NR3B2 | ||
| | | ERRb | ||
| | | エストロゲン関連受容体β | ||
| | | ESRRB | ||
| | | | ||
|- | |- | ||
| | | NR3B3 | ||
| | | ERRg | ||
| | | エストロゲン関連受容体γ | ||
| | | ESRRG | ||
| | | | ||
|- | |- | ||
| rowspan="4" | C | | rowspan="4" | C | ||
| rowspan="4" | [[3-ケトステロイド受容体]] | | rowspan="4" | [[3-ケトステロイド受容体]] | ||
| | | NR3C1 | ||
| GR | | GR | ||
| グルココルチコイド受容体 | | グルココルチコイド受容体 | ||
| 307行目: | 298行目: | ||
| [[コルチゾール]] | | [[コルチゾール]] | ||
|- | |- | ||
| | | NR3C2 | ||
| MR | | MR | ||
| [[ | | [[鉱質コルチコイド受容体]] | ||
| NR3C2 | | NR3C2 | ||
| [[アルドステロン]] | | [[アルドステロン]] | ||
|- | |- | ||
| | | NR3C3 | ||
| PR | | PR | ||
| [[プロゲステロン受容体]] | | [[プロゲステロン受容体]] | ||
| 319行目: | 310行目: | ||
| [[プロゲステロン]] | | [[プロゲステロン]] | ||
|- | |- | ||
| | | NR3C4 | ||
| AR | | AR | ||
| [[アンドロゲン受容体]] | | [[アンドロゲン受容体]] | ||
| 326行目: | 317行目: | ||
|- | |- | ||
| style="background-color:#d3d3d3" rowspan="3" | 4 | | style="background-color:#d3d3d3" rowspan="3" | 4 | ||
| style="background-color:#d3d3d3" rowspan="3" | | | style="background-color:#d3d3d3" rowspan="3" | 神経成長因子IB 型 | ||
| style="background-color:#d3d3d3" rowspan="3" | A | | style="background-color:#d3d3d3" rowspan="3" | A | ||
| style="background-color:#d3d3d3" rowspan="3" | | | style="background-color:#d3d3d3" rowspan="3" | NGFIB/NURR1/NOR1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR4A1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NGFIB | ||
| style="background-color:#d3d3d3" | [[ | | style="background-color:#d3d3d3" | [[神経成長因子]]IB | ||
| style="background-color:#d3d3d3" | NR4A1 | | style="background-color:#d3d3d3" | NR4A1 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR4A2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NURR1 | ||
| style="background-color:#d3d3d3" | [[Nuclear receptor related 1]] | | style="background-color:#d3d3d3" | [[Nuclear receptor related 1]] | ||
| style="background-color:#d3d3d3" | NR4A2 | | style="background-color:#d3d3d3" | NR4A2 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | | ||
|- | |- | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR4A3 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NOR1 | ||
| style="background-color:#d3d3d3" | [[Neuron-derived orphan receptor 1]] | | style="background-color:#d3d3d3" | [[Neuron-derived orphan receptor 1]] | ||
| style="background-color:#d3d3d3" | NR4A3 | | style="background-color:#d3d3d3" | NR4A3 | ||
| 351行目: | 342行目: | ||
| rowspan="2" | A | | rowspan="2" | A | ||
| rowspan="2" | SF1/LRH1 | | rowspan="2" | SF1/LRH1 | ||
| | | NR5A1 | ||
| SF1 | | SF1 | ||
| [[ステロイド産生因子1]] | | [[ステロイド産生因子1]] | ||
| | | NR5A1 | ||
| rowspan="2" | [[ホスファチジルイノシトール]] | | rowspan="2" | [[ホスファチジルイノシトール]] | ||
|- | |- | ||
| | | NR5A2 | ||
| | | LRH1 | ||
| [[Liver receptor homolog-1]] | | [[Liver receptor homolog-1]] | ||
| NR5A2 | | NR5A2 | ||
|- | |- | ||
| style="background-color:#d3d3d3" | 6 | | style="background-color:#d3d3d3" | 6 | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | 胚細胞核因子型 | ||
| style="background-color:#d3d3d3" | A | | style="background-color:#d3d3d3" | A | ||
| style="background-color:#d3d3d3" | [[GCNF]] | | style="background-color:#d3d3d3" | [[GCNF]] | ||
| style="background-color:#d3d3d3" | | | style="background-color:#d3d3d3" | NR6A1 | ||
| style="background-color:#d3d3d3" | GCNF | | style="background-color:#d3d3d3" | GCNF | ||
| style="background-color:#d3d3d3" | [[胚細胞核因子]] | | style="background-color:#d3d3d3" | [[胚細胞核因子]] | ||
| 376行目: | 367行目: | ||
| rowspan="2" | A | | rowspan="2" | A | ||
| rowspan="2" | [[DAX]]/[[SHP]] | | rowspan="2" | [[DAX]]/[[SHP]] | ||
| | | NR0B1 | ||
| | | DAX1 | ||
| [[X染色体上遺伝子量感受性性転換副腎低形成先天的必須領域遺伝子1]] | | [[X染色体上遺伝子量感受性性転換副腎低形成先天的必須領域遺伝子1]] | ||
| NR0B1 | | NR0B1 | ||
| | | | ||
|- | |- | ||
| | | NR0B2 | ||
| | | SHP | ||
| [[小型ヘテロ二量体パートナー]] | | [[小型ヘテロ二量体パートナー]] | ||
| NR0B2 | | NR0B2 | ||
| 395行目: | 386行目: | ||
組織特異的発現パターンや生理的機能から6群(クラスター)に分けられる(表2)<ref name="ref5"><pubmed>16923397</pubmed></ref> <ref name="ref6"><pubmed>22411605</pubmed></ref>。 | 組織特異的発現パターンや生理的機能から6群(クラスター)に分けられる(表2)<ref name="ref5"><pubmed>16923397</pubmed></ref> <ref name="ref6"><pubmed>22411605</pubmed></ref>。 | ||
{|cellspacing="1" cellpadding="1" | {| width="1008" cellspacing="1" cellpadding="1" class="wikitable" | ||
|- | |- | ||
| style="background-color:#a9a9a9; text-align:center" | クラスター | | style="background-color:#a9a9a9; text-align:center" | クラスター | ||
| style="background-color:#a9a9a9; text-align:center" | 機能 | | style="background-color:#a9a9a9; text-align:center" | 機能 | ||
| style="background-color:#a9a9a9; text-align:center" | 核内受容体 | | style="background-color:#a9a9a9; text-align:center" | 核内受容体 | ||
| style="background-color:#a9a9a9; text-align:center" | 機能 | | style="background-color:#a9a9a9; text-align:center" | 機能 | ||
| style="background-color:#a9a9a9; text-align:center" | 発現部位 | | style="background-color:#a9a9a9; text-align:center" | 発現部位 | ||
|- | |- | ||
| style="text-align:center" rowspan="3" | I | | style="text-align:center" rowspan="3" | I | ||
| rowspan="3" | ステロイド合成 | | rowspan="3" | ステロイド合成 | ||
| | | FXRb | ||
| ヒトになし、マウスで機能不明 | | ヒトになし、マウスで機能不明 | ||
| rowspan="3" | 中枢神経系、生殖器、副腎 | | rowspan="3" | 中枢神経系、生殖器、副腎 | ||
|- | |- | ||
| SF1 | | SF1 | ||
| rowspan="2" | [[wikipedia:ja:性分化|性分化]]とステロイド合成 | | rowspan="2" | [[wikipedia:ja:性分化|性分化]]とステロイド合成 | ||
|- | |- | ||
| DAX1 | | DAX1 | ||
|- | |- | ||
| style="text-align:center" rowspan="5" | II | | style="text-align:center" rowspan="5" | II | ||
| rowspan="5" | 生殖と発生 | | rowspan="5" | 生殖と発生 | ||
| AR | | AR | ||
| rowspan="3" | | | rowspan="3" | 内分泌ステロイドホルモン受容体(性決定、性生殖) | ||
|- | |- | ||
| | | ERa, ERb | ||
|- | |- | ||
| PR | | PR | ||
|- | |- | ||
| COUP-TFII | | COUP-TFII | ||
| RARシグナルの調節 | | RARシグナルの調節 | ||
|- | |- | ||
| | | RARa, RARg | ||
| 発生 | | 発生 | ||
|- | |- | ||
| style="text-align:center" rowspan="12" | III | | style="text-align:center" rowspan="12" | III | ||
| rowspan="12" | [[中枢神経系]]、[[概日リズム]]、基礎代謝機能 | | rowspan="12" | [[中枢神経系]]、[[概日リズム]]、基礎代謝機能 | ||
| TLX | | TLX | ||
| rowspan="4" | | | rowspan="4" | 神経細胞と末梢組織の分化 | ||
| rowspan="4" | 中枢神経系 | | rowspan="4" | 中枢神経系 | ||
|- | |- | ||
| 442行目: | 432行目: | ||
| NR4As (NGFIB, NOR1, NURR1) | | NR4As (NGFIB, NOR1, NURR1) | ||
|- | |- | ||
| Rev- | | Rev-ErbAa, Rev-ErbAb | ||
| rowspan="4" | 概日リズムと代謝の調節 | | rowspan="4" | 概日リズムと代謝の調節 | ||
|- | |- | ||
| | | RORa, RORb | ||
|- | |- | ||
| | | ERRb, ERRg | ||
|- | |- | ||
| NR4As | | NR4As | ||
|- | |- | ||
| | | TRa | ||
| rowspan="3" | [[wikipedia:ja:心臓|心臓]][[wikipedia:ja:血管|血管]]機能の調節 | | rowspan="3" | [[wikipedia:ja:心臓|心臓]][[wikipedia:ja:血管|血管]]機能の調節 | ||
|- | |- | ||
| MR | | MR | ||
|- | |- | ||
| | | LXRb | ||
|- | |- | ||
| | | RXRb, RXRg | ||
| | | 内分泌NRや脂質NRとヘテロダイマーを形成 | ||
|- | |- | ||
| style="text-align:center" rowspan="9" | IV | | style="text-align:center" rowspan="9" | IV | ||
| rowspan="9" | [[wikipedia:ja:胆汁酸|胆汁酸]]と生体異物の代謝 | | rowspan="9" | [[wikipedia:ja:胆汁酸|胆汁酸]]と生体異物の代謝 | ||
| | | HNF4a | ||
| [[wikipedia:ja:胃|胃]]・[[wikipedia:ja:腸|腸]]・[[wikipedia:ja:肝|肝]]の発生 | | [[wikipedia:ja:胃|胃]]・[[wikipedia:ja:腸|腸]]・[[wikipedia:ja:肝|肝]]の発生 | ||
|- | |- | ||
| | | HNF4g | ||
| [[wikipedia:ja:糖代謝|糖代謝]]と[[wikipedia:ja:インスリン|インスリン]]作用 | | [[wikipedia:ja:糖代謝|糖代謝]]と[[wikipedia:ja:インスリン|インスリン]]作用 | ||
|- | |- | ||
| | | FXRa | ||
| rowspan="3" | | | rowspan="3" | 胆汁酸代謝 | ||
|- | |- | ||
| LRH-1 | | LRH-1 | ||
| 477行目: | 466行目: | ||
| SHP | | SHP | ||
|- | |- | ||
| PXR | | PXR | ||
| rowspan="2" | ステロイド・食餌中の生体異物性脂質・毒性生理活性脂質の除去 | | rowspan="2" | ステロイド・食餌中の生体異物性脂質・毒性生理活性脂質の除去 | ||
|- | |- | ||
| CAR | | CAR | ||
|- | |- | ||
| VDR | | VDR | ||
| | | Ca吸収・代謝、腸での胆汁酸除去 | ||
|- | |- | ||
| | | RORg | ||
| リンパ管の発生、[[wikipedia:ja:胸腺|胸腺]][[wikipedia:ja:リンパ球|リンパ球]]形成 | | リンパ管の発生、[[wikipedia:ja:胸腺|胸腺]][[wikipedia:ja:リンパ球|リンパ球]]形成 | ||
|- | |- | ||
| style="text-align:center" rowspan="7" | V | | style="text-align:center" rowspan="7" | V | ||
| rowspan="11" | 脂質代謝とエネルギーの恒常性 | | rowspan="11" | 脂質代謝とエネルギーの恒常性 <br> <br> | ||
| | | TRb | ||
| 熱発生、脂肪酸・[[wikipedia:ja:コレステロール|コレステロール]]代謝 | | 熱発生、脂肪酸・[[wikipedia:ja:コレステロール|コレステロール]]代謝 | ||
|- | |- | ||
| | | PPARa, PPARd | ||
| 脂肪酸の酸化 | | 脂肪酸の酸化 | ||
|- | |- | ||
| | | ERRa | ||
| 酸化的遺伝子発現、脂質代謝、ミトコンドリア生成 | | 酸化的遺伝子発現、脂質代謝、ミトコンドリア生成 | ||
|- | |- | ||
| COUP- | | COUP-TFg | ||
| rowspan="3" | 機能不明 | | rowspan="3" | 機能不明 | ||
|- | |- | ||
| 506行目: | 495行目: | ||
| GCNF | | GCNF | ||
|- | |- | ||
| | | RXRa | ||
| ヘテロダイマー形成 | | ヘテロダイマー形成 | ||
|- | |- | ||
| style="text-align:center" rowspan="4" | VI | | style="text-align:center" rowspan="4" | VI <br> <br> | ||
|- | |- | ||
| | | PPARg | ||
| rowspan="2" | | | rowspan="2" | 食餌中のコレステロール・脂肪を感知してインスリンシグナルを亢進させ、脂肪を蓄積 | ||
|- | |- | ||
| | | LXRa | ||
|- | |- | ||
| GR | | GR | ||
| 脂肪分解・糖新生促進 | | 脂肪分解・糖新生促進 | ||
|- | |- | ||
| style="text-align:center" | その他 | | style="text-align:center" | その他 | ||
| | | <br> | ||
| PNR | | PNR | ||
| [[視細胞]]の発生と機能 | | [[視細胞]]の発生と機能 | ||
| 眼 | | 眼 | ||
|} | |} | ||
| 535行目: | 524行目: | ||
=== リガンドに基づく分類=== | === リガンドに基づく分類=== | ||
リガンドからNRを分類すると、(1)ホルモンやビタミンをリガンドとする内分泌受容体、(2)配列相同性から発見され、後に生体内でのリガンドが同定されたもの、(3)リガンドの生体での機能が明らかでないもの、(4)リガンドの同定されていないものがある。 | |||
*カテゴリー(1):内分泌受容体 | *カテゴリー(1):内分泌受容体 | ||
**ステロイドホルモン [ER, GR, MR, PR, AR](略称は表1を参照) | **ステロイドホルモン [ER, GR, MR, PR, AR](略称は表1を参照) | ||
**ビタミンD(ステロイドから生成)[VDR] | **ビタミンD(ステロイドから生成)[VDR] | ||
**[[ | **[[昆虫]][[脱皮ホルモン]]([[wikipedia:ja:エクジソン|エクジソン]]ecdysone)(ステロイド骨格をもつ) | ||
**甲状腺ホルモン([[wikipedia:ja:チロシン|チロシン]] | **甲状腺ホルモン([[wikipedia:ja:チロシン|チロシン]]tyrosineから生成)[TR] | ||
**レチノイド(ビタミンA):レチノイン酸など [RAR] | **レチノイド(ビタミンA):レチノイン酸など [RAR] | ||
*カテゴリー(2):脂質センサー | *カテゴリー(2):脂質センサー | ||
**9-シスレチノイン酸:RXRのリガンド。RXRはVDR, TR, RAR, LXR, PPARなどとヘテロダイマーをつくる。 | **9-シスレチノイン酸:RXRのリガンド。RXRはVDR, TR, RAR, LXR, PPARなどとヘテロダイマーをつくる。 | ||
** | **oxysterols (コレステロール酸化物):LXRのリガンド。 | ||
**胆汁酸(胆汁中のステロイド誘導体):FXRのリガンド。 | **胆汁酸(胆汁中のステロイド誘導体):FXRのリガンド。 | ||
**脂肪酸、細胞内脂質代謝物:PPARs のリガンド。 | **脂肪酸、細胞内脂質代謝物:PPARs のリガンド。 | ||
| 552行目: | 541行目: | ||
*カテゴリー(3) | *カテゴリー(3) | ||
** | **androstane(男性ホルモン代謝中間体):CARに結合。 | ||
**脂肪酸:HNF-4a, gに結合。 | **脂肪酸:HNF-4a, gに結合。 | ||
**リン酸化脂質(ホスファチジルイノシトール類):SF1/LRH1に結合。 | **リン酸化脂質(ホスファチジルイノシトール類):SF1/LRH1に結合。 | ||
** | **コレステロール、レチノイン酸:RORa,b,gに結合。 | ||
*カテゴリー(4):オーファン受容体 | *カテゴリー(4):オーファン受容体 | ||
**SHP, DAX1, TLX, PNR, GCNF, TR2,4, NGF1B, Rev- | **SHP, DAX1, TLX, PNR, GCNF, TR2,4, NGF1B, Rev-ErbAa,b, COUP-TFI,II,III | ||
== 作用機序 == | == 作用機序 == | ||
| 564行目: | 553行目: | ||
[[Image:核内受容体3.png|thumb|300px|<b>図3. 核内受容体活性化の2つのメカニズム</b><ref name="ref3" /><br>上図:リガンド結合による活性化。リガンドのないとき(左図)、核内受容体はHDAC(ヒストンデアセチラーゼ)やSMRT/NCORなどとリプレッサー複合体を形成しており、転写抑制状態にある。リガンドが結合すると(右図)、コリプレッサーが解離し、HAT(ヒストンアセチルトランスフェラーゼ)やクロマチン再編成複合体から成るコアクチベーターを取り込んで、転写活性化状態になる。<br>下図:リガンド結合によらない活性化。ERRなどリガンドなしに活性化される核内受容体もある。コアクチベーター(PGC-1など)が結合することで、さらに大きなコアクチベーター複合体を呼び込んで転写活性化状態になる。]] | [[Image:核内受容体3.png|thumb|300px|<b>図3. 核内受容体活性化の2つのメカニズム</b><ref name="ref3" /><br>上図:リガンド結合による活性化。リガンドのないとき(左図)、核内受容体はHDAC(ヒストンデアセチラーゼ)やSMRT/NCORなどとリプレッサー複合体を形成しており、転写抑制状態にある。リガンドが結合すると(右図)、コリプレッサーが解離し、HAT(ヒストンアセチルトランスフェラーゼ)やクロマチン再編成複合体から成るコアクチベーターを取り込んで、転写活性化状態になる。<br>下図:リガンド結合によらない活性化。ERRなどリガンドなしに活性化される核内受容体もある。コアクチベーター(PGC-1など)が結合することで、さらに大きなコアクチベーター複合体を呼び込んで転写活性化状態になる。]] | ||
核内受容体のリガンドは、輸送タンパク質に結合して血中や体液中を運搬され、標的細胞の中へは単独で入り、細胞質に存在する核内受容体に結合する。例えば、グルココルチコイド受容体 (GR) は、細胞質で[[シャペロンタンパク質]]である[[hsp90]]や[[p23]]と結合しており、リガンドが結合するとシャペロンから離れて核内に移行し、標的遺伝子の「[[グルココルチコイド応答エレメント]](glucocorticoid response element: GRE)」と呼ばれるDNA配列に結合する<ref name="ref1" /> | 核内受容体のリガンドは、輸送タンパク質に結合して血中や体液中を運搬され、標的細胞の中へは単独で入り、細胞質に存在する核内受容体に結合する。例えば、グルココルチコイド受容体 (GR) は、細胞質で[[シャペロンタンパク質]]である[[hsp90]]や[[p23]]と結合しており、リガンドが結合するとシャペロンから離れて核内に移行し、標的遺伝子の「[[グルココルチコイド応答エレメント]](glucocorticoid response element: GRE)」と呼ばれるDNA配列に結合する<ref name="ref1" />。リガンドおよびDNAと結合したNRは、コアクチベータータンパク質などと結合して、[[wikipedia:ja:クロマチン|クロマチン]]の構造を変えて転写を調節する大きな複合体としてはたらく。また、細胞核内でリガンドと結合していないNRはコリプレッサータンパク質と結合しており、標的遺伝子の転写を抑制している(図3)。NRは、細胞質タンパク質である[[SMAD3]]や[[JNK]]とも相互作用する。AF-1領域には[[リン酸化]]部位があり、リン酸化による活性調節を受ける。 | ||
認識するDNA配列(ホルモン応答エレメント:hormone response element)は6塩基RGGTCA(DNAハーフサイト)が、同じ方向あるいは反対方向に反復したDNA配列である。リガンドによって、GREなどと呼ぶ。モノマーの場合は1つのハーフサイトのみに結合する(図2)。 | 認識するDNA配列(ホルモン応答エレメント:hormone response element)は6塩基RGGTCA(DNAハーフサイト)が、同じ方向あるいは反対方向に反復したDNA配列である。リガンドによって、GREなどと呼ぶ。モノマーの場合は1つのハーフサイトのみに結合する(図2)。 | ||
| 570行目: | 559行目: | ||
== 病気、創薬との関連 == | == 病気、創薬との関連 == | ||
処方薬上位200のうち34がNRを標的としたものであるというデータがある(2003年)<ref name="ref2"><pubmed>16892386</pubmed></ref> 。[[タモキシフェン]](tamoxifen)が最初に合成されたNRリガンドで、[[wikipedia:ja:更年期障害|更年期障害]]の改善薬として使用されたが、[[wikipedia:ja:子宮体ガン|子宮体ガン]]のリスクを高めることがわかり、現在ではER陽性の[[wikipedia:ja:乳ガン|乳ガン]]治療薬として用いられている。その後、NRサブタイプ特異的アゴニスト薬剤の開発が進み、ER beta 特異的なアゴニストは[[wikipedia:ja:骨粗鬆症|骨粗鬆症]]に対する効果のみをもち、[[wikipedia:ja:子宮内膜|子宮内膜]]への増殖作用はないなど、副作用が極力抑えられるようになった。 | |||
HNF4a遺伝子変異により、[[wikipedia:ja:糖尿病|糖尿病]]の一つ である[[wikipedia:ja:成人発症型若年性糖尿病|成人発症型若年性糖尿病]](Maturity Onset Diabetes of the Young [MODY1])がおこる<ref name="ref3"><pubmed>18023286</pubmed></ref>。また、HNF4a遺伝子の[[プロモータ]]配列の[[多型性]]により[[wikipedia:ja:成人発症2型糖尿病|成人発症2型糖尿病]]がおこる。SHP遺伝子の変異で[[肥満症]]となる。 | HNF4a遺伝子変異により、[[wikipedia:ja:糖尿病|糖尿病]]の一つ である[[wikipedia:ja:成人発症型若年性糖尿病|成人発症型若年性糖尿病]](Maturity Onset Diabetes of the Young [MODY1])がおこる<ref name="ref3"><pubmed>18023286</pubmed></ref>。また、HNF4a遺伝子の[[プロモータ]]配列の[[多型性]]により[[wikipedia:ja:成人発症2型糖尿病|成人発症2型糖尿病]]がおこる。SHP遺伝子の変異で[[肥満症]]となる。 | ||
| 576行目: | 565行目: | ||
== 脳科学との関連 == | == 脳科学との関連 == | ||
表1のように中枢神経系に存在して機能を担うNRがある。 | |||
最近、NRは[[概日リズム]]を調節することがわかった<ref name="ref6"><pubmed>22411605</pubmed></ref>。概日リズムの形成には、1)転写アクチベーターである[[BMAL1]]と[[CLOCK]]のヘテロダイマーが、[[Period]] (PER)と[[Cryptochrome]] (CRY)遺伝子の転写を活性化すること、2)PERとCRYのヘテロダイマーは、逆にBMAL1/CLOCKのリプレッサーとして働くことが重要である。BMAL1/CLOCKはオーファンNRであるREV-ERBsの発現を促し、逆にREV-ERBsはBMAL1の発現を抑制する。 | |||
グルココルチコイド(Gc)の血中濃度は、[[視床下部]][[視交叉上核]]や[[副腎]]のはたらきにより日内変動する。Gcと結合したGRは、GREを介してPER1, PER2遺伝子発現を調節するので、Gcの日内変動もまた概日リズムの強化に関わっている。 | グルココルチコイド(Gc)の血中濃度は、[[視床下部]][[視交叉上核]]や[[副腎]]のはたらきにより日内変動する。Gcと結合したGRは、GREを介してPER1, PER2遺伝子発現を調節するので、Gcの日内変動もまた概日リズムの強化に関わっている。 | ||
| 589行目: | 578行目: | ||
*[[グルココルチコイド]] | *[[グルココルチコイド]] | ||
*[[ステロイド]] | *[[ステロイド]] | ||
(他にも有りましたらご指摘下さい) | |||
==外部リンク== | ==外部リンク== | ||
| 596行目: | 586行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:大内淑代 担当編集委員:大隅典子) | |||
2012年8月16日 (木) 11:27時点における版
| DNA binding domain (DBD) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
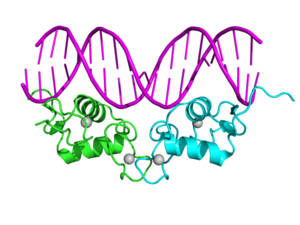 Crystallographic structure of the human progesterone receptor DNA-binding domain dimer (cyan and green) complexed with double strained DNA (magenta). Zinc atoms of are depicted as grey spheres.[1] | |||||||||
| Identifiers | |||||||||
| Symbol | zf-C4 | ||||||||
| Pfam | PF00105 | ||||||||
| InterPro | IPR001628 | ||||||||
| SMART | SM00399 | ||||||||
| PROSITE | PDOC00031 | ||||||||
| SCOP | 1hra | ||||||||
| SUPERFAMILY | 1hra | ||||||||
| CDD | cd06916 | ||||||||
| |||||||||
英語名:nuclear receptor 英略語:NR 独:Kernrezeptoren 仏:récepteur nucléaire
核内受容体は、ステロイドや甲状腺ホルモン、レチノイド、ビタミンDなどの受容体であり、主に、リガンドが結合すると細胞質から核内へ移行して転写調節因子としてはたらく[2]。リガンドの不明な核内受容体、リガンド結合とは別のしくみで活性が調節される核内受容体もある[3]。ヒトで48の遺伝子にコードされており、代謝、恒常性、分化、成長、発生、老化、生殖などの機能を担う。
研究の歴史、背景
- 1985年 ヒトGRのクローニング[3]
- 1986年 ヒトERαのクローニング
- ウイルスガン遺伝子のv-erbAとホルモン受容体とに、相同性のあることがわかった。
- 1986年 TRがv-erbAであることが明らかにされた。
- その後、MR, PR, AR, 脂溶性ビタミンA, Dの受容体のクローニングが相次いだ。配列相同性からオーファン核内受容体が多くクローニングされた。
- PXR(1998年)やPNR (1999年)が、遺伝子情報(ESTデータベース)をもとに発見された最後のNRメンバーとなった。
- 2001年 ヒトゲノムが明らかにされ、核内受容体はヒトでは48遺伝子、マウスでは49遺伝子にコードされることがわかった。
構造
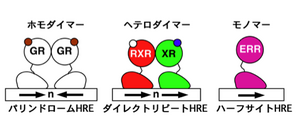
ホモダイマー化したGRなどホルモン受容体は、パリンドローム(回文配列)状に並んだ2つのホルモン応答エレメント(HRE)に結合する。ヘテロダイマー化したRXRと他の核内受容体(XR)は、同方向に並んだ(ダイレクトリピート)2つのHREに結合する。ERRなどオーファン受容体は、モノマーのまま1つのHRE(ハーフサイト)に結合する。
N末端にAF-1領域 (かつてA/Bドメインと呼ばれた)があり、リガンド非依存的に転写活性化作用をもつ。AF-1は、核内受容体間で多様性に富む領域である。中央部にDNA結合領域 (DBD) (C) があり、2つのジンクフィンガーモチーフ(70アミノ酸)から成る。DBDは、受容体間のホモロジーが高い。C末端側にリガンド結合領域 (LBD) (E)(250アミノ酸)をもつ。LBDのC末端 (F領域) にあるαヘリックスをAF-2ヘリックスといい、受容体の活性調節に関係がある。構造の特殊なNRとして、A/B領域を欠くもの(HNF4g)、A/B, C領域を欠くもの(SHP)がある。D領域はヒンジ領域で、DBDとLBDの連結部位である。
核内受容体は通常2量体、ホモダイマー(ステロイド受容体)あるいはヘテロダイマー(RXRとPPARs, LXR, FXRなど)を形成して転写調節を行う(図2)。単量体でDNAに結合するもの(ERR, LRH1, SF1, NGFIB)もある。HNF4sやNGFIBは、リガンド結合とは無関係に活性化されており、これらはオーファン核内受容体と呼ばれる。
核内受容体スーパーファミリー
分子系統樹に基づく分類
分子系統樹から7つのサブファミリー(NR0〜6)に分類され、個々の慣用名に対応する正式名がある[5](表1)。サブファミリー0 (NR0)は、DNA結合領域(DBD, C領域)またはリガンド結合領域(LBD, E領域)の一方しか持たないもので、例えばSHPはLBDしか持たずNR0B2と呼ばれる。各サブファミリーはさらにA, B,,,のグループに分けられ、1つのグループはパラログによって構成される。例えば、甲状腺ホルモン受容体 (TR) はサブファミリー1グループA (NR1A)で、TRαはNR1A1, TRβはNR1A2となる。また、例えばNR5A1a (=SF1)とNR5A1b(ELP)とは、同じ遺伝子からスプライシングの違いによってできた異なったアイソフォームである。
| サブファミリー | グループ | メンバー | ||||||
| 正式名 | 慣用名(略称) | 慣用名 | 遺伝子 | リガンド | ||||
| 1 | 甲状腺ホルモン型 | A | 甲状腺ホルモン受容体 | NR1A1 | TRa | 甲状腺ホルモン受容体α | THRA | 甲状腺ホルモン |
| NR1A2 | TRb | 甲状腺ホルモン受容体β | THRB | |||||
| B | レチノイン酸受容体 | NR1B1 | RARa | レチノイン酸受容体α | RARA | ビタミンA関連化合物 | ||
| NR1B2 | RARb | レチノイン酸受容体β | RARB | |||||
| NR1B3 | RARg | レチノイン酸受容体γ | RARG | |||||
| C | ペルオキシソーム増殖因子活性化受容体 | NR1C1 | PPARa | ペルオキシソーム増殖因子活性化受容体α | PPARA | 脂肪酸、プロスタグランジン | ||
| NR1C2 | PPARb/d | ペルオキシソーム増殖因子活性化受容体βδ | PPARD | |||||
| NR1C3 | PPARg | ペルオキシソーム増殖因子活性化受容体γ | PPARG | |||||
| D | Rev-ErbA | NR1D1 | Rev-ErbAa | Rev-ErbA-alpha | NR1D1 | ヘム | ||
| NR1D2 | Rev-ErbAb | Rev-ErbA-beta | NR1D2 | |||||
| F | RAR関連オーファン受容体 | NR1F1 | RORa | RAR関連オーファン受容体α | RORA | コレステロール、ATRA | ||
| NR1F2 | RORb | RAR関連オーファン受容体β | RORB | |||||
| NR1F3 | RORg, RORC | RAR関連オーファン受容体γ | RORC | |||||
| H | 肝X受容体型 | NR1H3 | LXRa | 肝X受容体α | NR1H3 | oxysteroids | ||
| NR1H2 | LXRb | 肝X受容体β | NR1H2 | |||||
| NR1H4 | FXR | ファルネソイドX受容体 | NR1H4 | |||||
| I | ビタミンD受容体型 | NR1I1 | VDR | ビタミンD受容体 | VDR | ビタミンD | ||
| NR1I2 | PXR | プレグナンX受容体 | NR1I2 | 生体異物 | ||||
| NR1I3 | CAR | 構成的アンドロスタン受容体 | NR1I3 | アンドロスタン | ||||
| 2 | レチノイドX受容体型 | A | 肝細胞核因子4 | NR2A1 | HNF4a | 肝細胞核因子4α | HNF4A | 脂肪酸 |
| NR2A2 | HNF4g | 肝細胞核因子4γ | HNF4G | |||||
| B | レチノイドX受容体 | NR2B1 | RXRa | レチノイドX受容体α | RXRA | レチノイド | ||
| NR2B2 | RXRb | レチノイドX受容体β | RXRB | |||||
| NR2B3 | RXRg | レチノイドX受容体γ | RXRG | |||||
| C | Testicular receptor | NR2C1 | TR2 | Testicular receptor 2 | NR2C1 | |||
| NR2C2 | TR4 | Testicular receptor 4 | NR2C2 | |||||
| E | TLX/PNR | NR2E1 | TLX | Drosophila tailless遺伝子ホモログ | NR2E1 | |||
| NR2E3 | PNR | 光受容細胞特異的核内受容体 | NR2E3 | |||||
| F | COUP/EAR | NR2F1 | COUP-TFI | トリ卵白アルブミン上流プロモータ転写因子I | NR2F1 | |||
| NR2F2 | COUP-TFII | トリ卵白アルブミン上流プロモータ転写因子II | NR2F2 | |||||
| NR2F6 | EAR-2, COUP-TFIII | V-erbA-related | NR2F6 | |||||
| 3 | エストロゲン受容体型 | A | エストロゲン受容体 | NR3A1 | ERa | エストロゲン受容体α | ESR1 | エストロゲン |
| NR3A2 | ERb | エストロゲン受容体β | ESR2 | |||||
| B | エストロゲン関連受容体 | NR3B1 | ERRa | エストロゲン関連受容体α | ESRRA | |||
| NR3B2 | ERRb | エストロゲン関連受容体β | ESRRB | |||||
| NR3B3 | ERRg | エストロゲン関連受容体γ | ESRRG | |||||
| C | 3-ケトステロイド受容体 | NR3C1 | GR | グルココルチコイド受容体 | NR3C1 | コルチゾール | ||
| NR3C2 | MR | 鉱質コルチコイド受容体 | NR3C2 | アルドステロン | ||||
| NR3C3 | PR | プロゲステロン受容体 | PGR | プロゲステロン | ||||
| NR3C4 | AR | アンドロゲン受容体 | AR | テストステロン | ||||
| 4 | 神経成長因子IB 型 | A | NGFIB/NURR1/NOR1 | NR4A1 | NGFIB | 神経成長因子IB | NR4A1 | |
| NR4A2 | NURR1 | Nuclear receptor related 1 | NR4A2 | |||||
| NR4A3 | NOR1 | Neuron-derived orphan receptor 1 | NR4A3 | |||||
| 5 | ステロイド産生因子型 | A | SF1/LRH1 | NR5A1 | SF1 | ステロイド産生因子1 | NR5A1 | ホスファチジルイノシトール |
| NR5A2 | LRH1 | Liver receptor homolog-1 | NR5A2 | |||||
| 6 | 胚細胞核因子型 | A | GCNF | NR6A1 | GCNF | 胚細胞核因子 | NR6A1 | |
| 0 | その他 | A | DAX/SHP | NR0B1 | DAX1 | X染色体上遺伝子量感受性性転換副腎低形成先天的必須領域遺伝子1 | NR0B1 | |
| NR0B2 | SHP | 小型ヘテロ二量体パートナー | NR0B2 | |||||
表1. ヒト核内受容体ファミリー 文献[5][4]、Wikipedia 核内受容体から作成。
組織特異的発現パターンや生理的機能による分類
組織特異的発現パターンや生理的機能から6群(クラスター)に分けられる(表2)[6] [7]。
| クラスター | 機能 | 核内受容体 | 機能 | 発現部位 |
| I | ステロイド合成 | FXRb | ヒトになし、マウスで機能不明 | 中枢神経系、生殖器、副腎 |
| SF1 | 性分化とステロイド合成 | |||
| DAX1 | ||||
| II | 生殖と発生 | AR | 内分泌ステロイドホルモン受容体(性決定、性生殖) | |
| ERa, ERb | ||||
| PR | ||||
| COUP-TFII | RARシグナルの調節 | |||
| RARa, RARg | 発生 | |||
| III | 中枢神経系、概日リズム、基礎代謝機能 | TLX | 神経細胞と末梢組織の分化 | 中枢神経系 |
| COUP-TFI | ||||
| TR4 | ||||
| NR4As (NGFIB, NOR1, NURR1) | ||||
| Rev-ErbAa, Rev-ErbAb | 概日リズムと代謝の調節 | |||
| RORa, RORb | ||||
| ERRb, ERRg | ||||
| NR4As | ||||
| TRa | 心臓血管機能の調節 | |||
| MR | ||||
| LXRb | ||||
| RXRb, RXRg | 内分泌NRや脂質NRとヘテロダイマーを形成 | |||
| IV | 胆汁酸と生体異物の代謝 | HNF4a | 胃・腸・肝の発生 | |
| HNF4g | 糖代謝とインスリン作用 | |||
| FXRa | 胆汁酸代謝 | |||
| LRH-1 | ||||
| SHP | ||||
| PXR | ステロイド・食餌中の生体異物性脂質・毒性生理活性脂質の除去 | |||
| CAR | ||||
| VDR | Ca吸収・代謝、腸での胆汁酸除去 | |||
| RORg | リンパ管の発生、胸腺リンパ球形成 | |||
| V | 脂質代謝とエネルギーの恒常性 |
TRb | 熱発生、脂肪酸・コレステロール代謝 | |
| PPARa, PPARd | 脂肪酸の酸化 | |||
| ERRa | 酸化的遺伝子発現、脂質代謝、ミトコンドリア生成 | |||
| COUP-TFg | 機能不明 | |||
| TR2 | ||||
| GCNF | ||||
| RXRa | ヘテロダイマー形成 | |||
| VI | ||||
| PPARg | 食餌中のコレステロール・脂肪を感知してインスリンシグナルを亢進させ、脂肪を蓄積 | |||
| LXRa | ||||
| GR | 脂肪分解・糖新生促進 | |||
| その他 | PNR | 視細胞の発生と機能 | 眼 |
表2.マウス核内受容体の機能による分類
- クラスターI: ステロイド合成
- クラスターII: 生殖と発生
- クラスターIII: 中枢神経系、概日リズム、基礎代謝機能
- クラスターIV: 胆汁酸と生体異物の代謝
- クラスターVとVI: 脂質代謝とエネルギーの恒常性
リガンドに基づく分類
リガンドからNRを分類すると、(1)ホルモンやビタミンをリガンドとする内分泌受容体、(2)配列相同性から発見され、後に生体内でのリガンドが同定されたもの、(3)リガンドの生体での機能が明らかでないもの、(4)リガンドの同定されていないものがある。
- カテゴリー(1):内分泌受容体
- ステロイドホルモン [ER, GR, MR, PR, AR](略称は表1を参照)
- ビタミンD(ステロイドから生成)[VDR]
- 昆虫脱皮ホルモン(エクジソンecdysone)(ステロイド骨格をもつ)
- 甲状腺ホルモン(チロシンtyrosineから生成)[TR]
- レチノイド(ビタミンA):レチノイン酸など [RAR]
- カテゴリー(2):脂質センサー
- 9-シスレチノイン酸:RXRのリガンド。RXRはVDR, TR, RAR, LXR, PPARなどとヘテロダイマーをつくる。
- oxysterols (コレステロール酸化物):LXRのリガンド。
- 胆汁酸(胆汁中のステロイド誘導体):FXRのリガンド。
- 脂肪酸、細胞内脂質代謝物:PPARs のリガンド。
- 生体異物 (xenobiotics):CAR, PXRのリガンド。薬物代謝物で、肝臓のチトクローム酵素P450によって生成される。
- カテゴリー(3)
- androstane(男性ホルモン代謝中間体):CARに結合。
- 脂肪酸:HNF-4a, gに結合。
- リン酸化脂質(ホスファチジルイノシトール類):SF1/LRH1に結合。
- コレステロール、レチノイン酸:RORa,b,gに結合。
- カテゴリー(4):オーファン受容体
- SHP, DAX1, TLX, PNR, GCNF, TR2,4, NGF1B, Rev-ErbAa,b, COUP-TFI,II,III
作用機序
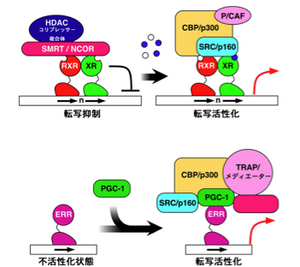
上図:リガンド結合による活性化。リガンドのないとき(左図)、核内受容体はHDAC(ヒストンデアセチラーゼ)やSMRT/NCORなどとリプレッサー複合体を形成しており、転写抑制状態にある。リガンドが結合すると(右図)、コリプレッサーが解離し、HAT(ヒストンアセチルトランスフェラーゼ)やクロマチン再編成複合体から成るコアクチベーターを取り込んで、転写活性化状態になる。
下図:リガンド結合によらない活性化。ERRなどリガンドなしに活性化される核内受容体もある。コアクチベーター(PGC-1など)が結合することで、さらに大きなコアクチベーター複合体を呼び込んで転写活性化状態になる。
核内受容体のリガンドは、輸送タンパク質に結合して血中や体液中を運搬され、標的細胞の中へは単独で入り、細胞質に存在する核内受容体に結合する。例えば、グルココルチコイド受容体 (GR) は、細胞質でシャペロンタンパク質であるhsp90やp23と結合しており、リガンドが結合するとシャペロンから離れて核内に移行し、標的遺伝子の「グルココルチコイド応答エレメント(glucocorticoid response element: GRE)」と呼ばれるDNA配列に結合する[2]。リガンドおよびDNAと結合したNRは、コアクチベータータンパク質などと結合して、クロマチンの構造を変えて転写を調節する大きな複合体としてはたらく。また、細胞核内でリガンドと結合していないNRはコリプレッサータンパク質と結合しており、標的遺伝子の転写を抑制している(図3)。NRは、細胞質タンパク質であるSMAD3やJNKとも相互作用する。AF-1領域にはリン酸化部位があり、リン酸化による活性調節を受ける。
認識するDNA配列(ホルモン応答エレメント:hormone response element)は6塩基RGGTCA(DNAハーフサイト)が、同じ方向あるいは反対方向に反復したDNA配列である。リガンドによって、GREなどと呼ぶ。モノマーの場合は1つのハーフサイトのみに結合する(図2)。
病気、創薬との関連
処方薬上位200のうち34がNRを標的としたものであるというデータがある(2003年)[3] 。タモキシフェン(tamoxifen)が最初に合成されたNRリガンドで、更年期障害の改善薬として使用されたが、子宮体ガンのリスクを高めることがわかり、現在ではER陽性の乳ガン治療薬として用いられている。その後、NRサブタイプ特異的アゴニスト薬剤の開発が進み、ER beta 特異的なアゴニストは骨粗鬆症に対する効果のみをもち、子宮内膜への増殖作用はないなど、副作用が極力抑えられるようになった。
HNF4a遺伝子変異により、糖尿病の一つ である成人発症型若年性糖尿病(Maturity Onset Diabetes of the Young [MODY1])がおこる[4]。また、HNF4a遺伝子のプロモータ配列の多型性により成人発症2型糖尿病がおこる。SHP遺伝子の変異で肥満症となる。
脳科学との関連
表1のように中枢神経系に存在して機能を担うNRがある。
最近、NRは概日リズムを調節することがわかった[7]。概日リズムの形成には、1)転写アクチベーターであるBMAL1とCLOCKのヘテロダイマーが、Period (PER)とCryptochrome (CRY)遺伝子の転写を活性化すること、2)PERとCRYのヘテロダイマーは、逆にBMAL1/CLOCKのリプレッサーとして働くことが重要である。BMAL1/CLOCKはオーファンNRであるREV-ERBsの発現を促し、逆にREV-ERBsはBMAL1の発現を抑制する。
グルココルチコイド(Gc)の血中濃度は、視床下部視交叉上核や副腎のはたらきにより日内変動する。Gcと結合したGRは、GREを介してPER1, PER2遺伝子発現を調節するので、Gcの日内変動もまた概日リズムの強化に関わっている。
甲状腺ホルモンの血中濃度にも日内変動がある。甲状腺を除去するとPER2の周期的な発現が消失する。PPARgのリガンドであるoleoylethanolamide (OEA)も食餌摂取によって昼間に高値を示し、PPARgはBMAL1, REV-ERBaの転写を直接制御している。他にレチノイド受容体もCLOCKと関連がある。
このように、概日リズムと代謝は核内受容体シグナル経路によって連携的にはたらくようになっている。概日時計が、核内受容体の周期的な発現を直接制御して代謝を調節している。核内受容体は、逆に代謝性のシグナルに応答して概日リズムを制御する。
関連項目
(他にも有りましたらご指摘下さい)
外部リンク
- Nuclear Receptor Signaling Atlas (NURSA) 2002年から米国NIHのサポートで設立されたコンソーシアムで、核内受容体と関連する転写コレギュエーターについてのゲノミクス・プロテオミクス公開データベースとなっている。
参考文献
- ↑
Roemer, S.C., Donham, D.C., Sherman, L., Pon, V.H., Edwards, D.P., & Churchill, M.E. (2006).
Structure of the progesterone receptor-deoxyribonucleic acid complex: novel interactions required for binding to half-site response elements. Molecular endocrinology (Baltimore, Md.), 20(12), 3042-52. [PubMed:16931575] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 Alberts B, Johnson A, Lewis J, Raff M.
Molecular Biology of the Cell, 5th Edition,
pp889-891, Garland Science, New York, 2008. - ↑ 3.0 3.1 3.2 3.3
Moore, J.T., Collins, J.L., & Pearce, K.H. (2006).
The nuclear receptor superfamily and drug discovery. ChemMedChem, 1(5), 504-23. [PubMed:16892386] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4
Sonoda, J., Pei, L., & Evans, R.M. (2008).
Nuclear receptors: decoding metabolic disease. FEBS letters, 582(1), 2-9. [PubMed:18023286] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Nuclear Receptors Nomenclature Committee (1999).
A unified nomenclature system for the nuclear receptor superfamily. Cell, 97(2), 161-3. [PubMed:10219237] [WorldCat] [DOI] - ↑
Bookout, A.L., Jeong, Y., Downes, M., Yu, R.T., Evans, R.M., & Mangelsdorf, D.J. (2006).
Anatomical profiling of nuclear receptor expression reveals a hierarchical transcriptional network. Cell, 126(4), 789-99. [PubMed:16923397] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Fan, W., Downes, M., Atkins, A., Yu, R., & Evans, R.M. (2011).
Nuclear receptors and AMPK: resetting metabolism. Cold Spring Harbor symposia on quantitative biology, 76, 17-22. [PubMed:22411605] [PMC] [WorldCat] [DOI]
(執筆者:大内淑代 担当編集委員:大隅典子)