「チャネル病」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の9版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0132108 中條 浩一]、[http://researchmap.jp/yoshihirokubo 久保 義弘]</font><br> | <font size="+1">[http://researchmap.jp/read0132108 中條 浩一]、[http://researchmap.jp/yoshihirokubo 久保 義弘]</font><br> | ||
''自然科学研究機構 生理学研究所''<br> | ''自然科学研究機構 生理学研究所''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2014年12月16日 原稿完成日:2014年月日<br> | ||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 10行目: | 10行目: | ||
同義語:チャネロパチー | 同義語:チャネロパチー | ||
{{box|text= | {{box|text= チャネル病は、イオンチャネルあるいはその関連タンパク質が原因で起こる疾患の総称である。チャネル遺伝子の変異による先天性のものと、薬剤や自己免疫疾患等で起こる後天性のものが存在する。特に電位依存性のイオンチャネルに関しては、神経細胞や筋細胞などの興奮性を制御する役割を担っているため、これらのイオンチャネルの異常は、てんかんや不整脈などの興奮性異常が生じる疾患につながる。チャネル病が起こる原因を理解するためには、原因である遺伝子とその変異を同定することはもちろん不可欠であるが、発現系によりそれら変異体の電気生理学的性質の変化を調べることで、チャネル病特有の原因、たとえば開閉の電位依存性の変化や、不活性化の異常など、より深いレベルで原因を解明することも可能である。近年では患者から作成したiPS細胞を心筋細胞などに分化させることで、遺伝子異常が活動電位等の電気的性質にどのような影響を与えるかということまで解析が可能になりつつある。}} | ||
==チャネル病とは== | ==チャネル病とは== | ||
チャネル病は[[イオンチャネル]]あるいはその関連タンパク質が原因で起こる疾患の総称である。イオンチャネルとは[[膜タンパク質]]の一種であり、特定の種類の[[イオン]]を通すことで細胞の電気的活動を担っている<ref>'''久保義弘、岡村康司'''<br>標準生理学 第8版 第4章 膜興奮性とイオンチャネル<br>''医学書院(東京)'':2014</ref>。そのため、[[興奮性細胞]]によって構成される[[脳神経]]系、[[心臓]]、[[骨格筋]]等におけるチャネル病の例が多数報告されている。あるいは[[腎臓]]や[[肺]] | チャネル病は[[イオンチャネル]]あるいはその関連タンパク質が原因で起こる疾患の総称である。イオンチャネルとは[[膜タンパク質]]の一種であり、特定の種類の[[イオン]]を通すことで細胞の電気的活動を担っている<ref>'''久保義弘、岡村康司'''<br>標準生理学 第8版 第4章 膜興奮性とイオンチャネル<br>''医学書院(東京)'':2014</ref>。そのため、[[興奮性細胞]]によって構成される[[脳神経]]系、[[心臓]]、[[骨格筋]]等におけるチャネル病の例が多数報告されている。あるいは[[腎臓]]や[[肺]]などでイオンの輸送が阻害されることによって起こるチャネル病なども知られている。イオンチャネルが身体のさまざまな部位で重要な役割を果たしていることから、チャネル病もさまざまな臓器において起こりうる。 | ||
チャネル病にはアミノ酸の変異等、先天的な原因によって起こるものと、[[免疫]]疾患や薬剤誘発性等、後天的な原因によるものとに大別される。いずれの場合においても、単にイオンチャネルとしての機能が欠損するもの、すなわちイオン電流がなくなる、あるいは電流量が減少してしまうことが原因の場合もあれば、イオンチャネルの生物物理学的な性質が変わってしまっている場合もある。前者としては、イオンを通す[[イオン選択性フィルター]]の性質が変わることでイオンが通りにくくなってしまったり、あるいは[[細胞膜]]への輸送(トラフィッキング)への影響で、細胞膜上で機能しているイオンチャネルの量(発現量)が減ってしまったりするケースが考えられる。後者としては、例えば電位依存性のイオンチャネルの場合、その活性化の電位依存性が変化すること、あるいは不活性化するイオンチャネルにおいて不活性化の性質が変化することなどが考えられる。 | |||
疾患の原因であるアミノ酸の変異が同定できれば、[[哺乳類]][[培養細胞]]等の発現系に変異を導入したイオンチャネルを発現させ、電気生理学的手法もしくは細胞生物学的手法により機能解析をすることで、変異によって生じたイオンチャネル機能もしくは発現量の変化と、それによる疾患の発生メカニズムを明らかにすることができる。近年はチャネル病の患者から作成された[[iPS細胞]]を用いた機能解析も始まっており、この流れは今後ますます加速していくと思われる<ref name=ref2><pubmed>21307850</pubmed></ref><ref><pubmed>23277474</pubmed></ref>。 | |||
以下、興奮性細胞である神経系、心筋、骨格筋のチャネル病を中心に代表的なチャネル病の例を挙げる。しかしながら、イオンチャネルの遺伝子数と発現部位の多様性を考えれば、下記の例以外にも多くのチャネル病が存在し、今後も発見・同定されていくのではないかと思われる。また最近の総説として、神経系のチャネル病については2010年6月1日号にJournal of Physiologyが、チャネル病全般については2010年7月号にPflügers Archivがそれぞれ特集号を出版しているので、そちらも参照されたい<ref><pubmed>20516349</pubmed></ref><ref><pubmed>20238123</pubmed></ref>。 | |||
==脳・神経系のチャネル病== | ==脳・神経系のチャネル病== | ||
脳・神経系では、神経細胞がネットワークを張り巡らせ、その電気的活動を担っている。神経細胞の電気的活動は、[[電位依存性ナトリウムチャネル]](NaV)、[[電位依存性カリウムチャネル]](KV)、[[電位依存性カルシウムチャネル]](CaV) | 脳・神経系では、神経細胞がネットワークを張り巡らせ、その電気的活動を担っている。神経細胞の電気的活動は、[[電位依存性ナトリウムチャネル]](NaV)、[[電位依存性カリウムチャネル]](KV)、[[電位依存性カルシウムチャネル]](CaV)などによって担われている。したがって、これらのイオンチャネルに異常が生じると、てんかんに代表される脳神経系のチャネル病につながる。 | ||
=== 電位依存性ナトリウムチャネルの異常 === | === 電位依存性ナトリウムチャネルの異常 === | ||
電位依存性ナトリウムチャネルが原因となる中枢神経系の異常としては、[[熱性けいれんプラス]] (GEFS+; generalized epilepsy with febrile seizures plus)とよばれる家族性の[[てんかん]]が知られているが、これは電位依存性ナトリウムチャネル遺伝子のうちの[[NaV1.1]] ([[ | 電位依存性ナトリウムチャネルが原因となる中枢神経系の異常としては、[[熱性けいれんプラス]] (GEFS+; generalized epilepsy with febrile seizures plus)とよばれる家族性の[[てんかん]]が知られているが、これは電位依存性ナトリウムチャネル遺伝子のうちの[[NaV1.1]] ([[SCNA1]]),[[NaV1.2]] ([[SCNA2]])、あるいはその修飾サブユニットである[[Naβ1]] ([[SCNB1]])に異常が生じることで引き起こされる<ref><pubmed>9697698</pubmed></ref><ref><pubmed>10742094</pubmed></ref>。電位依存性ナトリウムチャネルにおいては、その[[不活性化]]と呼ばれる性質が神経細胞の興奮性の制御に重要である。この疾患においては、アミノ酸変異によって不活性化の性質が不完全になっており、ナトリウムチャネルが開きやすい状態にあることが神経細胞の過興奮につながり、てんかん発作を引き起こすと考えられる。またより重度な[[乳児重症ミオクロニーてんかん]]においても、NaV1.1がその原因遺伝子であることが判明している<ref><pubmed>11359211</pubmed></ref>。 | ||
=== 電位依存性カリウムチャネルの異常 === | === 電位依存性カリウムチャネルの異常 === | ||
| 34行目: | 34行目: | ||
=== 電位依存性カルシウムチャネルの異常 === | === 電位依存性カルシウムチャネルの異常 === | ||
電位依存性カルシウムチャネルは、それぞれのサブタイプが、[[細胞体]]、[[神経終末]]、[[樹状突起]]などに局在して機能を果たしている。この中で、[[P/Q型カルシウムチャネル]]としても知られる[[Cav2.1|CaV2.1]]([[CACNA1A]])は、[[シナプス前終末]]での神経伝達物質放出に関わるイオンチャネルであるが、[[家族性片頭痛]]、[[反復発作性失調症2型]] ([[EA2]])、[[脊髄小脳失調症6型]] ([[SCA6]]) | 電位依存性カルシウムチャネルは、それぞれのサブタイプが、[[細胞体]]、[[神経終末]]、[[樹状突起]]などに局在して機能を果たしている。この中で、[[P/Q型カルシウムチャネル]]としても知られる[[Cav2.1|CaV2.1]]([[CACNA1A]])は、[[シナプス前終末]]での神経伝達物質放出に関わるイオンチャネルであるが、[[家族性片頭痛]]、[[反復発作性失調症2型]] ([[EA2]])、[[脊髄小脳失調症6型]] ([[SCA6]])といった、小脳に異常を呈するさまざまな神経疾患に関わっていることも知られている。 | ||
==心臓のチャネル病== | ==心臓のチャネル病== | ||
| 41行目: | 41行目: | ||
[[Image:チャネル病2.png|300px|thumb|right|'''図2. KCNQ1サブユニット上のLQT1またはJLNを起こすアミノ酸(マゼンタ)とSQT2を起こすアミノ酸(黄色)'''<br>ここでは1分子のみを表示している。構造はKCNQ1の開状態モデルを使用<ref><pubmed>17999538</pubmed></ref>。]] | [[Image:チャネル病2.png|300px|thumb|right|'''図2. KCNQ1サブユニット上のLQT1またはJLNを起こすアミノ酸(マゼンタ)とSQT2を起こすアミノ酸(黄色)'''<br>ここでは1分子のみを表示している。構造はKCNQ1の開状態モデルを使用<ref><pubmed>17999538</pubmed></ref>。]] | ||
心臓の収縮と弛緩は心筋細胞の活動電位によって制御されている。そしてその活動電位はやはり、各種のイオンチャネルによって制御されている。たとえば心室筋細胞の活動電位は電位依存性ナトリウムチャネル、電位依存性カルシウムチャネルおよび数種類のカリウムチャネルによって形成されている。ナトリウムチャネルあるいはカルシウムチャネルの機能亢進、あるいはカリウムチャネルの機能抑制が起こると、活動電位の延長が起こり、心電図の[[QT時間]]が延長する[[QT延長症候群]] | 心臓の収縮と弛緩は心筋細胞の活動電位によって制御されている。そしてその活動電位はやはり、各種のイオンチャネルによって制御されている。たとえば心室筋細胞の活動電位は電位依存性ナトリウムチャネル、電位依存性カルシウムチャネルおよび数種類のカリウムチャネルによって形成されている。ナトリウムチャネルあるいはカルシウムチャネルの機能亢進、あるいはカリウムチャネルの機能抑制が起こると、活動電位の延長が起こり、心電図の[[QT時間]]が延長する[[QT延長症候群]]となる(図1、表1)。これは[[不整脈]]の一種であり、[[心室細動]]を誘発するなど、最悪[[突然死]]につながる可能性もある。QT延長症候群と比べると頻度は低いが、カリウムチャネルの機能亢進によって活動電位が短縮し、心電図のQT時間が短縮する[[QT短縮症候群]]も心臓のチャネル病として知られている(表2)。 | ||
===電位依存性ナトリウムチャネルの異常=== | ===電位依存性ナトリウムチャネルの異常=== | ||
ナトリウムチャネルが原因のQT延長症候群は3型 (LQT3)であり、[[NaV1.5]] ([[SCN5A]])がその原因遺伝子である。LQT3ではナトリウム電流の不活性化が不完全になり、持続性の電流が多くなることで脱分極の状態を長くする。その他ナトリウムチャネル関連タンパク質として、ナトリウムチャネルを細胞膜の特定の場所にアンカーする[[アンキリンB]] (LQT4)、ナトリウムチャネルの[[ナトリウムチェネル#βサブユニット|βサブユニット]] [[ナトリウムチャネル#βサブユニット|SCN4B]] (LQT10)がQT延長症候群の原因遺伝子として同定されている。一方、同じNaV1.5が原因である[[ブルガダ症候群]]では、逆にNaV1.5の機能が低下する変異が原因である。活動電位が短縮し、心内膜から心外膜にわたって再分極の状態がばらつくことで、心室細動を起こしやすい状態になっていると考えられる。 | |||
===電位依存性カルシウムチャネルの異常=== | ===電位依存性カルシウムチャネルの異常=== | ||
カルシウムチャネルが原因のQT延長症候群は[[L型カルシウムチャネル]]の一種である[[CaV1.2]] ([[CACNA1C]]) | カルシウムチャネルが原因のQT延長症候群は[[L型カルシウムチャネル]]の一種である[[CaV1.2]] ([[CACNA1C]])の機能亢進が原因のLQT8である。CaV1.2のG406R変異は電位依存性不活性化を著しく弱くし、そのためカルシウム電流が亢進する。この場合、QT延長のみならず[[合指]]等の形成不全、[[免疫不全]]、[[自閉症]]などさまざまな症状を呈し、[[Timothy症候群]]と名付けられている<ref name=ref2 /><ref><pubmed>15454078</pubmed></ref>。このことは、CaV1.2カルシウムチャネルが、心臓のみならず、体中のさまざまな部位、そして発生過程も含めたさまざまなステージで重要な働きを担っていることを示している。 | ||
===電位依存性カリウムチャネルの異常=== | ===電位依存性カリウムチャネルの異常=== | ||
前述のとおり、心臓では複数種類のカリウムチャネルが心臓の興奮性制御に寄与しており、QT延長症候群にも複数種類のカリウムチャネルが原因遺伝子として報告されている。先天性QT延長症候群の中でもっとも高い頻度で報告されているのは、[[KCNQ1]]チャネルが原因のLQT1と、[[hERG]]チャネルが原因のLQT2である<ref><pubmed>7736582</pubmed></ref><ref><pubmed>7889573</pubmed></ref><ref><pubmed>8528244</pubmed></ref><ref><pubmed>8900282</pubmed></ref><ref><pubmed>8900283</pubmed></ref>。どちらも[[電位依存性カリウムチャネル|電位依存性カリウムチャネルαサブユニット]]をコードしており、両者でLQTとして遺伝子診断される患者全体の80%程度を占めている。それぞれのイオンチャネルからはこれまでに数十を超える変異部位が見つかっており、ほとんどどの部位に問題が生じても、疾患を生じうることがわかる(図2)。 | |||
これらカリウムチャネルのβサブユニットである[[KCNE1]] ( | これらカリウムチャネルのβサブユニットである[[KCNE1]] (LQT5の原因遺伝子)、[[KCNE2]] (LQT6の原因遺伝子)、KCNQ1結合タンパク質である[[AKAP-9]] (LQT11の原因遺伝子)もQT延長症候群原因遺伝子である。これらLQTは[[常染色体優性遺伝]]であり、[[Romano-Ward症候群]]とも分類される。 | ||
一方先天性の難聴を伴う[[常染色体劣性遺伝]]のものは[[Jervell and Lange-Nielsen症候群]] (JLN)と呼ばれて区別される。JLN1として[[KCNQ1]]、JLN2として[[KCNE1]]が知られている。 | 一方先天性の難聴を伴う[[常染色体劣性遺伝]]のものは[[Jervell and Lange-Nielsen症候群]] (JLN)と呼ばれて区別される。JLN1として[[KCNQ1]]、JLN2として[[KCNE1]]が知られている。 | ||
=== 内向き整流性カリウムチャネルの異常 === | |||
[[内向き整流性カリウムチャネル]][[Kir2.1]] ([[KCNJ2]])もQT延長症候群の原因遺伝子(LQT7)であるが、さらに[[周期性四肢麻痺]]、形態異常などを併発し、[[Andersen症候群]]と呼ばれる。Timothy症候群と同様、Kir2.1チャネルが、できあがった機能に必要なだけではなく、発生過程・形態形成においても重要な役割を果たしていることを示している。 | [[内向き整流性カリウムチャネル]][[Kir2.1]] ([[KCNJ2]])もQT延長症候群の原因遺伝子(LQT7)であるが、さらに[[周期性四肢麻痺]]、形態異常などを併発し、[[Andersen症候群]]と呼ばれる。Timothy症候群と同様、Kir2.1チャネルが、できあがった機能に必要なだけではなく、発生過程・形態形成においても重要な役割を果たしていることを示している。 | ||
[[hERGチャネル]] ([[SQT1]])、[[KCNQ1チャネル]] ([[SQT2]])、[[Kir2.1チャネル]] ([[SQT3]])については、それぞれ変異による機能亢進でQT短縮症候群を起こすことも知られている。上述の通り、活動電位が短縮し、心電図のQT時間が短縮する不整脈の一種である(表2)。 | |||
{| class="wikitable" | {| class="wikitable" | ||
| 129行目: | 128行目: | ||
==その他のチャネル病== | ==その他のチャネル病== | ||
[[嚢胞性線維症]]は、欧米白人に高頻度で見られる遺伝性疾患で、[[塩素イオンチャネル]]の一種である[[CFTR]]の異常によるものである。塩素イオンの輸送の異常に伴って水分の輸送にも以上をきたし、[[ | [[嚢胞性線維症]]は、欧米白人に高頻度で見られる遺伝性疾患で、[[塩素イオンチャネル]]の一種である[[CFTR]]の異常によるものである。塩素イオンの輸送の異常に伴って水分の輸送にも以上をきたし、[[外分泌腺粘液]]の粘度が高くなることで各器官の管に詰まりを起こし、呼吸困難や消化機能の低下を引き起こす。 | ||
[[バーター症候群]]は腎臓でのNa<sup>+</sup>とCl<sup>-</sup>の再吸収障害により生じる疾患であり、弱い内向き整流性カリウムチャネルである[[Kir1.1]] ([[ROMK1]])、塩素イオンチャネルである[[CLC-K2]]がその原因遺伝子として同定されている。塩素イオンチャネルはその他に[[CLC-K1]]が[[腎性尿崩症]]、[[CLC-5]]が[[デント病]]と呼ばれる疾患の原因遺伝子であることが知られている。 | [[バーター症候群]]は腎臓でのNa<sup>+</sup>とCl<sup>-</sup>の再吸収障害により生じる疾患であり、弱い内向き整流性カリウムチャネルである[[Kir1.1]] ([[ROMK1]])、塩素イオンチャネルである[[CLC-K2]]がその原因遺伝子として同定されている。塩素イオンチャネルはその他に[[CLC-K1]]が[[腎性尿崩症]]、[[CLC-5]]が[[デント病]]と呼ばれる疾患の原因遺伝子であることが知られている。 | ||
==関連項目== | ==関連項目== | ||
2014年12月17日 (水) 09:09時点における版
中條 浩一、久保 義弘
自然科学研究機構 生理学研究所
DOI:10.14931/bsd.5492 原稿受付日:2014年12月16日 原稿完成日:2014年月日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:channelopathy 独: Kanalopathie 仏: canalopathie
同義語:チャネロパチー
チャネル病は、イオンチャネルあるいはその関連タンパク質が原因で起こる疾患の総称である。チャネル遺伝子の変異による先天性のものと、薬剤や自己免疫疾患等で起こる後天性のものが存在する。特に電位依存性のイオンチャネルに関しては、神経細胞や筋細胞などの興奮性を制御する役割を担っているため、これらのイオンチャネルの異常は、てんかんや不整脈などの興奮性異常が生じる疾患につながる。チャネル病が起こる原因を理解するためには、原因である遺伝子とその変異を同定することはもちろん不可欠であるが、発現系によりそれら変異体の電気生理学的性質の変化を調べることで、チャネル病特有の原因、たとえば開閉の電位依存性の変化や、不活性化の異常など、より深いレベルで原因を解明することも可能である。近年では患者から作成したiPS細胞を心筋細胞などに分化させることで、遺伝子異常が活動電位等の電気的性質にどのような影響を与えるかということまで解析が可能になりつつある。
チャネル病とは
チャネル病はイオンチャネルあるいはその関連タンパク質が原因で起こる疾患の総称である。イオンチャネルとは膜タンパク質の一種であり、特定の種類のイオンを通すことで細胞の電気的活動を担っている[1]。そのため、興奮性細胞によって構成される脳神経系、心臓、骨格筋等におけるチャネル病の例が多数報告されている。あるいは腎臓や肺などでイオンの輸送が阻害されることによって起こるチャネル病なども知られている。イオンチャネルが身体のさまざまな部位で重要な役割を果たしていることから、チャネル病もさまざまな臓器において起こりうる。
チャネル病にはアミノ酸の変異等、先天的な原因によって起こるものと、免疫疾患や薬剤誘発性等、後天的な原因によるものとに大別される。いずれの場合においても、単にイオンチャネルとしての機能が欠損するもの、すなわちイオン電流がなくなる、あるいは電流量が減少してしまうことが原因の場合もあれば、イオンチャネルの生物物理学的な性質が変わってしまっている場合もある。前者としては、イオンを通すイオン選択性フィルターの性質が変わることでイオンが通りにくくなってしまったり、あるいは細胞膜への輸送(トラフィッキング)への影響で、細胞膜上で機能しているイオンチャネルの量(発現量)が減ってしまったりするケースが考えられる。後者としては、例えば電位依存性のイオンチャネルの場合、その活性化の電位依存性が変化すること、あるいは不活性化するイオンチャネルにおいて不活性化の性質が変化することなどが考えられる。
疾患の原因であるアミノ酸の変異が同定できれば、哺乳類培養細胞等の発現系に変異を導入したイオンチャネルを発現させ、電気生理学的手法もしくは細胞生物学的手法により機能解析をすることで、変異によって生じたイオンチャネル機能もしくは発現量の変化と、それによる疾患の発生メカニズムを明らかにすることができる。近年はチャネル病の患者から作成されたiPS細胞を用いた機能解析も始まっており、この流れは今後ますます加速していくと思われる[2][3]。
以下、興奮性細胞である神経系、心筋、骨格筋のチャネル病を中心に代表的なチャネル病の例を挙げる。しかしながら、イオンチャネルの遺伝子数と発現部位の多様性を考えれば、下記の例以外にも多くのチャネル病が存在し、今後も発見・同定されていくのではないかと思われる。また最近の総説として、神経系のチャネル病については2010年6月1日号にJournal of Physiologyが、チャネル病全般については2010年7月号にPflügers Archivがそれぞれ特集号を出版しているので、そちらも参照されたい[4][5]。
脳・神経系のチャネル病
脳・神経系では、神経細胞がネットワークを張り巡らせ、その電気的活動を担っている。神経細胞の電気的活動は、電位依存性ナトリウムチャネル(NaV)、電位依存性カリウムチャネル(KV)、電位依存性カルシウムチャネル(CaV)などによって担われている。したがって、これらのイオンチャネルに異常が生じると、てんかんに代表される脳神経系のチャネル病につながる。
電位依存性ナトリウムチャネルの異常
電位依存性ナトリウムチャネルが原因となる中枢神経系の異常としては、熱性けいれんプラス (GEFS+; generalized epilepsy with febrile seizures plus)とよばれる家族性のてんかんが知られているが、これは電位依存性ナトリウムチャネル遺伝子のうちのNaV1.1 (SCNA1),NaV1.2 (SCNA2)、あるいはその修飾サブユニットであるNaβ1 (SCNB1)に異常が生じることで引き起こされる[6][7]。電位依存性ナトリウムチャネルにおいては、その不活性化と呼ばれる性質が神経細胞の興奮性の制御に重要である。この疾患においては、アミノ酸変異によって不活性化の性質が不完全になっており、ナトリウムチャネルが開きやすい状態にあることが神経細胞の過興奮につながり、てんかん発作を引き起こすと考えられる。またより重度な乳児重症ミオクロニーてんかんにおいても、NaV1.1がその原因遺伝子であることが判明している[8]。
電位依存性カリウムチャネルの異常
電位依存性カリウムチャネルは神経細胞の電気的活動を鎮める方向に働くので、これらのチャネルの電流が減ると、やはり過興奮となり、てんかんなどの疾患の原因となる。軸索起始部 (axon initial segment)に存在するKCNQ2とKCNQ3は、ヘテロ四量体としてMチャネルと呼ばれるイオンチャネルを構成する。比較的活性化の閾値が低く、静止膜電位近くで開くことで神経細胞の膜興奮性を制御していると考えられるが、どちらも良性家族性新生児痙攣と呼ばれる疾患の原因遺伝子である[9][10][11]。
Gタンパク質結合型内向き整流性カリウムチャネルの異常
Weaverマウスと呼ばれるマウスは小脳形成に異常があり、重篤な小脳失調症状を示す。このマウスではGタンパク質結合型内向き整流性カリウムチャネルGIRK2のポア領域の点変異によることがあきらかとなっている。これは発生過程での静止膜電位の異常が神経の形態形成不全を引き起こした結果であるが、これもカリウムチャネルのチャネル病の一種である。
電位依存性カルシウムチャネルの異常
電位依存性カルシウムチャネルは、それぞれのサブタイプが、細胞体、神経終末、樹状突起などに局在して機能を果たしている。この中で、P/Q型カルシウムチャネルとしても知られるCaV2.1(CACNA1A)は、シナプス前終末での神経伝達物質放出に関わるイオンチャネルであるが、家族性片頭痛、反復発作性失調症2型 (EA2)、脊髄小脳失調症6型 (SCA6)といった、小脳に異常を呈するさまざまな神経疾患に関わっていることも知られている。
心臓のチャネル病
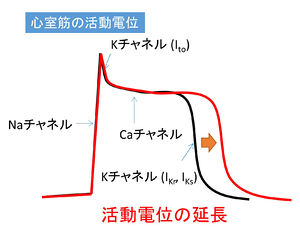
例えばカリウム電流が減少すると、脱分極後の再分極が遅れるために心室筋活動電位の延長(赤線)が起きる。
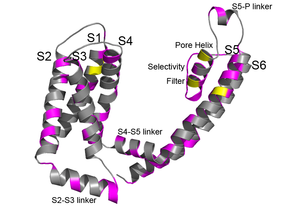
ここでは1分子のみを表示している。構造はKCNQ1の開状態モデルを使用[12]。
心臓の収縮と弛緩は心筋細胞の活動電位によって制御されている。そしてその活動電位はやはり、各種のイオンチャネルによって制御されている。たとえば心室筋細胞の活動電位は電位依存性ナトリウムチャネル、電位依存性カルシウムチャネルおよび数種類のカリウムチャネルによって形成されている。ナトリウムチャネルあるいはカルシウムチャネルの機能亢進、あるいはカリウムチャネルの機能抑制が起こると、活動電位の延長が起こり、心電図のQT時間が延長するQT延長症候群となる(図1、表1)。これは不整脈の一種であり、心室細動を誘発するなど、最悪突然死につながる可能性もある。QT延長症候群と比べると頻度は低いが、カリウムチャネルの機能亢進によって活動電位が短縮し、心電図のQT時間が短縮するQT短縮症候群も心臓のチャネル病として知られている(表2)。
電位依存性ナトリウムチャネルの異常
ナトリウムチャネルが原因のQT延長症候群は3型 (LQT3)であり、NaV1.5 (SCN5A)がその原因遺伝子である。LQT3ではナトリウム電流の不活性化が不完全になり、持続性の電流が多くなることで脱分極の状態を長くする。その他ナトリウムチャネル関連タンパク質として、ナトリウムチャネルを細胞膜の特定の場所にアンカーするアンキリンB (LQT4)、ナトリウムチャネルのβサブユニット SCN4B (LQT10)がQT延長症候群の原因遺伝子として同定されている。一方、同じNaV1.5が原因であるブルガダ症候群では、逆にNaV1.5の機能が低下する変異が原因である。活動電位が短縮し、心内膜から心外膜にわたって再分極の状態がばらつくことで、心室細動を起こしやすい状態になっていると考えられる。
電位依存性カルシウムチャネルの異常
カルシウムチャネルが原因のQT延長症候群はL型カルシウムチャネルの一種であるCaV1.2 (CACNA1C)の機能亢進が原因のLQT8である。CaV1.2のG406R変異は電位依存性不活性化を著しく弱くし、そのためカルシウム電流が亢進する。この場合、QT延長のみならず合指等の形成不全、免疫不全、自閉症などさまざまな症状を呈し、Timothy症候群と名付けられている[2][13]。このことは、CaV1.2カルシウムチャネルが、心臓のみならず、体中のさまざまな部位、そして発生過程も含めたさまざまなステージで重要な働きを担っていることを示している。
電位依存性カリウムチャネルの異常
前述のとおり、心臓では複数種類のカリウムチャネルが心臓の興奮性制御に寄与しており、QT延長症候群にも複数種類のカリウムチャネルが原因遺伝子として報告されている。先天性QT延長症候群の中でもっとも高い頻度で報告されているのは、KCNQ1チャネルが原因のLQT1と、hERGチャネルが原因のLQT2である[14][15][16][17][18]。どちらも電位依存性カリウムチャネルαサブユニットをコードしており、両者でLQTとして遺伝子診断される患者全体の80%程度を占めている。それぞれのイオンチャネルからはこれまでに数十を超える変異部位が見つかっており、ほとんどどの部位に問題が生じても、疾患を生じうることがわかる(図2)。
これらカリウムチャネルのβサブユニットであるKCNE1 (LQT5の原因遺伝子)、KCNE2 (LQT6の原因遺伝子)、KCNQ1結合タンパク質であるAKAP-9 (LQT11の原因遺伝子)もQT延長症候群原因遺伝子である。これらLQTは常染色体優性遺伝であり、Romano-Ward症候群とも分類される。
一方先天性の難聴を伴う常染色体劣性遺伝のものはJervell and Lange-Nielsen症候群 (JLN)と呼ばれて区別される。JLN1としてKCNQ1、JLN2としてKCNE1が知られている。
内向き整流性カリウムチャネルの異常
内向き整流性カリウムチャネルKir2.1 (KCNJ2)もQT延長症候群の原因遺伝子(LQT7)であるが、さらに周期性四肢麻痺、形態異常などを併発し、Andersen症候群と呼ばれる。Timothy症候群と同様、Kir2.1チャネルが、できあがった機能に必要なだけではなく、発生過程・形態形成においても重要な役割を果たしていることを示している。
hERGチャネル (SQT1)、KCNQ1チャネル (SQT2)、Kir2.1チャネル (SQT3)については、それぞれ変異による機能亢進でQT短縮症候群を起こすことも知られている。上述の通り、活動電位が短縮し、心電図のQT時間が短縮する不整脈の一種である(表2)。
| 型 | 原因遺伝子 | コードするタンパク質 |
|---|---|---|
| LQT1 | KCNQ1 | 電位依存性カリウムチャネル |
| LQT2 | KCNH2 | 電位依存性カリウムチャネル |
| LQT3 | SCN5A | 電位依存性ナトリウムチャネル |
| LQT4 | ANK2 | アンキリンB |
| LQT5 | KCNE1 | カリウムチャネル修飾サブユニット(βサブユニット) |
| LQT6 | KCNE2 | カリウムチャネル修飾サブユニット |
| LQT7 | KCNJ2 | 内向き整流性カリウムチャネル |
| LQT8 | CACNA1C | 電位依存性カルシウムチャネル |
| LQT9 | CAV3 | カベオリン |
| LQT10 | SCN4B | ナトリウムチャネル修飾サブユニット(βサブユニット) |
| LQT11 | AKAP9 | Aキナーゼアンカータンパク質 |
| LQT12 | SNTA1 | シントロフィン |
| LQT13 | GIRK4 | Gタンパク質活性化カリウムチャネル |
| 型 | 原因遺伝子 | コードするタンパク質 |
|---|---|---|
| SQT1 | KCNH2 | 電位依存性カリウムチャネル |
| SQT2 | KCNQ1 | 電位依存性カリウムチャネル |
| SQT3 | KCNJ2 | 内向き整流性カリウムチャネル |
骨格筋のチャネル病
周期性四肢麻痺は、定期的に全身の筋力が失われる疾患で、多くの場合は遺伝性疾患である。血漿のカリウムイオン濃度の低下によって誘発される低カリウム性周期性四肢麻痺については、骨格筋のL型電位依存性カルシウムチャネル CaV1.1 (CACNA1S)、電位依存性ナトリウムチャネルNaV1.4 (SCN4A)が原因遺伝子として同定されている。CaV1.1については、細胞膜電位を感じる電位センサー中の正電荷を持つアミノ酸が変異することで脱分極に反応しにくいカルシウムチャネルとなり、結果として筋肉がうまく収縮することができなくなり麻痺となる。
一方まれではあるが、血漿の高カリウムイオン濃度で誘発される高カリウム性周期性四肢麻痺も存在し、こちらはNaV1.4 (SCN4A)が原因遺伝子であると考えられている[19]。こちらはナトリウムチャネルの不活性化が不完全であるためにナトリウム電流が流れ続け、脱分極状態が続いてしまう。これによりナトリウムチャネルが不活性化状態から抜けられなくなってしまい、筋細胞の興奮性が低下してしまうことで麻痺がおこると考えられている。
ミオトニアは寒冷時に誘発される手足のこわばりを示す先天性の病気である。この場合も同様にNaV1.4 (SCN4A)が原因遺伝子であり、高カリウム性周期性四肢麻痺と同様に不活性化が不完全であるが、この場合は細胞の脱分極状態が続くことで筋肉の収縮が続いている状態になっていると考えられる。同じ不活性化の異常でも、その程度の差により、麻痺になる場合とミオトニアになる場合に分かれると考えられる。
その他のチャネル病
嚢胞性線維症は、欧米白人に高頻度で見られる遺伝性疾患で、塩素イオンチャネルの一種であるCFTRの異常によるものである。塩素イオンの輸送の異常に伴って水分の輸送にも以上をきたし、外分泌腺粘液の粘度が高くなることで各器官の管に詰まりを起こし、呼吸困難や消化機能の低下を引き起こす。
バーター症候群は腎臓でのNa+とCl-の再吸収障害により生じる疾患であり、弱い内向き整流性カリウムチャネルであるKir1.1 (ROMK1)、塩素イオンチャネルであるCLC-K2がその原因遺伝子として同定されている。塩素イオンチャネルはその他にCLC-K1が腎性尿崩症、CLC-5がデント病と呼ばれる疾患の原因遺伝子であることが知られている。
関連項目
参考文献
- ↑ 久保義弘、岡村康司
標準生理学 第8版 第4章 膜興奮性とイオンチャネル
医学書院(東京):2014 - ↑ 2.0 2.1
Yazawa, M., Hsueh, B., Jia, X., Pasca, A.M., Bernstein, J.A., Hallmayer, J., & Dolmetsch, R.E. (2011).
Using induced pluripotent stem cells to investigate cardiac phenotypes in Timothy syndrome. Nature, 471(7337), 230-4. [PubMed:21307850] [PMC] [WorldCat] [DOI] - ↑
Terrenoire, C., Wang, K., Tung, K.W., Chung, W.K., Pass, R.H., Lu, J.T., ..., & Kass, R.S. (2013).
Induced pluripotent stem cells used to reveal drug actions in a long QT syndrome family with complex genetics. The Journal of general physiology, 141(1), 61-72. [PubMed:23277474] [PMC] [WorldCat] [DOI] - ↑
Robertson, B. (2010).
Introduction to the Journal of Physiology's special issue on neurological channelopathies. The Journal of physiology, 588(Pt 11), 1821-2. [PubMed:20516349] [PMC] [WorldCat] [DOI] - ↑
Nilius, B. (2010).
A Special Issue on channelopathies. Pflugers Archiv : European journal of physiology, 460(2), 221-2. [PubMed:20238123] [WorldCat] [DOI] - ↑
Wallace, R.H., Wang, D.W., Singh, R., Scheffer, I.E., George, A.L., Phillips, H.A., ..., & Mulley, J.C. (1998).
Febrile seizures and generalized epilepsy associated with a mutation in the Na+-channel beta1 subunit gene SCN1B. Nature genetics, 19(4), 366-70. [PubMed:9697698] [WorldCat] [DOI] - ↑
Escayg, A., MacDonald, B.T., Meisler, M.H., Baulac, S., Huberfeld, G., An-Gourfinkel, I., ..., & Malafosse, A. (2000).
Mutations of SCN1A, encoding a neuronal sodium channel, in two families with GEFS+2. Nature genetics, 24(4), 343-5. [PubMed:10742094] [WorldCat] [DOI] - ↑
Claes, L., Del-Favero, J., Ceulemans, B., Lagae, L., Van Broeckhoven, C., & De Jonghe, P. (2001).
De novo mutations in the sodium-channel gene SCN1A cause severe myoclonic epilepsy of infancy. American journal of human genetics, 68(6), 1327-32. [PubMed:11359211] [PMC] [WorldCat] [DOI] - ↑
Biervert, C., Schroeder, B.C., Kubisch, C., Berkovic, S.F., Propping, P., Jentsch, T.J., & Steinlein, O.K. (1998).
A potassium channel mutation in neonatal human epilepsy. Science (New York, N.Y.), 279(5349), 403-6. [PubMed:9430594] [WorldCat] [DOI] - ↑
Schroeder, B.C., Kubisch, C., Stein, V., & Jentsch, T.J. (1998).
Moderate loss of function of cyclic-AMP-modulated KCNQ2/KCNQ3 K+ channels causes epilepsy. Nature, 396(6712), 687-90. [PubMed:9872318] [WorldCat] [DOI] - ↑
Wang, H.S., Pan, Z., Shi, W., Brown, B.S., Wymore, R.S., Cohen, I.S., ..., & McKinnon, D. (1998).
KCNQ2 and KCNQ3 potassium channel subunits: molecular correlates of the M-channel. Science (New York, N.Y.), 282(5395), 1890-3. [PubMed:9836639] [WorldCat] [DOI] - ↑
Smith, J.A., Vanoye, C.G., George, A.L., Meiler, J., & Sanders, C.R. (2007).
Structural models for the KCNQ1 voltage-gated potassium channel. Biochemistry, 46(49), 14141-52. [PubMed:17999538] [PMC] [WorldCat] [DOI] - ↑
Splawski, I., Timothy, K.W., Sharpe, L.M., Decher, N., Kumar, P., Bloise, R., ..., & Keating, M.T. (2004).
Ca(V)1.2 calcium channel dysfunction causes a multisystem disorder including arrhythmia and autism. Cell, 119(1), 19-31. [PubMed:15454078] [WorldCat] [DOI] - ↑
Sanguinetti, M.C., Jiang, C., Curran, M.E., & Keating, M.T. (1995).
A mechanistic link between an inherited and an acquired cardiac arrhythmia: HERG encodes the IKr potassium channel. Cell, 81(2), 299-307. [PubMed:7736582] [WorldCat] [DOI] - ↑
Curran, M.E., Splawski, I., Timothy, K.W., Vincent, G.M., Green, E.D., & Keating, M.T. (1995).
A molecular basis for cardiac arrhythmia: HERG mutations cause long QT syndrome. Cell, 80(5), 795-803. [PubMed:7889573] [WorldCat] [DOI] - ↑
Wang, Q., Curran, M.E., Splawski, I., Burn, T.C., Millholland, J.M., VanRaay, T.J., ..., & Keating, M.T. (1996).
Positional cloning of a novel potassium channel gene: KVLQT1 mutations cause cardiac arrhythmias. Nature genetics, 12(1), 17-23. [PubMed:8528244] [WorldCat] [DOI] - ↑
Barhanin, J., Lesage, F., Guillemare, E., Fink, M., Lazdunski, M., & Romey, G. (1996).
K(V)LQT1 and lsK (minK) proteins associate to form the I(Ks) cardiac potassium current. Nature, 384(6604), 78-80. [PubMed:8900282] [WorldCat] [DOI] - ↑
Sanguinetti, M.C., Curran, M.E., Zou, A., Shen, J., Spector, P.S., Atkinson, D.L., & Keating, M.T. (1996).
Coassembly of K(V)LQT1 and minK (IsK) proteins to form cardiac I(Ks) potassium channel. Nature, 384(6604), 80-3. [PubMed:8900283] [WorldCat] [DOI] - ↑
Catterall, W.A. (2010).
Ion channel voltage sensors: structure, function, and pathophysiology. Neuron, 67(6), 915-28. [PubMed:20869590] [PMC] [WorldCat] [DOI]