「周期性四肢麻痺」の版間の差分
細 →病態生理 |
細 →病態生理 |
(相違点なし)
| |
2021年1月27日 (水) 10:59時点における最新版
久保田智哉、高橋正紀
大阪大学大学院医学系研究科 生体病態情報科学講座 臨床神経生理学
DOI:10.14931/bsd.9687 原稿受付日:2021年1月15日 原稿完成日:2021年1月24日
担当編集委員:山中 宏二(名古屋大学 環境医学研究所 病態神経科学)
英:periodic paralysis 独:periodische Lähmung 仏:paralysie périodique
周期性四肢麻痺は、一過性の筋力低下・麻痺発作を繰り返す疾患群であり、麻痺発作時の血清カリウムの値により、大きく高カリウム性周期性四肢麻痺(Hyperkalemic periodic paralysis:HyperPP)、低カリウム性周期性四肢麻痺(Hypokalemic periodic paralysis:HypoPP)とAndersen-Tawil症候群(Andersen-Tawil Syndrome: ATS)とに大別される。HyperPPは、遺伝性で、骨格筋型電位依存性ナトリウムチャネルNav1.4のαサブユニットをコードするSCN4A遺伝子の変異により発症する。変異Nav1.4チャネル機能解析を通じて、病態メカニズムの理解が進んだ。一方、低カリウム性周期性四肢麻痺は、遺伝性、二次性、孤発性など多岐にわたるが、もっとも頻度の高いのは二次性の甲状腺機能亢進症に伴うもの(thyrotoxic periodic paralysis:TPP)である。病態研究は遺伝性を中心に進んでいるが、治療法の確立していない希少難治性筋疾患の一つである。
周期性四肢麻痺とは
周期性四肢麻痺とは、一過性の筋力低下・麻痺発作を繰り返す希少難治性筋疾患の一つである。臨床的には、麻痺発作中の血清カリウム値により、高カリウム性周期性四肢麻痺(hyperkalemic periodic paralysis:HyperPP)と低カリウム性周期性四肢麻痺(hypokalemic periodic paralysis:HypoPP)とに大別される[1][2][3]。高カリウム性周期性四肢麻痺、低カリウム性周期性四肢麻痺のほか、不整脈や小奇形を伴うAndersen-Tawil症候群(Andersen-Tawil Syndrome: ATS)がある。Andersen-Tawil症候群の場合、麻痺発作・不整脈・小奇形の3徴がそろわない不全型も多く、麻痺発作を合併する場合の発作時血清カリウム値は一定しない(表1)[3]。
| 高カリウム性周期性四肢麻痺(Hyperkalemic periodic paralysis: HyperPP) | |
| 遺伝性 | SCN4A遺伝子変異による常染色体優性遺伝 |
| 低カリウム性周期性四肢麻痺(Hypokalemic periodic paralysis: HypoPP) | |
| 遺伝性 | 1型: CACNA1A遺伝子(常染色体優性遺伝) |
| 2型: SCN4A遺伝子(常染色体優性遺伝) | |
| 孤発性 | 孤発性周期性四肢麻痺(sporadic periodic paralysis:SPP):疾患感受性一塩基多型が指摘されている。 |
| 二次性 | 甲状腺中毒性周期性四肢麻痺(thyrotoxic periodic paralysis: TPP):甲状腺機能亢進症に伴うもの |
| Andersen-Tawil症候群(Andersen-Tawil syndrome: ATS) | |
| 遺伝性 | KCNJ2遺伝子(常染色体優性遺伝) |
| KCNJ5遺伝子(常染色体優性遺伝) | |
高カリウム性周期性四肢麻痺は、骨格筋型電位依存性ナトリウムチャネル(Nav1.4)のαサブユニットをコードするSCN4A遺伝子の変異による遺伝性疾患である。ヘテロ接合性変異がほとんどであり、常染色体顕性(優性)遺伝形式を示す。
一方、低カリウム性周期性四肢麻痺の中には、骨格筋に発現するチャネル遺伝子の異常による遺伝性(一次性)と、内科的疾患に伴う二次性とがある。一次性には、骨格筋型電位依存性カルシウムチャネル(Cav1.1)のαサブユニットをコードするCACNA1S遺伝子の変異による低カリウム性周期性四肢麻痺1型と、SCN4A遺伝子の変異による低カリウム性周期性四肢麻痺2型とが知られている。いずれもヘテロ接合性変異がほとんどで、常染色体顕性(優性)遺伝形式を示す[2]。欧米では、1型が遺伝性低カリウム性周期性四肢麻痺の60%、2型が20%を占めるといわれている[2]が、本邦での調査では、2型の割合が多い傾向が示されている[4]。遺伝性の残りの20%については原因不明であるが、近年、上記2つの遺伝子以外にも原因遺伝子として提唱されるものが報告されてきている(後述)。
また、二次性については、本邦では甲状腺機能亢進症に伴う低カリウム性周期性四肢麻痺(thyrotoxic periodic paralysis:TPP)がほとんどであり、本邦におけるすべての周期性四肢麻痺の中で最多である。また、原因遺伝子に異常を認めず、内科的疾患の合併も認めない孤発性周期性四肢麻痺(sporadic periodic paralysis:SPP)も存在する[5]。
Andersen-Tawil症候群は、遅延整流性カリウムチャネルKir2.1をコードするKCNJ2遺伝子の異常がほとんどである[2][6]。一部、Kir3.4をコードするKCNJ5遺伝子の変異例が報告されている[7][8]。
疫学
欧米では、高カリウム性周期性四肢麻痺は10万人当たり0.5人、低カリウム性周期性四肢麻痺は10万人当たり1人、Andersen-Tawil症候群は10万人当たり0.1人と言われるが、各国の調査でばらつきがあり、一定していない[2]。
本邦での正確な疫学調査はない。遺伝性周期性四肢麻痺全体は、遺伝子解析施行機関で把握する症例からの推測で1000人程度と推定されている。遺伝性周期性四肢麻痺のみが、国の指定難病である。上述のとおり、一般臨床では、TPPが最も多い。
臨床症状
高カリウム性周期性四肢麻痺
高カリウム血症を伴う麻痺発作を繰り返す疾患である。初回発作は通常20歳以下である。カリウムを多く含む果物や食事、運動後の休息、空腹、気温の低下、妊娠などが誘因となる。誘因から麻痺発作発現までの時間は数時間以内と比較的短く、麻痺発作の時間は、数十分から数時間で24時間を超えることはすくない。麻痺発作のない間欠期には、筋のこわばりなどを訴えることもある[2]。
低カリウム性周期性四肢麻痺
低カリウム血症を伴う麻痺発作を繰り返す疾患である。思春期頃に初回発作がみられることが多いが、1歳や30歳代の報告もある。炭水化物の摂取や運動後の休息などが誘因となる。高カリウム性周期性四肢麻痺に比べて、誘因から麻痺発作出現までの時間も長く、数時間~半日のことがある。運動の後、夜遅くに米飯・麺類などを大量に食べ、夜中あるいは起床時に麻痺に気づき、午後にようやく収まるというエピソードが典型的である。麻痺発作も高カリウム性周期性四肢麻痺に比べて長く、半日から数日、場合によっては1週間ほど筋力低下が続くこともある[2]。女性は軽症であることが多い。また男性も中年以降発作回数は減ることが多い。
Andersen-Tawil症候群
麻痺発作・不整脈・小奇形を3徴とする。KCNJ2遺伝子の変異による症例の60~80%に典型的3徴が見られるといわれるが、未診断のまま潜在している不全型も多いと考えられる。不整脈は、心室性不整脈、QT延長、U波の増高などが見られる。致死性の不整脈発作を起こすことがあり、特に血清カリウム値が変動しうる麻痺発作時には、心症状にも注意を要する。麻痺発作時の血清カリウムの変動は、高カリウム、低カリウム、正常範囲といずれのパターンも取りうるとされる。小奇形は、耳介低位、眼間解離、小顎、小指斜指・合指、低身長、側弯、幅広い額などがあり、診断に有用である[2][6]。
診断・検査
周期性四肢麻痺全般において、発作間欠期では症状がはっきりしないことが多い。
高カリウム性周期性四肢麻痺においては、発作間欠期に筋のこわばりを訴えることがある。それを反映して、血液検査において筋逸脱酵素であるクレアチンキナーゼ(creatine kinase:CK)が高値を示すことがある。また、発作極期においては血清カリウム値が異常高値を示す。
低カリウム性周期性四肢麻痺では、発作間欠期は無症状であることが多い。発作時には血清カリウム値が異常低値を示す。低カリウム性周期性四肢麻痺では、二次性低カリウム性周期性四肢麻痺の鑑別が治療の点からも重要である。
Andersen-Tawil症候群の場合は、不整脈や手指小奇形・低位耳介などが診断を疑うきっかけになることがあり、家族歴・視診・心電図などが有用である。
臨床神経生理検査の針筋電図によるミオトニー放電の有無の確認、さらに神経伝導検査を応用したExercise testが、その病型予測などに有用と言われるが、感度・特異度ともに60%前後と低い[9]。最終診断は遺伝的解析による。
本邦では、厚生労働科学研究事業「希少難治性筋疾患に関する調査研究班」により策定された診断基準および手引きがある(外部リンク参照)。
治療
治療は、発作間欠期の治療と急性期治療に大別される[2]。
発作間欠期
高カリウム性周期性四肢麻痺において、ミオトニーや筋のこわばりが強いことはまれではあるが、痛みを伴うミオトニーなどにはメキシレチンが有効とされる(保険適応外)。麻痺発作抑制に対しては、血清カリウム値を低くするループ利尿剤などが用いられる。低カリウム性周期性四肢麻痺において、血清カリウム値を維持するために、経口カリウム製剤の内服などが発作抑制に有効とされる。いずれの周期性四肢麻痺の発作抑制にもアセタゾラミドが使用される事が多く(保険適応外)、有効な症例が一部にあるが、悪化する例もある。ほか、ジクロフェナミドが周期性四肢麻痺の発作抑制に有効であることが確認され、米国FDAの承認をうけたが、日本では薬として上市されていない。
発作急性期
Andersen-Tawil症候群、高カリウム性周期性四肢麻痺、低カリウム性周期性四肢麻痺のいずれの場合も麻痺発作極期の血清カリウム値の値により、急性期治療が異なる。血清カリウム値異常による、心伝導異常・致死性不整脈の誘発が生命予後に直結するため、心電図モニターとともに血清カリウム値の測定とその補正を緩やかに行う事が重要である。一般に呼吸筋障害は起こさないとされる。二次性低カリウム性周期性四肢麻痺のうち、特に甲状腺機能亢進症の合併が判明した場合には、βブロッカーなどによる甲状腺機能亢進症の治療を開始することで、麻痺の改善が得られる。
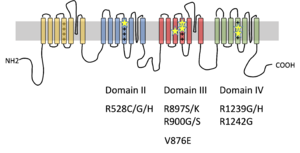
遺伝性低カリウム性周期性四肢麻痺1型(HypoPP1)のCACNA1S遺伝子の変異箇所を星印で示す。多くは電位感受性ドメイン(VSD)のセグメント4にあるアルギニンが他のアミノ酸に変化している。例外的に、p.V876Eの報告があるが、他の変異と同じく、Gating pore電流が流れることが証明されている。
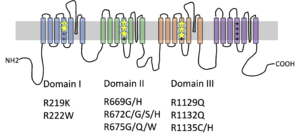
遺伝性低カリウム性周期性四肢麻痺2型(HypoPP2)のSCN4A遺伝子の変異箇所を星印で示す。多くは電位感受性ドメイン(VSD)のセグメント4にあるアルギニンが他のアミノ酸に変化し、Gating pore電流が流れることが証明されている。
病態生理
高カリウム性周期性四肢麻痺
Nav1.4のαサブユニットをコードするSCN4A遺伝子のヘテロ接合性変異による。様々な変異が報告されているが、中でもp.T704Mとp.M1592Vが頻度の高い変異として知られており、これらの変異Nav1.4チャネルは、persistent current(完全に不活化されないわずかな持続電流)の増大などの機能獲得gain of function effectを呈し、筋細胞膜の興奮性を異常亢進させることで、脱分極性麻痺にいたることが、チャネル機能解析を基にしたシミュレーションモデルで提唱されている[1][3]。
低カリウム性周期性四肢麻痺
Cav1.1のαサブユニットをコードするCACNA1S遺伝子のヘテロ接合性変異による1型と、Nav1.4のαサブユニットをコードするSCN4A遺伝子のヘテロ接合性変異による2型とがある。両者の低カリウム性周期性四肢麻痺変異をもつチャネル機能・構造上の共通点として、いずれもチャネルの電位感受性ドメイン(voltage sensing domain: VSD)内にあるセグメント4のアルギニンがほかのアミノ酸に変異することが注目されてきた(図1、2)。このセグメント4にあるアルギニンは、3アミノ酸ごとに並び、チャネルの電位感受性の中心的役割を担う。
細胞物理学的手法を用いた実験により、低カリウム性周期性四肢麻痺変異をもつチャネルは、gating pore電流と呼ばれる電位依存性漏洩電流をもつことが証明され、低カリウム性周期性四肢麻痺の病態メカニズムの中心と考えられている[10][11]。しかしながら、低カリウム性周期性四肢麻痺にみられる脱分極性麻痺を引き起こすにはgating pore電流自体が小さすぎることなどが指摘され、gating pore電流の発生から麻痺に至るメカニズムは未だ仮説段階である[12]。さらに、典型的低カリウム性周期性四肢麻痺を示す症例においてgating pore電流を欠く症例の報告[13]や、CACNA1S遺伝子とSCN4A遺伝子以外にも、リアノジン受容体1型をコードするRYR1遺伝子内のヘテロ接合性変異[14]、Na+-K+-ATPase isoform2をコードするATP1A2遺伝子内のヘテロ接合性変異[15]、ミトコンドリアDNA内のMT-ATP6/8遺伝子のホモ接合性変異[16]など、低カリウム性周期性四肢麻痺は複数の病態が混在している可能性が示唆されている。また、原因遺伝子に異常を認めず、内科的疾患の合併も認めない孤発性周期性四肢麻痺(SPP)においては、近年、アジアを中心として疾患感受性一塩基多型の報告があり、何らかの遺伝学的背景が発症に関わっていることが示唆される[5]。
Andersen-Tawil症候群
骨格筋に豊富に発現する内向き整流性カリウムチャネルKir2.1をコードするKCNJ2遺伝子の変異により発症する。変異チャネルは、機能喪失loss of functionを示し、筋細胞膜のカリウムコンダクタンスを低下させることで、脱分極性麻痺をもたらすとされる。その機能変化にはPIP2感受性の変化が関与していることが示されている[17][18]。近年、報告されたGタンパク共役型チャネルであるKir3.4をコードするKCNJ5遺伝子の変異例が報告されたが、これらはKir2.1とヘテロテトラマーを形成する際に、ドミナントネガティブ効果によるKir2.1の機能喪失をもたらすことで発症が説明されている[7]。
外部リンク
参考文献
- ↑ 1.0 1.1
Cannon, S.C. (2015).
Channelopathies of skeletal muscle excitability. Comprehensive Physiology, 5(2), 761-90. [PubMed:25880512] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 2.8
Statland, J.M., Fontaine, B., Hanna, M.G., Johnson, N.E., Kissel, J.T., Sansone, V.A., ..., & Griggs, R.C. (2018).
Review of the Diagnosis and Treatment of Periodic Paralysis. Muscle & nerve, 57(4), 522-530. [PubMed:29125635] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Cannon, S.C. (2006).
Pathomechanisms in channelopathies of skeletal muscle and brain. Annual review of neuroscience, 29, 387-415. [PubMed:16776591] [WorldCat] [DOI] - ↑
Sasaki, R., Nakaza, M., Furuta, M., Fujino, H., Kubota, T., & Takahashi, M.P. (2020).
Mutation spectrum and health status in skeletal muscle channelopathies in Japan. Neuromuscular disorders : NMD, 30(7), 546-553. [PubMed:32660787] [WorldCat] [DOI] - ↑ 5.0 5.1
Nakaza, M., Kitamura, Y., Furuta, M., Kubota, T., Sasaki, R., & Takahashi, M.P. (2020).
Analysis of the genetic background associated with sporadic periodic paralysis in Japanese patients. Journal of the neurological sciences, 412, 116795. [PubMed:32234253] [WorldCat] [DOI] - ↑ 6.0 6.1
Venance, S.L., Cannon, S.C., Fialho, D., Fontaine, B., Hanna, M.G., Ptacek, L.J., ..., & CINCH investigators (2006).
The primary periodic paralyses: diagnosis, pathogenesis and treatment. Brain : a journal of neurology, 129(Pt 1), 8-17. [PubMed:16195244] [WorldCat] [DOI] - ↑ 7.0 7.1
Kokunai, Y., Nakata, T., Furuta, M., Sakata, S., Kimura, H., Aiba, T., ..., & Takahashi, M.P. (2014).
A Kir3.4 mutation causes Andersen-Tawil syndrome by an inhibitory effect on Kir2.1. Neurology, 82(12), 1058-64. [PubMed:24574546] [WorldCat] [DOI] - ↑
Hiraide, T., Fukumura, S., Yamamoto, A., Nakashima, M., & Saitsu, H. (2020).
Familial periodic paralysis associated with a rare KCNJ5 variant that supposed to have incomplete penetrance. Brain & development. [PubMed:33199157] [WorldCat] [DOI] - ↑
Fournier, E., Arzel, M., Sternberg, D., Vicart, S., Laforet, P., Eymard, B., ..., & Fontaine, B. (2004).
Electromyography guides toward subgroups of mutations in muscle channelopathies. Annals of neurology, 56(5), 650-61. [PubMed:15389891] [WorldCat] [DOI] - ↑
Sokolov, S., Scheuer, T., & Catterall, W.A. (2007).
Gating pore current in an inherited ion channelopathy. Nature, 446(7131), 76-8. [PubMed:17330043] [WorldCat] [DOI] - ↑
Struyk, A.F., Markin, V.S., Francis, D., & Cannon, S.C. (2008).
Gating pore currents in DIIS4 mutations of NaV1.4 associated with periodic paralysis: saturation of ion flux and implications for disease pathogenesis. The Journal of general physiology, 132(4), 447-64. [PubMed:18824591] [PMC] [WorldCat] [DOI] - ↑
Cannon, S.C. (2010).
Voltage-sensor mutations in channelopathies of skeletal muscle. The Journal of physiology, 588(Pt 11), 1887-95. [PubMed:20156847] [PMC] [WorldCat] [DOI] - ↑
Kubota, T., Wu, F., Vicart, S., Nakaza, M., Sternberg, D., Watanabe, D., ..., & Takahashi, M.P. (2020).
Hypokalaemic periodic paralysis with a charge-retaining substitution in the voltage sensor. Brain communications, 2(2), fcaa103. [PubMed:33005891] [PMC] [WorldCat] [DOI] - ↑
Matthews, E., Neuwirth, C., Jaffer, F., Scalco, R.S., Fialho, D., Parton, M., ..., & Hanna, M.G. (2018).
Atypical periodic paralysis and myalgia: A novel RYR1 phenotype. Neurology, 90(5), e412-e418. [PubMed:29298851] [PMC] [WorldCat] [DOI] - ↑
Sampedro Castañeda, M., Zanoteli, E., Scalco, R.S., Scaramuzzi, V., Marques Caldas, V., Conti Reed, U., ..., & Matthews, E. (2018).
A novel ATP1A2 mutation in a patient with hypokalaemic periodic paralysis and CNS symptoms. Brain : a journal of neurology, 141(12), 3308-3318. [PubMed:30423015] [PMC] [WorldCat] [DOI] - ↑
Auré, K., Dubourg, O., Jardel, C., Clarysse, L., Sternberg, D., Fournier, E., ..., & Lombès, A. (2013).
Episodic weakness due to mitochondrial DNA MT-ATP6/8 mutations. Neurology, 81(21), 1810-8. [PubMed:24153443] [WorldCat] [DOI] - ↑
Plaster, N.M., Tawil, R., Tristani-Firouzi, M., Canún, S., Bendahhou, S., Tsunoda, A., ..., & Ptácek, L.J. (2001).
Mutations in Kir2.1 cause the developmental and episodic electrical phenotypes of Andersen's syndrome. Cell, 105(4), 511-9. [PubMed:11371347] [WorldCat] [DOI] - ↑
Handklo-Jamal, R., Meisel, E., Yakubovich, D., Vysochek, L., Beinart, R., Glikson, M., ..., & Oz, S. (2020).
Andersen-Tawil Syndrome Is Associated With Impaired PIP2 Regulation of the Potassium Channel Kir2.1. Frontiers in pharmacology, 11, 672. [PubMed:32499698] [PMC] [WorldCat] [DOI]