「ホスホリパーゼA2」の版間の差分
細 →関連項目 |
細編集の要約なし |
||
| (同じ利用者による、間の1版が非表示) | |||
| 11行目: | 11行目: | ||
[[ファイル:Murakami PLA2 Fig1.png|サムネイル|350px|'''図1. PLA2によるアラキドン酸の遊離と脂質メディエーターの産生'''<br> | [[ファイル:Murakami PLA2 Fig1.png|サムネイル|350px|'''図1. PLA2によるアラキドン酸の遊離と脂質メディエーターの産生'''<br> | ||
多くの組織や細胞において、リン脂質からアラキドン酸(AA)を選択的に切り出し脂質メディエーター(エイコサノイド)の産生に関わる主要な酵素はcPLA2αである。組織や細胞に応じて、iPLA2、sPLA2、リパーゼ(モノアシルグリセロールリパーゼ (monoacylglycerol lipase, MGL)、ジアシルグリセロールリパーゼ (diacylglycerol lipase, DGL)、脂肪細胞トリグリセリドリパーゼ(adipose triglyceride lipase, ATGL)もアラキドン酸遊離に関与し得る。]] | 多くの組織や細胞において、リン脂質からアラキドン酸(AA)を選択的に切り出し脂質メディエーター(エイコサノイド)の産生に関わる主要な酵素はcPLA2αである。組織や細胞に応じて、iPLA2、sPLA2、リパーゼ(モノアシルグリセロールリパーゼ (monoacylglycerol lipase, MGL)、ジアシルグリセロールリパーゼ (diacylglycerol lipase, DGL)、脂肪細胞トリグリセリドリパーゼ(adipose triglyceride lipase, ATGL)もアラキドン酸遊離に関与し得る。]] | ||
1980年代後半に、ヘビ毒に含まれるPLA2と構造の類似した低分子量PLA2が哺乳類の膵液とリウマチ関節炎滲出液から精製され、それぞれI型、II型PLA2と呼ばれた。1990年代初頭に、ヒト単球の細胞質から全く別の構造をもつ高分子量PLA2が同定され、低分子量PLA2を分泌性PLA2(sPLA2; secreted PLA2)、高分子量PLA2を細胞質型PLA2(cPLA2; cytosolic PLA2)と呼ぶ習慣が定着した。その後1990年代半ばに、細胞質から別の高分子量PLA2が精製されたが、cPLA2とは異なり酵素活性にCa<sup>2+</sup>を必要としないことから、Ca<sup>2+</sup>非依存性PLA2(iPLA2)と呼ばれた。その後、2000年代半ばまでに、ヒトやマウスの全ゲノム構造が明らかになるにつれて、構造的にcPLA2、iPLA2、sPLA2の特徴をそれぞれ有するアイソフォームや、このいずれにも属さない新しいタイプのPLA2が次々と同定された(サブファミリーの項目参照)。 | |||
1980〜1990年代は、プロスタグランジン(PG)やロイコトリエン(LT)などの脂質メディエーターの生合成に関わる酵素や、そのシグナル伝達に関わる受容体が次々と同定された時期でもあり、PLA2はこれらの脂質メディエーターの共通の前駆体であるアラキドン酸を膜リン脂質から遊離するシグナル酵素(アラキドン酸代謝の初発律速酵素)として注目された。現在では、プロスタグランジン、ロイコトリエンの生合成に最も密接に関わるPLA2は細胞質型PLA2のαサブタイプ(cPLA2α)であることがわかっているが、iPLA2やsPLA2、さらには中性脂質を分解するリパーゼも、状況に応じてアラキドン酸代謝に関わる('''図1''')。 | |||
==サブファミリー== | ==サブファミリー== | ||
PLA2の分類は、分子として同定された歴史的順番に沿ってI、II、III…. | PLA2の分類は、分子として同定された歴史的順番に沿ってI、II、III….と番号をつけ、さらに近縁の酵素にA、B、C…のアルファベット大文字を添える命名法(提唱者にちなんでDennis分類と呼ばれる)と、各酵素の構造と性質の類似性からサブファミリー別に分類する命名法がある。PLA2の遺伝子名は概ねDennis分類に基づくが (例;PLA2G2A、PLA2 group IIA)、この命名法はPLA2ファミリーの全ての酵素をカバーできていない上に、どのサブファミリーに属するかを識別できず、さらに哺乳動物には存在しないPLA2にも番号が振り分けられているため、最近はサブグループを識別できるcPLA2、iPLA2、sPLA2などの名称が使われる場合が多い。ただし、sPLA2ファミリーに関しては、伝統的にDennis分類に基づく番号が各酵素に付けられている。 | ||
[[ファイル:Murakami PLA2 Fig2.png|サムネイル|'''図2. cPLA2ファミリーの構造'''<br>cPLA2には6種のサブタイプ(α-δ)が存在する。]] | [[ファイル:Murakami PLA2 Fig2.png|サムネイル|'''図2. cPLA2ファミリーの構造'''<br>cPLA2には6種のサブタイプ(α-δ)が存在する。]] | ||
[[ファイル:Murakami PLA2 Fig3.png|サムネイル|'''図3. cPLA2αの活性化機構'''<br>プロトタイプであるcPLA2αは、細胞質Ca<sup>2+</sup>濃度の上昇に応じてゴルジ体などの膜に移行し、MAPKによるリン酸化を受けて活性化する。cPLA2αにより遊離されたアラキドン酸は下流の酵素により脂質メディエーター(エイコサノイド。プロスタグランジン類やロイコトリエン)に変換され、リゾホスファチジルコリン(LPC)は血小板活性化因子(PAF)に変換される。cPLA2αは、ホスファチジルコリン(PC)に加えて、セラミド-1-リン酸(ceramide-1-phosphate, C1P)やホスファチジルイノシトール-4,5-ビスリン酸 (phosphatidylinositol-4.5-bisphosphate, PIP2)を含む膜に親和性が高い。]] | [[ファイル:Murakami PLA2 Fig3.png|サムネイル|'''図3. cPLA2αの活性化機構'''<br>プロトタイプであるcPLA2αは、細胞質Ca<sup>2+</sup>濃度の上昇に応じてゴルジ体などの膜に移行し、MAPKによるリン酸化を受けて活性化する。cPLA2αにより遊離されたアラキドン酸は下流の酵素により脂質メディエーター(エイコサノイド。プロスタグランジン類やロイコトリエン)に変換され、リゾホスファチジルコリン(LPC)は血小板活性化因子(PAF)に変換される。cPLA2αは、ホスファチジルコリン(PC)に加えて、セラミド-1-リン酸(ceramide-1-phosphate, C1P)やホスファチジルイノシトール-4,5-ビスリン酸 (phosphatidylinositol-4.5-bisphosphate, PIP2)を含む膜に親和性が高い。]] | ||
===細胞質型PLA2ファミリー=== | ===細胞質型PLA2ファミリー=== | ||
細胞質PLA2(cPLA2; cytosolic | 細胞質PLA2(cPLA2; cytosolic PLA2)は脊椎動物にのみ存在し、哺乳動物にはα―ζ(Dennis分類ではIVA―F)の6種類が存在する('''図2''')<ref name=Murakami2023><pubmed>36918102</pubmed></ref>[1]。cPLA2群は、N末端側にCa<sup>2+</sup>依存的に膜に結合するC2ドメイン、C末端側にSer-Aspを活性中心とする触媒ドメインを持つが、例外的にcPLA2γにはC2ドメインがない。 | ||
プロトタイプであるcPLA2αは最もよく研究されているPLA2であり、ほぼ全ての組織に普遍的に分布している。細胞が活性化して細胞質のCa<sup>2+</sup> | プロトタイプであるcPLA2αは最もよく研究されているPLA2であり、ほぼ全ての組織に普遍的に分布している。細胞が活性化して細胞質のCa<sup>2+</sup>濃度がµMレベルに上昇すると、cPLA2αはC2ドメインを介して細胞質から核周縁膜(ゴルジ体、小胞体)に移行するとともに、MAPキナーゼによるリン酸化を受けて活性化し、膜リン脂質から不飽和脂肪酸の一種であるアラキドン酸を選択的に切り出す<ref name=Lin1993><pubmed>8381049</pubmed></ref>[2]。この性質は、アラキドン酸代謝による脂質メディエーター(プロスタグランジン、ロイコトリエンなど)の産生に極めて重要である('''図3''')。 | ||
cPLA2εはPLA2活性ではなくN-アシルトランスフェラーゼ活性(リン脂質の1位の脂肪酸をホスファチジルエタノールアミンのアミノ基に転移する反応)を触媒し、別のクラスの脂質メディエーターであるN-アシルエタノールアミン(NAE)の生合成に関わる<ref name=Ogura2016><pubmed>27399000</pubmed></ref>[3]。 | |||
他のcPLA2アイソザイムの機能は不明であるが、少なくともin | 他のcPLA2アイソザイムの機能は不明であるが、少なくともin vitroにおいては、cPLA2γはPLA2反応に加えてリン脂質の2位の脂肪酸を別のリン脂質に直接転移するトランスアシラーゼ反応、cPLA2δはリン脂質の1位を切るPLA1反応、cPLA2ζは脂肪酸を非選択的に切り出すPLA2反応を触媒する。 | ||
[[ファイル:Murakami PLA2 Fig4.png|サムネイル|'''図4. PNPLA/iPLA2ファミリーの構造'''<br>N末側に長いドメインを持つリン脂質作用型(PNPLA6-9)、N末側ドメインを持たない中性脂質作用型(PNPLA1~5)に大別される。単一の酵素が複数の名称で呼ばれているので、代表的な名称を列挙した。]] | [[ファイル:Murakami PLA2 Fig4.png|サムネイル|'''図4. PNPLA/iPLA2ファミリーの構造'''<br>N末側に長いドメインを持つリン脂質作用型(PNPLA6-9)、N末側ドメインを持たない中性脂質作用型(PNPLA1~5)に大別される。単一の酵素が複数の名称で呼ばれているので、代表的な名称を列挙した。]] | ||
===Ca<sup>2+</sup>非依存性PLA2ファミリー=== | ===Ca<sup>2+</sup>非依存性PLA2ファミリー=== | ||
Ca<sup>2+</sup>非依存性PLA2(iPLA2; Ca<sup>2+</sup>-independent PLA2)は、酵素活性にCa<sup>2+</sup> | Ca<sup>2+</sup>非依存性PLA2(iPLA2; Ca<sup>2+</sup>-independent PLA2)は、酵素活性にCa<sup>2+</sup>を必要とせず、動物のみならず植物から微生物まで生物界に広く分布する。植物のリパーゼであるpatatinと相同性が高い触媒ドメイン(patatinドメインと呼ばれる)を持つことから、PNPLA (patatin-like phospholipase)とも呼ばれ、ヒトのゲノムには9種類の酵素がコードされている('''図4''')<ref name=Murakami2023 /> [1]。 | ||
分子進化的には上述のcPLA2に近縁で、脊椎動物の出現に伴いiPLA2からcPLA2が分岐したと考えられている。発見当初はpatatinをiPLA2αと呼び、哺乳動物の酵素には発見順にiPLA2β、γ、δ…(Dennis分類ではVIA、B、C…)と呼ばれていたが、必ずしも全ての酵素がPLA2反応を触媒するとは限らないため、最近ではiPLA2よりもPNPLAの名称で呼ばれることが多く、ここでは両名称を併記する。 | 分子進化的には上述のcPLA2に近縁で、脊椎動物の出現に伴いiPLA2からcPLA2が分岐したと考えられている。発見当初はpatatinをiPLA2αと呼び、哺乳動物の酵素には発見順にiPLA2β、γ、δ…(Dennis分類ではVIA、B、C…)と呼ばれていたが、必ずしも全ての酵素がPLA2反応を触媒するとは限らないため、最近ではiPLA2よりもPNPLAの名称で呼ばれることが多く、ここでは両名称を併記する。 | ||
| 36行目: | 36行目: | ||
[[ファイル:Murakami PLA2 Fig5.png|サムネイル|'''図5. sPLA2ファミリーの構造'''<br>3つのサブグループ(Group I/II/V/X、III、XII)に分類される。このうちGroup I/II/V/Xは、古くから知られるヘビ毒sPLA2と共通の構造を持ち、Classical sPLA2と呼ばれる。Group IIIとGroup XIIは、他のいずれのsPLA2とも相同性が低いため、Atypical sPLA2と呼ばれる。]] | [[ファイル:Murakami PLA2 Fig5.png|サムネイル|'''図5. sPLA2ファミリーの構造'''<br>3つのサブグループ(Group I/II/V/X、III、XII)に分類される。このうちGroup I/II/V/Xは、古くから知られるヘビ毒sPLA2と共通の構造を持ち、Classical sPLA2と呼ばれる。Group IIIとGroup XIIは、他のいずれのsPLA2とも相同性が低いため、Atypical sPLA2と呼ばれる。]] | ||
===分泌性PLA2ファミリー=== | ===分泌性PLA2ファミリー=== | ||
分泌性PLA2 (sPLA2; secreted PLA2) | 分泌性PLA2 (sPLA2; secreted PLA2) はN末端にシグナル配列を持ち、細胞外に分泌される低分子量(14-18 kDa)のPLA2の一群であり、動物だけでなく植物、真菌、さらには一部のウイルスまで広く分布している。哺乳動物のゲノムにはIB、IIA、IIC、IID、IIE、IIF、III、V、X、XIIA、XIIBの合計11種類のsPLA2がコードされている('''図5''')<ref name=Murakami2016><pubmed>27769509</pubmed></ref>[4]。酵素活性に必要なHis-Asp活性中心とCa<sup>2+</sup>結合配列はアイソザイム間でよく保存されており、分子内ジスルフィド結合の数と位置関係に基づき細かく分類されている。 | ||
sPLA2は酵素活性にmM濃度のCa<sup>2+</sup>を必要とし、Ca<sup>2+</sup> | sPLA2は酵素活性にmM濃度のCa<sup>2+</sup>を必要とし、Ca<sup>2+</sup>が十分量存在する細胞外環境において、細胞外に存在するリン脂質(細胞外小胞、リポタンパク質、サーファクタント、微生物膜、食事成分など)を分解する。 | ||
一般に、動物細胞の細胞膜はsPLA2に対する感受性が低いが、活性化した細胞や損傷を受けた細胞の膜はsPLA2の標的基質となり得る。各sPLA2の酵素活性は同一ではなく、リン脂質の2位の脂肪酸と3位の極性基に応じて異なる基質選択性を示す。また、各sPLA2は異なる組織に分布しており、刺激に対する発現誘導パターンも異なる。このため、各sPLA2の生体内での機能は同一ではなく、それぞれが固有の生命応答に関与すると考えられている。 | |||
===その他のPLA2ファミリー=== | ===その他のPLA2ファミリー=== | ||
cPLA2、iPLA2、sPLA2の三大ファミリー以外にPLA2活性もしくは類縁の脂質代謝活性を持つ酵素群として、PAF-AHファミリー(4種類)、PLAATファミリー(5種類)、リソソーム型PLA2(2種類)、ABHDファミリー(20種以上)などが同定されている。 | |||
==生体内機能および疾患との関わり== | ==生体内機能および疾患との関わり== | ||
===cPLA2ファミリー=== | ===cPLA2ファミリー=== | ||
====cPLA2α==== | ====cPLA2α==== | ||
多くの細胞・組織においてアラキドン酸代謝の始動に必須であり、プロスタグランジンやロイコトリエンなどの脂質メディエーターの産生を介して多くの炎症性疾患やがんの増悪に寄与する一方で、生理的には雌性生殖、止血、粘膜保護などに<ref name=Uozumi1997><pubmed>9403692</pubmed></ref><ref name=Hegen2003><pubmed>12743172</pubmed></ref><ref name=Marusic2005><pubmed>16172261</pubmed></ref><ref name=Nagase2002><pubmed>11984592</pubmed></ref><ref name=Nagase2000><pubmed>10881173</pubmed></ref><ref name=Takaku2000><pubmed>10969066</pubmed></ref>[5-10]。 | |||
脳神経系との関わりについては、cPLA2αの欠損や薬理的阻害によって脳虚血モデルやアルツハイマー病モデルが軽減することや、長期記憶の形成が乱れることが報告されている<ref name=Bonventre1997><pubmed>9403693</pubmed></ref><ref name=Sanchez-Mejia2008><pubmed>18931664</pubmed></ref>[11,12]。脳神経系におけるプロスタグランジン類の作用は多岐にわたるが、例えば代表的なプロスタグランジンであるPGE2は、EP1~EP4の4つの受容体を介して、発熱(EP3)、痛覚過敏(EP1)、ミクログリア活性化(EP2/EP4)、衝動(EP1)、心理的ストレス(EP1)などの調節に関わる<ref name=Furuyashiki2011><pubmed>21116297</pubmed></ref>[13]。PGD2は睡眠の調節に関わる<ref name=Qu2006><pubmed>17093043</pubmed></ref>[14]。 | |||
しかしながら、脳内のプロスタグランジン量はcPLA2αを欠損してもほとんど減少せず、むしろ中性脂質(逆行性シナプス伝達物質として知られる2-アラキドノイルグリセロール)からモノアシルグリセロールリパーゼにより遊離されるアラキドン酸が脳内プロスタグランジンの産生に重要である<ref name=Nomura2011><pubmed>22021672</pubmed></ref>[15]。したがって、脳内におけるcPLA2αによるプロスタグランジンの産生は、脳虚血やアルツハイマー病などの病態時に顕在化する一方で、生理的には脳内の局所で起こっており、脳全体としてはシナプス伝達と連動してモノアシルグリセロールリパーゼにより遊離されるアラキドン酸にマスクされてしまっていると考えられる。 | |||
注意すべき点として、cPLA2ファミリーは脊椎動物にしか存在しないので、無脊椎動物の脳の活動にはcPLA2αは必要ない。 | |||
====cPLA2ε==== | ====cPLA2ε==== | ||
普遍的に分布しているcPLA2αとは異なり、皮膚、筋肉、胃、脳など限られた組織に発現している。皮膚においては抗炎症性脂質であるNAEの産生を介して乾癬を抑える<ref name=Liang2022><pubmed>35478358</pubmed></ref>[16]。脳虚血やアルツハイマー病においては、NAEの産生を介して神経保護に関わると考えられる<ref name=Rahman2022><pubmed>35988872</pubmed></ref>[17]。 | |||
===iPLA2ファミリー=== | ===iPLA2ファミリー=== | ||
リン脂質分解型のアイソザイム(PNPLA6―9)の欠損または変異は、神経変性疾患と密接に関連している。 | |||
====PNPLA9/iPLA2β==== | ====PNPLA9/iPLA2β==== | ||
神経科学の領域ではPLA2G6とも呼ばれることが多く、その変異はPLA2G6-related disordersと総称される神経変性疾患(INAD; infantile neuroaxonal dystrophy, NBIA; neurodegeneration with brain iron accumulation、パーキンソン病など)の原因となる<ref name=Morgan2006><pubmed>16783378</pubmed></ref>[18]。パーキンソン病の領域ではPARK14(parkinsonism-associated protein 14)とも呼ばれる。 | |||
マウス、ゼブラフィッシュ、ショウジョウバエで本酵素を欠損させた場合も類似の神経変性を引き起こす<ref name=Mori2019><pubmed>31548400</pubmed></ref>[19]。メカニズムとして、脳内膜リン脂質の脂肪酸組成の変化、リゾリン脂質の減少によるドパミン神経のCa<sup>2+</sup>チャネルの開口不全、酸化リン脂質の除去が低下することによる神経細胞死(フェロトーシス)などが報告されている<ref name=Smani2004><pubmed>14730314</pubmed></ref><ref name=Zhou2016><pubmed>26755131</pubmed></ref><ref name=Sun2021><pubmed>33542532</pubmed></ref> [20-22]。 | |||
====PNPLA8/iPLA2γ==== | ====PNPLA8/iPLA2γ==== | ||
欠損・変異は、神経変性を伴う筋力の低下(ミオパチー)を特徴とし、ミトコンドリア特有のリン脂質であるカルジオリピンの代謝異常によるミトコンドリア病(mitochondriopathy)の一種と考えられている<ref name=Saunders2015><pubmed>25512002</pubmed></ref><ref name=Mancuso2009><pubmed>19840936</pubmed></ref>[23,24]。 | |||
====PNPLA6/iPLA2δ==== | ====PNPLA6/iPLA2δ==== | ||
ヒトにおける変異はPNPLA6-related disordersと称される神経変性疾患を引き起こし、この中には痙性椎麻痺(SPG39)に加えて、運動失調、性腺機能低下症、脈絡網膜ジストロフィーを主症状とするBoucher-Neuhäuser症候群、Gordon Holmes症候群、Oliver-McFarlane症候群、Laurence-Moon症候群が含まれる<ref name=Kretzschmar2022><pubmed>35448471</pubmed></ref>[25]。マウス、ゼブラフィッシュ、ショウジョウバエにおける本酵素の変異や脳特異的欠損も類似の症状を発症し、メカニズムとして、神経細胞やグリア細胞におけるリン脂質の新陳代謝の異常、神経軸索の脂質小胞輸送の撹乱、髄鞘の形成不全などが提唱されている<ref name=Kretzschmar1997><pubmed>9295388</pubmed></ref><ref name=Akassoglou2004><pubmed>15051870</pubmed></ref>[26,27]。 | |||
また、有機リン系農薬による遅発性神経傷害(OPIN; organophosphate-induced delayed neuropathy)の標的分子の一つである<ref name=Lotti2005><pubmed>16042503</pubmed></ref>[28]。有機リン系農薬の標的としてはコリンエステラーゼの阻害による急性の神経毒性が有名であるが、それとは別に、PNPLA6の阻害による神経障害は薬剤暴露から2~4週間後に顕在化する。臨床症状としては、四肢のしびれや痛み、感覚の低下、筋力の低下が進行し、最終的には運動失調や麻痺に至る。組織学的には、主に下肢、重症例では上肢にまでワーラー型軸索障害を示し、リン脂質の新陳代謝が損なわれる結果、シュワン細胞がミエリンを合成できないために脱髄を生じる。 | |||
====中性脂質分解型アイソザイム==== | ====中性脂質分解型アイソザイム==== | ||
PNPLA1の欠損・変異は皮膚バリアの必須成分であるアシルセラミドの合成不全による魚鱗癬<ref name=Grall2012><pubmed>22246504</pubmed></ref><ref name=Hirabayashi2017><pubmed>28248300</pubmed></ref>[29,30]、PNPLA2(別名ATGL; adipose triglyceride lipase)の欠損・変異は脂肪分解の不全による中性脂肪蓄積症を引き起こす<ref name=Fischer2007><pubmed>17187067</pubmed></ref><ref name=Haemmerle2006><pubmed>16675698</pubmed></ref>[31,32]。PNPLA3のI158M変異はPNPLA2の補助因子であるABHD5を競合的に奪うことでPNPLA2による脂肪分解を抑制し、脂肪肝を引き起こす<ref name=Romeo2008><pubmed>18820647</pubmed></ref><ref name=Yang2019><pubmed>31497752</pubmed></ref>[33, 34]。 | |||
===sPLA2ファミリー=== | ===sPLA2ファミリー=== | ||
====sPLA2-IB==== | ====sPLA2-IB==== | ||
膵液に大量に含まれており、腸管腔内で食餌や胆汁のリン脂質を分解する消化酵素である<ref name=Huggins2002><pubmed>12376327</pubmed></ref>[35]。 | |||
====sPLA2-IIA==== | ====sPLA2-IIA==== | ||
血中で検出される唯一のsPLA2であり、細菌感染や炎症により免疫細胞や上皮細胞に発現誘導される<ref name=Seilhamer1989><pubmed>2925608</pubmed></ref>[36]。本酵素は細菌膜を分解する活性が強く、感染細菌に対する生体防御や腸内細菌叢の調節に関わる<ref name=Weiss1994><pubmed>7929350</pubmed></ref><ref name=Miki2022><pubmed>35076024</pubmed></ref>[37,38]。一方、感染を伴わない炎症において発現誘導されたsPLA2-IIAは、細胞外小胞のリン脂質を分解して脂質メディエーターを動員し、炎症の増悪に関わる<ref name=Duchez2015><pubmed>26106157</pubmed></ref>[39]。脳内においても、炎症や虚血障害により発現誘導されたsPLA2-IIAが炎症の増悪に寄与すると考えられているが、C57BL/6マウスでは本酵素の遺伝子にフレームシフト変異があり元来発現していないため、証明されていない。 | |||
====sPLA2-IID==== | ====sPLA2-IID==== | ||
リンパ節の樹状細胞に発現しており、抗炎症性脂質であるω3脂肪酸を選択的に切り出して獲得免疫を抑制する<ref name=Miki2013><pubmed>23690440</pubmed></ref>[40]。本酵素の免疫抑制作用は炎症を抑える点では体にとって有益であるが、癌やウイルス感染に対しては生体防御を抑えるため増悪する方向に作用する<ref name=Wong2022><pubmed>35314834</pubmed></ref>[41]。 | |||
====sPLA2-IIE==== | ====sPLA2-IIE==== | ||
マウスにおいては脳虚血時に神経細胞に誘導され、死細胞の膜から神経保護性の脂質メディエーター(不飽和脂肪酸の一種であるジホモγリノレン酸とその代謝物15-HETrE (15-hydroxy-eicosatrienoic acid))を動員する<ref name=Nakamura2023><pubmed>37490917</pubmed></ref>[42]。15-HETrEは梗塞部位周縁のPADI4陽性の神経集団に作用して神経生存に関わる分子の発現を促進する。 | |||
====sPLA2-IIF==== | ====sPLA2-IIF==== | ||
表皮に発現しており、特殊なリゾリン脂質を動員して皮膚の恒常性維持や疾患に関わる<ref name=Yamamoto2015><pubmed>26438362</pubmed></ref>。 | 表皮に発現しており、特殊なリゾリン脂質を動員して皮膚の恒常性維持や疾患に関わる<ref name=Yamamoto2015><pubmed>26438362</pubmed></ref>[43]。 | ||
====sPLA2-III==== | ====sPLA2-III==== | ||
精巣上体、マスト細胞、大腸上皮細胞などに発現しており、精子運動性、アナフィラキシー応答、大腸疾患の制御に関わる<ref name=Sato2010><pubmed>20424323</pubmed></ref><ref name=Taketomi2013><pubmed>23624557</pubmed></ref><ref name=Murase2017><pubmed>28947740</pubmed></ref>[44-46]。脊髄においてリゾリン脂質を動員して神経性疼痛に関わる<ref name=Tanaka2021><pubmed>34237486</pubmed></ref>[47]。 | |||
====sPLA2-V==== | ====sPLA2-V==== | ||
気管支上皮細胞、M2マクロファージ、脂肪細胞、血管内皮細胞などに発現しており、アラキドン酸よりもオレイン酸やリノール酸を遊離する活性が強く、喘息の増悪、肥満の抑制、血管の安定化に関わる<ref name=Ohta2013><pubmed>23650617</pubmed></ref><ref name=Sato2014><pubmed>24910243</pubmed></ref><ref name=Watanabe2020><pubmed>32482892</pubmed></ref>[48-50]。グリア細胞との関連が指摘されているが、確証は得られてない。 | |||
====sPLA2-X==== | ====sPLA2-X==== | ||
精子と大腸上皮細胞に高発現しており、高度不飽和脂肪酸を遊離して精子の活性化と大腸粘膜の保護に関わる<ref name=Escoffier2010><pubmed>20424324</pubmed></ref><ref name=Murase2016><pubmed>26828067</pubmed></ref>。肺では喘息の増悪に関わる<ref name=Henderson2007><pubmed>17403936</pubmed></ref>。 | 精子と大腸上皮細胞に高発現しており、高度不飽和脂肪酸を遊離して精子の活性化と大腸粘膜の保護に関わる<ref name=Escoffier2010><pubmed>20424324</pubmed></ref><ref name=Murase2016><pubmed>26828067</pubmed></ref>[51,52]。肺では喘息の増悪に関わる<ref name=Henderson2007><pubmed>17403936</pubmed></ref>[53]。 | ||
===その他のPLA2ファミリー=== | ===その他のPLA2ファミリー=== | ||
PAF-AHのうち、血漿型PAF-AH(リポタンパク質結合型PLA2 (Lp-PLA2)とも呼ばれる)と細胞質型PAF-AH2は酸化リン脂質を特異的に分解するPLA2であり、生理活性を持つ酸化脂肪酸をリン脂質から直接遊離する<ref name=Wilensky2008><pubmed>18806801</pubmed></ref><ref name=Shimanaka2017><pubmed>29035365</pubmed></ref>[54,55]。血漿型PAF-AHとアルツハイマー病の関連が指摘されているが、異論もある。 | |||
PLAATファミリーのうち、PLAAT3はオルガネラの大規模分解を通じて水晶体レンズの透明化に関わる<ref name=Hiraoka2006><pubmed>16880524</pubmed></ref>[56]。 | |||
リソソーム型PLA2はリソソーム内でのリン脂質の分解に関わる<ref name=Morishita2021><pubmed>33854238</pubmed></ref>。 | リソソーム型PLA2はリソソーム内でのリン脂質の分解に関わる<ref name=Morishita2021><pubmed>33854238</pubmed></ref>[57]。 | ||
ABHDファミリーのうち、ABHD6はモノアシルグリセロールリパーゼ活性を有し、逆行性シナプス伝達物質である2-アラキドノイルグリセロールの分解に部分的に<ref name=Pusch2022><pubmed>36005632</pubmed></ref>[58]。 | |||
ABHD12はリゾホスファチジルセリンを分解するリゾホスホリパーゼであり、その変異または欠損はPHARC(多発性神経炎、難聴、運動失調症、網膜色素変性症、白内障)を引き起こす<ref name=Blankman2013><pubmed>23297193</pubmed></ref>[59]。 | |||
ABHD16Aは痙性椎麻痺の原因遺伝子であり、ホスファチジルセリンを分解するPLA2活性を持つことが報告されている<ref name=Kamat2015><pubmed>25580854</pubmed></ref>[60]。 | |||
==関連項目== | ==関連項目== | ||
* [[アラキドン酸]] | * [[アラキドン酸]] | ||
* [[プロスタグランジン]] | * [[プロスタグランジン]] | ||
* [[エンドカナビノイド]] | * [[エンドカナビノイド]] | ||
* [[ホスホリパーゼC]] | * [[ホスホリパーゼC]] | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2023年8月11日 (金) 10:54時点における版
村上 誠
東京大学大学院医学系研究科
DOI:10.14931/bsd.10464 原稿受付日:2023年4月28日 原稿完成日:2023年8月10日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英:phospholipase A2
英略語:PLA2
ホスホリパーゼA2は、グリセロリン脂質(以下、リン脂質)のグリセロール骨格の2位のエステル結合を加水分解し、脂肪酸と1-リゾリン脂質を生成する酵素である。広義には、構造上PLA2ファミリーに分類される酵素を指し、この中にはPLA2活性とは異なる酵素活性を持つものもある。ヒトのゲノムには広義のPLA2が50種類以上コードされており、細胞質型(cPLA2)、Ca2+非依存性(iPLA2)、分泌性(sPLA2)、ほかいくつかのサブグループに分類される。細胞質PLA2のうちαサブタイプは細胞質のCa2+濃度が上昇すると膜リン脂質からアラキドン酸を切り出す。切り出されたアラキドン酸はプロスタグランジン、ロイコトリエンなどの脂質メディエーターに変換され、細胞間情報伝達に関わる。
歴史的経緯
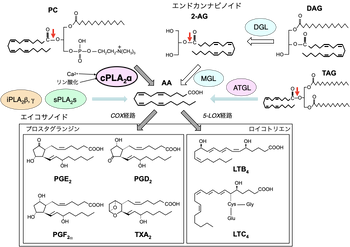
多くの組織や細胞において、リン脂質からアラキドン酸(AA)を選択的に切り出し脂質メディエーター(エイコサノイド)の産生に関わる主要な酵素はcPLA2αである。組織や細胞に応じて、iPLA2、sPLA2、リパーゼ(モノアシルグリセロールリパーゼ (monoacylglycerol lipase, MGL)、ジアシルグリセロールリパーゼ (diacylglycerol lipase, DGL)、脂肪細胞トリグリセリドリパーゼ(adipose triglyceride lipase, ATGL)もアラキドン酸遊離に関与し得る。
1980年代後半に、ヘビ毒に含まれるPLA2と構造の類似した低分子量PLA2が哺乳類の膵液とリウマチ関節炎滲出液から精製され、それぞれI型、II型PLA2と呼ばれた。1990年代初頭に、ヒト単球の細胞質から全く別の構造をもつ高分子量PLA2が同定され、低分子量PLA2を分泌性PLA2(sPLA2; secreted PLA2)、高分子量PLA2を細胞質型PLA2(cPLA2; cytosolic PLA2)と呼ぶ習慣が定着した。その後1990年代半ばに、細胞質から別の高分子量PLA2が精製されたが、cPLA2とは異なり酵素活性にCa2+を必要としないことから、Ca2+非依存性PLA2(iPLA2)と呼ばれた。その後、2000年代半ばまでに、ヒトやマウスの全ゲノム構造が明らかになるにつれて、構造的にcPLA2、iPLA2、sPLA2の特徴をそれぞれ有するアイソフォームや、このいずれにも属さない新しいタイプのPLA2が次々と同定された(サブファミリーの項目参照)。
1980〜1990年代は、プロスタグランジン(PG)やロイコトリエン(LT)などの脂質メディエーターの生合成に関わる酵素や、そのシグナル伝達に関わる受容体が次々と同定された時期でもあり、PLA2はこれらの脂質メディエーターの共通の前駆体であるアラキドン酸を膜リン脂質から遊離するシグナル酵素(アラキドン酸代謝の初発律速酵素)として注目された。現在では、プロスタグランジン、ロイコトリエンの生合成に最も密接に関わるPLA2は細胞質型PLA2のαサブタイプ(cPLA2α)であることがわかっているが、iPLA2やsPLA2、さらには中性脂質を分解するリパーゼも、状況に応じてアラキドン酸代謝に関わる(図1)。
サブファミリー
PLA2の分類は、分子として同定された歴史的順番に沿ってI、II、III….と番号をつけ、さらに近縁の酵素にA、B、C…のアルファベット大文字を添える命名法(提唱者にちなんでDennis分類と呼ばれる)と、各酵素の構造と性質の類似性からサブファミリー別に分類する命名法がある。PLA2の遺伝子名は概ねDennis分類に基づくが (例;PLA2G2A、PLA2 group IIA)、この命名法はPLA2ファミリーの全ての酵素をカバーできていない上に、どのサブファミリーに属するかを識別できず、さらに哺乳動物には存在しないPLA2にも番号が振り分けられているため、最近はサブグループを識別できるcPLA2、iPLA2、sPLA2などの名称が使われる場合が多い。ただし、sPLA2ファミリーに関しては、伝統的にDennis分類に基づく番号が各酵素に付けられている。
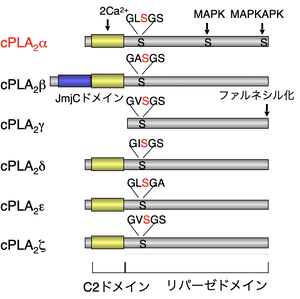
cPLA2には6種のサブタイプ(α-δ)が存在する。
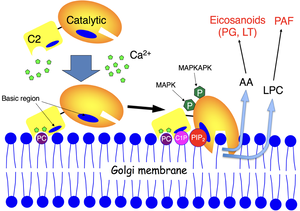
プロトタイプであるcPLA2αは、細胞質Ca2+濃度の上昇に応じてゴルジ体などの膜に移行し、MAPKによるリン酸化を受けて活性化する。cPLA2αにより遊離されたアラキドン酸は下流の酵素により脂質メディエーター(エイコサノイド。プロスタグランジン類やロイコトリエン)に変換され、リゾホスファチジルコリン(LPC)は血小板活性化因子(PAF)に変換される。cPLA2αは、ホスファチジルコリン(PC)に加えて、セラミド-1-リン酸(ceramide-1-phosphate, C1P)やホスファチジルイノシトール-4,5-ビスリン酸 (phosphatidylinositol-4.5-bisphosphate, PIP2)を含む膜に親和性が高い。
細胞質型PLA2ファミリー
細胞質PLA2(cPLA2; cytosolic PLA2)は脊椎動物にのみ存在し、哺乳動物にはα―ζ(Dennis分類ではIVA―F)の6種類が存在する(図2)[1][1]。cPLA2群は、N末端側にCa2+依存的に膜に結合するC2ドメイン、C末端側にSer-Aspを活性中心とする触媒ドメインを持つが、例外的にcPLA2γにはC2ドメインがない。
プロトタイプであるcPLA2αは最もよく研究されているPLA2であり、ほぼ全ての組織に普遍的に分布している。細胞が活性化して細胞質のCa2+濃度がµMレベルに上昇すると、cPLA2αはC2ドメインを介して細胞質から核周縁膜(ゴルジ体、小胞体)に移行するとともに、MAPキナーゼによるリン酸化を受けて活性化し、膜リン脂質から不飽和脂肪酸の一種であるアラキドン酸を選択的に切り出す[2][2]。この性質は、アラキドン酸代謝による脂質メディエーター(プロスタグランジン、ロイコトリエンなど)の産生に極めて重要である(図3)。
cPLA2εはPLA2活性ではなくN-アシルトランスフェラーゼ活性(リン脂質の1位の脂肪酸をホスファチジルエタノールアミンのアミノ基に転移する反応)を触媒し、別のクラスの脂質メディエーターであるN-アシルエタノールアミン(NAE)の生合成に関わる[3][3]。
他のcPLA2アイソザイムの機能は不明であるが、少なくともin vitroにおいては、cPLA2γはPLA2反応に加えてリン脂質の2位の脂肪酸を別のリン脂質に直接転移するトランスアシラーゼ反応、cPLA2δはリン脂質の1位を切るPLA1反応、cPLA2ζは脂肪酸を非選択的に切り出すPLA2反応を触媒する。
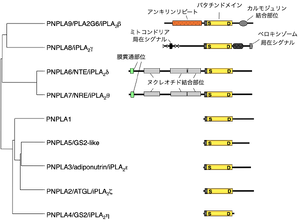
N末側に長いドメインを持つリン脂質作用型(PNPLA6-9)、N末側ドメインを持たない中性脂質作用型(PNPLA1~5)に大別される。単一の酵素が複数の名称で呼ばれているので、代表的な名称を列挙した。
Ca2+非依存性PLA2ファミリー
Ca2+非依存性PLA2(iPLA2; Ca2+-independent PLA2)は、酵素活性にCa2+を必要とせず、動物のみならず植物から微生物まで生物界に広く分布する。植物のリパーゼであるpatatinと相同性が高い触媒ドメイン(patatinドメインと呼ばれる)を持つことから、PNPLA (patatin-like phospholipase)とも呼ばれ、ヒトのゲノムには9種類の酵素がコードされている(図4)[1] [1]。
分子進化的には上述のcPLA2に近縁で、脊椎動物の出現に伴いiPLA2からcPLA2が分岐したと考えられている。発見当初はpatatinをiPLA2αと呼び、哺乳動物の酵素には発見順にiPLA2β、γ、δ…(Dennis分類ではVIA、B、C…)と呼ばれていたが、必ずしも全ての酵素がPLA2反応を触媒するとは限らないため、最近ではiPLA2よりもPNPLAの名称で呼ばれることが多く、ここでは両名称を併記する。
哺乳動物のiPLA2として最初に同定されたPNPLA9/iPLA2βは主にPLA2として働く。PNPLA8/iPLA2γはリン脂質の種類により1位または2位を分解するPLA1/2活性、PNPLA7/iPLA2θはリゾリン脂質を分解するリゾホスホリパーゼ活性、PNPLA6/iPLA2δはホスホリパーゼB(PLA1/2+リゾホスホリパーゼ)活性を持つ。PNPLA9/iPLA2βは細胞質、PNPLA8/iPLA2γはミトコンドリアとペルオキシソーム、PNPLA6/iPLA2δとPNPLA7/iPLA2θは小胞体に局在する。PNPLA1―5はリン脂質ではなく中性脂質を基質とするリパーゼまたはトランスアシラーゼであり、脂肪滴に局在する。
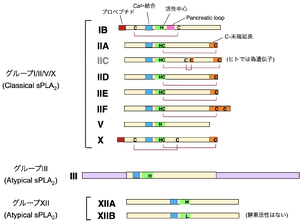
3つのサブグループ(Group I/II/V/X、III、XII)に分類される。このうちGroup I/II/V/Xは、古くから知られるヘビ毒sPLA2と共通の構造を持ち、Classical sPLA2と呼ばれる。Group IIIとGroup XIIは、他のいずれのsPLA2とも相同性が低いため、Atypical sPLA2と呼ばれる。
分泌性PLA2ファミリー
分泌性PLA2 (sPLA2; secreted PLA2) はN末端にシグナル配列を持ち、細胞外に分泌される低分子量(14-18 kDa)のPLA2の一群であり、動物だけでなく植物、真菌、さらには一部のウイルスまで広く分布している。哺乳動物のゲノムにはIB、IIA、IIC、IID、IIE、IIF、III、V、X、XIIA、XIIBの合計11種類のsPLA2がコードされている(図5)[4][4]。酵素活性に必要なHis-Asp活性中心とCa2+結合配列はアイソザイム間でよく保存されており、分子内ジスルフィド結合の数と位置関係に基づき細かく分類されている。
sPLA2は酵素活性にmM濃度のCa2+を必要とし、Ca2+が十分量存在する細胞外環境において、細胞外に存在するリン脂質(細胞外小胞、リポタンパク質、サーファクタント、微生物膜、食事成分など)を分解する。
一般に、動物細胞の細胞膜はsPLA2に対する感受性が低いが、活性化した細胞や損傷を受けた細胞の膜はsPLA2の標的基質となり得る。各sPLA2の酵素活性は同一ではなく、リン脂質の2位の脂肪酸と3位の極性基に応じて異なる基質選択性を示す。また、各sPLA2は異なる組織に分布しており、刺激に対する発現誘導パターンも異なる。このため、各sPLA2の生体内での機能は同一ではなく、それぞれが固有の生命応答に関与すると考えられている。
その他のPLA2ファミリー
cPLA2、iPLA2、sPLA2の三大ファミリー以外にPLA2活性もしくは類縁の脂質代謝活性を持つ酵素群として、PAF-AHファミリー(4種類)、PLAATファミリー(5種類)、リソソーム型PLA2(2種類)、ABHDファミリー(20種以上)などが同定されている。
生体内機能および疾患との関わり
cPLA2ファミリー
cPLA2α
多くの細胞・組織においてアラキドン酸代謝の始動に必須であり、プロスタグランジンやロイコトリエンなどの脂質メディエーターの産生を介して多くの炎症性疾患やがんの増悪に寄与する一方で、生理的には雌性生殖、止血、粘膜保護などに[5][6][7][8][9][10][5-10]。
脳神経系との関わりについては、cPLA2αの欠損や薬理的阻害によって脳虚血モデルやアルツハイマー病モデルが軽減することや、長期記憶の形成が乱れることが報告されている[11][12][11,12]。脳神経系におけるプロスタグランジン類の作用は多岐にわたるが、例えば代表的なプロスタグランジンであるPGE2は、EP1~EP4の4つの受容体を介して、発熱(EP3)、痛覚過敏(EP1)、ミクログリア活性化(EP2/EP4)、衝動(EP1)、心理的ストレス(EP1)などの調節に関わる[13][13]。PGD2は睡眠の調節に関わる[14][14]。
しかしながら、脳内のプロスタグランジン量はcPLA2αを欠損してもほとんど減少せず、むしろ中性脂質(逆行性シナプス伝達物質として知られる2-アラキドノイルグリセロール)からモノアシルグリセロールリパーゼにより遊離されるアラキドン酸が脳内プロスタグランジンの産生に重要である[15][15]。したがって、脳内におけるcPLA2αによるプロスタグランジンの産生は、脳虚血やアルツハイマー病などの病態時に顕在化する一方で、生理的には脳内の局所で起こっており、脳全体としてはシナプス伝達と連動してモノアシルグリセロールリパーゼにより遊離されるアラキドン酸にマスクされてしまっていると考えられる。
注意すべき点として、cPLA2ファミリーは脊椎動物にしか存在しないので、無脊椎動物の脳の活動にはcPLA2αは必要ない。
cPLA2ε
普遍的に分布しているcPLA2αとは異なり、皮膚、筋肉、胃、脳など限られた組織に発現している。皮膚においては抗炎症性脂質であるNAEの産生を介して乾癬を抑える[16][16]。脳虚血やアルツハイマー病においては、NAEの産生を介して神経保護に関わると考えられる[17][17]。
iPLA2ファミリー
リン脂質分解型のアイソザイム(PNPLA6―9)の欠損または変異は、神経変性疾患と密接に関連している。
PNPLA9/iPLA2β
神経科学の領域ではPLA2G6とも呼ばれることが多く、その変異はPLA2G6-related disordersと総称される神経変性疾患(INAD; infantile neuroaxonal dystrophy, NBIA; neurodegeneration with brain iron accumulation、パーキンソン病など)の原因となる[18][18]。パーキンソン病の領域ではPARK14(parkinsonism-associated protein 14)とも呼ばれる。
マウス、ゼブラフィッシュ、ショウジョウバエで本酵素を欠損させた場合も類似の神経変性を引き起こす[19][19]。メカニズムとして、脳内膜リン脂質の脂肪酸組成の変化、リゾリン脂質の減少によるドパミン神経のCa2+チャネルの開口不全、酸化リン脂質の除去が低下することによる神経細胞死(フェロトーシス)などが報告されている[20][21][22] [20-22]。
PNPLA8/iPLA2γ
欠損・変異は、神経変性を伴う筋力の低下(ミオパチー)を特徴とし、ミトコンドリア特有のリン脂質であるカルジオリピンの代謝異常によるミトコンドリア病(mitochondriopathy)の一種と考えられている[23][24][23,24]。
PNPLA6/iPLA2δ
ヒトにおける変異はPNPLA6-related disordersと称される神経変性疾患を引き起こし、この中には痙性椎麻痺(SPG39)に加えて、運動失調、性腺機能低下症、脈絡網膜ジストロフィーを主症状とするBoucher-Neuhäuser症候群、Gordon Holmes症候群、Oliver-McFarlane症候群、Laurence-Moon症候群が含まれる[25][25]。マウス、ゼブラフィッシュ、ショウジョウバエにおける本酵素の変異や脳特異的欠損も類似の症状を発症し、メカニズムとして、神経細胞やグリア細胞におけるリン脂質の新陳代謝の異常、神経軸索の脂質小胞輸送の撹乱、髄鞘の形成不全などが提唱されている[26][27][26,27]。
また、有機リン系農薬による遅発性神経傷害(OPIN; organophosphate-induced delayed neuropathy)の標的分子の一つである[28][28]。有機リン系農薬の標的としてはコリンエステラーゼの阻害による急性の神経毒性が有名であるが、それとは別に、PNPLA6の阻害による神経障害は薬剤暴露から2~4週間後に顕在化する。臨床症状としては、四肢のしびれや痛み、感覚の低下、筋力の低下が進行し、最終的には運動失調や麻痺に至る。組織学的には、主に下肢、重症例では上肢にまでワーラー型軸索障害を示し、リン脂質の新陳代謝が損なわれる結果、シュワン細胞がミエリンを合成できないために脱髄を生じる。
中性脂質分解型アイソザイム
PNPLA1の欠損・変異は皮膚バリアの必須成分であるアシルセラミドの合成不全による魚鱗癬[29][30][29,30]、PNPLA2(別名ATGL; adipose triglyceride lipase)の欠損・変異は脂肪分解の不全による中性脂肪蓄積症を引き起こす[31][32][31,32]。PNPLA3のI158M変異はPNPLA2の補助因子であるABHD5を競合的に奪うことでPNPLA2による脂肪分解を抑制し、脂肪肝を引き起こす[33][34][33, 34]。
sPLA2ファミリー
sPLA2-IB
膵液に大量に含まれており、腸管腔内で食餌や胆汁のリン脂質を分解する消化酵素である[35][35]。
sPLA2-IIA
血中で検出される唯一のsPLA2であり、細菌感染や炎症により免疫細胞や上皮細胞に発現誘導される[36][36]。本酵素は細菌膜を分解する活性が強く、感染細菌に対する生体防御や腸内細菌叢の調節に関わる[37][38][37,38]。一方、感染を伴わない炎症において発現誘導されたsPLA2-IIAは、細胞外小胞のリン脂質を分解して脂質メディエーターを動員し、炎症の増悪に関わる[39][39]。脳内においても、炎症や虚血障害により発現誘導されたsPLA2-IIAが炎症の増悪に寄与すると考えられているが、C57BL/6マウスでは本酵素の遺伝子にフレームシフト変異があり元来発現していないため、証明されていない。
sPLA2-IID
リンパ節の樹状細胞に発現しており、抗炎症性脂質であるω3脂肪酸を選択的に切り出して獲得免疫を抑制する[40][40]。本酵素の免疫抑制作用は炎症を抑える点では体にとって有益であるが、癌やウイルス感染に対しては生体防御を抑えるため増悪する方向に作用する[41][41]。
sPLA2-IIE
マウスにおいては脳虚血時に神経細胞に誘導され、死細胞の膜から神経保護性の脂質メディエーター(不飽和脂肪酸の一種であるジホモγリノレン酸とその代謝物15-HETrE (15-hydroxy-eicosatrienoic acid))を動員する[42][42]。15-HETrEは梗塞部位周縁のPADI4陽性の神経集団に作用して神経生存に関わる分子の発現を促進する。
sPLA2-IIF
表皮に発現しており、特殊なリゾリン脂質を動員して皮膚の恒常性維持や疾患に関わる[43][43]。
sPLA2-III
精巣上体、マスト細胞、大腸上皮細胞などに発現しており、精子運動性、アナフィラキシー応答、大腸疾患の制御に関わる[44][45][46][44-46]。脊髄においてリゾリン脂質を動員して神経性疼痛に関わる[47][47]。
sPLA2-V
気管支上皮細胞、M2マクロファージ、脂肪細胞、血管内皮細胞などに発現しており、アラキドン酸よりもオレイン酸やリノール酸を遊離する活性が強く、喘息の増悪、肥満の抑制、血管の安定化に関わる[48][49][50][48-50]。グリア細胞との関連が指摘されているが、確証は得られてない。
sPLA2-X
精子と大腸上皮細胞に高発現しており、高度不飽和脂肪酸を遊離して精子の活性化と大腸粘膜の保護に関わる[51][52][51,52]。肺では喘息の増悪に関わる[53][53]。
その他のPLA2ファミリー
PAF-AHのうち、血漿型PAF-AH(リポタンパク質結合型PLA2 (Lp-PLA2)とも呼ばれる)と細胞質型PAF-AH2は酸化リン脂質を特異的に分解するPLA2であり、生理活性を持つ酸化脂肪酸をリン脂質から直接遊離する[54][55][54,55]。血漿型PAF-AHとアルツハイマー病の関連が指摘されているが、異論もある。
PLAATファミリーのうち、PLAAT3はオルガネラの大規模分解を通じて水晶体レンズの透明化に関わる[56][56]。
リソソーム型PLA2はリソソーム内でのリン脂質の分解に関わる[57][57]。
ABHDファミリーのうち、ABHD6はモノアシルグリセロールリパーゼ活性を有し、逆行性シナプス伝達物質である2-アラキドノイルグリセロールの分解に部分的に[58][58]。
ABHD12はリゾホスファチジルセリンを分解するリゾホスホリパーゼであり、その変異または欠損はPHARC(多発性神経炎、難聴、運動失調症、網膜色素変性症、白内障)を引き起こす[59][59]。
ABHD16Aは痙性椎麻痺の原因遺伝子であり、ホスファチジルセリンを分解するPLA2活性を持つことが報告されている[60][60]。
関連項目
参考文献
- ↑ 1.0 1.1
Murakami, M. (2023).
The phospholipase A2 superfamily as a central hub of bioactive lipids and beyond. Pharmacology & therapeutics, 244, 108382. [PubMed:36918102] [WorldCat] [DOI] - ↑
Lin, L.L., Wartmann, M., Lin, A.Y., Knopf, J.L., Seth, A., & Davis, R.J. (1993).
cPLA2 is phosphorylated and activated by MAP kinase. Cell, 72(2), 269-78. [PubMed:8381049] [WorldCat] [DOI] - ↑
Ogura, Y., Parsons, W.H., Kamat, S.S., & Cravatt, B.F. (2016).
A calcium-dependent acyltransferase that produces N-acyl phosphatidylethanolamines. Nature chemical biology, 12(9), 669-71. [PubMed:27399000] [PMC] [WorldCat] [DOI] - ↑
Murakami, M., Yamamoto, K., Miki, Y., Murase, R., Sato, H., & Taketomi, Y. (2016).
The Roles of the Secreted Phospholipase A2 Gene Family in Immunology. Advances in immunology, 132, 91-134. [PubMed:27769509] [PMC] [WorldCat] [DOI] - ↑
Uozumi, N., Kume, K., Nagase, T., Nakatani, N., Ishii, S., Tashiro, F., ..., & Shimizu, T. (1997).
Role of cytosolic phospholipase A2 in allergic response and parturition. Nature, 390(6660), 618-22. [PubMed:9403692] [WorldCat] [DOI] - ↑
Hegen, M., Sun, L., Uozumi, N., Kume, K., Goad, M.E., Nickerson-Nutter, C.L., ..., & Clark, J.D. (2003).
Cytosolic phospholipase A2alpha-deficient mice are resistant to collagen-induced arthritis. The Journal of experimental medicine, 197(10), 1297-302. [PubMed:12743172] [PMC] [WorldCat] [DOI] - ↑
Marusic, S., Leach, M.W., Pelker, J.W., Azoitei, M.L., Uozumi, N., Cui, J., ..., & Clark, J.D. (2005).
Cytosolic phospholipase A2 alpha-deficient mice are resistant to experimental autoimmune encephalomyelitis. The Journal of experimental medicine, 202(6), 841-51. [PubMed:16172261] [PMC] [WorldCat] [DOI] - ↑
Nagase, T., Uozumi, N., Ishii, S., Kita, Y., Yamamoto, H., Ohga, E., ..., & Shimizu, T. (2002).
A pivotal role of cytosolic phospholipase A(2) in bleomycin-induced pulmonary fibrosis. Nature medicine, 8(5), 480-4. [PubMed:11984592] [WorldCat] [DOI] - ↑
Nagase, T., Uozumi, N., Ishii, S., Kume, K., Izumi, T., Ouchi, Y., & Shimizu, T. (2000).
Acute lung injury by sepsis and acid aspiration: a key role for cytosolic phospholipase A2. Nature immunology, 1(1), 42-6. [PubMed:10881173] [WorldCat] [DOI] - ↑
Takaku, K., Sonoshita, M., Sasaki, N., Uozumi, N., Doi, Y., Shimizu, T., & Taketo, M.M. (2000).
Suppression of intestinal polyposis in Apc(delta 716) knockout mice by an additional mutation in the cytosolic phospholipase A(2) gene. The Journal of biological chemistry, 275(44), 34013-6. [PubMed:10969066] [WorldCat] [DOI] - ↑
Bonventre, J.V., Huang, Z., Taheri, M.R., O'Leary, E., Li, E., Moskowitz, M.A., & Sapirstein, A. (1997).
Reduced fertility and postischaemic brain injury in mice deficient in cytosolic phospholipase A2. Nature, 390(6660), 622-5. [PubMed:9403693] [WorldCat] [DOI] - ↑
Sanchez-Mejia, R.O., Newman, J.W., Toh, S., Yu, G.Q., Zhou, Y., Halabisky, B., ..., & Mucke, L. (2008).
Phospholipase A2 reduction ameliorates cognitive deficits in a mouse model of Alzheimer's disease. Nature neuroscience, 11(11), 1311-8. [PubMed:18931664] [PMC] [WorldCat] [DOI] - ↑
Furuyashiki, T., & Narumiya, S. (2011).
Stress responses: the contribution of prostaglandin E(2) and its receptors. Nature reviews. Endocrinology, 7(3), 163-75. [PubMed:21116297] [WorldCat] [DOI] - ↑
Qu, W.M., Huang, Z.L., Xu, X.H., Aritake, K., Eguchi, N., Nambu, F., ..., & Hayaishi, O. (2006).
Lipocalin-type prostaglandin D synthase produces prostaglandin D2 involved in regulation of physiological sleep. Proceedings of the National Academy of Sciences of the United States of America, 103(47), 17949-54. [PubMed:17093043] [PMC] [WorldCat] [DOI] - ↑
Nomura, D.K., Morrison, B.E., Blankman, J.L., Long, J.Z., Kinsey, S.G., Marcondes, M.C., ..., & Cravatt, B.F. (2011).
Endocannabinoid hydrolysis generates brain prostaglandins that promote neuroinflammation. Science (New York, N.Y.), 334(6057), 809-13. [PubMed:22021672] [PMC] [WorldCat] [DOI] - ↑
Liang, L., Takamiya, R., Miki, Y., Heike, K., Taketomi, Y., Sugimoto, N., ..., & Murakami, M. (2022).
Group IVE cytosolic phospholipase A2 limits psoriatic inflammation by mobilizing the anti-inflammatory lipid N-acylethanolamine. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 36(5), e22301. [PubMed:35478358] [WorldCat] [DOI] - ↑
Rahman, S.M.K., Hussain, Z., Morito, K., Takahashi, N., Sikder, M.M., Tanaka, T., ..., & Ueda, N. (2022).
Formation of N-acyl-phosphatidylethanolamines by cytosolic phospholipase A2ε in an ex vivo murine model of brain ischemia. Biochimica et biophysica acta. Molecular and cell biology of lipids, 1867(12), 159222. [PubMed:35988872] [WorldCat] [DOI] - ↑
Morgan, N.V., Westaway, S.K., Morton, J.E., Gregory, A., Gissen, P., Sonek, S., ..., & Hayflick, S.J. (2006).
PLA2G6, encoding a phospholipase A2, is mutated in neurodegenerative disorders with high brain iron. Nature genetics, 38(7), 752-4. [PubMed:16783378] [PMC] [WorldCat] [DOI] - ↑
Mori, A., Hatano, T., Inoshita, T., Shiba-Fukushima, K., Koinuma, T., Meng, H., ..., & Hattori, N. (2019).
Parkinson's disease-associated iPLA2-VIA/PLA2G6 regulates neuronal functions and α-synuclein stability through membrane remodeling. Proceedings of the National Academy of Sciences of the United States of America, 116(41), 20689-20699. [PubMed:31548400] [PMC] [WorldCat] [DOI] - ↑
Smani, T., Zakharov, S.I., Csutora, P., Leno, E., Trepakova, E.S., & Bolotina, V.M. (2004).
A novel mechanism for the store-operated calcium influx pathway. Nature cell biology, 6(2), 113-20. [PubMed:14730314] [WorldCat] [DOI] - ↑
Zhou, Q., Yen, A., Rymarczyk, G., Asai, H., Trengrove, C., Aziz, N., ..., & Bolotina, V.M. (2016).
Impairment of PARK14-dependent Ca(2+) signalling is a novel determinant of Parkinson's disease. Nature communications, 7, 10332. [PubMed:26755131] [PMC] [WorldCat] [DOI] - ↑
Sun, W.Y., Tyurin, V.A., Mikulska-Ruminska, K., Shrivastava, I.H., Anthonymuthu, T.S., Zhai, Y.J., ..., & Kagan, V.E. (2021).
Phospholipase iPLA2β averts ferroptosis by eliminating a redox lipid death signal. Nature chemical biology, 17(4), 465-476. [PubMed:33542532] [PMC] [WorldCat] [DOI] - ↑
Saunders, C.J., Moon, S.H., Liu, X., Thiffault, I., Coffman, K., LePichon, J.B., ..., & Gross, R.W. (2015).
Loss of function variants in human PNPLA8 encoding calcium-independent phospholipase A2 γ recapitulate the mitochondriopathy of the homologous null mouse. Human mutation, 36(3), 301-6. [PubMed:25512002] [PMC] [WorldCat] [DOI] - ↑
Mancuso, D.J., Kotzbauer, P., Wozniak, D.F., Sims, H.F., Jenkins, C.M., Guan, S., ..., & Gross, R.W. (2009).
Genetic ablation of calcium-independent phospholipase A2{gamma} leads to alterations in hippocampal cardiolipin content and molecular species distribution, mitochondrial degeneration, autophagy, and cognitive dysfunction. The Journal of biological chemistry, 284(51), 35632-44. [PubMed:19840936] [PMC] [WorldCat] [DOI] - ↑
Kretzschmar, D. (2022).
PNPLA6/NTE, an Evolutionary Conserved Phospholipase Linked to a Group of Complex Human Diseases. Metabolites, 12(4). [PubMed:35448471] [PMC] [WorldCat] [DOI] - ↑
Kretzschmar, D., Hasan, G., Sharma, S., Heisenberg, M., & Benzer, S. (1997).
The swiss cheese mutant causes glial hyperwrapping and brain degeneration in Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(19), 7425-32. [PubMed:9295388] [PMC] [WorldCat] [DOI] - ↑
Akassoglou, K., Malester, B., Xu, J., Tessarollo, L., Rosenbluth, J., & Chao, M.V. (2004).
Brain-specific deletion of neuropathy target esterase/swisscheese results in neurodegeneration. Proceedings of the National Academy of Sciences of the United States of America, 101(14), 5075-80. [PubMed:15051870] [PMC] [WorldCat] [DOI] - ↑
Lotti, M., & Moretto, A. (2005).
Organophosphate-induced delayed polyneuropathy. Toxicological reviews, 24(1), 37-49. [PubMed:16042503] [WorldCat] [DOI] - ↑
Grall, A., Guaguère, E., Planchais, S., Grond, S., Bourrat, E., Hausser, I., ..., & Fischer, J. (2012).
PNPLA1 mutations cause autosomal recessive congenital ichthyosis in golden retriever dogs and humans. Nature genetics, 44(2), 140-7. [PubMed:22246504] [WorldCat] [DOI] - ↑
Hirabayashi, T., Anjo, T., Kaneko, A., Senoo, Y., Shibata, A., Takama, H., ..., & Murakami, M. (2017).
PNPLA1 has a crucial role in skin barrier function by directing acylceramide biosynthesis. Nature communications, 8, 14609. [PubMed:28248300] [PMC] [WorldCat] [DOI] - ↑
Fischer, J., Lefèvre, C., Morava, E., Mussini, J.M., Laforêt, P., Negre-Salvayre, A., ..., & Salvayre, R. (2007).
The gene encoding adipose triglyceride lipase (PNPLA2) is mutated in neutral lipid storage disease with myopathy. Nature genetics, 39(1), 28-30. [PubMed:17187067] [WorldCat] [DOI] - ↑
Haemmerle, G., Lass, A., Zimmermann, R., Gorkiewicz, G., Meyer, C., Rozman, J., ..., & Zechner, R. (2006).
Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase. Science (New York, N.Y.), 312(5774), 734-7. [PubMed:16675698] [WorldCat] [DOI] - ↑
Romeo, S., Kozlitina, J., Xing, C., Pertsemlidis, A., Cox, D., Pennacchio, L.A., ..., & Hobbs, H.H. (2008).
Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nature genetics, 40(12), 1461-5. [PubMed:18820647] [PMC] [WorldCat] [DOI] - ↑
Yang, A., Mottillo, E.P., Mladenovic-Lucas, L., Zhou, L., & Granneman, J.G. (2019).
Dynamic interactions of ABHD5 with PNPLA3 regulate triacylglycerol metabolism in brown adipocytes. Nature metabolism, 1(5), 560-569. [PubMed:31497752] [PMC] [WorldCat] [DOI] - ↑
Huggins, K.W., Boileau, A.C., & Hui, D.Y. (2002).
Protection against diet-induced obesity and obesity- related insulin resistance in Group 1B PLA2-deficient mice. American journal of physiology. Endocrinology and metabolism, 283(5), E994-E1001. [PubMed:12376327] [WorldCat] [DOI] - ↑
Seilhamer, J.J., Pruzanski, W., Vadas, P., Plant, S., Miller, J.A., Kloss, J., & Johnson, L.K. (1989).
Cloning and recombinant expression of phospholipase A2 present in rheumatoid arthritic synovial fluid. The Journal of biological chemistry, 264(10), 5335-8. [PubMed:2925608] [WorldCat] - ↑
Weiss, J., Inada, M., Elsbach, P., & Crowl, R.M. (1994).
Structural determinants of the action against Escherichia coli of a human inflammatory fluid phospholipase A2 in concert with polymorphonuclear leukocytes. The Journal of biological chemistry, 269(42), 26331-7. [PubMed:7929350] [WorldCat] - ↑
Miki, Y., Taketomi, Y., Kidoguchi, Y., Yamamoto, K., Muramatsu, K., Nishito, Y., ..., & Murakami, M. (2022).
Group IIA secreted phospholipase A2 controls skin carcinogenesis and psoriasis by shaping the gut microbiota. JCI insight, 7(2). [PubMed:35076024] [PMC] [WorldCat] [DOI] - ↑
Duchez, A.C., Boudreau, L.H., Naika, G.S., Bollinger, J., Belleannée, C., Cloutier, N., ..., & Boilard, E. (2015).
Platelet microparticles are internalized in neutrophils via the concerted activity of 12-lipoxygenase and secreted phospholipase A2-IIA. Proceedings of the National Academy of Sciences of the United States of America, 112(27), E3564-73. [PubMed:26106157] [PMC] [WorldCat] [DOI] - ↑
Miki, Y., Yamamoto, K., Taketomi, Y., Sato, H., Shimo, K., Kobayashi, T., ..., & Murakami, M. (2013).
Lymphoid tissue phospholipase A2 group IID resolves contact hypersensitivity by driving antiinflammatory lipid mediators. The Journal of experimental medicine, 210(6), 1217-34. [PubMed:23690440] [PMC] [WorldCat] [DOI] - ↑
Wong, L.R., Zheng, J., Wilhelmsen, K., Li, K., Ortiz, M.E., Schnicker, N.J., ..., & Perlman, S. (2022).
Eicosanoid signalling blockade protects middle-aged mice from severe COVID-19. Nature, 605(7908), 146-151. [PubMed:35314834] [PMC] [WorldCat] [DOI] - ↑
Nakamura, A., Sakai, S., Taketomi, Y., Tsuyama, J., Miki, Y., Hara, Y., ..., & Shichita, T. (2023).
PLA2G2E-mediated lipid metabolism triggers brain-autonomous neural repair after ischemic stroke. Neuron. [PubMed:37490917] [WorldCat] [DOI] - ↑
Yamamoto, K., Miki, Y., Sato, M., Taketomi, Y., Nishito, Y., Taya, C., ..., & Murakami, M. (2015).
The role of group IIF-secreted phospholipase A2 in epidermal homeostasis and hyperplasia. The Journal of experimental medicine, 212(11), 1901-19. [PubMed:26438362] [PMC] [WorldCat] [DOI] - ↑
Sato, H., Taketomi, Y., Isogai, Y., Miki, Y., Yamamoto, K., Masuda, S., ..., & Murakami, M. (2010).
Group III secreted phospholipase A2 regulates epididymal sperm maturation and fertility in mice. The Journal of clinical investigation, 120(5), 1400-14. [PubMed:20424323] [PMC] [WorldCat] [DOI] - ↑
Taketomi, Y., Ueno, N., Kojima, T., Sato, H., Murase, R., Yamamoto, K., ..., & Murakami, M. (2013).
Mast cell maturation is driven via a group III phospholipase A2-prostaglandin D2-DP1 receptor paracrine axis. Nature immunology, 14(6), 554-63. [PubMed:23624557] [PMC] [WorldCat] [DOI] - ↑
Murase, R., Taketomi, Y., Miki, Y., Nishito, Y., Saito, M., Fukami, K., ..., & Murakami, M. (2017).
Group III phospholipase A2 promotes colitis and colorectal cancer. Scientific reports, 7(1), 12261. [PubMed:28947740] [PMC] [WorldCat] [DOI] - ↑
Tanaka, K., Dozono, N., Neyama, H., Nagai, J., Tsukahara, R., Nagayasu, K., ..., & Ueda, H. (2021).
Secreted PLA2-III is a possible therapeutic target to treat neuropathic pain. Biochemical and biophysical research communications, 568, 167-173. [PubMed:34237486] [WorldCat] [DOI] - ↑
Ohta, S., Imamura, M., Xing, W., Boyce, J.A., & Balestrieri, B. (2013).
Group V secretory phospholipase A2 is involved in macrophage activation and is sufficient for macrophage effector functions in allergic pulmonary inflammation. Journal of immunology (Baltimore, Md. : 1950), 190(12), 5927-38. [PubMed:23650617] [PMC] [WorldCat] [DOI] - ↑
Sato, H., Taketomi, Y., Ushida, A., Isogai, Y., Kojima, T., Hirabayashi, T., ..., & Murakami, M. (2014).
The adipocyte-inducible secreted phospholipases PLA2G5 and PLA2G2E play distinct roles in obesity. Cell metabolism, 20(1), 119-32. [PubMed:24910243] [PMC] [WorldCat] [DOI] - ↑
Watanabe, K., Taketomi, Y., Miki, Y., Kugiyama, K., & Murakami, M. (2020).
Group V secreted phospholipase A2 plays a protective role against aortic dissection. The Journal of biological chemistry, 295(30), 10092-10111. [PubMed:32482892] [PMC] [WorldCat] [DOI] - ↑
Escoffier, J., Jemel, I., Tanemoto, A., Taketomi, Y., Payre, C., Coatrieux, C., ..., & Arnoult, C. (2010).
Group X phospholipase A2 is released during sperm acrosome reaction and controls fertility outcome in mice. The Journal of clinical investigation, 120(5), 1415-28. [PubMed:20424324] [PMC] [WorldCat] [DOI] - ↑
Murase, R., Sato, H., Yamamoto, K., Ushida, A., Nishito, Y., Ikeda, K., ..., & Murakami, M. (2016).
Group X Secreted Phospholipase A2 Releases ω3 Polyunsaturated Fatty Acids, Suppresses Colitis, and Promotes Sperm Fertility. The Journal of biological chemistry, 291(13), 6895-911. [PubMed:26828067] [PMC] [WorldCat] [DOI] - ↑
Henderson, W.R., Chi, E.Y., Bollinger, J.G., Tien, Y.T., Ye, X., Castelli, L., ..., & Gelb, M.H. (2007).
Importance of group X-secreted phospholipase A2 in allergen-induced airway inflammation and remodeling in a mouse asthma model. The Journal of experimental medicine, 204(4), 865-77. [PubMed:17403936] [PMC] [WorldCat] [DOI] - ↑
Wilensky, R.L., Shi, Y., Mohler, E.R., Hamamdzic, D., Burgert, M.E., Li, J., ..., & Macphee, C.H. (2008).
Inhibition of lipoprotein-associated phospholipase A2 reduces complex coronary atherosclerotic plaque development. Nature medicine, 14(10), 1059-66. [PubMed:18806801] [PMC] [WorldCat] [DOI] - ↑
Shimanaka, Y., Kono, N., Taketomi, Y., Arita, M., Okayama, Y., Tanaka, Y., ..., & Arai, H. (2017).
Omega-3 fatty acid epoxides are autocrine mediators that control the magnitude of IgE-mediated mast cell activation. Nature medicine, 23(11), 1287-1297. [PubMed:29035365] [WorldCat] [DOI] - ↑
Hiraoka, M., Abe, A., Lu, Y., Yang, K., Han, X., Gross, R.W., & Shayman, J.A. (2006).
Lysosomal phospholipase A2 and phospholipidosis. Molecular and cellular biology, 26(16), 6139-48. [PubMed:16880524] [PMC] [WorldCat] [DOI] - ↑
Morishita, H., Eguchi, T., Tsukamoto, S., Sakamaki, Y., Takahashi, S., Saito, C., ..., & Mizushima, N. (2021).
Organelle degradation in the lens by PLAAT phospholipases. Nature, 592(7855), 634-638. [PubMed:33854238] [WorldCat] [DOI] - ↑
Pusch, L.M., Riegler-Berket, L., Oberer, M., Zimmermann, R., & Taschler, U. (2022).
α/β-Hydrolase Domain-Containing 6 (ABHD6)- A Multifunctional Lipid Hydrolase. Metabolites, 12(8). [PubMed:36005632] [PMC] [WorldCat] [DOI] - ↑
Blankman, J.L., Long, J.Z., Trauger, S.A., Siuzdak, G., & Cravatt, B.F. (2013).
ABHD12 controls brain lysophosphatidylserine pathways that are deregulated in a murine model of the neurodegenerative disease PHARC. Proceedings of the National Academy of Sciences of the United States of America, 110(4), 1500-5. [PubMed:23297193] [PMC] [WorldCat] [DOI] - ↑
Kamat, S.S., Camara, K., Parsons, W.H., Chen, D.H., Dix, M.M., Bird, T.D., ..., & Cravatt, B.F. (2015).
Immunomodulatory lysophosphatidylserines are regulated by ABHD16A and ABHD12 interplay. Nature chemical biology, 11(2), 164-71. [PubMed:25580854] [PMC] [WorldCat] [DOI]