「ナトリウムチャネル」の版間の差分
細編集の要約なし |
Soheisakata (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の69版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:sodium channel | |||
ナトリウムチャネルは高い選択性を持ってナトリウムイオンを透過させるイオンチャネルである。ナトリウムチャネルとしては、電位依存性ナトリウムチャネル(Navチャネル)、および上皮性ナトリウムチャネル(ENaC)が知られているが、これらは分子構造が全く異なっているため、本項目では電位依存性ナトリウムチャネルについてのみ記述する。電位依存性ナトリウムチャネルは[[wikipedia:ja:アラン・ロイド・ホジキン|ホジキン(Alan Lloyd Hodgkin)]]と[[wikipedia:ja:アンドリュー・フィールディング・ハクスりー|ハクスレー(Andrew Fielding Huxley)]]によるイカの[[wikipedia:Squid giant axon|巨大軸索]]を用いた研究によりその存在が予測され、1984年に沼博士らによって遺伝子が同定された。[[wikipedia:ja:中枢神経系|中枢神経]]や[[wikipedia:ja:末梢神経|末梢神経]]、[[wikipedia:ja:骨格筋|骨格筋]]、[[wikipedia:ja:心筋|心筋]]に存在し、[[カリウムチャネル]]とともに[[wikipedia:ja:膜電位|膜電位]]を介して機能的に共役し、[[活動電位]]の開始および伝搬に本質的な役割を担っている。 | |||
<br> | |||
== 神経細胞における分布 == | == 神経細胞における分布 == | ||
Navチャネルは広く[[神経細胞]]において発現し、[[樹状突起]]、[[細胞体]]、[[軸索]]に存在しているが、一様に発現しているのではなく、[[有髄神経]]の軸索に存在する[[ランビエ紋輪]](nodes of Ranvier)、および[[軸索起始部]](axon initial segment)に強く局在する。ランビエ紋輪とaxon initial | Navチャネルは広く[[神経細胞]]において発現し、[[樹状突起]]、[[細胞体]]、[[軸索]]に存在しているが、一様に発現しているのではなく、[[有髄神経]]の軸索に存在する[[ランビエ紋輪]](nodes of Ranvier)、および[[軸索起始部]](axon initial segment)に強く局在する。ランビエ紋輪とaxon initial segmentでのNavチャネルは、アダプタータンパク質であるアンキリンを介して細胞の裏打ち構造に繋ぎとめられることで局在が可能になっている。 | ||
[[Image:Nav channelの2次元構造.png|thumb| | == 構造 == | ||
=== 二次構造 === | |||
[[Image:Nav channelの2次元構造.png|thumb|right|482x199px|図1. 電位依存性ナトリウムチャネルの二次構造]] 脳および心筋のNavチャネルは分子量約260kのαサブユニットと1回膜貫通型のβサブユニットから構成されている。神経細胞や心筋に存在するチャネルは1つのαサブユニットとβ1、β2もしくはβ3、β4の二つのβサブユニットで構成され、骨格筋ではαサブユニットと1つのβサブユニットにより構成されている。αサブユニットは4つの相同性の高いドメインの反復で構成されており、各ドメインは6つの膜貫通ヘリックスを含んでいる(図1参照)。基本的なαサブユニットの二次構造は他の[[電位依存性イオンチャネル]](電位依存性[[カルシウムチャネル]]、電位依存性[[カリウムチャネル]]など)と同様で あり、各ドメインの最初の4つの膜貫通ヘリックス(S1-S4)は膜電位を感知する電位センサーとして働き、残りの2つ(S5,S6)はナトリウムイオンを透過させるための孔(ポアドメイン)を構成する | |||
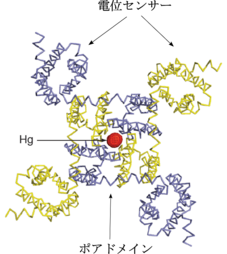
[[Image:Nachannel-TopView.png|thumb|right|229x254px|図2. 電位依存性ナトリウムチャネルの立体構造。この図ではポアドメインの中央部に、構造を決定する際に使用した水銀原子が見える。(Payandeh et al. 2011より転載)]] | |||
<br> | |||
=== 立体構造 === | |||
2011年、Catterallらは[[wikipedia:ja:真正細菌|真正細菌]]の一種であるArcobacter butzleri由来の電位依存性ナトリウムチャネル(NachBac)を用いてX線結晶構造解析を行い、その三次元構造を明らかにした<ref><pubmed> 21743477 </pubmed></ref>。[[wikipedia:ja:真核生物|真核生物]]のNavチャネルが1分子に4つのリピート構造を含んでいるのに対して、NachBacはホモ4量体として機能する。電位依存性のカリウムチャネルの構造と同様に、αサブユニットの各リピートのS5およびS6が集まってポアドメインを形成し、その四隅にS1からS4によって構成される電位センサーが配置する(図2参照)。 | |||
イオン選択性は孔が一番狭くなっているselective filterと呼ばれる部分で行われている。Navチャネルはグアニジウムなどの[[wikipedia:ja:イオン半径|イオン半径]]の大きいイオンに対してもある程度の透過性を持つことから、Navチャネルのselective filterの幅はナトリウムイオンよりも大きく、ナトリウムイオン1分子に対し、1分子の水を配位した状態で、孔を選択的に透過するという考えが提唱されてきた<ref>'''Bertil Hille''' <br>Ion Channels of Excitable Membrane third edition<br>Sinauer Associates,Inc.(Massachusetts,USA)</ref>。実際、NachBacの立体構造を見てみると、selective filterの一番狭くなっている部分の幅は、ちょうどナトリウムイオンに水分子が1つ配位したときのサイズに近いことが明らかになった。 | |||
<br> | |||
== イオン選択性 == | |||
[[Image:SelectiveFilter付近のアミノ酸配列.png|thumb|right|247x122px|図3. 電位依存性ナトリウムチャネル、およびカルシムチャネルのselective filter 付近のアミノ酸配列の比較。イオン選択性に最も重要であると考えられる部分をboxで囲んだ。]] | |||
イオン選択性に関わるselective filterは5番目のヘリックス(S5)と6番目のヘリックス(S6)の間に存在する。1価の正電荷を持つイオンの透過性はイオン半径に比例している。イオン半径の小さいプロトンに対して、非常に強い透過性を持ち、Li<sup>+</sup>≈Na<sup>+</sup>>K<sup>+</sup>>Rb<sup>+</sup>>Cs<sup>+</sup>の順に透過性が高い。またグアニジウムはK<sup>+</sup>より透過しやすい。図3に真核生物のNavチャネルのselective filterのアミノ酸配列を示した。電位依存性カルシウムチャネルでは4つのリピート、すべてがマイナス電荷を持ったグルタミン酸になっている部分が、Navチャネルでは各リピートで異なり、中には電荷を持たない アミノ酸も含まれている。ナトリウムチャネルのリピートIII, IVのリジン、アラニンのいずれかをグルタミン酸に変異させると、ナトリウムイオンだけでなく、カリウムイオン、アンモニウムイオン、さらにカルシウムイオンに対しても透過性が現れる。特に、両方ともグルタミン酸に置き換えると、ナトリウムイオンよりカルシウムイオンに対して選択的になってしまう<ref><pubmed> 1313551 </pubmed></ref>。そのためアスパラギン酸、グルタミン酸、リジン、アラニンが形成する環状の配置が、ナトリウムイオンの選択性に重要であると考えられている。 | |||
<br> | |||
== 膜電位依存的な活性化および不活性化 == | |||
一般に、イオンチャネルの電位センサーは4つの膜貫通ヘリックスで構成されており、4番目のヘッリクス(S4)に存在するリジンやアルギニンなどのプラス電荷を帯びたアミノ酸が電位の感知に重要であることが分かっている。細胞膜が脱分極すると電位センサーが動き、“ゲート“が開くことで、ナトリウムイオンが流れる。 | |||
Navチャネルは脱分極により活性化された後、”不活性化”する。不活性化とは一旦開いたチャネルを閉じておく機構で、連続的なスパイク状の活動電位の形成に必須である。またこの機構が存在することで、活動電位に不応期が生じる。不活性化には数ミリ秒単位の速い不活性化と数十ミリ秒単位の遅い不活性化の2つの機構が存在する。速い不活性化については電位依存性カリウムチャネル(Kv1、Shaker型)のメカニズムと同様のball and chain modelによる孔の細胞内側からのブロックであることが知られている。リピートIIIとリピートIVの間のリンカー部分を認識する[[wikipedia:ja:抗体|抗体]]を細胞内側から投与すると不活性化が遅くなる<ref><pubmed> 2554301 </pubmed></ref>、またリンカー部分を欠失したチャネルは不活性が著しく遅いこと<ref><pubmed> 2543931 </pubmed></ref>、さらにリンカーを欠失したチャネルに、“ball”に相当するペプチド(IFM)を細胞内側から投与すると、速い不活性化が起きることが分かっている<ref><pubmed> 8185942 </pubmed></ref>。遅い不活性化については速い不活性化ほど分子機構は明瞭ではない。ヒトの骨格筋や心筋の興奮性の異常を示すいくつかの遺伝病の研究により、遅い不活性化の異常を引き起こすアミノ酸変異が見つかっている。変異は複数の部分に渡っているため、遅い不活性化の過程には複数のドメインが関与していると考えられる。 | |||
[[ | 通常、Navチャネルは不活性化が速いため、一過的にしか内向き電流は流れないが、[[小脳]]の[[プルキンエ細胞]]をはじめ多くの神経細胞では、長時間にわたり不活性化せずに開き続ける持続的な内向き電流が存在する(持続性ナトリウム電流)。また、これに加えて小脳のプルキンエ細胞などでは、不活性化状態ののち再開口が起こりやすく(resurgent電流)、これによりスパイクの後に脱分極が引き起こされることが知られている。 | ||
<br> | |||
== αサブユニットの多様性 == | |||
[[Image:Tree.png|thumb|right|図4. αサブユニットの系統樹]] Navチャネルのαサブユニットは、[[wikipedia:ja:哺乳類|哺乳類]]では9つの[[wikipedia:ja:遺伝子|遺伝子]]が知られている。それぞれ発現場所や発生段階における発現のタイミング、および分子特性や薬理学的作用などが異なっている(表、図4参照)。Nav1.4は骨格筋、Nav1.5は心筋に多く発現し、Nav1.7、Nav1.8、Nav1.9は末梢神経に発現している。Nav1.1、Nav1.2、Nav1.3およびNav1.6は主に中枢神経で発現しているが、一部は末梢神経にも存在する。Axon initial segmentとランビエ紋輪のNavチャネルの多くはNav1.6であることが知られている。中枢神経細胞の樹状突起にもNav1.6は分布する。 | |||
またNavチャネルと似た配列を持つNaxと呼ばれるタンパク質が存在する。アミノ酸配列上、Navチャネルと同様、電位センサーおよびポアドメインに似た構造を持っているが、電位依存的にナトリウムイオンを透過させる機能を持っていない。Naxは中枢神経系などに発現し、チャネルではなくナトリウムセンサーとして働いているという報告がある<ref><pubmed> 11992118 </pubmed></ref>。 | |||
[[wikipedia:ja:サソリ|サソリ]]や[[wikipedia:ja:イソギンチャク|イソギンチャク]]、[[wikipedia:ja:クモ|クモ]]などの種々の生物毒はNavチャネルに結合することが知られているが、結合性はαサブユニット間で異なる。[[フグ毒]] | [[wikipedia:ja:サソリ|サソリ]]や[[wikipedia:ja:イソギンチャク|イソギンチャク]]、[[wikipedia:ja:クモ|クモ]]などの種々の生物毒はNavチャネルに結合することが知られているが、結合性はαサブユニット間で異なる。[[フグ毒]]として知られているテトロドトキシン(tetrodotoxin, TTX)はナトリウムチャネルの細胞外側に結合し、ナトリウムイオン透過を阻害する。テトロドトキシンは多くのナトリムチャネルに結合するが、Nav1.5、Nav1.8およびNav1.9はテトロドトキシン抵抗性である。 | ||
{| | {| cellspacing="1" cellpadding="1" border="1" align="center" style="width: 823px; height: 531px;" | ||
|+ | |+ 表. 各αサブユニットの発現場所、および機能等 | ||
|- | |- | ||
| <br> | | <br> | ||
| 43行目: | 62行目: | ||
| ヒトの遺伝病<br> | | ヒトの遺伝病<br> | ||
|- | |- | ||
| Nav1.1 <br>( | | Nav1.1 <br>(SCN1a) <br><br> | ||
| | | 中枢神経(主に神経細胞の細胞体)、心筋<br> | ||
| | | テトロドトキシン、サキシトキシン | ||
| | | 2番染色体<br> | ||
| | | 全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん<br> | ||
|- | |- | ||
| Nav.1.2<br>( | | Nav.1.2<br>(SCN2a)<br> | ||
| | | 中枢神経(主に無髄、髄鞘化前の軸索)<br> | ||
| テトロドトキシン、サキシトキシン<br> | | テトロドトキシン、サキシトキシン<br> | ||
| | | 2番染色体<br> | ||
| 全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん<br> | | 全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん<br> | ||
|- | |- | ||
| Nav1.3<br>( | | Nav1.3<br>(SCN3a)<br> | ||
| | | 中枢神経(主に初期胚)、心筋<br> | ||
| テトロドトキシン、サキシトキシン<br> | | テトロドトキシン、サキシトキシン<br> | ||
| 2番染色体<br> | | 2番染色体<br> | ||
| 全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん<br> | | 全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん<br> | ||
|- | |- | ||
| Nav1.4<br>( | | Nav1.4<br>(SCN4a)<br> | ||
| 骨格筋<br> | | 骨格筋<br> | ||
| μ- | | μ-コノトキシン、テトロドトキシン、サキシトキシン<br> | ||
| | | 17番染色体<br> | ||
| | | 高カリウム性周期性四肢麻痺、筋硬直症<br> | ||
|- | |- | ||
| Nav1.5<br>( | | Nav1.5<br>(SCN5a)<br> | ||
| 心筋、脳の一部<br> | | 心筋、脳の一部<br> | ||
| テトロドトキシン抵抗性、サキシトキシン抵抗性<br> | | テトロドトキシン抵抗性、サキシトキシン抵抗性<br> | ||
| | | 3番染色体<br> | ||
| [[wikipedia: | | 先天性QT延長症候群、[[wikipedia:ja:ブルガダ症候群|ブルガダ症候群]]<br> | ||
|- | |- | ||
| Nav1.6<br>( | | Nav1.6<br>(SCN8a<br> | ||
| 脳、有髄および[[後根神経節]]細胞<br> | | 脳、有髄および[[wikipedia:ja:後根神経節|後根神経節]]細胞<br> | ||
| <br> | | <br> | ||
| 12番染色体<br> | | 12番染色体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| Nav1.7<br>( | | Nav1.7<br>(SCN9a<br> | ||
| | | 後根神経節細胞、交感神経、[[シュワン細胞]]<br> | ||
| テトロドトキシン、サキシトキシン<br> | | テトロドトキシン、サキシトキシン<br> | ||
| 2番染色体<br> | | 2番染色体<br> | ||
| | | 無痛症、先端紅痛症<br> | ||
|- | |- | ||
| Nav1.8<br>( | | Nav1.8<br>(SCN10a)<br> | ||
| 後根神経節細胞<br> | | 後根神経節細胞<br> | ||
| テトロドトキシン抵抗性<br> | | テトロドトキシン抵抗性<br> | ||
| | | 3番染色体<br> | ||
| <br> | | <br> | ||
|- | |- | ||
| Nav1.9<br>( | | Nav1.9<br>(SCN11a)<br> | ||
| 後根神経節細胞、[[wikipedia:ja:三叉神経|三叉神経]]<br> | | 後根神経節細胞、[[wikipedia:ja:三叉神経|三叉神経]]<br> | ||
| テトロドトキシン抵抗性<br> | | テトロドトキシン抵抗性<br> | ||
| | | 3番染色体<br> | ||
| <br> | | <br> | ||
|} | |} | ||
<br> | |||
== βサブユニット == | |||
βサブユニットは1回膜貫通型のサブユニットで、β1からβ4まで4種類存在する。これまでの研究によりαサブユニットだけでも、電位依存的にナトリウムチャネルを透過させる機能を保持していることが分かっているが、βサブユニットはαサブユニットと共に存在することで、ナトリウムチャネルの機能を変える。またすべてのβサブユニットは細胞外側に細胞接着に関わる分子に見られるイムノグロブリンドメインを持っている。そのため一部のβサブユニットは、チャネルの機能を補完するだけでなく、種々の細胞接着因子と結合し、細胞運動や[[wikipedia:ja:細胞接着|細胞接着]]、[[wikipedia:neurite|神経突起]]の伸長に重要な役割を担っていることが知られている。またβ4は細胞内側からのblocking particleとして作用し、resurgent電流の形成に関わることが示唆されている。 | |||
== 薬剤による機能の修飾 == | == 薬剤による機能の修飾 == | ||
Navチャネルに特異的に結合し、その性質を変える種々の薬剤が知られている(表参照)。最も早く発見されたのは、フグ毒として知られているテトロドトキシンで、ナトリウムチャネルのポアドメインに結合して、イオン透過を阻害する。β-サソリ毒はナトリウムチャネルの電位センサー部分に結合し、不活性化を阻害する。また、アコニチニン、グラヤノトキシン、ベラトリジン、バトラコトキシンは[[wikipedia:ja:細胞膜|細胞膜]]を透過し、細胞の内側からナトリウムチャネルに結合して、ナトリウムチャネルが開いている時間を長くする作用がある。また局所[[wikipedia:ja:麻酔|麻酔薬]]として知られているリドカインは不活性化状態を安定化し電流量を減らす作用がある。 | |||
== 転写の制御 == | == 転写の制御 == | ||
Nav1. | Nav1.2遺伝子の転写調節には転写抑制因子REST/NRSFが関わっている。通常、神経細胞由来の培養細胞(PC12 cell)では、神経細胞成長因子(neural growth factor) により神経突起の形成が誘導される。しかしながらREST/NRSFを発現させると、神経突起の形成が見られなくなり、ナトリウム電流も計測されない<ref><pubmed> 11516394 </pubmed></ref>。神経細胞以外の細胞ではREST/NRSFが発現し、他の多くの神経細胞特異的に発現する遺伝子の転写を抑制するとともに、Nav1.2の転写を抑制していると考えられている。<br> | ||
== リン酸化による制御 == | == リン酸化による制御 == | ||
| 138行目: | 135行目: | ||
=== プロテインキナーゼAによるリン酸化 === | === プロテインキナーゼAによるリン酸化 === | ||
[[wikipedia:ja:ラット|ラット]] | [[wikipedia:ja:ラット|ラット]]の神経系のナトリウムチャネルでは、リピートIとIIの間の細胞内側のリンカー部分に、[[wikipedia:ja:プロテインキナーゼ|プロテインキナーゼA(PKA)]]により[[wikipedia:ja:リン酸化|リン酸化]]を受けるコンセンサス配列が存在し、実際にリン酸化されていることが示されている。リン酸化によりチャネルの開口確率が減り、電流が減少する。また、ホスファターゼ2A、およびカルシニューリンが、この部位を脱リン酸化することも知られている。 | ||
=== プロテインキナーゼCによるリン酸化 === | === プロテインキナーゼCによるリン酸化 === | ||
リピートIIIとリピートIVの間の細胞内側リンカー部分は、速い不活性化に重要であるが、この部位は[[ | リピートIIIとリピートIVの間の細胞内側リンカー部分は、速い不活性化に重要であるが、この部位は[[wikipedia:ja:プロテインキナーゼ|プロテインキナーゼC(PKC)]]によるリン酸化サイトでもある。リン酸化をされると不活性化が遅くなるのと同時に、同じ電位で比べたときに最大電流量が半分程度までに減少する。[[wikipedia:ja:海馬|海馬]]の培養神経細胞では[[wikipedia:ja:アセチルコリン受容体|ムスカリン性アセリルコリン受容体]]を刺激すると、ナトリウムチャネルがPKCを介してリン酸化されることが示されている<ref><pubmed> 8630240 </pubmed></ref>。 | ||
== | == RNA editing == | ||
[[ショウジョウバエ]]のNavチャネルには、[[ | [[wikipedia:ja:ショウジョウバエ|ショウジョウバエ]]のNavチャネルには、[[wikipedia:RNA editing|RNA editing]]が存在していることが知られている<ref><pubmed> 10414281 </pubmed></ref>。ショウジョウバエのナトリウムチャネルをコードしている[[wikipedia:ja:遺伝子座|遺伝子座]](para)には、少なくとも10か所の[[wikipedia:ja:選択的スプライシング|選択的スプライシング]]を受けるサイトが知られている。ここから転写されるアイソフォームの多くは、[[wikipedia:ja:アデノシン|アデノシン]]が[[wikipedia:ja:イノシン|イノシン]]に“編集”されるRNA editingを受けている。これまでのところナトリウムチャネルのRNA editingは、[[wikipedia:ja:昆虫|昆虫]]でのみ報告されており、哺乳類を含め他の生物種では見られていない。 | ||
== チャネル病 == | == チャネル病 == | ||
Navチャネルは活動電位の形成に本質的な役割を担っており、変異が生じると重篤な病気の原因となる。骨格筋に発現しているNav1.4のαサブユニットにおけるある種の変異は、家族性の[[周期性四肢麻痺]]や[[筋強直症]]を引き起こす。高カリウム性の周期性四肢麻痺では、Nav1.4の不活性化が不完全になり、持続的にナトリウム電流が流れる。そのため膜の再分極が浅くなり、Navチャネルの不活性化が解除されなくなる。その結果、活動電位が伝搬しなくなり筋の麻痺が生じる<ref><pubmed> 1849724 </pubmed></ref> <ref><pubmed> 8382500 </pubmed></ref>。 | Navチャネルは活動電位の形成に本質的な役割を担っており、変異が生じると重篤な病気の原因となる。骨格筋に発現しているNav1.4のαサブユニットにおけるある種の変異は、家族性の[[wikipedia:ja:周期性四肢麻痺|周期性四肢麻痺]]や[[wikipedia:Myotonia congenita|筋強直症]]を引き起こす。高カリウム性の周期性四肢麻痺では、Nav1.4の不活性化が不完全になり、持続的にナトリウム電流が流れる。そのため膜の再分極が浅くなり、Navチャネルの不活性化が解除されなくなる。その結果、活動電位が伝搬しなくなり筋の麻痺が生じる<ref><pubmed> 1849724 </pubmed></ref> <ref><pubmed> 8382500 </pubmed></ref>。 | ||
また心筋に発現しているNav1.5の変異は、[[ | また心筋に発現しているNav1.5の変異は、[[wikipedia:Long QT syndrome|先天性QT延長症候群(LQT)]]、特発性の[[wikipedia:ja:心室細動|心室細動]]等の[[wikipedia:ja:不整脈|不整脈]]を引き起こす。LQTを引き起こす変異は複数存在するが、その多くはチャネルの不活性化が不完全になる変異である<ref><pubmed> 8917568 </pubmed></ref> <ref><pubmed> 7651517 </pubmed></ref> <ref><pubmed> 8620612 </pubmed></ref>。このため持続的にナトリウム電流が流れ膜の再分極が遅れるため、QT間隔が伸長する。LQTの患者のうちNav1.5に変異を持つのは約10%である。 | ||
中枢神経系で発現しているNav1. | 中枢神経系で発現しているNav1.1の変異は[[てんかん]]の原因になる。これまで、[[wikipedia:Generalized epilepsy with febrile seizures plus|全般てんかん熱性痙攣プラス(generalized epilepsy with febrile seizures plus, GEFS+)]]および[[wikipedia:SMEI|乳児重症ミオクロニーてんかん(severe myoclonic epilepsy of infant, SMEI)]]を引き起こすNav1.1の変異が多数例、報告されている。不活性化が不完全になり持続的にナトリウム電流が流れるような変異や、不活性化がより高い電位で起こるような変異が報告されている。またGEFS+を引き起こす変異はβ1サブユニットにも見だされ、この変異を持ったβサブユニットは、αサブユニットの機能の調整をすることができない<ref><pubmed> 12486163 </pubmed></ref> <ref><pubmed> 9697698 </pubmed></ref>。 侵害受容に関わる[[wikipedia:sensory neuron|一次知覚ニューロン]]に発現しているNav1.7の変異は、[[wikipedia:ja:先天性無痛無汗症|先天性の無痛症(congenital insensitivity to pain, CIP)]]や[[wikipedia:erythromelalgia|先端紅痛症(erythromelalgia, IEM)]]、[[wikipedia:paroxysmal extreme pain disorder|発作性の神経痛(paroxysmal extreme pain disorder, PEPD)]]に関わっている。これまで知られているCIPを引き起こす変異はすべてNav1.7をコードする遺伝子の途中に[[wikipedia:ja:終止コドン|終止コドン]]が挿入され、チャネルとしての機能を喪失することが分かっている<ref name="refa"><pubmed> 20101409 </pubmed></ref>。またIEMでは遺伝子の変異により、低い電位でナトリウムチャネルが開口するため、[[閾値]]が低くなり活動電位が生じやすくなる17。PEPDの患者では速い不活性化に関わっているリピートIIIとIVの間に変異が見つかっている。この変異を持ったナトリウムチャネルは速い不活性化が起こる膜電位が高い電位にシフトする。そのため低い膜電位でも電気的に興奮しやすくなり、PEPDの症状が現れると考えられている<ref name="refa" />。 | ||
== | == 参考文献 == | ||
<references /> | |||
< | <br> (執筆者:坂田宗平、岡村康司 担当編集委員:林康紀) | ||
2012年5月7日 (月) 14:55時点における版
英語名:sodium channel
ナトリウムチャネルは高い選択性を持ってナトリウムイオンを透過させるイオンチャネルである。ナトリウムチャネルとしては、電位依存性ナトリウムチャネル(Navチャネル)、および上皮性ナトリウムチャネル(ENaC)が知られているが、これらは分子構造が全く異なっているため、本項目では電位依存性ナトリウムチャネルについてのみ記述する。電位依存性ナトリウムチャネルはホジキン(Alan Lloyd Hodgkin)とハクスレー(Andrew Fielding Huxley)によるイカの巨大軸索を用いた研究によりその存在が予測され、1984年に沼博士らによって遺伝子が同定された。中枢神経や末梢神経、骨格筋、心筋に存在し、カリウムチャネルとともに膜電位を介して機能的に共役し、活動電位の開始および伝搬に本質的な役割を担っている。
神経細胞における分布
Navチャネルは広く神経細胞において発現し、樹状突起、細胞体、軸索に存在しているが、一様に発現しているのではなく、有髄神経の軸索に存在するランビエ紋輪(nodes of Ranvier)、および軸索起始部(axon initial segment)に強く局在する。ランビエ紋輪とaxon initial segmentでのNavチャネルは、アダプタータンパク質であるアンキリンを介して細胞の裏打ち構造に繋ぎとめられることで局在が可能になっている。
構造
二次構造

脳および心筋のNavチャネルは分子量約260kのαサブユニットと1回膜貫通型のβサブユニットから構成されている。神経細胞や心筋に存在するチャネルは1つのαサブユニットとβ1、β2もしくはβ3、β4の二つのβサブユニットで構成され、骨格筋ではαサブユニットと1つのβサブユニットにより構成されている。αサブユニットは4つの相同性の高いドメインの反復で構成されており、各ドメインは6つの膜貫通ヘリックスを含んでいる(図1参照)。基本的なαサブユニットの二次構造は他の電位依存性イオンチャネル(電位依存性カルシウムチャネル、電位依存性カリウムチャネルなど)と同様で あり、各ドメインの最初の4つの膜貫通ヘリックス(S1-S4)は膜電位を感知する電位センサーとして働き、残りの2つ(S5,S6)はナトリウムイオンを透過させるための孔(ポアドメイン)を構成する
立体構造
2011年、Catterallらは真正細菌の一種であるArcobacter butzleri由来の電位依存性ナトリウムチャネル(NachBac)を用いてX線結晶構造解析を行い、その三次元構造を明らかにした[1]。真核生物のNavチャネルが1分子に4つのリピート構造を含んでいるのに対して、NachBacはホモ4量体として機能する。電位依存性のカリウムチャネルの構造と同様に、αサブユニットの各リピートのS5およびS6が集まってポアドメインを形成し、その四隅にS1からS4によって構成される電位センサーが配置する(図2参照)。
イオン選択性は孔が一番狭くなっているselective filterと呼ばれる部分で行われている。Navチャネルはグアニジウムなどのイオン半径の大きいイオンに対してもある程度の透過性を持つことから、Navチャネルのselective filterの幅はナトリウムイオンよりも大きく、ナトリウムイオン1分子に対し、1分子の水を配位した状態で、孔を選択的に透過するという考えが提唱されてきた[2]。実際、NachBacの立体構造を見てみると、selective filterの一番狭くなっている部分の幅は、ちょうどナトリウムイオンに水分子が1つ配位したときのサイズに近いことが明らかになった。
イオン選択性
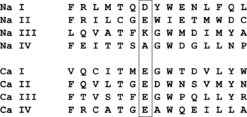
イオン選択性に関わるselective filterは5番目のヘリックス(S5)と6番目のヘリックス(S6)の間に存在する。1価の正電荷を持つイオンの透過性はイオン半径に比例している。イオン半径の小さいプロトンに対して、非常に強い透過性を持ち、Li+≈Na+>K+>Rb+>Cs+の順に透過性が高い。またグアニジウムはK+より透過しやすい。図3に真核生物のNavチャネルのselective filterのアミノ酸配列を示した。電位依存性カルシウムチャネルでは4つのリピート、すべてがマイナス電荷を持ったグルタミン酸になっている部分が、Navチャネルでは各リピートで異なり、中には電荷を持たない アミノ酸も含まれている。ナトリウムチャネルのリピートIII, IVのリジン、アラニンのいずれかをグルタミン酸に変異させると、ナトリウムイオンだけでなく、カリウムイオン、アンモニウムイオン、さらにカルシウムイオンに対しても透過性が現れる。特に、両方ともグルタミン酸に置き換えると、ナトリウムイオンよりカルシウムイオンに対して選択的になってしまう[3]。そのためアスパラギン酸、グルタミン酸、リジン、アラニンが形成する環状の配置が、ナトリウムイオンの選択性に重要であると考えられている。
膜電位依存的な活性化および不活性化
一般に、イオンチャネルの電位センサーは4つの膜貫通ヘリックスで構成されており、4番目のヘッリクス(S4)に存在するリジンやアルギニンなどのプラス電荷を帯びたアミノ酸が電位の感知に重要であることが分かっている。細胞膜が脱分極すると電位センサーが動き、“ゲート“が開くことで、ナトリウムイオンが流れる。
Navチャネルは脱分極により活性化された後、”不活性化”する。不活性化とは一旦開いたチャネルを閉じておく機構で、連続的なスパイク状の活動電位の形成に必須である。またこの機構が存在することで、活動電位に不応期が生じる。不活性化には数ミリ秒単位の速い不活性化と数十ミリ秒単位の遅い不活性化の2つの機構が存在する。速い不活性化については電位依存性カリウムチャネル(Kv1、Shaker型)のメカニズムと同様のball and chain modelによる孔の細胞内側からのブロックであることが知られている。リピートIIIとリピートIVの間のリンカー部分を認識する抗体を細胞内側から投与すると不活性化が遅くなる[4]、またリンカー部分を欠失したチャネルは不活性が著しく遅いこと[5]、さらにリンカーを欠失したチャネルに、“ball”に相当するペプチド(IFM)を細胞内側から投与すると、速い不活性化が起きることが分かっている[6]。遅い不活性化については速い不活性化ほど分子機構は明瞭ではない。ヒトの骨格筋や心筋の興奮性の異常を示すいくつかの遺伝病の研究により、遅い不活性化の異常を引き起こすアミノ酸変異が見つかっている。変異は複数の部分に渡っているため、遅い不活性化の過程には複数のドメインが関与していると考えられる。
通常、Navチャネルは不活性化が速いため、一過的にしか内向き電流は流れないが、小脳のプルキンエ細胞をはじめ多くの神経細胞では、長時間にわたり不活性化せずに開き続ける持続的な内向き電流が存在する(持続性ナトリウム電流)。また、これに加えて小脳のプルキンエ細胞などでは、不活性化状態ののち再開口が起こりやすく(resurgent電流)、これによりスパイクの後に脱分極が引き起こされることが知られている。
αサブユニットの多様性
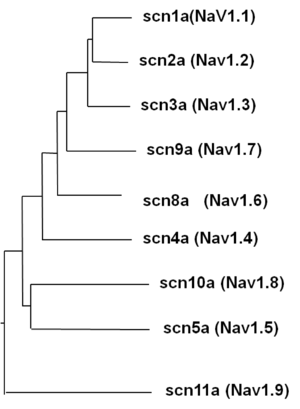
Navチャネルのαサブユニットは、哺乳類では9つの遺伝子が知られている。それぞれ発現場所や発生段階における発現のタイミング、および分子特性や薬理学的作用などが異なっている(表、図4参照)。Nav1.4は骨格筋、Nav1.5は心筋に多く発現し、Nav1.7、Nav1.8、Nav1.9は末梢神経に発現している。Nav1.1、Nav1.2、Nav1.3およびNav1.6は主に中枢神経で発現しているが、一部は末梢神経にも存在する。Axon initial segmentとランビエ紋輪のNavチャネルの多くはNav1.6であることが知られている。中枢神経細胞の樹状突起にもNav1.6は分布する。
またNavチャネルと似た配列を持つNaxと呼ばれるタンパク質が存在する。アミノ酸配列上、Navチャネルと同様、電位センサーおよびポアドメインに似た構造を持っているが、電位依存的にナトリウムイオンを透過させる機能を持っていない。Naxは中枢神経系などに発現し、チャネルではなくナトリウムセンサーとして働いているという報告がある[7]。
サソリやイソギンチャク、クモなどの種々の生物毒はNavチャネルに結合することが知られているが、結合性はαサブユニット間で異なる。フグ毒として知られているテトロドトキシン(tetrodotoxin, TTX)はナトリウムチャネルの細胞外側に結合し、ナトリウムイオン透過を阻害する。テトロドトキシンは多くのナトリムチャネルに結合するが、Nav1.5、Nav1.8およびNav1.9はテトロドトキシン抵抗性である。
| 発現場所 |
阻害剤 |
ヒトにおける染色体上の遺伝子の位置 |
ヒトの遺伝病 | |
| Nav1.1 (SCN1a) |
中枢神経(主に神経細胞の細胞体)、心筋 |
テトロドトキシン、サキシトキシン | 2番染色体 |
全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん |
| Nav.1.2 (SCN2a) |
中枢神経(主に無髄、髄鞘化前の軸索) |
テトロドトキシン、サキシトキシン |
2番染色体 |
全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん |
| Nav1.3 (SCN3a) |
中枢神経(主に初期胚)、心筋 |
テトロドトキシン、サキシトキシン |
2番染色体 |
全般性てんかん熱性痙攣プラス、乳児重症ミオクロニーてんかん |
| Nav1.4 (SCN4a) |
骨格筋 |
μ-コノトキシン、テトロドトキシン、サキシトキシン |
17番染色体 |
高カリウム性周期性四肢麻痺、筋硬直症 |
| Nav1.5 (SCN5a) |
心筋、脳の一部 |
テトロドトキシン抵抗性、サキシトキシン抵抗性 |
3番染色体 |
先天性QT延長症候群、ブルガダ症候群 |
| Nav1.6 (SCN8a |
脳、有髄および後根神経節細胞 |
12番染色体 |
||
| Nav1.7 (SCN9a |
後根神経節細胞、交感神経、シュワン細胞 |
テトロドトキシン、サキシトキシン |
2番染色体 |
無痛症、先端紅痛症 |
| Nav1.8 (SCN10a) |
後根神経節細胞 |
テトロドトキシン抵抗性 |
3番染色体 |
|
| Nav1.9 (SCN11a) |
後根神経節細胞、三叉神経 |
テトロドトキシン抵抗性 |
3番染色体 |
βサブユニット
βサブユニットは1回膜貫通型のサブユニットで、β1からβ4まで4種類存在する。これまでの研究によりαサブユニットだけでも、電位依存的にナトリウムチャネルを透過させる機能を保持していることが分かっているが、βサブユニットはαサブユニットと共に存在することで、ナトリウムチャネルの機能を変える。またすべてのβサブユニットは細胞外側に細胞接着に関わる分子に見られるイムノグロブリンドメインを持っている。そのため一部のβサブユニットは、チャネルの機能を補完するだけでなく、種々の細胞接着因子と結合し、細胞運動や細胞接着、神経突起の伸長に重要な役割を担っていることが知られている。またβ4は細胞内側からのblocking particleとして作用し、resurgent電流の形成に関わることが示唆されている。
薬剤による機能の修飾
Navチャネルに特異的に結合し、その性質を変える種々の薬剤が知られている(表参照)。最も早く発見されたのは、フグ毒として知られているテトロドトキシンで、ナトリウムチャネルのポアドメインに結合して、イオン透過を阻害する。β-サソリ毒はナトリウムチャネルの電位センサー部分に結合し、不活性化を阻害する。また、アコニチニン、グラヤノトキシン、ベラトリジン、バトラコトキシンは細胞膜を透過し、細胞の内側からナトリウムチャネルに結合して、ナトリウムチャネルが開いている時間を長くする作用がある。また局所麻酔薬として知られているリドカインは不活性化状態を安定化し電流量を減らす作用がある。
転写の制御
Nav1.2遺伝子の転写調節には転写抑制因子REST/NRSFが関わっている。通常、神経細胞由来の培養細胞(PC12 cell)では、神経細胞成長因子(neural growth factor) により神経突起の形成が誘導される。しかしながらREST/NRSFを発現させると、神経突起の形成が見られなくなり、ナトリウム電流も計測されない[8]。神経細胞以外の細胞ではREST/NRSFが発現し、他の多くの神経細胞特異的に発現する遺伝子の転写を抑制するとともに、Nav1.2の転写を抑制していると考えられている。
リン酸化による制御
プロテインキナーゼAによるリン酸化
ラットの神経系のナトリウムチャネルでは、リピートIとIIの間の細胞内側のリンカー部分に、プロテインキナーゼA(PKA)によりリン酸化を受けるコンセンサス配列が存在し、実際にリン酸化されていることが示されている。リン酸化によりチャネルの開口確率が減り、電流が減少する。また、ホスファターゼ2A、およびカルシニューリンが、この部位を脱リン酸化することも知られている。
プロテインキナーゼCによるリン酸化
リピートIIIとリピートIVの間の細胞内側リンカー部分は、速い不活性化に重要であるが、この部位はプロテインキナーゼC(PKC)によるリン酸化サイトでもある。リン酸化をされると不活性化が遅くなるのと同時に、同じ電位で比べたときに最大電流量が半分程度までに減少する。海馬の培養神経細胞ではムスカリン性アセリルコリン受容体を刺激すると、ナトリウムチャネルがPKCを介してリン酸化されることが示されている[9]。
RNA editing
ショウジョウバエのNavチャネルには、RNA editingが存在していることが知られている[10]。ショウジョウバエのナトリウムチャネルをコードしている遺伝子座(para)には、少なくとも10か所の選択的スプライシングを受けるサイトが知られている。ここから転写されるアイソフォームの多くは、アデノシンがイノシンに“編集”されるRNA editingを受けている。これまでのところナトリウムチャネルのRNA editingは、昆虫でのみ報告されており、哺乳類を含め他の生物種では見られていない。
チャネル病
Navチャネルは活動電位の形成に本質的な役割を担っており、変異が生じると重篤な病気の原因となる。骨格筋に発現しているNav1.4のαサブユニットにおけるある種の変異は、家族性の周期性四肢麻痺や筋強直症を引き起こす。高カリウム性の周期性四肢麻痺では、Nav1.4の不活性化が不完全になり、持続的にナトリウム電流が流れる。そのため膜の再分極が浅くなり、Navチャネルの不活性化が解除されなくなる。その結果、活動電位が伝搬しなくなり筋の麻痺が生じる[11] [12]。
また心筋に発現しているNav1.5の変異は、先天性QT延長症候群(LQT)、特発性の心室細動等の不整脈を引き起こす。LQTを引き起こす変異は複数存在するが、その多くはチャネルの不活性化が不完全になる変異である[13] [14] [15]。このため持続的にナトリウム電流が流れ膜の再分極が遅れるため、QT間隔が伸長する。LQTの患者のうちNav1.5に変異を持つのは約10%である。
中枢神経系で発現しているNav1.1の変異はてんかんの原因になる。これまで、全般てんかん熱性痙攣プラス(generalized epilepsy with febrile seizures plus, GEFS+)および乳児重症ミオクロニーてんかん(severe myoclonic epilepsy of infant, SMEI)を引き起こすNav1.1の変異が多数例、報告されている。不活性化が不完全になり持続的にナトリウム電流が流れるような変異や、不活性化がより高い電位で起こるような変異が報告されている。またGEFS+を引き起こす変異はβ1サブユニットにも見だされ、この変異を持ったβサブユニットは、αサブユニットの機能の調整をすることができない[16] [17]。 侵害受容に関わる一次知覚ニューロンに発現しているNav1.7の変異は、先天性の無痛症(congenital insensitivity to pain, CIP)や先端紅痛症(erythromelalgia, IEM)、発作性の神経痛(paroxysmal extreme pain disorder, PEPD)に関わっている。これまで知られているCIPを引き起こす変異はすべてNav1.7をコードする遺伝子の途中に終止コドンが挿入され、チャネルとしての機能を喪失することが分かっている[18]。またIEMでは遺伝子の変異により、低い電位でナトリウムチャネルが開口するため、閾値が低くなり活動電位が生じやすくなる17。PEPDの患者では速い不活性化に関わっているリピートIIIとIVの間に変異が見つかっている。この変異を持ったナトリウムチャネルは速い不活性化が起こる膜電位が高い電位にシフトする。そのため低い膜電位でも電気的に興奮しやすくなり、PEPDの症状が現れると考えられている[18]。
参考文献
- ↑
Payandeh, J., Scheuer, T., Zheng, N., & Catterall, W.A. (2011).
The crystal structure of a voltage-gated sodium channel. Nature, 475(7356), 353-8. [PubMed:21743477] [PMC] [WorldCat] [DOI] - ↑ Bertil Hille
Ion Channels of Excitable Membrane third edition
Sinauer Associates,Inc.(Massachusetts,USA) - ↑
Heinemann, S.H., Terlau, H., Stühmer, W., Imoto, K., & Numa, S. (1992).
Calcium channel characteristics conferred on the sodium channel by single mutations. Nature, 356(6368), 441-3. [PubMed:1313551] [WorldCat] [DOI] - ↑
Vassilev, P., Scheuer, T., & Catterall, W.A. (1989).
Inhibition of inactivation of single sodium channels by a site-directed antibody. Proceedings of the National Academy of Sciences of the United States of America, 86(20), 8147-51. [PubMed:2554301] [PMC] [WorldCat] [DOI] - ↑
Stühmer, W., Conti, F., Suzuki, H., Wang, X.D., Noda, M., Yahagi, N., ..., & Numa, S. (1989).
Structural parts involved in activation and inactivation of the sodium channel. Nature, 339(6226), 597-603. [PubMed:2543931] [WorldCat] [DOI] - ↑
Eaholtz, G., Scheuer, T., & Catterall, W.A. (1994).
Restoration of inactivation and block of open sodium channels by an inactivation gate peptide. Neuron, 12(5), 1041-8. [PubMed:8185942] [WorldCat] [DOI] - ↑
Hiyama, T.Y., Watanabe, E., Ono, K., Inenaga, K., Tamkun, M.M., Yoshida, S., & Noda, M. (2002).
Na(x) channel involved in CNS sodium-level sensing. Nature neuroscience, 5(6), 511-2. [PubMed:11992118] [WorldCat] [DOI] - ↑
Ballas, N., Battaglioli, E., Atouf, F., Andres, M.E., Chenoweth, J., Anderson, M.E., ..., & Mandel, G. (2001).
Regulation of neuronal traits by a novel transcriptional complex. Neuron, 31(3), 353-65. [PubMed:11516394] [WorldCat] [DOI] - ↑
Cantrell, A.R., Ma, J.Y., Scheuer, T., & Catterall, W.A. (1996).
Muscarinic modulation of sodium current by activation of protein kinase C in rat hippocampal neurons. Neuron, 16(5), 1019-26. [PubMed:8630240] [WorldCat] [DOI] - ↑
Hanrahan, C.J., Palladino, M.J., Bonneau, L.J., & Reenan, R.A. (1999).
RNA editing of a Drosophila sodium channel gene. Annals of the New York Academy of Sciences, 868, 51-66. [PubMed:10414281] [WorldCat] [DOI] - ↑
Cannon, S.C., Brown, R.H., & Corey, D.P. (1991).
A sodium channel defect in hyperkalemic periodic paralysis: potassium-induced failure of inactivation. Neuron, 6(4), 619-26. [PubMed:1849724] [WorldCat] [DOI] - ↑
Cannon, S.C., & Strittmatter, S.M. (1993).
Functional expression of sodium channel mutations identified in families with periodic paralysis. Neuron, 10(2), 317-26. [PubMed:8382500] [WorldCat] [DOI] - ↑
Wang, D.W., Yazawa, K., George, A.L., & Bennett, P.B. (1996).
Characterization of human cardiac Na+ channel mutations in the congenital long QT syndrome. Proceedings of the National Academy of Sciences of the United States of America, 93(23), 13200-5. [PubMed:8917568] [PMC] [WorldCat] [DOI] - ↑
Bennett, P.B., Yazawa, K., Makita, N., & George, A.L. (1995).
Molecular mechanism for an inherited cardiac arrhythmia. Nature, 376(6542), 683-5. [PubMed:7651517] [WorldCat] [DOI] - ↑
Dumaine, R., Wang, Q., Keating, M.T., Hartmann, H.A., Schwartz, P.J., Brown, A.M., & Kirsch, G.E. (1996).
Multiple mechanisms of Na+ channel--linked long-QT syndrome. Circulation research, 78(5), 916-24. [PubMed:8620612] [WorldCat] [DOI] - ↑
Meadows, L.S., Malhotra, J., Loukas, A., Thyagarajan, V., Kazen-Gillespie, K.A., Koopman, M.C., ..., & Ragsdale, D.S. (2002).
Functional and biochemical analysis of a sodium channel beta1 subunit mutation responsible for generalized epilepsy with febrile seizures plus type 1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(24), 10699-709. [PubMed:12486163] [PMC] [WorldCat] - ↑
Wallace, R.H., Wang, D.W., Singh, R., Scheffer, I.E., George, A.L., Phillips, H.A., ..., & Mulley, J.C. (1998).
Febrile seizures and generalized epilepsy associated with a mutation in the Na+-channel beta1 subunit gene SCN1B. Nature genetics, 19(4), 366-70. [PubMed:9697698] [WorldCat] [DOI] - ↑ 18.0 18.1
Lampert, A., O'Reilly, A.O., Reeh, P., & Leffler, A. (2010).
Sodium channelopathies and pain. Pflugers Archiv : European journal of physiology, 460(2), 249-63. [PubMed:20101409] [WorldCat] [DOI]
(執筆者:坂田宗平、岡村康司 担当編集委員:林康紀)