SNARE複合体
英語名:Soluble NSF Attachment protein REceptor complex
細胞内小胞輸送や開口分泌が起こるためには、輸送小胞膜やシナプス小胞膜と標的となる生体膜との融合が起こることが不可欠である。SNAREタンパク質は、これらの膜融合を誘発する役割を担うタンパク質で、小胞膜にあるv-SNAREと標的膜にあるt-SNAREとが、分子内にあるSNAREモチーフを介して会合しSNARE複合体を形成することで膜融合が引き起こされる。シナプス小胞に貯蔵される神経伝達物質の放出にもSNAREタンパク質が関与しているが、神経終末への活動電位の到達後数ミリ秒以内に素早く放出するため、シナプスでのSNARE複合体形成は様々なタンパク質によって巧みに制御されている。シナプス前膜に融合したシナプス小胞膜はエンドサイトーシスによって回収され再びシナプス小胞が作られ、そのためにはSNARE複合体を解離させる必要がある。吸エルゴン反応であるSNARE複合体の解離に必要な自由エネルギーはNSFと呼ばれるATPaseがATPを加水分解することで供給される。SNAREタンパク質は4つの主サブファミリーから構成されるファミリータンパク質で、異なる組み合わせのSNAREタンパク質が様々な細胞内小胞輸送系に関わっている。さらにSNAREタンパク質は開口放出による細胞膜タンパク質の細胞膜への組み込みや、細胞膜の伸長などにも関与している。
イントロダクション
細胞膜での開口放出や細胞内小胞輸送では、小胞膜が標的とする細胞膜や細胞内小胞膜に融合する過程が必須である。脂質膜同士の融合は自然には起こりにくく、効率的に引き起こすためにはタンパク質の助けが必要である。CHO(Chinese Hamster Ovary)細胞を用いた研究から、細胞内小胞輸送に必須なタンパク質としてNSF (N-ethylmaleimide-sensitive factor)とSNAP (Soluble NSF Attachment Protein)が特定された[1]。脳からNSF/αSNAP複合体に結合するタンパク質としてシンタキシン1 (syntaxin 1)、SNAP-25およびシナプトブレビン2 (VAMP-2とも呼ばれる)が同定され、SNARE (SNAP Receptor)と総称された[2]。SNAREタンパク質は分子内に8回のheptad repeatからなるSNAREモチーフを持ち、coiled-coil複合体を形成する性質がある。リコンビナントタンパク質や脳から調整された内在性のタンパク質を用いた免疫沈降法などで、シンタキシン1、 SNAP-25およびシナプトブレビン2が複合体を形成することが示された[3, 4]。X線解析やNMR解析の結果、SNARE複合体はSNAREモチーフを持つ4本のへリックスからなる複合体であることが示された[5]。シンタキシン1 、SNAP-25、シナプトブレビン2のノックアウトマウスでは開口放出による同期した神経伝達物質放出が見られないことや[6-8]、タイプ特異的にSNAREタンパク質を切断する破傷風毒素やボツリヌス毒素を作用させると、神経伝達物質放出が抑制されること[9]、リポソームにSNAREタンパク質を組み込むとリポソーム同士の融合が引き起こされることなどから[10, 11]、SNARE複合体の形成が脂質膜の融合を引き起こすと考えられるようになった[12-14]。SNAREタンパク質は多くのメンバーを持つファミリータンパク質で、細胞膜での開口放出のみならず、様々な細胞内小胞輸送に関わっている[4, 15]。更に細胞膜へのタンパク質の組み込みや[16]、細胞の大きさや形態変化に伴う細胞膜の伸展などにもSNAREタンパク質が関わっていることも明らかにされている[17]。
脂質膜の融合
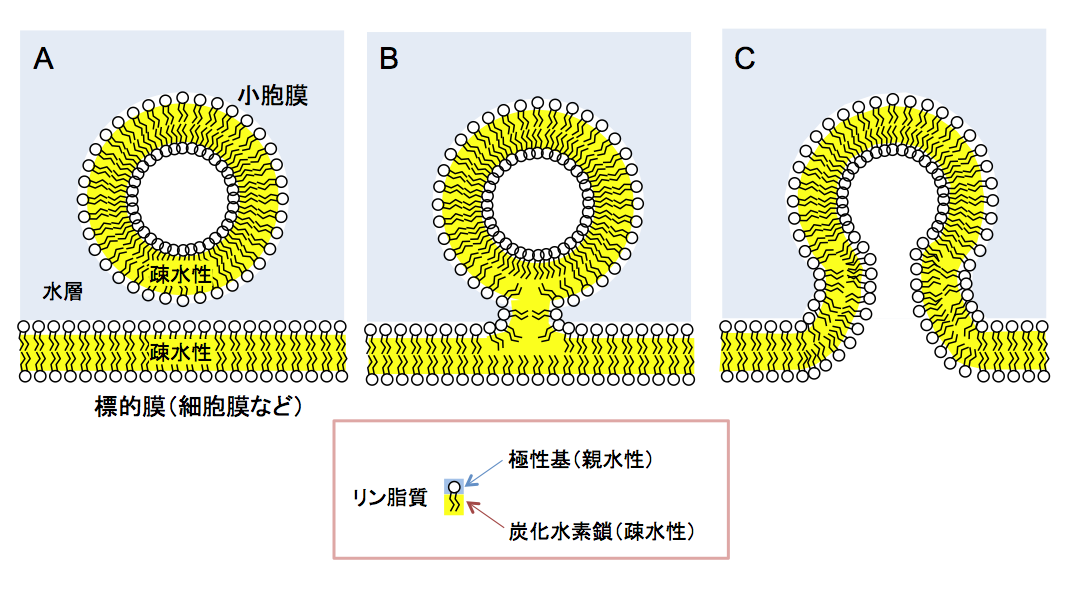
神経伝達物質や水溶性ホルモンの分泌は、シナプス小胞膜や分泌小胞膜が細胞膜と融合する開口放出機構によって営まれている。さらに小胞体からゴルジ体を含むさまざまな細胞内小器官へのタンパク質輸送は、送り手の膜から出芽した輸送小胞が標的の生体膜に融合する細胞内小胞輸送機構によって営まれている。これらの過程では小胞膜が標的の生体膜と融合するステップが必須である。細胞膜や細胞内膜は脂質二重層からできており、表面は親水性であるリン脂質の極性部分が被い、膜の内部には疎水性の炭化水素の尾の部分が並んでいる(図1)。小胞膜と標的の生体膜が融合するためには、二つの膜の疎水性部分が水層を超えて連絡するヘミフュージョン状態をとる必要があり、そのためには2つの膜が非常に接近する必要がある。しかしリン脂質の親水性の頭部には水分子が水和しており、2つの脂質膜は2.5 A以内に接近することは通常では困難である。このため脂質膜の融合が起こるためには、タンパク質の助けが必要となるが、その役割を担うタンパク質がSNAREタンパク質と呼ばれる一群のタンパク質である。
SNAREタンパク質の特徴
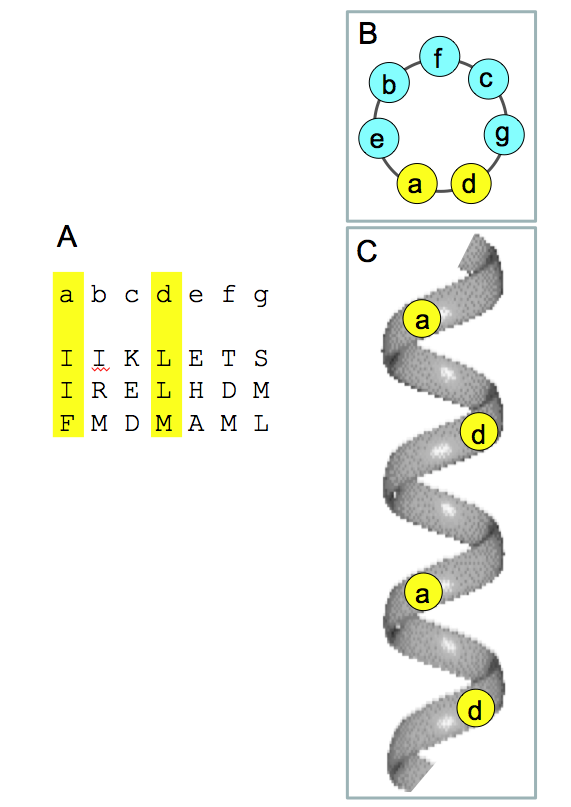
SNAREタンパク質は概してアミノ酸100~300位からなる小さなタンパク質で、分子内に約60アミノ酸からなるSNAREモチーフを持っている。SNAREモチーフにはheptad repeatと呼ばれる7アミノ酸の繰り返し構造がある(図2)。Heptad repeatを構成する7つのアミノ酸残基をa~gとした時、aとdの位置にはLeu、Ile、Valなどの疎水性アミノ酸が、他の部位には主に親水性アミノ酸が配置されている。Heptad repeatを持つポリペプチド鎖がヘリックスを巻くと、へリックスの片側に疎水性残基が帯状に連なるため、heptad repeatを持つ他のへリックスと疎水性面を介して会合しcoiled-coil複合体を作る。
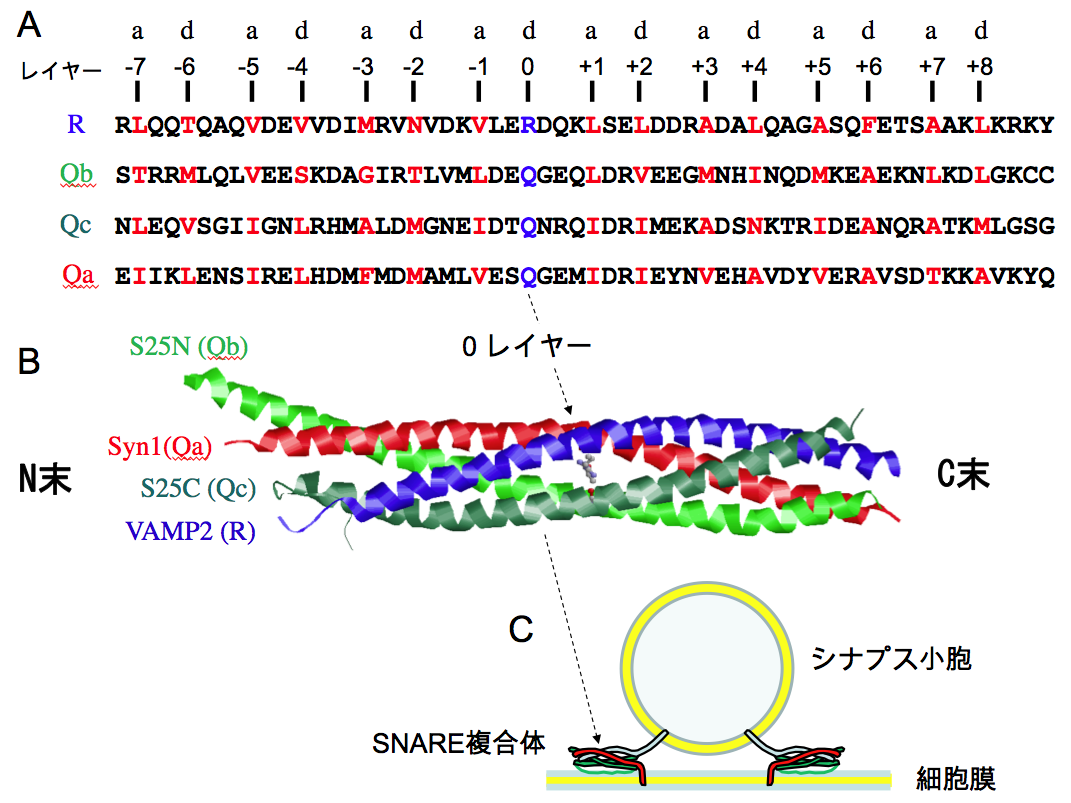
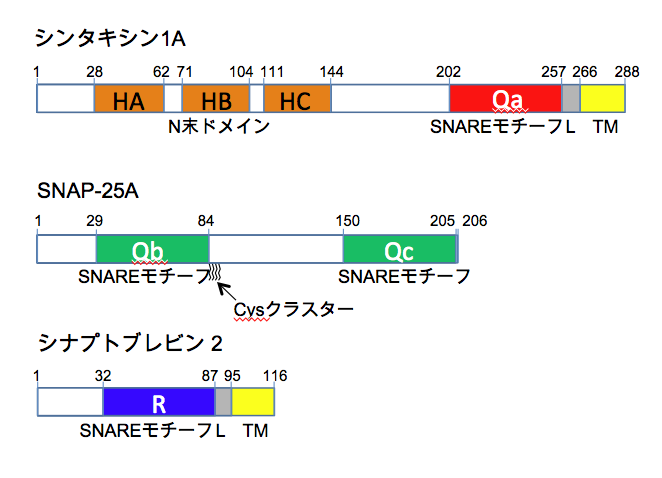
シナプス膜での開口放出に関わるSNAREタンパク質であるシンタキシン1はIle202 –Tyr257、シナプトブレビン2はLeu32 –Lys87、SNAP-25はThr29 –Phe84およびLeu150 –Ser205の2か所にSNAREモチーフが存在し、それぞれheptad repeat が8回繰り返されている。SNAREタンパク質はSNAREモチーフを介して会合し、4本のへリックスからなるヘテロ複合体であるSNARE複合体を形成する[5] (図4)。
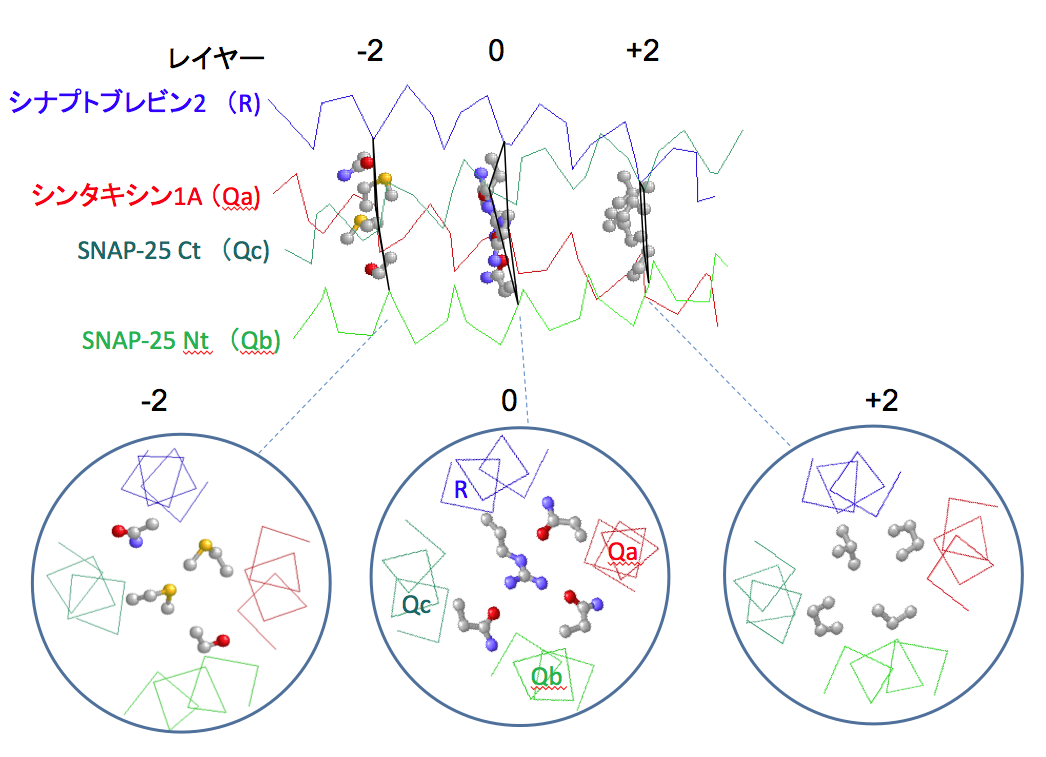
SNAREモチーフではaおよびdの位置にくるアミノ酸側鎖は複合体の内側に向いており、疎水性結合で結ばれたレイヤー面を構成する(図5)。SNAREモチーフではaとdの位置にLeu, Ile, Val以外の残基も見られ、Pheのようにかさばる残基がくる場合には、同じレイヤー面の他のへリックスではAlaになる。SNAREモチーフではモチーフの中央付近にある4つ目のheptad repeatのd位は正電荷をもつArgか親水性のGlnであるという顕著な特徴を持っており、これらの残基を含む面を0レイヤーと呼んでいる。0レイヤーにArg (R)を供出するSNAREをR-SNAREと呼び、Gln (Q)を供出するSNAREをQ-SNAREと呼んでいる。シナプス膜ではシナプトブレビン2がR-SNAREで、シンタキシン1とSNAP-25の二つのSNAREモチーフがQ-SNAREである。SNARE複合体ではSNAREモチーフを持つ4つのへリックスのN末端が同じ方向に向くように配置されている(図4)。
シナプトブレビン2とシンタキシン1を含む多くのSNAREタンパク質はC末に膜貫通へリックスを持ち脂質膜に組み込まれている。それに対してSNAP-25は膜貫通部位を持たないが、分子の中央付近にパルミトイル化されたシステイン残基クラスターを持ち、細胞膜に係留されている[18](図3)。
SNAREタンパク質の種類
小胞体で作られた膜タンパク質は、細胞内小胞輸送機構で細胞膜やゴルジ体をはじめとする様々な細胞内小器官に輸送されていく。これらのタンパク質輸送には送り手の膜から出芽した輸送小胞が標的の膜に融合する細胞内小胞輸送機構によって営まれており、全ての膜融合にSNAREタンパク質が関わっている。小胞膜のSNAREをv-SNARE、融合する標的膜のSNAREをt-SNAREと呼ぶが、シナプスではシナプス小胞にあるシナプトブレビン2がv-SNAREとして、シナプス前膜にあるシンタキシン1とSNAP-25がt-SNAREとして機能している。
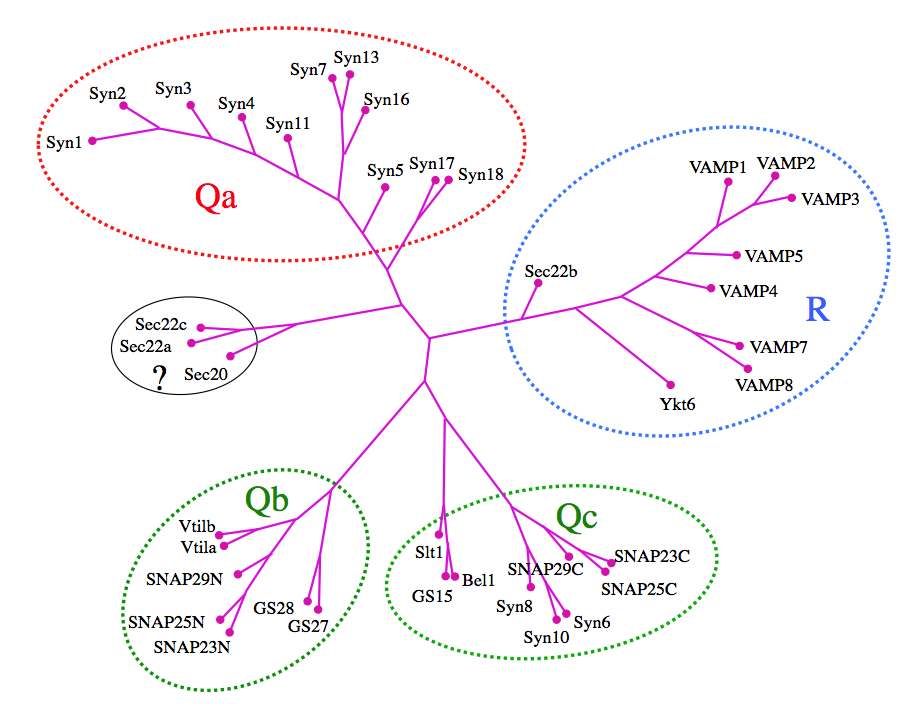
哺乳類ではこれまでに40種類近いSNAREタンパク質が見出されており、アミノ酸配列の類似性を基に系統樹が作られている[4](図6)。SNAREタンパク質にはQa、Qb、Qc およびRの4つの大きなサブファミリーが存在する。SNARE複合体は4つのブファミリーから1本ずつのSNAREモチーフを持つヘリックスが供出されて形成されるので、SNARE複合体は3本のQ-SNAREと1本のR-SNAREから構成されている。様々な生体膜間での小胞輸送には、それぞれ特有のSNAREタンパク質の組み合わせが関与している [4, 15]。
小胞輸送の素過程
標的の脂質膜に接近した輸送小胞が、標的膜に接触してから膜融合を起こすまでにはいくつかの素過程を経由する。接近してきた小胞膜が標的の膜にゆるく結合する状態をtethering(係留)、強固に結合した状態をdocking(結合)、膜融合が可能になった状態をpriming(プライミング)、2つの脂質膜が融合する過程をfusionと呼んでいる。それぞれのステップにSNAREタンパク質の関与が示唆されているが、どのように寄与しているかは必ずしも明確にはされていない。
SNARE複合体形成の制御
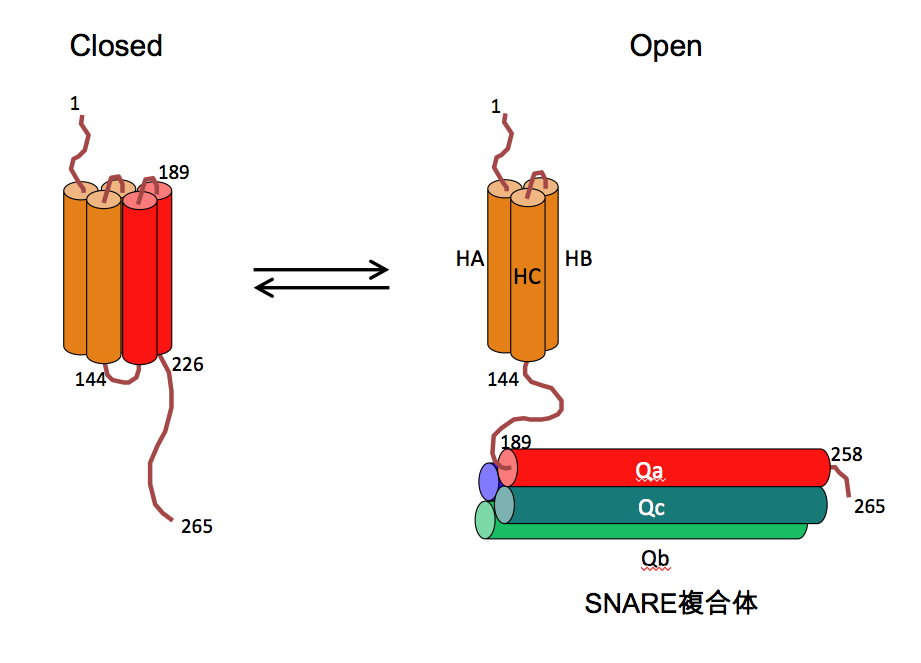
細胞膜に存在するシンタキシン1の細胞質部分は、HA、HBおよびHCの3つのへリックス構造をとり得るN末ドメイン(27-146)と、C末側のSNAREモチーフを持つH3ドメインから構成されている(図3)。HA、HB、HCの3つのへリックスは交互に折りたたまれたHabc 3-helical bundleを形成し、SNARE複合体形成制御に関わっている[19]。シンタキシン1はHabc 3-helical bundle にシンタキシン1のSNAREモチーフが結合したclosed conformation と、Habc 3-helical bundle とSNAREモチーフが解離したopen conformation とをとる[20-22](図7)。Open conformationにあるSNAREモチーフは、SNAP-25およびシナプトブレビン2のSNAREモチーフと結合しSNARE複合体を形成できるが、closed conformationをとるシンタキシン1は、N末ドメインがSNAREモチーフを持つH3に結合してシナプトブレビン2との結合を抑制するためSNARE複合体を形成することができない。
Munc18は68 kDaのタンパク質でclosed conformationにあるシンタキシン1に結合し安定化させることで、SNARE複合体形成に抑制的な制御因子として働いている[20, 23]。Munc18には、このような抑制的な機能の他に、SNARE複合体の会合解離サイクルの全体でSNARE複合体に常に結合し、開口放出に必須な役割も果たしているが、その詳細は明らかにはなっていない[24-26]。
SNARE複合体形成とクランプ
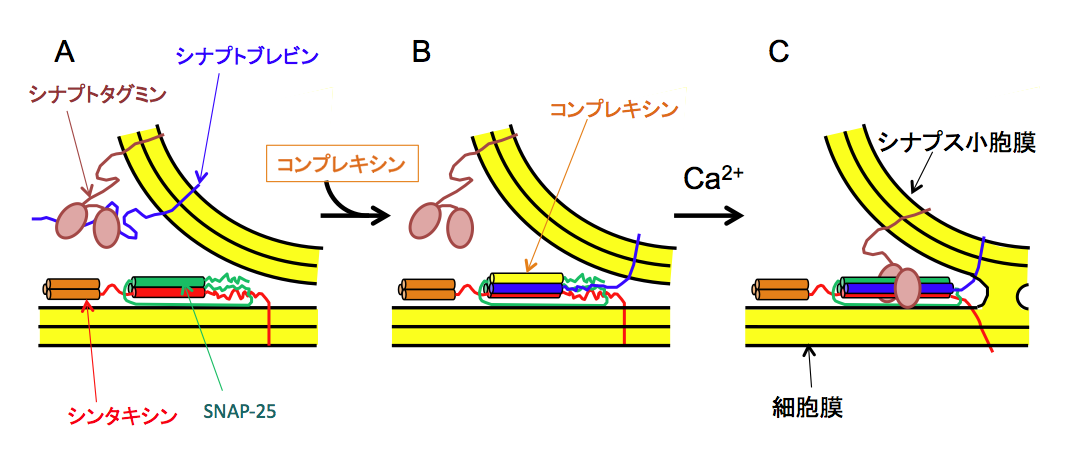
v-SNAREを組み込んだリポソームの平面膜への融合速度は遅く、結合してから10-100 ms後でないと起らないが、神経伝達物質放出は非常に素早く起こり、Ca2+流入後1 ms以内には完了する。このような素早い放出を可能にするためには、律速段階であるSNARE複合体形成は予めある段階まで進行させておき、Ca2+の流入に即応して素早く複合体形成が完了できる状態にしておく必要があると考えられる[21, 27-29]。SNARE複合体形成はN末端側から始まり、ジッパーを締めるようにC末方向に進行していく。コンプレキシン(Complexin)は134アミノ酸からなる小型のタンパク質で、分子の中央部のへリックス部位がSNARE複合体のN末側に結合しSNARE複合体形成の開始を促進する[30]。しかしコンプレキシンのN末側のへリックスはシナプトブレビン2のSNAREモチーフのC末側と拮抗しSNARE複合体形成の完了を阻害する。このためコンプレキシン存在下ではSNARE複合体形成は0レイヤー付近で停止した「クランプ」状態に止まることになり膜融合は引き起こされない [31-33]。Ca2+濃度が高まるとシナプトタグミン(Synaptotagmin)がコンプレキシンにとって代わって結合してクランプ状態を解除し、その結果SNARE複合体形成が完了して膜融合が速やかに引き起こされる[13, 34](図8)。シナプトタグミンはCa2+依存的にリン脂質に結合するが、リポソームにシナプトタグミンを加えると、チューブ状の構造ができることから、結合した脂質2重膜の曲率を変化させる作用があると考えられる。これらのことからシナプトタグミンにはクランプ状態を解除させる機能に加え、細胞膜の曲率を局所的に変えることにより、膜融合の速度をさらに加速する機能もあると考えられる[35-37]。
膜融合
膜融合が完全に進行し、小胞膜が細胞膜に完全に組み込まれると、SNARE複合体はv-SNAREとt-SNAREが異なる膜に存在するtrans型から、同一の膜に存在するcis-型に移行する。v-SNAREであるシナプトブレビン2とt-SNAREであるシンタキシンはC末端に細胞膜貫通するへリックス構造を持つが、SNAREモチーフとの間にはリンカー部分が存在する(図3)。細胞膜貫通部位を含むcis-SNARE複合体の構造がNMR構造解析で明らかにされたが、へリックス構造はSNAREモチーフのみならず、リンカー部分や膜貫通部位にまで及んでいる [38](図8)。このためt-SNAREとv-SNAREの複合体形成はSNARE複合体を超えて細胞膜貫通部位にまで及び、その結果2つの脂質膜は非常に接近させられ膜融合へと移行すると考えられる。
SNARE複合体形成は発エルゴン反応であるが、SNARE複合体形成により放出される自由エネルギーは膜融合を起こすのに十分な大きさであることが示されている[4]。膜融合が完全に進行する以前に小胞膜と細胞膜が連結すると、フュージョンポアが形成され、小胞の内容物の放出が始まる。フュージョンポアが形成されるにはSNARE複合体が完全に形成されることが必要で、フュージョンポアの形成にはシナプトブレビン2やシンタキシン1の膜貫通領域が間接的に寄与している[39, 40]。
SNARE複合体の解離
エンドサイトーシスで小胞膜タンパク質が再回収されるためには、cis-SNARE複合体が解離し、v-SNAREとt-SNAREに分離される必要がある。この変化は吸エルゴン反応であり、進行するためには自由エネルギーの供給が必要である。NSF (N-ethylmaleimide-sensitive factor)はATPase活性を持ち、ATPの加水分解エネルギーを利用してcis-SNARE複合体を解離させる。cis-SNARE複合体へのNSFの結合にはαSNAP (soluble N-ethylmaleimide-sensitive factor attachment protein)と呼ばれるタンパク質が必要である。cis-SNARE複合体に結合した3分子の αSNAPが6量体のNSFと結合し20S複合体を形成した後、ATP加水分解に伴いcis-SNARE複合体の解離が引き起こされる[1, 4, 12, 41]。
SNAREサイクルの制御タンパク質
Munc18やコンプレキシン、シナプトタグミン以外にもSNAREサイクルの制御に関わるタンパク質が知られている。Munc13はシンタキシン/Munc18-1複合体に結合し、シンタキシンのclosed conformationをopen conformationに変化させることによりSNARE複合体形成を促進するプライミング因子である[42]。シンタキシン1とSNAP-25を組み込んだリポソームはシナプトタグミンが存在すればシナプトブレビン2を組み込んだリポソームと効率的に融合する。それに対して、シンタキシンとMunc18を組み込んだリポソームがシナプトブレビン2を組み込んだリポソームと融合するにはSNAP-25とシナプトタグミン以外にMunc13が必要であることが明らかにされている[43]。シンタキシン1/SNAP-25複合体はNSF/αSNAPの作用で解離させられるが、Munc18とMunc13が存在するとNSF/αSNAPの作用を受けなくなり、SNARE複合体形成とそれに続く膜融合が効率的に進行すると考えられる。
198アミノ酸からなるタンパク質であるcysteine string protein (csp) はシャペロンタンパク質であるHsc70のコシャペロンで、DnaJファミリーに属し分子内にJドメインを有している。Cspα/Hsc70/SGT複合体はSNAP-25のミスフォールディングを抑える働きがあり、cspを欠失させるとSNAP-25のミスフォールディングが増加し、SNARE複合体量が減少する[44]。
関連語
シナプトブレビン]]