「アセチルコリン」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の12版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0127493/?lang=japanese 三澤 日出巳]</font><br> | <font size="+1">[http://researchmap.jp/read0127493/?lang=japanese 三澤 日出巳]</font><br> | ||
''慶應義塾大学 薬学部''<br> | ''慶應義塾大学 薬学部''<br> | ||
DOI:<selfdoi /> 原稿受付日:2013年1月15日 原稿完成日:2013年7月22日 原稿改訂日:2017年9月20日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター) | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター) | ||
</div> | </div> | ||
| 75行目: | 75行目: | ||
== 生合成 == | == 生合成 == | ||
[[コリンアセチル転移酵素]]([[acetyl-CoA: choline O-acetyltransferase]]; ChAT, EC 2.3.1.6)によりコリンと[[wikipedia:ja:アセチルCoA|アセチルCoA]]から合成される。ChATは細胞質に存在する可溶性タンパク質であるが、神経[[軸索]]を経て終末部に運ばれる。ChATの[[wikipedia:ja:比活|比活]]性(specific activity)は極めて高く、通常の条件では、連続した神経活動時にもアセチルコリンが不足することはない。ChATのコリンに対する[[親和性]]([[Km]])は細胞内のコリン濃度に比べて大きいため、コリンの供給がアセチルコリン合成の律速段階となる。ChATの特異[[wikipedia:ja:抗体|抗体]]による[[免疫組織化学]]がアセチルコリンを合成する神経(コリン作動性神経)の[[細胞体]] | [[コリンアセチル転移酵素]]([[acetyl-CoA: choline O-acetyltransferase]]; ChAT, EC 2.3.1.6)によりコリンと[[wikipedia:ja:アセチルCoA|アセチルCoA]]から合成される。ChATは細胞質に存在する可溶性タンパク質であるが、神経[[軸索]]を経て終末部に運ばれる。ChATの[[wikipedia:ja:比活|比活]]性(specific activity)は極めて高く、通常の条件では、連続した神経活動時にもアセチルコリンが不足することはない。ChATのコリンに対する[[親和性]]([[Km]])は細胞内のコリン濃度に比べて大きいため、コリンの供給がアセチルコリン合成の律速段階となる。ChATの特異[[wikipedia:ja:抗体|抗体]]による[[免疫組織化学]]がアセチルコリンを合成する神経(コリン作動性神経)の[[細胞体]]や軸索を同定する目的で汎用される<ref name=ref1><pubmed>10594838</pubmed></ref>。 | ||
== コリンの取り込み == | == コリンの取り込み == | ||
アセチルコリン合成の基質となるコリンの大部分は細胞外から供給される。コリンの輸送系は高親和性 (Km 1〜5 | アセチルコリン合成の基質となるコリンの大部分は細胞外から供給される。コリンの輸送系は高親和性 (Km 1〜5 microM)と低親和性 (Km 50〜100 microM)の2種類が知られているが、コリン作動性性神経には特異的な高親和性の取り込みが観察され、その活性は神経活動に依存して上昇する。[[高親和性コリントランスポーター]]([[high-affinity choline transporter]]; [[CHT1]], [[SLC5A7]])は[[Na+依存性グルコーストランスポーター|Na<sup>+</sup>依存性グルコーストランスポーター]]ファミリーに属する13回膜貫通型のタンパク質であり、コリン作動性神経での高親和性コリン取り込みを担う<ref name=ref2><pubmed>12675135</pubmed></ref>。CHT1は、速い軸索流により神経終末部に輸送される。静止状態ではCHT1の大部分は[[シナプス小胞]]膜に局在するが、神経活動時にシナプス小胞の[[開口放出]]に伴ってCHT1が[[形質膜]]に移行することで、細胞外からのコリン輸送活性が上昇すると考えられる<ref name=ref3><pubmed>14993474</pubmed></ref>。 | ||
== 貯蔵、放出 == | == 貯蔵、放出 == | ||
細胞質で合成されたアセチルコリンは、[[小胞アセチルコリントランスポーター]]([[vesicular acetylcholine transporter]]; VAChT, SLC18A3)の働きにより、[[wikipedia:ja:プロトン|プロトン]]電気化学勾配を駆動力としてシナプス小胞に輸送される。一個のシナプス小胞には1,000から50, | 細胞質で合成されたアセチルコリンは、[[小胞アセチルコリントランスポーター]]([[vesicular acetylcholine transporter]]; VAChT, SLC18A3)の働きにより、[[wikipedia:ja:プロトン|プロトン]]電気化学勾配を駆動力としてシナプス小胞に輸送される。一個のシナプス小胞には1,000から50,000分子のアセチルコリンが含まれると概算される。VAChTはChAT遺伝子の第一イントロンに全長がコードされ、共通の転写制御を受けると考えられている<ref name=ref4><pubmed>9603187</pubmed></ref>。実際にVAChTとChATの発現は共通の部位・細胞で観察される<ref name=ref5><pubmed>23410039</pubmed></ref>。 | ||
神経終末部にインパルスが到達すると、シナプス小胞に蓄えられたアセチルコリンは開口放出(exocytosis)により放出される。この過程には細胞内での[[カルシウム]]イオンの上昇が重要である。アセチルコリンの放出は、一つのシナプス小胞に蓄えられた数千分子が1単位として同期放出される[[素量的放出]](quantal release)として検出される。 | 神経終末部にインパルスが到達すると、シナプス小胞に蓄えられたアセチルコリンは開口放出(exocytosis)により放出される。この過程には細胞内での[[カルシウム]]イオンの上昇が重要である。アセチルコリンの放出は、一つのシナプス小胞に蓄えられた数千分子が1単位として同期放出される[[素量的放出]](quantal release)として検出される。 | ||
| 89行目: | 89行目: | ||
== 代謝、分解 == | == 代謝、分解 == | ||
細胞外に放出されたアセチルコリンは、[[アセチルコリンエステラーゼ]]([[acetylcholinesterase]]; AChE, EC3.1.1.7)によって極めて短時間 (ミリ秒の時間単位)で分解され、コリンと酢酸になる<ref name= | 細胞外に放出されたアセチルコリンは、[[アセチルコリンエステラーゼ]]([[acetylcholinesterase]]; AChE, EC3.1.1.7)によって極めて短時間 (ミリ秒の時間単位)で分解され、コリンと酢酸になる<ref name=ref6><pubmed>8042853</pubmed></ref>。この分解によって化学伝達は終了するとともに、コリンは高親和性コリントランスポーターによって効率良くシナプス前終末に取り込まれてアセチルコリン合成に再利用される。アセチルコリンを分解する酵素は、アセチルコリンエステラーゼの他に[[ブチルコリンエステラーゼ]](偽性コリンエステラーゼ)が知られている。コリンエステラーゼに対して阻害活性を持つ薬物は、シナプス間隙のアセチルコリンを増やして化学伝達を増強するため、様々な薬物として臨床応用されている。このうち、[[ネオスチグミン]]は[[重症筋無力症]]、[[wikipedia:ja:術後腸管麻痺|術後腸管麻痺]]、[[wikipedia:ja:排尿障害|排尿障害]]などに、[[ドネペジル]]、[[ガランタミン]]、[[リバスチグミン]]は[[アルツハイマー病]]に適応される。また、マラチオンやダイアジノンなどの非可逆的コリンエステラーゼ阻害剤が殺虫剤や農薬の成分として使われる。これらの誤飲事故の場合には、頭痛、吐き気、多量発汗、目の調節異常などの中毒症状が現れることがある。さらに、きわめて強力な非可逆的コリンエステラーゼ阻害剤であるサリンやVXガスなどは、化学兵器として知られる。 | ||
== 受容体 == | == 受容体 == | ||
| 101行目: | 101行目: | ||
nicotinic acetylcholine receptor; nAChR | nicotinic acetylcholine receptor; nAChR | ||
陽イオン選択性の[[イオンチャネル内蔵型受容体]]であり、アセチルコリンやニコチンが結合すると、ごく短時間(ミリ秒単位)にNa<sup>+</sup>, K<sup>+</sup>, Ca<sup>2+</sup>などのイオン透過性が亢進する。nAChRは、神経筋接合部、自律神経節、副腎髄質、中枢神経系などに分布する。ニコチン受容体は、類似構造をもつ複数サブユニットが会合した5量体として機能する。様々な動物種で、α (α1〜10), β (β1〜4), γ, δ, εの17種類のサブユニットが存在し、それらの組み合わせにより骨格筋型(Nm)と神経型(Nn)に大別される。骨格筋型nAChRはα1が2個, β1, δ(またはε) | 陽イオン選択性の[[イオンチャネル内蔵型受容体]]であり、アセチルコリンやニコチンが結合すると、ごく短時間(ミリ秒単位)にNa<sup>+</sup>, K<sup>+</sup>, Ca<sup>2+</sup>などのイオン透過性が亢進する。nAChRは、神経筋接合部、自律神経節、副腎髄質、中枢神経系などに分布する。ニコチン受容体は、類似構造をもつ複数サブユニットが会合した5量体として機能する。様々な動物種で、α (α1〜10), β (β1〜4), γ, δ, εの17種類のサブユニットが存在し、それらの組み合わせにより骨格筋型(Nm)と神経型(Nn)に大別される。骨格筋型nAChRはα1が2個, β1, δ, γ(またはε) が各1個の5量体からなる。神経型nAChRは、αとβからなるヘテロ5量体、あるいは同一のαからなるホモ5量体の構造をとるが、サブユニット構成により高度に多様性に富み、それぞれ独自のチャネル特性を持つとされる。1つのnAChRには2分子のアセチルコリンが結合してチャネルを開口させる。[[パンクロニウム]]、[[ベクロニウム]]などのNmを遮断する薬物は筋弛緩薬である。[[バレニクリン]]はnAChRの部分作動薬で、[[依存症#ニコチン|ニコチン依存症]]に対する[[wj:禁煙補助薬|禁煙補助薬]]として用いられる。重症筋無力症では、筋肉型nAChRに対する自己抗体の産生が報告されている。 | ||
=== ムスカリン性アセチルコリン受容体 === | === ムスカリン性アセチルコリン受容体 === | ||
| 143行目: | 143行目: | ||
=== 大脳皮質 === | === 大脳皮質 === | ||
[[前脳基底部]]のコリン作動性神経は、大脳皮質の広範な領域に投射して、アセチルコリンを供給する。投射を受ける細胞(主として[[錐体細胞]])との間には明確なシナプス構造が認められる場合と、認められない場合があり、後者の場合を[[拡散性伝達]](diffuse transmission)と呼ぶことがある<ref name= | [[前脳基底部]]のコリン作動性神経は、大脳皮質の広範な領域に投射して、アセチルコリンを供給する。投射を受ける細胞(主として[[錐体細胞]])との間には明確なシナプス構造が認められる場合と、認められない場合があり、後者の場合を[[拡散性伝達]](diffuse transmission)と呼ぶことがある<ref name=ref7><pubmed>9421837</pubmed></ref>。アセチルコリンは、一般的には錐体細胞の興奮性を上昇させるが、一方で錐体細胞サブタイプごとに作用が異なることも知られている。さらに、アセチルコリンはGABA作動性の抑制性介在神経にも作用する。大脳皮質のアセチルコリンは、脳の[[感覚]]入力処理におけるSN比の調整に関与する「[[感覚ゲート]]」を駆動するとされる<ref name=ref8><pubmed>12644356</pubmed></ref> <ref name=ref9><pubmed>14650918</pubmed></ref>。この働きは[[認知機能]]の基盤となる[[注意]]、[[集中]]などに重要であり、アルツハイマー病や統合失調症の患者ではこの機能に変化が見られることが知られている<ref name=ref10><pubmed>11481170</pubmed></ref>。 | ||
===大脳基底核=== | ===大脳基底核=== | ||
| 151行目: | 151行目: | ||
===中脳=== | ===中脳=== | ||
脚橋被蓋核と背外側被蓋核コリン作動性神経は上行性と下降性の2種類の投射経路をもつ<ref name= | 脚橋被蓋核と背外側被蓋核コリン作動性神経は上行性と下降性の2種類の投射経路をもつ<ref name=ref11><pubmed>9219969</pubmed></ref>。視床へ投射する上行性投射系は、[[網様体賦活系]]の一部として[[睡眠]]サイクルや[[覚醒]]レベルの調節に関与する。脳幹網様体へ投射する下降性投射系は[[歩行運動]]、[[姿勢反射]]、筋緊張の調節などに関与する。また、脚橋被蓋核のコリン作動性神経は視床のほか大脳基底核にも投射する。特に、黒質緻密部のドーパミン神経細胞に投射して、ドーパミンの放出を促進する。パーキンソン病患者では、この部位のコリン作動性神経が減少することでドーパミン放出が減弱していることも病状の一因になると考えられている<ref name=ref12><pubmed>3475716</pubmed></ref>。 | ||
===海馬=== | |||
[[海馬]]は[[内側中隔野]]や[[対角帯垂直脚]]からコリン作動性神経の投射を受ける。アセチルコリンは[[錐体細胞]]や[[介在ニューロン]]のnAChRやmAChRに作用することで、[[記憶]]の形成や強化に関与するとされる。 | |||
アセチルコリンは錐体細胞の興奮と抑制のバランス調整に関与するが、そのメカニズムとしては、錐体細胞への直接作用と介在神経が関与する間接作用が知られている。nAChRとmAChRではその発現部位と作用が異なるため、コリン作動性神経の入力強度の違いにより、アセチルコリンは錐体細胞に対して興奮・抑制の二面性の作用をもたらす。 | |||
また、アセチルコリンは[[シナプス長期増強]]([[long-term potentiation]]; [[LTP]])や[[シナプス長期抑圧]]([[long-term depression]]; [[LTD]])などの[[シナプス可塑性]]に関与することが示されているが、nAChRやmAChRを刺激するタイミングや強度、他の神経伝達物質による入力との相互作用など、複雑な時空間制御をうける。アセチルコリンは海馬を含む神経回路での[[ネットワーク・オシレーション]]の制御にも関与する<ref name=ref13><pubmed>23908628</pubmed></ref>。 | |||
== 非神経性アセチルコリン == | == 非神経性アセチルコリン == | ||
アセチルコリンは、[[wikipedia:ja:真性細菌|真性細菌]]などの[[wikipedia:ja:原核生物|原核生物]]を始めとして、ほぼすべての生物での存在が報告されている<ref name= | アセチルコリンは、[[wikipedia:ja:真性細菌|真性細菌]]などの[[wikipedia:ja:原核生物|原核生物]]を始めとして、ほぼすべての生物での存在が報告されている<ref name=ref14><pubmed>17363003</pubmed></ref>。植物では水や[[wikipedia:ja:電解質|電解質]]、栄養物質などの輸送に関与するとされるが、その生理的役割は不明な点が多い。[[wikipedia:ja:タケノコ|タケノコ]]の先端部には、[[wikipedia:ja:哺乳動物|哺乳動物]]の脳をはるかに超える量のアセチルコリンが含まれている<ref name=ref15><pubmed>12559395</pubmed></ref>。 | ||
[[ヒト]]を含めた[[哺乳動物]]では、様々な非神経細胞や組織でアセチルコリンの合成と放出が確認されている。このうち、[[wikipedia:ja:免疫|免疫]]系細胞、[[wikipedia:ja:血管内皮細胞|血管内皮細胞]]、[[wikipedia:ja:胎盤|胎盤]]、[[wikipedia:ja:ケラチノサイト|ケラチノサイト]]、[[wikipedia:ja:気道上皮細胞|気道上皮細胞]]、[[wikipedia:ja:消化管上皮細胞|消化管上皮細胞]]、[[wikipedia:ja:膀胱上皮細胞|膀胱上皮細胞]]などでは、神経系とは独立した非神経性アセチルコリンが局所の[[細胞間情報伝達]]を担うことが報告されている<ref name=ref16><pubmed>28552584</pubmed></ref>。 | |||
== コリン作動性抗炎症反応 == | |||
cholinergic anti-inflammatory pathway | |||
迷走神経の刺激 (vagal nerve stimulation; VNS) により誘導される全身性の抗炎症反応のこと。 | |||
迷走神経には、中枢神経系の情報を末梢臓器に伝える遠心性の副交感神経と、末梢臓器からの感覚情報を中枢神経系に伝える求心性の[[内臓知覚神経]]が走行している。[[齧歯類]]では、迷走神経の実験的切断は敗血症による炎症やショックによる致死率を高めること、電気的にVNSを行うことで[[wj:敗血症|敗血症]]、[[wj:関節リウマチ|関節リウマチ]]、[[wj:炎症腸疾患|炎症腸疾患]]などの疾患モデルでの[[wj:炎症性サイトカイン|炎症性サイトカイン]] ([[wj:TNFα|TNFα]]や[[wj:IL-6|IL-6]]など)の産生が著明に抑制されて病状が緩解することが報告されている<ref name=ref17><pubmed>27059884</pubmed></ref>。この反応経路には、AChと[[α7 ニコチン性アセチルコリン受容体]]が必要であることから”コリン作動性“と呼ばれているが、そのメカニズムは不明な点が多い。 | |||
なお医療現場では、[[迷走神経刺激装置]]VNSシステムは難治性[[てんかん]]や[[うつ病]]の治療法として承認され、すでに各国で多くの臨床実績をもつ。その有用性は高いとされるが、メカニズムは完全には解明されていない。 | |||
==関連項目 == | ==関連項目 == | ||
*[[ニコチン性アセチルコリン受容体]] | *[[ニコチン性アセチルコリン受容体]] | ||
*[[ムスカリン性アセチルコリン受容体]] | *[[ムスカリン性アセチルコリン受容体]] | ||
*[[小胞アセチルコリントランスポーター]] | |||
*[[高親和性コリントランスポーター]] | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2020年6月30日 (火) 13:56時点における最新版
三澤 日出巳
慶應義塾大学 薬学部
DOI:10.14931/bsd.3079 原稿受付日:2013年1月15日 原稿完成日:2013年7月22日 原稿改訂日:2017年9月20日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
| アセチルコリン | |||
|---|---|---|---|
| |||
| |||
2-Acetoxy-N,N,N-trimethylethanaminium | |||
| Identifiers | |||
| 51-84-3 | |||
| 3DMet | B00379 | ||
| Abbreviations | ACh | ||
| Beilstein Reference | 1764436 | ||
| ChEBI | |||
| ChEMBL | ChEMBL667 | ||
| ChemSpider | 182 | ||
| DrugBank | {{{value}}} | ||
| EC-number | [1] | ||
| Gmelin Reference | 326108 | ||
| |||
| 294 | |||
| Jmol-3D images | Image | ||
| KEGG | C01996 | ||
| MeSH | Acetylcholine | ||
| PubChem | 187 | ||
| |||
| UNII | N9YNS0M02X | ||
| Properties | |||
| Molar mass | 146.2074 g mol-1 | ||
| Pharmacology | |||
| Elimination half-life |
2 min | ||
| | |||
| Infobox references | |||
英語名:Acetylcholine 英語略名:ACh
アセチルコリンは最も早く同定された神経伝達物質である。末梢神経系では、運動神経の神経筋接合部、交感神経および副交感神経の節前線維の終末、副交感神経の節後線維の終末などのシナプスで伝達物質として働く。中枢神経系の一部にもアセチルコリンを伝達物質とする神経が存在する。また、神経系以外でも化学伝達物質として幅広い作用を発揮する。
発見
1914年にHenry H. Daleよって発見された。Otto Loewiは、2つのカエル摘出心標本を用い、迷走神経を刺激中に採取した心灌流液で別の標本の心収縮が抑制されることを示すなどの実験を行い、アセチルコリンが神経伝達物質であることを証明した。DaleとLoewiは、これらの業績によって1936年にノーベル生理学・医学賞を受賞している。
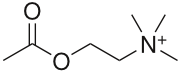
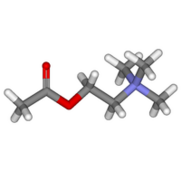
化学構造
コリンと酢酸のエステル化合物で、四級アンモニウム構造をもつ。
生合成
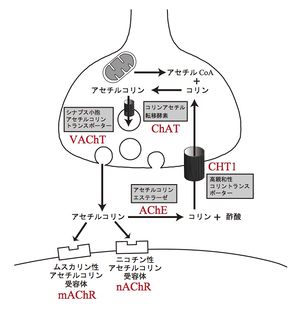
コリンアセチル転移酵素(acetyl-CoA: choline O-acetyltransferase; ChAT, EC 2.3.1.6)によりコリンとアセチルCoAから合成される。ChATは細胞質に存在する可溶性タンパク質であるが、神経軸索を経て終末部に運ばれる。ChATの比活性(specific activity)は極めて高く、通常の条件では、連続した神経活動時にもアセチルコリンが不足することはない。ChATのコリンに対する親和性(Km)は細胞内のコリン濃度に比べて大きいため、コリンの供給がアセチルコリン合成の律速段階となる。ChATの特異抗体による免疫組織化学がアセチルコリンを合成する神経(コリン作動性神経)の細胞体や軸索を同定する目的で汎用される[1]。
コリンの取り込み
アセチルコリン合成の基質となるコリンの大部分は細胞外から供給される。コリンの輸送系は高親和性 (Km 1〜5 microM)と低親和性 (Km 50〜100 microM)の2種類が知られているが、コリン作動性性神経には特異的な高親和性の取り込みが観察され、その活性は神経活動に依存して上昇する。高親和性コリントランスポーター(high-affinity choline transporter; CHT1, SLC5A7)はNa+依存性グルコーストランスポーターファミリーに属する13回膜貫通型のタンパク質であり、コリン作動性神経での高親和性コリン取り込みを担う[2]。CHT1は、速い軸索流により神経終末部に輸送される。静止状態ではCHT1の大部分はシナプス小胞膜に局在するが、神経活動時にシナプス小胞の開口放出に伴ってCHT1が形質膜に移行することで、細胞外からのコリン輸送活性が上昇すると考えられる[3]。
貯蔵、放出
細胞質で合成されたアセチルコリンは、小胞アセチルコリントランスポーター(vesicular acetylcholine transporter; VAChT, SLC18A3)の働きにより、プロトン電気化学勾配を駆動力としてシナプス小胞に輸送される。一個のシナプス小胞には1,000から50,000分子のアセチルコリンが含まれると概算される。VAChTはChAT遺伝子の第一イントロンに全長がコードされ、共通の転写制御を受けると考えられている[4]。実際にVAChTとChATの発現は共通の部位・細胞で観察される[5]。
神経終末部にインパルスが到達すると、シナプス小胞に蓄えられたアセチルコリンは開口放出(exocytosis)により放出される。この過程には細胞内でのカルシウムイオンの上昇が重要である。アセチルコリンの放出は、一つのシナプス小胞に蓄えられた数千分子が1単位として同期放出される素量的放出(quantal release)として検出される。
代謝、分解
細胞外に放出されたアセチルコリンは、アセチルコリンエステラーゼ(acetylcholinesterase; AChE, EC3.1.1.7)によって極めて短時間 (ミリ秒の時間単位)で分解され、コリンと酢酸になる[6]。この分解によって化学伝達は終了するとともに、コリンは高親和性コリントランスポーターによって効率良くシナプス前終末に取り込まれてアセチルコリン合成に再利用される。アセチルコリンを分解する酵素は、アセチルコリンエステラーゼの他にブチルコリンエステラーゼ(偽性コリンエステラーゼ)が知られている。コリンエステラーゼに対して阻害活性を持つ薬物は、シナプス間隙のアセチルコリンを増やして化学伝達を増強するため、様々な薬物として臨床応用されている。このうち、ネオスチグミンは重症筋無力症、術後腸管麻痺、排尿障害などに、ドネペジル、ガランタミン、リバスチグミンはアルツハイマー病に適応される。また、マラチオンやダイアジノンなどの非可逆的コリンエステラーゼ阻害剤が殺虫剤や農薬の成分として使われる。これらの誤飲事故の場合には、頭痛、吐き気、多量発汗、目の調節異常などの中毒症状が現れることがある。さらに、きわめて強力な非可逆的コリンエステラーゼ阻害剤であるサリンやVXガスなどは、化学兵器として知られる。
受容体
アセチルコリンの受容体は、ニコチン性アセチルコリン受容体とムスカリン性アセチルコリン受容体に大別され、それぞれアセチルコリンによるニコチン様作用(骨格筋や神経節での刺激作用)とムスカリン様作用(副交感神経支配器官での刺激作用)を担う。
ニコチン性アセチルコリン受容体
nicotinic acetylcholine receptor; nAChR
陽イオン選択性のイオンチャネル内蔵型受容体であり、アセチルコリンやニコチンが結合すると、ごく短時間(ミリ秒単位)にNa+, K+, Ca2+などのイオン透過性が亢進する。nAChRは、神経筋接合部、自律神経節、副腎髄質、中枢神経系などに分布する。ニコチン受容体は、類似構造をもつ複数サブユニットが会合した5量体として機能する。様々な動物種で、α (α1〜10), β (β1〜4), γ, δ, εの17種類のサブユニットが存在し、それらの組み合わせにより骨格筋型(Nm)と神経型(Nn)に大別される。骨格筋型nAChRはα1が2個, β1, δ, γ(またはε) が各1個の5量体からなる。神経型nAChRは、αとβからなるヘテロ5量体、あるいは同一のαからなるホモ5量体の構造をとるが、サブユニット構成により高度に多様性に富み、それぞれ独自のチャネル特性を持つとされる。1つのnAChRには2分子のアセチルコリンが結合してチャネルを開口させる。パンクロニウム、ベクロニウムなどのNmを遮断する薬物は筋弛緩薬である。バレニクリンはnAChRの部分作動薬で、ニコチン依存症に対する禁煙補助薬として用いられる。重症筋無力症では、筋肉型nAChRに対する自己抗体の産生が報告されている。
ムスカリン性アセチルコリン受容体
muscarinic acetylcholine receptor; mAChR
GTP結合タンパク質に共役した代謝型受容体(GPCR)であり、M1〜M5の5種類のサブタイプが存在する。M1, M3, M5は、百日咳毒素非感受性のGTP結合タンパク質(Gq/11)と共役して、ホスファチジルイノシトール代謝回転の促進と細胞内Ca2+濃度の上昇を引き起こす。M2とM4は、百日咳毒素感受性のGTP結合タンパク質(Gi/o)と共役し、アデニル酸シクラーゼを抑制して細胞内cAMP濃度の低下や、内向き整流K+チャネルの活性化を引き起こす。mAChRは、副交感神経支配器官に分布して、消化管や肺などの平滑筋収縮や分泌腺刺激、心臓機能の抑制などを担う。また中枢神経系、末梢神経系にも広く分布して神経伝達の修飾に関与する。ベタネコールやピロカルピンなどのコリンエステル類および天然アルカロイドが作用薬として、アトロピンと類似構造をもつ天然または合成アルカロイドが遮断薬として、どちらも臨床適応される。完全にサブタイプ特異的なリガンド開発は困難とされているが、幾つかのサブタイプに対する作用薬またはアロステリックリガンドが、アルツハイマー病や統合失調症の創薬ターゲットとして注目されている。
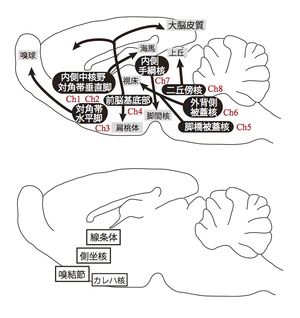
主たるアセチルコリン含有神経の分布
中枢神経系でのアセチルコリン含有神経(コリン作動性神経)は、限局した脳部位に存在し、Ch1〜8に分類される。細胞体から長い軸索を伸ばす投射神経と、比較的短い軸索を伸ばす局所回路神経に大別される。
投射神経(および代表的投射部位)
Ch2: 対角帯垂直脚から海馬へ
Ch3: 対角帯水平脚から嗅球へ
Ch6: 背外側被蓋核から視床へ
その他:脳の運動神経諸核および脊髄の運動神経から筋肉へ、交感神経節前神経(脊髄側角)から節後神経へ
局所回路神経
線条体、側坐核、嗅結節、カレハ核などに小型の介在神経が存在する。
機能
大脳皮質
前脳基底部のコリン作動性神経は、大脳皮質の広範な領域に投射して、アセチルコリンを供給する。投射を受ける細胞(主として錐体細胞)との間には明確なシナプス構造が認められる場合と、認められない場合があり、後者の場合を拡散性伝達(diffuse transmission)と呼ぶことがある[7]。アセチルコリンは、一般的には錐体細胞の興奮性を上昇させるが、一方で錐体細胞サブタイプごとに作用が異なることも知られている。さらに、アセチルコリンはGABA作動性の抑制性介在神経にも作用する。大脳皮質のアセチルコリンは、脳の感覚入力処理におけるSN比の調整に関与する「感覚ゲート」を駆動するとされる[8] [9]。この働きは認知機能の基盤となる注意、集中などに重要であり、アルツハイマー病や統合失調症の患者ではこの機能に変化が見られることが知られている[10]。
大脳基底核
運動制御に重要とされる線条体のGABA作動性投射神経の機能は、線条体神経の1〜2%を占めるコリン作動性介在神経と黒質緻密部からのドーパミン神経入力によって調節される。パーキンソン病患者では、ドーパミンの欠乏とそれに伴うアセチルコリン放出の増加により、大脳基底核の神経回路が抑制された状態となる。
中脳
脚橋被蓋核と背外側被蓋核コリン作動性神経は上行性と下降性の2種類の投射経路をもつ[11]。視床へ投射する上行性投射系は、網様体賦活系の一部として睡眠サイクルや覚醒レベルの調節に関与する。脳幹網様体へ投射する下降性投射系は歩行運動、姿勢反射、筋緊張の調節などに関与する。また、脚橋被蓋核のコリン作動性神経は視床のほか大脳基底核にも投射する。特に、黒質緻密部のドーパミン神経細胞に投射して、ドーパミンの放出を促進する。パーキンソン病患者では、この部位のコリン作動性神経が減少することでドーパミン放出が減弱していることも病状の一因になると考えられている[12]。
海馬
海馬は内側中隔野や対角帯垂直脚からコリン作動性神経の投射を受ける。アセチルコリンは錐体細胞や介在ニューロンのnAChRやmAChRに作用することで、記憶の形成や強化に関与するとされる。
アセチルコリンは錐体細胞の興奮と抑制のバランス調整に関与するが、そのメカニズムとしては、錐体細胞への直接作用と介在神経が関与する間接作用が知られている。nAChRとmAChRではその発現部位と作用が異なるため、コリン作動性神経の入力強度の違いにより、アセチルコリンは錐体細胞に対して興奮・抑制の二面性の作用をもたらす。
また、アセチルコリンはシナプス長期増強(long-term potentiation; LTP)やシナプス長期抑圧(long-term depression; LTD)などのシナプス可塑性に関与することが示されているが、nAChRやmAChRを刺激するタイミングや強度、他の神経伝達物質による入力との相互作用など、複雑な時空間制御をうける。アセチルコリンは海馬を含む神経回路でのネットワーク・オシレーションの制御にも関与する[13]。
非神経性アセチルコリン
アセチルコリンは、真性細菌などの原核生物を始めとして、ほぼすべての生物での存在が報告されている[14]。植物では水や電解質、栄養物質などの輸送に関与するとされるが、その生理的役割は不明な点が多い。タケノコの先端部には、哺乳動物の脳をはるかに超える量のアセチルコリンが含まれている[15]。
ヒトを含めた哺乳動物では、様々な非神経細胞や組織でアセチルコリンの合成と放出が確認されている。このうち、免疫系細胞、血管内皮細胞、胎盤、ケラチノサイト、気道上皮細胞、消化管上皮細胞、膀胱上皮細胞などでは、神経系とは独立した非神経性アセチルコリンが局所の細胞間情報伝達を担うことが報告されている[16]。
コリン作動性抗炎症反応
cholinergic anti-inflammatory pathway
迷走神経の刺激 (vagal nerve stimulation; VNS) により誘導される全身性の抗炎症反応のこと。
迷走神経には、中枢神経系の情報を末梢臓器に伝える遠心性の副交感神経と、末梢臓器からの感覚情報を中枢神経系に伝える求心性の内臓知覚神経が走行している。齧歯類では、迷走神経の実験的切断は敗血症による炎症やショックによる致死率を高めること、電気的にVNSを行うことで敗血症、関節リウマチ、炎症腸疾患などの疾患モデルでの炎症性サイトカイン (TNFαやIL-6など)の産生が著明に抑制されて病状が緩解することが報告されている[17]。この反応経路には、AChとα7 ニコチン性アセチルコリン受容体が必要であることから”コリン作動性“と呼ばれているが、そのメカニズムは不明な点が多い。
なお医療現場では、迷走神経刺激装置VNSシステムは難治性てんかんやうつ病の治療法として承認され、すでに各国で多くの臨床実績をもつ。その有用性は高いとされるが、メカニズムは完全には解明されていない。
関連項目
参考文献
- ↑
Oda, Y. (1999).
Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system. Pathology international, 49(11), 921-37. [PubMed:10594838] [WorldCat] [DOI] - ↑
Okuda, T., & Haga, T. (2003).
High-affinity choline transporter. Neurochemical research, 28(3-4), 483-8. [PubMed:12675135] [WorldCat] [DOI] - ↑
Ferguson, S.M., & Blakely, R.D. (2004).
The choline transporter resurfaces: new roles for synaptic vesicles? Molecular interventions, 4(1), 22-37. [PubMed:14993474] [WorldCat] [DOI] - ↑
Eiden, L.E. (1998).
The cholinergic gene locus. Journal of neurochemistry, 70(6), 2227-40. [PubMed:9603187] [WorldCat] [DOI] - ↑
Prado, V.F., Roy, A., Kolisnyk, B., Gros, R., & Prado, M.A. (2013).
Regulation of cholinergic activity by the vesicular acetylcholine transporter. The Biochemical journal, 450(2), 265-74. [PubMed:23410039] [WorldCat] [DOI] - ↑
Taylor, P., & Radić, Z. (1994).
The cholinesterases: from genes to proteins. Annual review of pharmacology and toxicology, 34, 281-320. [PubMed:8042853] [WorldCat] [DOI] - ↑
Descarries, L., Gisiger, V., & Steriade, M. (1997).
Diffuse transmission by acetylcholine in the CNS. Progress in neurobiology, 53(5), 603-25. [PubMed:9421837] [WorldCat] - ↑
Grunwald, T., Boutros, N.N., Pezer, N., von Oertzen, J., Fernández, G., Schaller, C., & Elger, C.E. (2003).
Neuronal substrates of sensory gating within the human brain. Biological psychiatry, 53(6), 511-9. [PubMed:12644356] [WorldCat] [DOI] - ↑
Hasselmo, M.E., & McGaughy, J. (2004).
High acetylcholine levels set circuit dynamics for attention and encoding and low acetylcholine levels set dynamics for consolidation. Progress in brain research, 145, 207-31. [PubMed:14650918] [WorldCat] [DOI] - ↑
Jessen, F., Kucharski, C., Fries, T., Papassotiropoulos, A., Hoenig, K., Maier, W., & Heun, R. (2001).
Sensory gating deficit expressed by a disturbed suppression of the P50 event-related potential in patients with Alzheimer's disease. The American journal of psychiatry, 158(8), 1319-21. [PubMed:11481170] [WorldCat] [DOI] - ↑
Takakusaki, K., Shiroyama, T., & Kitai, S.T. (1997).
Two types of cholinergic neurons in the rat tegmental pedunculopontine nucleus: electrophysiological and morphological characterization. Neuroscience, 79(4), 1089-109. [PubMed:9219969] [WorldCat] [DOI] - ↑
Hirsch, E.C., Graybiel, A.M., Duyckaerts, C., & Javoy-Agid, F. (1987).
Neuronal loss in the pedunculopontine tegmental nucleus in Parkinson disease and in progressive supranuclear palsy. Proceedings of the National Academy of Sciences of the United States of America, 84(16), 5976-80. [PubMed:3475716] [PMC] [WorldCat] [DOI] - ↑
Teles-Grilo Ruivo, L.M., & Mellor, J.R. (2013).
Cholinergic modulation of hippocampal network function. Frontiers in synaptic neuroscience, 5, 2. [PubMed:23908628] [PMC] [WorldCat] [DOI] - ↑
Kawashima, K., Misawa, H., Moriwaki, Y., Fujii, Y.X., Fujii, T., Horiuchi, Y., ..., & Kamekura, M. (2007).
Ubiquitous expression of acetylcholine and its biological functions in life forms without nervous systems. Life sciences, 80(24-25), 2206-9. [PubMed:17363003] [WorldCat] [DOI] - ↑
Horiuchi, Y., Kimura, R., Kato, N., Fujii, T., Seki, M., Endo, T., ..., & Kawashima, K. (2003).
Evolutional study on acetylcholine expression. Life sciences, 72(15), 1745-56. [PubMed:12559395] [WorldCat] [DOI] - ↑
Fujii, T., Mashimo, M., Moriwaki, Y., Misawa, H., Ono, S., Horiguchi, K., & Kawashima, K. (2017).
Physiological functions of the cholinergic system in immune cells. Journal of pharmacological sciences, 134(1), 1-21. [PubMed:28552584] [WorldCat] [DOI] - ↑
Bonaz, B., Sinniger, V., & Pellissier, S. (2016).
Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. The Journal of physiology, 594(20), 5781-5790. [PubMed:27059884] [PMC] [WorldCat] [DOI]