「逆行性伝達物質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の9版が非表示) | |||
| 1行目: | 1行目: | ||
英:retrograde messengers, retrograde signals | 英:retrograde messengers, retrograde signals | ||
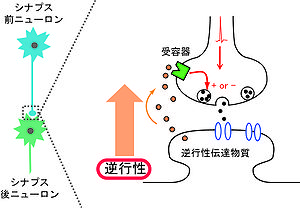
逆行性伝達物質とは[[化学シナプス]]において[[シナプス後部]]から細胞外へ放出されて、[[シナプス前終末]]に作用し[[シナプス伝達]]を調節する物質をさす(図1)。逆行性伝達物質によってシナプス後細胞はシナプス前側の活動を調節することができる。逆行性伝達物質には様々な種類があるが大別すると、[[wikipedia:ja:脂質|脂質]]、[[wikipedia:ja:気体|気体]]分子、[[神経栄養因子]]、[[ペプチド]]、古典的[[神経伝達物質]]がある。逆行性伝達物質を介した逆行性シナプス伝達は新規シナプス形成やその維持に重要な役割を担っているが、本稿では特に成熟したシナプスにおける[[シナプス可塑性]]に限定して述べる。 | 逆行性伝達物質とは[[化学シナプス]]において[[シナプス後部]]から細胞外へ放出されて、[[シナプス前終末]]に作用し[[シナプス伝達]]を調節する物質をさす(図1)。逆行性伝達物質によってシナプス後細胞はシナプス前側の活動を調節することができる。逆行性伝達物質には様々な種類があるが大別すると、[[wikipedia:ja:脂質|脂質]]、[[wikipedia:ja:気体|気体]]分子、[[神経栄養因子]]、[[ペプチド]]、古典的[[神経伝達物質]]がある。逆行性伝達物質を介した逆行性シナプス伝達は新規シナプス形成やその維持に重要な役割を担っているが、本稿では特に成熟したシナプスにおける[[シナプス可塑性]]に限定して述べる。 | ||
[[Image:Yukihashimotodani fig 5.jpg|thumb|right|300px|'''図1.逆行性シナプス伝達''']] | [[Image:Yukihashimotodani fig 5.jpg|thumb|right|300px|'''図1.逆行性シナプス伝達''']] | ||
| 32行目: | 20行目: | ||
脂質のなかではエンドカンナビノイドが最も詳しく調べられている逆行性伝達物質である<ref name="ref2"><pubmed> 19126760 </pubmed></ref>。エンドカンナビノイドによる逆行性シナプス伝達はシナプス前終末に局在する[[カンナビノイド受容体]]I型(CB1)の活性化を介して引き起こされる。脳の非常に広い範囲の多くのシナプスでこの逆行性シナプス伝達が報告されている。詳しくは後述。 | 脂質のなかではエンドカンナビノイドが最も詳しく調べられている逆行性伝達物質である<ref name="ref2"><pubmed> 19126760 </pubmed></ref>。エンドカンナビノイドによる逆行性シナプス伝達はシナプス前終末に局在する[[カンナビノイド受容体]]I型(CB1)の活性化を介して引き起こされる。脳の非常に広い範囲の多くのシナプスでこの逆行性シナプス伝達が報告されている。詳しくは後述。 | ||
[[アラキドン酸]]が[[海馬]]において逆行性伝達物質として働き[[長期増強]](long-term potentiation: LTP)や[[長期抑圧]](long-term depression: LTD)を引き起こすことが提案された<ref><pubmed> 2571939 </pubmed></ref><ref><pubmed> 8606806 </pubmed></ref>。しかし、アラキドン酸を逆行性伝達物質と考えるには十分な実験的証拠がなく疑問視されている<ref><pubmed> 9457171 </pubmed></ref>。現在ではアラキドン酸自身ではなく、その代謝産物が逆行性伝達物質として働くことが考えられている<ref><pubmed> 16957004 </pubmed></ref>。海馬CA1において[[ | [[アラキドン酸]]が[[海馬]]において逆行性伝達物質として働き[[長期増強]](long-term potentiation: LTP)や[[長期抑圧]](long-term depression: LTD)を引き起こすことが提案された<ref><pubmed> 2571939 </pubmed></ref><ref><pubmed> 8606806 </pubmed></ref>。しかし、アラキドン酸を逆行性伝達物質と考えるには十分な実験的証拠がなく疑問視されている<ref><pubmed> 9457171 </pubmed></ref>。現在ではアラキドン酸自身ではなく、その代謝産物が逆行性伝達物質として働くことが考えられている<ref><pubmed> 16957004 </pubmed></ref>。海馬CA1において[[COX-2]]によってアラキドン酸から[[プロスタグランジンE2]]が作られ、それが逆行性伝達物質として興奮性シナプス前終末に存在するプロスタグランジンE2受容体を活性化し、シナプス伝達を促進させることが報告されている<ref><pubmed> 16251433 </pubmed></ref>。 | ||
[[エイコサノイド]]の一種である[[12-(S)-HPETE]]が海馬[[CA1]]の抑制性ニューロンから放出され興奮性シナプス前終末に存在する[[TRPV1]]を活性化しLTDを誘導することが報告されている<ref><pubmed> 18341994 </pubmed></ref>。 | [[エイコサノイド]]の一種である[[12-(S)-HPETE]]が海馬[[CA1]]の抑制性ニューロンから放出され興奮性シナプス前終末に存在する[[TRPV1]]を活性化しLTDを誘導することが報告されている<ref><pubmed> 18341994 </pubmed></ref>。 | ||
=== 気体分子 === | === 気体分子 === | ||
[[一酸化窒素]] (NO)はセカンドメッセンジャーとして働くことが知られているが、特に海馬のLTP誘導において逆行性伝達物質として働くことが報告されている<ref name="ref19"><pubmed> 8083727 </pubmed></ref><ref><pubmed> 9223222 </pubmed></ref>。[[ | [[一酸化窒素]](NO)はセカンドメッセンジャーとして働くことが知られているが、特に海馬のLTP誘導において逆行性伝達物質として働くことが報告されている<ref name="ref19"><pubmed> 8083727 </pubmed></ref><ref><pubmed> 9223222 </pubmed></ref>。[[NMDA受容体]]を介して流入した[[カルシウム]]が[[NO合成酵素]]を活性化することによって[[wikipedia:ja:L-アルギニン|L-アルギニン]]からNOがシナプス後部で作られる。細胞外へと放出されたNOはシナプス前終末の内部に入り、[[可溶性グアニル酸シクラーゼ]]を活性化し[[cGMP]]産生とそれに引き続き[[cGMP依存性プロテインキナーゼ]]の活性化を引き起こす。その結果、神経伝達物質の放出が促進される。海馬以外にも例えば[[腹側被蓋野]]<ref><pubmed> 17460674 </pubmed></ref>、[[視床下部]]<ref><pubmed> 19144839 </pubmed></ref>、[[大脳皮質]]<ref><pubmed> 16837587 </pubmed></ref>、[[脊髄]]<ref><pubmed> 22131400 </pubmed></ref>などでNOによる逆行性シナプス伝達が報告されている。 | ||
NOが順行性伝達物質としても働くことが、特に[[小脳]]の[[LTD]]でよく調べられている<ref><pubmed> 18588525 </pubmed></ref>。小脳[[プルキンエ細胞]]に入力する興奮性の[[平行線維]]終末からNOが放出され<ref><pubmed> 9032691 </pubmed></ref>シナプス後部に入り、可溶性グアニル酸シクラーゼを活性化する。その結果、cGMP/cGMP依存性プロテインキナーゼのカスケードが活性化し[[G-substrate]]を[[リン酸化]]する<ref><pubmed> 10051666 </pubmed></ref>。リン酸化したG-substrateは[[ホスファターゼ]]の[[阻害剤]]として働き、別経路で活性化された[[プロテインキナーゼC]]と合わせて、最終的に[[ | NOが順行性伝達物質としても働くことが、特に[[小脳]]の[[LTD]]でよく調べられている<ref><pubmed> 18588525 </pubmed></ref>。小脳[[プルキンエ細胞]]に入力する興奮性の[[平行線維]]終末からNOが放出され<ref><pubmed> 9032691 </pubmed></ref>シナプス後部に入り、可溶性グアニル酸シクラーゼを活性化する。その結果、cGMP/cGMP依存性プロテインキナーゼのカスケードが活性化し[[G-substrate]]を[[リン酸化]]する<ref><pubmed> 10051666 </pubmed></ref>。リン酸化したG-substrateは[[ホスファターゼ]]の[[阻害剤]]として働き、別経路で活性化された[[プロテインキナーゼC]]と合わせて、最終的に[[AMPA受容体]]のリン酸化および[[エンドサイトーシス]]を促進する方向へ向かう。 | ||
[[一酸化炭素]]も逆行性伝達物質として働くことが示唆されているが<ref><pubmed> 7682336 </pubmed></ref><ref name="ref19" />まだそれを支持する十分な証拠は揃っていない。 | [[一酸化炭素]]も逆行性伝達物質として働くことが示唆されているが<ref><pubmed> 7682336 </pubmed></ref><ref name="ref19" />まだそれを支持する十分な証拠は揃っていない。 | ||
=== 神経栄養因子 === | === 神経栄養因子 === | ||
| 58行目: | 46行目: | ||
=== 古典的神経伝達物質 === | === 古典的神経伝達物質 === | ||
グルタミン酸や[[GABA]]といった神経伝達物質が特定のシナプスでは逆行性伝達物質として働く可能性が報告されている<ref name="ref30"><pubmed> 16061520 </pubmed></ref><ref><pubmed> 19375301 </pubmed></ref>。大脳皮質では興奮性シナプスや抑制性シナプスにおいてグルタミン酸やGABAによる逆行性シナプス伝達が起こることが報告されている<ref name="ref30" />。小脳ではグルタミン酸<ref | グルタミン酸や[[GABA]]といった神経伝達物質が特定のシナプスでは逆行性伝達物質として働く可能性が報告されている<ref name="ref30"><pubmed> 16061520 </pubmed></ref><ref><pubmed> 19375301 </pubmed></ref>。大脳皮質では興奮性シナプスや抑制性シナプスにおいてグルタミン酸やGABAによる逆行性シナプス伝達が起こることが報告されている<ref name="ref30" />。小脳ではグルタミン酸<ref><pubmed> 15097992 </pubmed></ref>が[[脳幹]]ではGABAが<ref><pubmed> 18614034 </pubmed></ref>逆行性伝達物質として働くことが報告されている。特殊なシナプスとして[[嗅球]]の[[僧帽細胞]]と顆粒細胞間の[[dendro-dendritic結合]]でGABAによる逆行性伝達がみられる<ref><pubmed> 9581766 </pubmed></ref>。 | ||
[[セロトニン]]や[[ドーパミン]]も樹状突起から放出されることが知られているが、逆行性伝達物質として働きシナプス伝達を制御しうるかどうかはまだ定かでない。 | [[セロトニン]]や[[ドーパミン]]も樹状突起から放出されることが知られているが、逆行性伝達物質として働きシナプス伝達を制御しうるかどうかはまだ定かでない。 | ||
| 64行目: | 52行目: | ||
== エンドカンナビノイドによる逆行性伝達 == | == エンドカンナビノイドによる逆行性伝達 == | ||
上記のほとんどの逆行性伝達物質が脳の限られた範囲のシナプスでのみ働くのに対して、[[エンドカンナビノイド]] | 上記のほとんどの逆行性伝達物質が脳の限られた範囲のシナプスでのみ働くのに対して、[[エンドカンナビノイド]]による逆行性伝達は脳の非常に広い範囲で起こる。CB1受容体はシナプスによっては興奮性あるいは抑制性神経終末に発現しており、これらの入力を短期あるいは長期に抑制することで[[記憶]]・[[認知]]、[[運動制御]]、[[鎮痛]]、[[食欲]]調節、[[報酬系]]の制御、[[神経保護]]などの様々な脳機能に関与する<ref name="ref2" />。 | ||
=== エンドカンナビノイド産生機構 === | === エンドカンナビノイド産生機構 === | ||
エンドカンナビノイドの一種である[[2-アラキドノイルグリセロール]](2-AG)はシナプス後部のニューロンの[[脱分極]]による[[カルシウム]]イオン流入、あるいは[[Gq/11タンパク質共役型受容体]]の活性化によって作られる(図2)。2-AGは前駆体である[[ジアシルグリセロール]](DG)から[[DGリパーゼ]](DGL)によって作られる。シナプス後ニューロンで強い脱分極が起きると[[電位依存性カルシウムチャネル]] | エンドカンナビノイドの一種である[[2-アラキドノイルグリセロール]](2-AG)はシナプス後部のニューロンの[[脱分極]]による[[カルシウム]]イオン流入、あるいは[[Gq/11タンパク質共役型受容体]]の活性化によって作られる(図2)。2-AGは前駆体である[[ジアシルグリセロール]](DG)から[[DGリパーゼ]](DGL)によって作られる。シナプス後ニューロンで強い脱分極が起きると[[電位依存性カルシウムチャネル]]が開いてカルシウムイオンが流入する。細胞内カルシウム濃度がマイクロモーラー以上に達すると、2-AGが産生される(図2)。また、グループI[[代謝型グルタミン酸受容体]]やM1/M3[[ムスカリン受容体]]といったGq/11タンパク質共役型受容体の活性化によって[[PLCβ]]を介する経路で2-AG産生が引き起こされる(図2)。この場合、細胞内カルシウム上昇は必要ない<ref><pubmed> 11516402 </pubmed></ref>。さらに、こういった受容体の活性化と脱分極による細胞内へのカルシウムイオン流入が同時に起こると、2-AG産生が相乗的に促進される。これは、PLCβがカルシウム感受性を持つため、[[受容体]]活性化と同時に細胞内カルシウム濃度が高まると、PLCβ活性が増強するためである<ref><pubmed> 15664177 </pubmed></ref><ref name="ref40"><pubmed> 16033892 </pubmed></ref> (図2)。 | ||
[[Image:Yukihashimotodani fig 6.jpg|thumb|right|300px|'''図2.エンドカンナビノイドによる逆行性シナプス伝達抑制'''<br>橋本谷祐輝 他:実験医学,Vol.28 No.20:3409-3414,2010より引用]] | [[Image:Yukihashimotodani fig 6.jpg|thumb|right|300px|'''図2.エンドカンナビノイドによる逆行性シナプス伝達抑制'''<br>橋本谷祐輝 他:実験医学,Vol.28 No.20:3409-3414,2010より引用]] | ||
| 74行目: | 62行目: | ||
=== 逆行性シナプス伝達抑圧 === | === 逆行性シナプス伝達抑圧 === | ||
上記のような刺激によって産生された2-AGは[[細胞膜]]を通って逆行性に[[シナプス前終末]]に局在する[[CB1受容体]]を活性化する。活性化したCB1受容体は共役する[[Gi/oタンパク質]] | 上記のような刺激によって産生された2-AGは[[細胞膜]]を通って逆行性に[[シナプス前終末]]に局在する[[CB1受容体]]を活性化する。活性化したCB1受容体は共役する[[Gi/oタンパク質]]を介してシナプス前終末の電位依存性カルシウムチャネルの開口を抑制し、神経伝達物質の放出を抑制する(図2)。ニューロンの脱分極によって生じるエンドカンナビノイドによる逆行性シナプス伝達抑圧を[[depolarization-induced suppression of inhibition]]/excitation (DSI/DSE)とよぶ。脱分極したニューロンに入力する抑制性入力が抑えられる場合がDSI、興奮性入力が抑えられる場合がDSEである。単なる脱分極と違い、生理的条件に近いシナプス刺激によってエンドカンナビノイドによる短期の逆行性シナプス伝達抑圧が起こることがわかっている<ref><pubmed> 14502290 </pubmed></ref><ref><pubmed> 15564588 </pubmed></ref><ref name="ref40" />。この場合、上述のようなGq/11タンパク質共役型受容体の活性化と細胞内へのカルシウム流入の相乗効果で2-AGが作られると考えられる<ref><pubmed> 17404373 </pubmed></ref>。 | ||
エンドカンナビノイドは細胞外を非常に限られた範囲でしか拡散できない。海馬では10~20μm程度しか拡散しないと考えられている。2-AGの分解酵素である[[モノアシルグリセロールリパーゼ]](MGL)はシナプス前終末に局在しており、逆行性に運ばれて来た2-AGを速やかに分解する<ref><pubmed> 17267577 </pubmed></ref>(図2) 。 | エンドカンナビノイドは細胞外を非常に限られた範囲でしか拡散できない。海馬では10~20μm程度しか拡散しないと考えられている。2-AGの分解酵素である[[モノアシルグリセロールリパーゼ]](MGL)はシナプス前終末に局在しており、逆行性に運ばれて来た2-AGを速やかに分解する<ref><pubmed> 17267577 </pubmed></ref>(図2) 。 | ||
=== LTD === | |||
エンドカンナビノイドはLTDの誘導にも寄与する。興奮性シナプスでみられるエンドカンナビノイド依存性のLTDは、背側線条体、大脳皮質、[[側坐核]]、小脳、海馬、背側[[蝸牛神経核]]などで報告されている。一方、抑制性シナプスでは、扁桃体、海馬、大脳皮質、腹側[[被蓋野]]などで報告がある。 | |||
エンドカンナビノイド依存性のLTD(eCB-LTD)誘導にはLTD誘発刺激中にエンドカンナビノイドが産生されてシナプス前終末のCB1受容体が活性化されることが必要である。海馬ではCB1受容体が5-10分間、活性化されることがLTD誘導に必須であることが示されており、LTDの維持にはCB1受容体活性は不要となる<ref><pubmed> 12741992 </pubmed></ref>。LTD誘発刺激条件は脳部位によって様々であるがシナプス後部ニューロンへのカルシウムイオン流入あるいはグループI代謝型グルタミン酸受容体の活性化を介してエンドカンナビノイド産生が引き起こされることが明らかになっている <ref name="ref50"><pubmed> 19575681 </pubmed></ref>。エンドカンナビノイドは興奮性シナプスで作られるので、抑制性シナプスで起こるeCB-LTDは異シナプス的に誘導されるLTDである。小脳を除いて、eCB-LTDの発現は、これまですべてシナプス前性の可塑的変化によることが示されている。しかし数分間のCB1受容体の活性化がどのようにして長期の神経伝達物質放出の抑制を誘導するのかについてはまだよくわかっていない。海馬においてはシナプス前終末における[[RIM1α]]の作用と、カルシウムイオン流入による[[カルシニューリン]]の活性化が必須であることが示されている<ref name="ref50" />。 | |||
== 参考文献 == | |||
<references /> | |||
(執筆者:橋本谷祐輝、狩野方伸 担当編集委員:河西春郎) | |||
2012年7月18日 (水) 11:13時点における版
英:retrograde messengers, retrograde signals
逆行性伝達物質とは化学シナプスにおいてシナプス後部から細胞外へ放出されて、シナプス前終末に作用しシナプス伝達を調節する物質をさす(図1)。逆行性伝達物質によってシナプス後細胞はシナプス前側の活動を調節することができる。逆行性伝達物質には様々な種類があるが大別すると、脂質、気体分子、神経栄養因子、ペプチド、古典的神経伝達物質がある。逆行性伝達物質を介した逆行性シナプス伝達は新規シナプス形成やその維持に重要な役割を担っているが、本稿では特に成熟したシナプスにおけるシナプス可塑性に限定して述べる。
条件
ある物質が逆行性伝達物質として働くかどうかは以下の基準を満たす必要があると提唱されている[1]。
- 逆行性伝達物質を合成あるいは放出する能力がシナプス後部にある。
- 合成や放出の過程を阻害すると逆行性伝達が起こらなくなる。
- シナプス前終末に逆行性伝達物質の標的となる受容器が存在する。
- その受容器を阻害すると逆行性伝達が起こらなくなる。
- その受容器のアクチベーター、あるいは逆行性伝達物質を投与することで逆行性伝達と同様の効果が発揮される。
種類
脂質
脂質のなかではエンドカンナビノイドが最も詳しく調べられている逆行性伝達物質である[2]。エンドカンナビノイドによる逆行性シナプス伝達はシナプス前終末に局在するカンナビノイド受容体I型(CB1)の活性化を介して引き起こされる。脳の非常に広い範囲の多くのシナプスでこの逆行性シナプス伝達が報告されている。詳しくは後述。
アラキドン酸が海馬において逆行性伝達物質として働き長期増強(long-term potentiation: LTP)や長期抑圧(long-term depression: LTD)を引き起こすことが提案された[3][4]。しかし、アラキドン酸を逆行性伝達物質と考えるには十分な実験的証拠がなく疑問視されている[5]。現在ではアラキドン酸自身ではなく、その代謝産物が逆行性伝達物質として働くことが考えられている[6]。海馬CA1においてCOX-2によってアラキドン酸からプロスタグランジンE2が作られ、それが逆行性伝達物質として興奮性シナプス前終末に存在するプロスタグランジンE2受容体を活性化し、シナプス伝達を促進させることが報告されている[7]。
エイコサノイドの一種である12-(S)-HPETEが海馬CA1の抑制性ニューロンから放出され興奮性シナプス前終末に存在するTRPV1を活性化しLTDを誘導することが報告されている[8]。
気体分子
一酸化窒素(NO)はセカンドメッセンジャーとして働くことが知られているが、特に海馬のLTP誘導において逆行性伝達物質として働くことが報告されている[9][10]。NMDA受容体を介して流入したカルシウムがNO合成酵素を活性化することによってL-アルギニンからNOがシナプス後部で作られる。細胞外へと放出されたNOはシナプス前終末の内部に入り、可溶性グアニル酸シクラーゼを活性化しcGMP産生とそれに引き続きcGMP依存性プロテインキナーゼの活性化を引き起こす。その結果、神経伝達物質の放出が促進される。海馬以外にも例えば腹側被蓋野[11]、視床下部[12]、大脳皮質[13]、脊髄[14]などでNOによる逆行性シナプス伝達が報告されている。
NOが順行性伝達物質としても働くことが、特に小脳のLTDでよく調べられている[15]。小脳プルキンエ細胞に入力する興奮性の平行線維終末からNOが放出され[16]シナプス後部に入り、可溶性グアニル酸シクラーゼを活性化する。その結果、cGMP/cGMP依存性プロテインキナーゼのカスケードが活性化しG-substrateをリン酸化する[17]。リン酸化したG-substrateはホスファターゼの阻害剤として働き、別経路で活性化されたプロテインキナーゼCと合わせて、最終的にAMPA受容体のリン酸化およびエンドサイトーシスを促進する方向へ向かう。
一酸化炭素も逆行性伝達物質として働くことが示唆されているが[18][9]まだそれを支持する十分な証拠は揃っていない。
神経栄養因子
神経栄養因子は順行性あるいは逆行性に分泌され神経細胞の分化、軸索伸張、発達期のシナプス形成に重要であることがよく知られている。一方で成熟シナプスにおいて逆行性伝達物質として働きシナプス伝達を促進する急性効果もある。例えばBDNFは高頻度刺激によって生じる細胞内のカルシウムイオン濃度上昇によってシナプス後部から放出され、シナプス前終末のTrkB受容体を活性化し、シナプス伝達を促進する。海馬[19]や大脳皮質[20]あるいはアフリカツメガエルの視蓋[21]において、興奮性シナプスや抑制性シナプスでBDNFによる逆行性伝達によってLTPが誘導されることが報告されている。
TGF-βなど他の神経栄養因子も逆行性伝達物質として働く可能性がある[22]。
ペプチド
オピオイドの一種であるダイノルフィンが逆行性伝達物質として働くことが知られている。ダイノルフィンは海馬歯状回の顆粒細胞において電位依存性カルシウムチャネルを介するカルシウムイオン流入によって小胞から分泌される[23]。顆粒細胞の樹状突起から分泌されたダイノルフィンは貫通線維のシナプス前終末に存在するκオピオイド受容体を活性化し、グルタミン酸の放出を抑制する[24][25][23]。最近、視床下部でもダイノルフィンが逆行性伝達物質として働くことが報告された[26][27]。
ダイノルフィンの他にも様々なペプチドが樹状突起から分泌されることが知られているが[28]、それが逆行性にシナプス伝達を調節するかどうかは定かでない。
古典的神経伝達物質
グルタミン酸やGABAといった神経伝達物質が特定のシナプスでは逆行性伝達物質として働く可能性が報告されている[29][30]。大脳皮質では興奮性シナプスや抑制性シナプスにおいてグルタミン酸やGABAによる逆行性シナプス伝達が起こることが報告されている[29]。小脳ではグルタミン酸[31]が脳幹ではGABAが[32]逆行性伝達物質として働くことが報告されている。特殊なシナプスとして嗅球の僧帽細胞と顆粒細胞間のdendro-dendritic結合でGABAによる逆行性伝達がみられる[33]。
セロトニンやドーパミンも樹状突起から放出されることが知られているが、逆行性伝達物質として働きシナプス伝達を制御しうるかどうかはまだ定かでない。
エンドカンナビノイドによる逆行性伝達
上記のほとんどの逆行性伝達物質が脳の限られた範囲のシナプスでのみ働くのに対して、エンドカンナビノイドによる逆行性伝達は脳の非常に広い範囲で起こる。CB1受容体はシナプスによっては興奮性あるいは抑制性神経終末に発現しており、これらの入力を短期あるいは長期に抑制することで記憶・認知、運動制御、鎮痛、食欲調節、報酬系の制御、神経保護などの様々な脳機能に関与する[2]。
エンドカンナビノイド産生機構
エンドカンナビノイドの一種である2-アラキドノイルグリセロール(2-AG)はシナプス後部のニューロンの脱分極によるカルシウムイオン流入、あるいはGq/11タンパク質共役型受容体の活性化によって作られる(図2)。2-AGは前駆体であるジアシルグリセロール(DG)からDGリパーゼ(DGL)によって作られる。シナプス後ニューロンで強い脱分極が起きると電位依存性カルシウムチャネルが開いてカルシウムイオンが流入する。細胞内カルシウム濃度がマイクロモーラー以上に達すると、2-AGが産生される(図2)。また、グループI代謝型グルタミン酸受容体やM1/M3ムスカリン受容体といったGq/11タンパク質共役型受容体の活性化によってPLCβを介する経路で2-AG産生が引き起こされる(図2)。この場合、細胞内カルシウム上昇は必要ない[34]。さらに、こういった受容体の活性化と脱分極による細胞内へのカルシウムイオン流入が同時に起こると、2-AG産生が相乗的に促進される。これは、PLCβがカルシウム感受性を持つため、受容体活性化と同時に細胞内カルシウム濃度が高まると、PLCβ活性が増強するためである[35][36] (図2)。
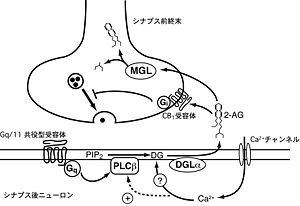
橋本谷祐輝 他:実験医学,Vol.28 No.20:3409-3414,2010より引用
逆行性シナプス伝達抑圧
上記のような刺激によって産生された2-AGは細胞膜を通って逆行性にシナプス前終末に局在するCB1受容体を活性化する。活性化したCB1受容体は共役するGi/oタンパク質を介してシナプス前終末の電位依存性カルシウムチャネルの開口を抑制し、神経伝達物質の放出を抑制する(図2)。ニューロンの脱分極によって生じるエンドカンナビノイドによる逆行性シナプス伝達抑圧をdepolarization-induced suppression of inhibition/excitation (DSI/DSE)とよぶ。脱分極したニューロンに入力する抑制性入力が抑えられる場合がDSI、興奮性入力が抑えられる場合がDSEである。単なる脱分極と違い、生理的条件に近いシナプス刺激によってエンドカンナビノイドによる短期の逆行性シナプス伝達抑圧が起こることがわかっている[37][38][36]。この場合、上述のようなGq/11タンパク質共役型受容体の活性化と細胞内へのカルシウム流入の相乗効果で2-AGが作られると考えられる[39]。
エンドカンナビノイドは細胞外を非常に限られた範囲でしか拡散できない。海馬では10~20μm程度しか拡散しないと考えられている。2-AGの分解酵素であるモノアシルグリセロールリパーゼ(MGL)はシナプス前終末に局在しており、逆行性に運ばれて来た2-AGを速やかに分解する[40](図2) 。
LTD
エンドカンナビノイドはLTDの誘導にも寄与する。興奮性シナプスでみられるエンドカンナビノイド依存性のLTDは、背側線条体、大脳皮質、側坐核、小脳、海馬、背側蝸牛神経核などで報告されている。一方、抑制性シナプスでは、扁桃体、海馬、大脳皮質、腹側被蓋野などで報告がある。
エンドカンナビノイド依存性のLTD(eCB-LTD)誘導にはLTD誘発刺激中にエンドカンナビノイドが産生されてシナプス前終末のCB1受容体が活性化されることが必要である。海馬ではCB1受容体が5-10分間、活性化されることがLTD誘導に必須であることが示されており、LTDの維持にはCB1受容体活性は不要となる[41]。LTD誘発刺激条件は脳部位によって様々であるがシナプス後部ニューロンへのカルシウムイオン流入あるいはグループI代謝型グルタミン酸受容体の活性化を介してエンドカンナビノイド産生が引き起こされることが明らかになっている [42]。エンドカンナビノイドは興奮性シナプスで作られるので、抑制性シナプスで起こるeCB-LTDは異シナプス的に誘導されるLTDである。小脳を除いて、eCB-LTDの発現は、これまですべてシナプス前性の可塑的変化によることが示されている。しかし数分間のCB1受容体の活性化がどのようにして長期の神経伝達物質放出の抑制を誘導するのかについてはまだよくわかっていない。海馬においてはシナプス前終末におけるRIM1αの作用と、カルシウムイオン流入によるカルシニューリンの活性化が必須であることが示されている[42]。
参考文献
- ↑
Regehr, W.G., Carey, M.R., & Best, A.R. (2009).
Activity-dependent regulation of synapses by retrograde messengers. Neuron, 63(2), 154-70. [PubMed:19640475] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Kano, M., Ohno-Shosaku, T., Hashimotodani, Y., Uchigashima, M., & Watanabe, M. (2009).
Endocannabinoid-mediated control of synaptic transmission. Physiological reviews, 89(1), 309-80. [PubMed:19126760] [WorldCat] [DOI] - ↑
Williams, J.H., Errington, M.L., Lynch, M.A., & Bliss, T.V. (1989).
Arachidonic acid induces a long-term activity-dependent enhancement of synaptic transmission in the hippocampus. Nature, 341(6244), 739-42. [PubMed:2571939] [WorldCat] [DOI] - ↑
Bolshakov, V.Y., & Siegelbaum, S.A. (1995).
Hippocampal long-term depression: arachidonic acid as a potential retrograde messenger. Neuropharmacology, 34(11), 1581-7. [PubMed:8606806] [WorldCat] [DOI] - ↑
Fitzsimonds, R.M., & Poo, M.M. (1998).
Retrograde signaling in the development and modification of synapses. Physiological reviews, 78(1), 143-70. [PubMed:9457171] [WorldCat] [DOI] - ↑
Sang, N., & Chen, C. (2006).
Lipid signaling and synaptic plasticity. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 12(5), 425-34. [PubMed:16957004] [WorldCat] [DOI] - ↑
Sang, N., Zhang, J., Marcheselli, V., Bazan, N.G., & Chen, C. (2005).
Postsynaptically synthesized prostaglandin E2 (PGE2) modulates hippocampal synaptic transmission via a presynaptic PGE2 EP2 receptor. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(43), 9858-70. [PubMed:16251433] [PMC] [WorldCat] [DOI] - ↑
Gibson, H.E., Edwards, J.G., Page, R.S., Van Hook, M.J., & Kauer, J.A. (2008).
TRPV1 channels mediate long-term depression at synapses on hippocampal interneurons. Neuron, 57(5), 746-59. [PubMed:18341994] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Dawson, T.M., & Snyder, S.H. (1994).
Gases as biological messengers: nitric oxide and carbon monoxide in the brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(9), 5147-59. [PubMed:8083727] [WorldCat] - ↑
Hölscher, C. (1997).
Nitric oxide, the enigmatic neuronal messenger: its role in synaptic plasticity. Trends in neurosciences, 20(7), 298-303. [PubMed:9223222] [WorldCat] [DOI] - ↑
Nugent, F.S., Penick, E.C., & Kauer, J.A. (2007).
Opioids block long-term potentiation of inhibitory synapses. Nature, 446(7139), 1086-90. [PubMed:17460674] [WorldCat] [DOI] - ↑
Di, S., Maxson, M.M., Franco, A., & Tasker, J.G. (2009).
Glucocorticoids regulate glutamate and GABA synapse-specific retrograde transmission via divergent nongenomic signaling pathways. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(2), 393-401. [PubMed:19144839] [PMC] [WorldCat] [DOI] - ↑
Hardingham, N., & Fox, K. (2006).
The role of nitric oxide and GluR1 in presynaptic and postsynaptic components of neocortical potentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(28), 7395-404. [PubMed:16837587] [PMC] [WorldCat] [DOI] - ↑
Fenselau, H., Heinke, B., & Sandkühler, J. (2011).
Heterosynaptic long-term potentiation at GABAergic synapses of spinal lamina I neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(48), 17383-91. [PubMed:22131400] [PMC] [WorldCat] [DOI] - ↑
Garthwaite, J. (2008).
Concepts of neural nitric oxide-mediated transmission. The European journal of neuroscience, 27(11), 2783-802. [PubMed:18588525] [PMC] [WorldCat] [DOI] - ↑
Shibuki, K., & Kimura, S. (1997).
Dynamic properties of nitric oxide release from parallel fibres in rat cerebellar slices. The Journal of physiology, 498 ( Pt 2), 443-52. [PubMed:9032691] [PMC] [WorldCat] [DOI] - ↑
Endo, S., Suzuki, M., Sumi, M., Nairn, A.C., Morita, R., Yamakawa, K., ..., & Ito, M. (1999).
Molecular identification of human G-substrate, a possible downstream component of the cGMP-dependent protein kinase cascade in cerebellar Purkinje cells. Proceedings of the National Academy of Sciences of the United States of America, 96(5), 2467-72. [PubMed:10051666] [PMC] [WorldCat] [DOI] - ↑
Bacskai, B.J., Hochner, B., Mahaut-Smith, M., Adams, S.R., Kaang, B.K., Kandel, E.R., & Tsien, R.Y. (1993).
Spatially resolved dynamics of cAMP and protein kinase A subunits in Aplysia sensory neurons. Science (New York, N.Y.), 260(5105), 222-6. [PubMed:7682336] [WorldCat] [DOI] - ↑
Magby, J.P., Bi, C., Chen, Z.Y., Lee, F.S., & Plummer, M.R. (2006).
Single-cell characterization of retrograde signaling by brain-derived neurotrophic factor. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(52), 13531-6. [PubMed:17192436] [PMC] [WorldCat] [DOI] - ↑
Inagaki, T., Begum, T., Reza, F., Horibe, S., Inaba, M., Yoshimura, Y., & Komatsu, Y. (2008).
Brain-derived neurotrophic factor-mediated retrograde signaling required for the induction of long-term potentiation at inhibitory synapses of visual cortical pyramidal neurons. Neuroscience research, 61(2), 192-200. [PubMed:18395922] [WorldCat] [DOI] - ↑
Du, J.L., & Poo, M.M. (2004).
Rapid BDNF-induced retrograde synaptic modification in a developing retinotectal system. Nature, 429(6994), 878-83. [PubMed:15215865] [WorldCat] [DOI] - ↑
Sanyal, S., Kim, S.M., & Ramaswami, M. (2004).
Retrograde regulation in the CNS; neuron-specific interpretations of TGF-beta signaling. Neuron, 41(6), 845-8. [PubMed:15046717] [WorldCat] [DOI] - ↑ 23.0 23.1
Simmons, M.L., Terman, G.W., Gibbs, S.M., & Chavkin, C. (1995).
L-type calcium channels mediate dynorphin neuropeptide release from dendrites but not axons of hippocampal granule cells. Neuron, 14(6), 1265-72. [PubMed:7605635] [WorldCat] [DOI] - ↑
Wagner, J.J., Caudle, R.M., & Chavkin, C. (1992).
Kappa-opioids decrease excitatory transmission in the dentate gyrus of the guinea pig hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 12(1), 132-41. [PubMed:1345943] [WorldCat] - ↑
Drake, C.T., Terman, G.W., Simmons, M.L., Milner, T.A., Kunkel, D.D., Schwartzkroin, P.A., & Chavkin, C. (1994).
Dynorphin opioids present in dentate granule cells may function as retrograde inhibitory neurotransmitters. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(6), 3736-50. [PubMed:7911518] [WorldCat] - ↑
Iremonger, K.J., & Bains, J.S. (2009).
Retrograde opioid signaling regulates glutamatergic transmission in the hypothalamus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(22), 7349-58. [PubMed:19494156] [PMC] [WorldCat] [DOI] - ↑
Bonfardin, V.D., Theodosis, D.T., Konnerth, A., & Oliet, S.H. (2012).
Kainate receptor-induced retrograde inhibition of glutamatergic transmission in vasopressin neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(4), 1301-10. [PubMed:22279215] [PMC] [WorldCat] [DOI] - ↑
Ludwig, M., & Pittman, Q.J. (2003).
Talking back: dendritic neurotransmitter release. Trends in neurosciences, 26(5), 255-61. [PubMed:12744842] [WorldCat] [DOI] - ↑ 29.0 29.1
Zilberter, Y., Harkany, T., & Holmgren, C.D. (2005).
Dendritic release of retrograde messengers controls synaptic transmission in local neocortical networks. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 11(4), 334-44. [PubMed:16061520] [WorldCat] [DOI] - ↑
Koch, U., & Magnusson, A.K. (2009).
Unconventional GABA release: mechanisms and function. Current opinion in neurobiology, 19(3), 305-10. [PubMed:19375301] [WorldCat] [DOI] - ↑
Duguid, I.C., & Smart, T.G. (2004).
Retrograde activation of presynaptic NMDA receptors enhances GABA release at cerebellar interneuron-Purkinje cell synapses. Nature neuroscience, 7(5), 525-33. [PubMed:15097992] [WorldCat] [DOI] - ↑
Magnusson, A.K., Park, T.J., Pecka, M., Grothe, B., & Koch, U. (2008).
Retrograde GABA signaling adjusts sound localization by balancing excitation and inhibition in the brainstem. Neuron, 59(1), 125-37. [PubMed:18614034] [WorldCat] [DOI] - ↑
Isaacson, J.S., & Strowbridge, B.W. (1998).
Olfactory reciprocal synapses: dendritic signaling in the CNS. Neuron, 20(4), 749-61. [PubMed:9581766] [WorldCat] [DOI] - ↑
Maejima, T., Hashimoto, K., Yoshida, T., Aiba, A., & Kano, M. (2001).
Presynaptic inhibition caused by retrograde signal from metabotropic glutamate to cannabinoid receptors. Neuron, 31(3), 463-75. [PubMed:11516402] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., Tsubokawa, H., Ogata, H., Emoto, K., Maejima, T., ..., & Kano, M. (2005).
Phospholipase Cbeta serves as a coincidence detector through its Ca2+ dependency for triggering retrograde endocannabinoid signal. Neuron, 45(2), 257-68. [PubMed:15664177] [WorldCat] [DOI] - ↑ 36.0 36.1
Maejima, T., Oka, S., Hashimotodani, Y., Ohno-Shosaku, T., Aiba, A., Wu, D., ..., & Kano, M. (2005).
Synaptically driven endocannabinoid release requires Ca2+-assisted metabotropic glutamate receptor subtype 1 to phospholipase Cbeta4 signaling cascade in the cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(29), 6826-35. [PubMed:16033892] [PMC] [WorldCat] [DOI] - ↑
Brown, S.P., Brenowitz, S.D., & Regehr, W.G. (2003).
Brief presynaptic bursts evoke synapse-specific retrograde inhibition mediated by endogenous cannabinoids. Nature neuroscience, 6(10), 1048-57. [PubMed:14502290] [WorldCat] [DOI] - ↑
Melis, M., Perra, S., Muntoni, A.L., Pillolla, G., Lutz, B., Marsicano, G., ..., & Pistis, M. (2004).
Prefrontal cortex stimulation induces 2-arachidonoyl-glycerol-mediated suppression of excitation in dopamine neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(47), 10707-15. [PubMed:15564588] [PMC] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., & Kano, M. (2007).
Endocannabinoids and synaptic function in the CNS. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry, 13(2), 127-37. [PubMed:17404373] [WorldCat] [DOI] - ↑
Hashimotodani, Y., Ohno-Shosaku, T., & Kano, M. (2007).
Presynaptic monoacylglycerol lipase activity determines basal endocannabinoid tone and terminates retrograde endocannabinoid signaling in the hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(5), 1211-9. [PubMed:17267577] [PMC] [WorldCat] [DOI] - ↑
Chevaleyre, V., & Castillo, P.E. (2003).
Heterosynaptic LTD of hippocampal GABAergic synapses: a novel role of endocannabinoids in regulating excitability. Neuron, 38(3), 461-72. [PubMed:12741992] [WorldCat] [DOI] - ↑ 42.0 42.1
Heifets, B.D., & Castillo, P.E. (2009).
Endocannabinoid signaling and long-term synaptic plasticity. Annual review of physiology, 71, 283-306. [PubMed:19575681] [PMC] [WorldCat] [DOI]
(執筆者:橋本谷祐輝、狩野方伸 担当編集委員:河西春郎)