視覚運動性眼振
永雄 総一
のぞみ病院
DOI:10.14931/bsd.1729 原稿受付日:2012年7月3日 原稿完成日:2016年5月10日 一部改訂:2021年9月10日
担当編集委員:田中 啓治(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:optokinetic nystagmus 独:optokinetischer Nystagmus 仏:nystagmus optocinétique
同義語:視運動性眼振
外界が大きく動く時、例えば電車中でぼんやりと車窓から景色を眺めている時には、流れていく風景を追うよう遅い眼球運動(緩徐相)と、リセットのための緩徐相とは逆向きの速い眼球運動(急速相)が繰り返される。これを視覚運動性眼振(optokinetic nystagmus, OKN)と呼ぶ。マウスやウサギの視覚運動性眼振の緩徐相は、周辺視による視機性眼球反応(optokinetic response, OKR)に起因する。視機性眼球反応は、網膜上の像が外界の動きによってブレないように作用する眼球反射であり、前庭動眼反射とともに姿勢保持に重要な役割を演じている。視機性眼球反応では前庭動眼反射の場合と同様に、小脳片葉では長期抑圧により反射の効率を最適にするような運動学習が生じる。霊長類では、網膜の中心窩に対象を捉えてものを固視する(中心視)ための滑動性追跡眼球運動(smooth pursuit eye movement)が発達しており、ヒトやサルの視覚運動性眼振の緩徐相の大部分は滑動性追跡眼球運動に起因する。
視機性眼球反応の神経回路と動特性
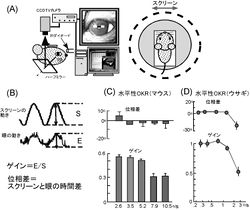
(A)マウスを円筒状の縞模様(ドットパターン)スクリーンの中に置き、頭を固定する。スクリーンを正弦波状に回転させたときに誘発される眼球運動を赤外線テレビカメラで記録し、瞳孔の中心の位置を計測する。
(B)視機性眼球反応のゲインと位相差の算出法。計測された眼球運動とスクリーンの動きとを比較し、ゲインと位相差(時間、もしくは1周期360度として角度に換算)を算出する。
(C)マウスの水平性視機性眼球反応の位相差とゲイン。[1]を改変。
(D)黒眼ウサギの水平性視機性眼球反応の位相差とゲイン。[2]を改変。
視機性眼球反応(視機性眼球反応)とは、動物のまわりの視野が動く時に、網膜に写る外界の像がブレないように眼が動く反射である。視機性眼球反応を誘発するのは、網膜上に像の滑り(retinal slip)が生じることが必要であり、眼が動くことによってretinal slipは減少する。従って、視機性眼球反応はネガテイブフィードバック制御の反射である。視機性眼球反応はすべての動物種に見られる。実験的に視機性眼球反応を誘発するには、動物の眼前に、コントラストが明瞭な縦縞もしくはチェック模様のドラム状の大きなスクリーンをおき、それを一方向もしくは正弦波状に回転させる[2] [1]。周辺視しかない単眼視の動物種(魚類、鳥類、マウス、ラットやウサギ)では、スクリーンをゆっくりと動かすと、あたかもそれを追従するように視機性眼球反応が誘発される。ところが両眼視で中心視の発達しているサルやヒトなどの霊長類では、固視の機能があるので、ただ単に単純な模様のスクリーンを廻しても視機性眼球反応はほとんど誘発されない。ヒトやサルでこのような方法で視機性眼球反応が観察されるのは、固視機能があまり発達していない幼弱期か、あるいは特定の視標に注視していない時、例えば電車に乗ってぼんやりと外を眺めている時である。
視機性眼球反応を起こす刺激となる外界の大きな動きは網膜の視細胞に感知され、その情報は視神経により対側の視蓋前域にある視索路核(nucleus of optic tract)に伝わる。視索路核は脳幹の橋被蓋網様核(nucleus reticularis tegmenti pontis、NRTP)に投射し、NRTPは対側(従って刺激された眼球とは同側)の前庭神経核の前庭動眼反射を中継する神経細胞群に投射する。明るいところで頭を回転したときは、前庭動眼反射により頭の回転を補正する方向に眼が動くが、前庭動眼反射だけでは頭の回転を完全に補償することができないので、retinal slipが生じる。するとそのretinal slipを打ち消すように視機性眼球反応が働き、結果として頭の動きを完全に補償だけ眼が動き視野はぶれずにすむ。このように視機性眼球反応と前庭動眼反射は機能的に密接な関係を持ち、脳幹と小脳の神経回路を共有する[3] [4][5]。
NOTやNRTPの神経細胞は対側の眼球上で、スクリーンが鼻から耳の方向に動く時には反応するが、耳から鼻の方向に動く時はあまり反応しない。これに対応して視機性眼球反応にも方向選択性があり、単眼にスクリーンの回転刺激を提示した時に、鼻―耳方向に誘発される視機性眼球反応に比べて、耳―鼻方向に誘発される視機性眼球反応ははるかに小さい。一方、垂直方向の視機性眼球反応には、水平性の視機性眼球反応で見られるような方向選択性はない[5]。
視機性眼球反応の動特性を調べるには、縞もしくがパターン模様のスクリーンを眼前におき、それを正弦波状に動かす。誘誘発される眼球運動を数十周期程度、テレビカメラもしくはサーチコイルで記録する方法を用いる(図1A)。記録したデータから眼球運動の位置もしくは速度のトレースを算出し、スクリーンの動きと比較することで、視機性眼球反応の利得(ゲイン)と位相差を算出する(図1B)。図1Cと図1Dにそれぞれマウスと黒眼のウサギの視機性眼球反応のゲインと位相差を示す。通常比較的遅いスクリーンの回転に対してゲインはほぼ一定であり、スクリーンの回転が速くなるとゲインは低下する。位相差は、ゲインが一定のところではほぼ0度であるが、ゲインが下がるにつれて遅れが増加する。これらは、閉ループの視機性眼球反応の動特性である。
開ループの視機性眼球反応ゲインは次のように測定する。一側の外眼筋を支配する神経を局所麻酔し眼球を不動化する。次に不動化した眼にのみ視覚刺激を提示し、視覚刺激を遮断した対側の眼球で誘発される視機性眼球反応を記録する。あるいは視機性眼球反応を高速で測定しながら、retinal slipが実質0(stabilized retinal image)となるようにスクリーンの動きを調節する。視機性眼球反応の開ループゲインは100程度である[5]。
小脳片葉による視機性眼球反応ゲインの適応調節

(A)視機性眼球反応の短期と長期のゲインの適応。マウスに1日1時間の周期0.16Hz、振幅15度の正弦波状スクリーンの回転によるトレーニングを連続して5日間行ったときの視機性眼球反応のゲインの変化。○は毎日のトレーニングの前のゲイン、●は1時間のトレーニング後のゲイン。トレーニング時以外はマウスを暗所飼育した。5日間のトレーニング後、マウスを通常の飼育(明、12時間;暗、12時間)に戻し、視機性眼球反応のゲインの回復を2週間ほど調べた。右は、同じマウスの1日目と3, 4、6日目の視機性眼球反応の平均とレース。**, P < 0.01; *, P <0.1(paired t-test).
(B)小脳片葉による視機性眼球反応の適応制御機構。適応の短期の記憶痕跡は小脳片葉に形成されるが、長期の記憶は前庭神経核に保持される。[6]を改変。
外界がゆっくりと動く時には視機性眼球反応のゲインが高く外界の動きに眼は十分追従できるが、外界が速く動く時にはゲインが低いので、眼は追従できずretinal slipが生じてしまう。そのような場合が続くと、視機性眼球反応のゲインを高めるような小脳による運動学習がおこる。これを視機性眼球反応の適応と呼ぶ。
図2Aはマウスの例であるが、高速度で正弦波状に動くスクリーンを眼前に提示することを1時間持続的に行うと、視機性眼球反応に適応が生じゲインが増加する。視機性眼球反応の適応は、コイ(金魚)、ニワトリやウサギなどの動物種で見られる。このような1時間のトレーニングで生じるゲインの増加は通常24時間で消失するので短期の適応である。さらに、毎日1時間の視機性眼球反応のトレーニングを1週間続けると、各日のトレーニング前の視機性眼球反応ゲインが徐々に上昇する。この長期間のトレーニングによるゲインの増加は、訓練終了後も2週間程度持続するので長期の適応である。
小脳片葉が短期の適応に不可欠であることが、前庭動眼反射と同様に様々な実験結果により確認されている(図2B)。片葉のH-ゾーンと呼ばれる領域のプルキンエ細胞には、平行線維を介して視機性眼球反応を引き起こすのに必要な視覚情報が伝えられる。また適応に必要なretinal slipの情報は、登上線維を介して下オリーブ核(正中副オリーブ)背側帽(dorsal cap)から、H-ゾーンのプルキンエ細胞に伝えられる。一方、H-ゾーンのプルキンエ細胞は前庭動眼反射を中継する前庭神経核の神経細胞に投射する。従ってこのH-ゾーンのプルキンエ細胞が変化すると視機性眼球反応の特性(ゲイン)も変化することになる。
長期抑圧とは、平行線維―プルキンエ細胞間のシナプス伝達が同じプルキンエ細胞に入力する登上線維の信号によって長期間にわたり減弱されるという可塑性であり、伊藤正男らによって1982年に発見された。この長期抑圧がH-ゾーンのプルキンエ細胞に生じると前庭動眼反射と視機性眼球反応のゲインに適応が生じるという仮説があり、片葉仮説と呼ばれている。片葉仮説は、片葉や下オリーブ核の破壊実験、長期抑圧の阻害剤を用いた薬理学の実験、多くの遺伝子変異マウスを用いた実験、片葉の神経活動の記録実験や計算論によるシミュレーションの研究により支持されている[3] [4][7]。
適応をはじめとするような脳による運動学習の結果は、記憶としてある程度保持され利用される。記憶のもとになる神経の変化を記憶痕跡(memory trace)と呼ぶ。この視機性眼球反応の適応の記憶痕跡が脳のどの部位に保持されているかが、神経組織の活動を局所麻酔剤で遮断する方法により調べられている。もし神経活動が遮断された脳部位に記憶痕跡が存在するならば、遮断により記憶が消され、適応は直ちに消去されるはずである。実験の結果は、前庭動眼反射の場合と同様に、数時間のトレーニングで生じた短期の適応の記憶の痕跡が片葉に保持されているのに対して、数日間の長期の適応の記憶の痕跡は片葉の出力先の前庭神経核に保持されていることを示唆する(図2B)。つまりトレーニングを繰り返し行うことで、視機性眼球反応の適応の記憶痕跡がプルキンエ細胞からシナプスを越えて前庭神経核に移動することになる。前庭核のシナプスでは長期増強が起こることが示されており、それが長期適応の記憶痕跡の元になると推定されている[6] [8]。
視覚運動性眼振と視機性眼球反応
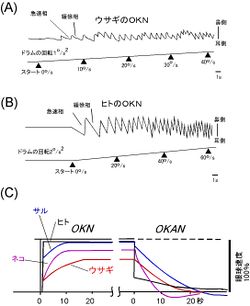
(A)ウサギの周りのドラム状のスクリーンを左方向に一定速度(30°/s)で回転させると、ウサギの左眼には、回転と同じ方向の緩徐相と、逆の方向の急速相が生じる。緩徐相が一定の速度に達するには時間がかかり、かつその最高速度はスクリーンの回転速度に比べて小さい。
(B)Aと同様の実験をヒトで行なったときに観察される視覚運動性眼振。ただしドラムの回転速度を一定の加速度(2°/s2)で増加させた。ウサギの時に比べて、視覚運動性眼振はすぐに立ち上がり、そのあとやや遅れてスクリーンの速度と同じ速度に達する。▲でその時点でのスクリーンの回転速度を示す。
(C)視覚運動性眼振とOKANの緩徐相の速度(ドラムの速度に対するパーセント比率)の時間経過をヒト、サル、ネコ,ウサギで比べたもの。AとBは[9]を改変。Cは[10]を改変。
臨床医学の前庭や視覚の機能の検査に、ドラム状の縞模様のスクリーンを定加速度かつ定方向にまわすことで誘発される視覚運動性眼振(視覚運動性眼振)が用いられる。視覚運動性眼振は、1820年に、小脳のプルキンエ細胞の命名者であるJ. E. Purkinje(1787-1869)によって初めて記載された。図3Aと図3Bにウサギとヒトの視覚運動性眼振の例をそれぞれ示す。
視覚運動性眼振は、遅い眼球運動と速い眼球運動が規則的に繰り返されることによって生じる。遅い眼球運動は、視機性眼球反応と同じくスクリーンの回転と同方向に生じ、緩徐相(slow phase)と呼ばれる。一方、スクリーンの回転と逆方向に生じる速い眼球運動は、急速相(fast phase)と呼ばれる。ウサギでは、スクリーンの回転開始からかなり遅れて視覚運動性眼振の緩徐相が出現し、やがて一定速度に達する。その速度はスクリーンの速度に比べてかなり小さい。一方、ヒトやサルでは、緩徐相はスクリーンが回転を始めると急速に立ち上がり、そのあと数秒かけて徐々に増加し、やがてスクリーンの回転速度にほぼ等しくなる。
視覚運動性眼振の緩徐相がスクリーンの回転速度に達した段階で、スクリーンの回転を止めてまっ暗にすると、視(覚)運動性後眼振(optokinetic after nystagmus, OKAN)が生じる。視(覚)運動性後眼振にも緩徐相と急速相がある。ヒトやサルの視(覚)運動性後眼振の緩徐相の速度とその減衰の時間経過は、ウサギの視(覚)運動性後眼振の緩徐相の速度とその立ち上がりの時間経過に似ている。一方、ウサギの視覚運動性眼振の緩徐相には、サルやヒトで見られる速い立ち上がりの成分はなく、視(覚)運動性後眼振の緩徐相と同じような遅い成分しかない(図3C)。そこで、ヒトやサルの視覚運動性眼振と視(覚)運動性後眼振の緩徐相のうち、視覚運動性眼振緩徐相の立ち上がりの遅い成分と視(覚)運動性後眼振緩徐相が視機性眼球反応に由来するが、視覚運動性眼振緩徐相の立ち上がりの速い成分は霊長類でよく発達している滑動性追跡眼球運動に由来すると考えられている。サルでは両側の前庭器官を破壊すると視(覚)運動性後眼振が完全に消失し、ヒトでも両側の前庭器官が障害されると視(覚)運動性後眼振が出なくなることがある。また、ヒトで網膜の中心部の損傷により滑動性追跡眼球運動が障害されても、遅い成分の視覚運動性眼振は誘発される。これらの所見は、ヒトやサルの立ち上がりの遅い視覚運動性眼振の緩徐相 = 視(覚)運動性後眼振の緩徐相 = 視機性眼球反応という考え方を支持する[9]。
ヒトのサルでは、眼前に提示した比較的大きなパターンをステップランプ状に動かす時に、サッケード眼球運動に引き続いてランプ状のパターンの動きに依存したドリフト状の遅い眼球運動が誘発される。この眼球運動は追従性眼球運動反応(ocular following response, OFR)と呼ばれる。追従性眼球運動反応の発現には大脳皮質視覚連合野MT野や橋核、小脳腹側傍片葉が関与する。滑動性追跡眼球運動には大脳皮質の前頭眼野に由来するものと頭頂連合野に由来するものがあるが、追従性眼球運動反応はそのうちの頭頂連合野に由来するものと考えられる。ヒトやサルの視覚運動性眼振の緩徐相の立ち上がりの速い成分は滑動性追跡眼球運動に起因するのは確かであるが、この立ち上がりの速い成分に追従性眼球運動反応がどの程度寄与しているかは定量的には分かっていない。
関連項目
外部リンク
参考文献
- ↑ 1.0 1.1
Shutoh, F., Katoh, A., Kitazawa, H., Aiba, A., Itohara, S., & Nagao, S. (2002).
Loss of adaptability of horizontal optokinetic response eye movements in mGluR1 knockout mice. Neuroscience research, 42(2), 141-5. [PubMed:11849733] [WorldCat] [DOI] - ↑ 2.0 2.1
Nagao, S. (1983).
Effects of vestibulocerebellar lesions upon dynamic characteristics and adaptation of vestibulo-ocular and optokinetic responses in pigmented rabbits. Experimental brain research, 53(1), 36-46. [PubMed:6609085] [WorldCat] [DOI] - ↑ 3.0 3.1 Ito M
The cerebellum and neural control.
Raven, New York, 1984. - ↑ 4.0 4.1 Ito M
The cerebellum: Brain for an implicit self.
FT Press, New York, 2011. - ↑ 5.0 5.1 5.2 Collewijn H
The oculomotor system of the rabbit and plasticity.
Springer, Berlin Heidelberg New York, 1981 - ↑ 6.0 6.1
Shutoh, F., Ohki, M., Kitazawa, H., Itohara, S., & Nagao, S. (2006).
Memory trace of motor learning shifts transsynaptically from cerebellar cortex to nuclei for consolidation. Neuroscience, 139(2), 767-77. [PubMed:16458438] [WorldCat] [DOI] - ↑ 永雄総一
神経研究の進歩 44:748-758, 2000. - ↑ 永雄総一
生体の科学 63: 34-41, 2012. - ↑ 9.0 9.1 時田喬
眼振の生理と検査
金原出版, 東京, 1973. - ↑ 篠田義一
視運動性眼振の動特性と神経機構. 眼球運動の生理学(小松崎, 篠田,丸尾編)
医学書院,東京, 1985.