「トリプレット病」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の33版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:trinucleotide repeat disorders, triplet repeat diseases | |||
同義語:トリプレットリピート病 | |||
同義語:トリプレットリピート病 | |||
トリプレット病とは[[wikipedia:ja:ゲノム|ゲノム]]内の[[wikipedia:ja:遺伝子|遺伝子]]に存在する3塩基の繰り返し配列(トリプレット・リピート)が異常に伸長することによっておこる一群の遺伝性神経疾患のことである。これらの疾患においては、リピート長が遺伝学的に不安定で、親から子孫への疾患遺伝子の伝播に伴ってリピート長が変動することが多い。少なくとも17種類の疾患が知られている。トリプレット病 におけるリピート長の伸長は、遺伝子産物(タンパク質・RNA)の機能喪失 (loss of function)または機能獲得(gain of function)の機構を介して、病態を発症させると考えられる。 | |||
{| | == トリプレット病とは == | ||
| | |||
トリプレット病とは[[wikipedia:ja:ゲノム|ゲノム]]内の[[wikipedia:ja:遺伝子|遺伝子]]に存在する3塩基の繰り返し配列(トリプレット・リピート)が異常に伸長することによっておこる一群の遺伝性神経疾患のことである。これらの疾患においては、リピート長が遺伝学的に不安定で、親から子孫への疾患遺伝子の伝播に伴ってリピート長が変動することが多い。世代を経る毎に発症年齢が若年化し、疾患の病態がより重篤になる表現促進現象 (anticipation)が認められることがあり、従って一般にそれぞれの疾患の表現型は同一家系内でも多様である。現在までに典型的なトリプレット病として、若年性発症の精神遅滞を主徴とする疾患から中年期以降に発症する神経変性疾患まで少なくとも17種類の疾患が知られている。 | |||
|- | |||
{| cellspacing="1" cellpadding="1" border="1" | |||
|- style="background-color: rgb(221, 255, 221);" | |||
| style="text-align: center;" | 疾患 | |||
| style="text-align: center;" | 略号 | |||
| style="text-align: center;" | OMIM | |||
| style="text-align: center;" | 染色体 | |||
| style="text-align: center;" | 遺伝子内の局在 | |||
| style="text-align: center;" | リピート | |||
| style="text-align: center;" | 遺伝子 | |||
| style="text-align: center;" | 遺伝子産物 | |||
| style="text-align: center;" | 正常サイズ | |||
| style="text-align: center;" | 伸張サイズ | |||
| style="text-align: center;" | 主な臨床症状 | |||
|- style="background-color: rgb(169, 169, 169);" | |||
| colspan="11" | Loss of Funtionによるもの | |||
|- | |- | ||
| | | 脆弱X症候群 | ||
| | | FRAXA | ||
| [http://omim.org/entry/300624 300624] | | [http://omim.org/entry/300624 300624] | ||
| Xq27.3 | | Xq27.3 | ||
| [[ | | [[wikipedia:Five prime untranslated region|5'UTR]] | ||
| (CGC)n | | (CGC)n | ||
| | | FMR1 | ||
| | | fragile X mental retardation 1 | ||
| 6-50 | | 6-50 | ||
| >200 | | >200 | ||
| [[精神遅滞]]、[[自閉症]]、巨大[[ | | [[精神遅滞]]、[[自閉症]]、巨大[[wikipedia:ja:睾丸|睾丸]] | ||
|- | |- | ||
| | | Fragile XE症候群 | ||
| | | FRAXE | ||
| [http://omim.org/entry/309548 309548] | | [http://omim.org/entry/309548 309548] | ||
| Xq28 | | Xq28 | ||
| 5'UTR | | 5'UTR | ||
| (CCG)n | | (CCG)n | ||
| | | FMR2 | ||
| | | | ||
| 4-39 | | 4-39 | ||
| >200 | | >200 | ||
| 精神遅滞 | | 精神遅滞 | ||
|- | |- | ||
| | | フリードライヒ失調症 | ||
| | | FRDA | ||
| [http://omim.org/entry/229300 229300] | | [http://omim.org/entry/229300 229300] | ||
| 9q21.11 | | 9q21.11 | ||
| [[ | | [[wikipedia:ja:イントロン|イントロン]] | ||
| (GAA)n | | (GAA)n | ||
| | | FXN | ||
| | | frataxin | ||
| 6-32 | | 6-32 | ||
| 200-1700 | | 200-1700 | ||
| 感覚性失調、[[ | | 感覚性失調、[[wikipedia:ja:心筋症|心筋症]]、[[wikipedia:ja:糖尿病|糖尿病]] | ||
|- | |- style="background-color: rgb(169, 169, 169);" | ||
| colspan="11" | Toxic Gain of Function(伸長ポリグルタミン鎖)によるもの | |||
|- | |- | ||
| | | ハンチントン病 | ||
| HD | | HD | ||
| [http://omim.org/entry/143100 143100] | | [http://omim.org/entry/143100 143100] | ||
| 4p16.3 | | 4p16.3 | ||
| [[ | | [[wikipedia:ja:エクソン|エクソン]] | ||
| (CAG)n | | (CAG)n | ||
| | | HTT | ||
| | | huntingtin | ||
| 6-34 | | 6-34 | ||
| 36-121 | | 36-121 | ||
| [[舞踏病]]、[[ジストニア]]、[[認知症]]、精神症状 | | [[舞踏病]]、[[ジストニア]]、[[認知症]]、精神症状 | ||
|- | |- | ||
| | | 球脊髄性筋萎縮症 | ||
| | | SBMA | ||
| [http://omim.org/entry/313200 313200] | | [http://omim.org/entry/313200 313200] | ||
| Xq12 | | Xq12 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | AR | ||
| | | androgen receptor | ||
| 9-36 | | 9-36 | ||
| 38-62 | | 38-62 | ||
| 筋力低下、[[ | | 筋力低下、[[wikipedia:ja:女性化乳房|女性化乳房]] | ||
|- | |- | ||
| | | 脊髄小脳変性症1 | ||
| | | SCA1 | ||
| [http://omim.org/entry/164400 164400] | | [http://omim.org/entry/164400 164400] | ||
| 6p22.3 | | 6p22.3 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | ATXN1 | ||
| | | ataxin 1 | ||
| 19-38 | | 19-38 | ||
| 39-82 | | 39-82 | ||
| [[小脳失調]]、[[構音障害]]、認知症 | | [[小脳失調]]、[[構音障害]]、認知症 | ||
|- | |- | ||
| | | 脊髄小脳変性症2 | ||
| | | SCA2 | ||
| [http://omim.org/entry/183090 183090] | | [http://omim.org/entry/183090 183090] | ||
| 12q24.12 | | 12q24.12 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | ATXN2 | ||
| | | ataxin 2 | ||
| 13-31 | | 13-31 | ||
| 35-500 | | 35-500 | ||
| 小脳失調、[[ | | 小脳失調、[[wikipedia:ja:腱反射|腱反射]]消失、緩徐眼球運動 | ||
|- | |- | ||
| | | 脊髄小脳変性症3 | ||
| | | SCA3 | ||
| [http://omim.org/entry/109150 109150] | | [http://omim.org/entry/109150 109150] | ||
| 14q32.12 | | 14q32.12 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | ATXN3 | ||
| | | ataxin 3 | ||
| 14-40 | | 14-40 | ||
| 61-84 | | 61-84 | ||
| 小脳失調、[[パーキンソニズム]]、下肢の痙性 | | 小脳失調、[[パーキンソニズム]]、下肢の痙性 | ||
|- | |- | ||
| | | 脊髄小脳変性症6 | ||
| | | SCA6 | ||
| [http://omim.org/entry/183086 183086] | | [http://omim.org/entry/183086 183086] | ||
| 19p13.2 | | 19p13.2 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | CACNA1A | ||
| calcium channel, voltage-dependent, P/Q type, alpha 1A subunit | |||
| 4-19 | | 4-19 | ||
| 19-33 | | 19-33 | ||
| 小脳失調、構音障害、眼振 | | 小脳失調、構音障害、眼振 | ||
|- | |- | ||
| | | 脊髄小脳変性症7 | ||
| | | SCA7 | ||
| [http://omim.org/entry/164500 164500] | | [http://omim.org/entry/164500 164500] | ||
| 3p14.1 | | 3p14.1 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | ATXN7 | ||
| | | ataxin 7 | ||
| 4-35 | | 4-35 | ||
| 37-306 | | 37-306 | ||
| 小脳失調、[[視力障害]] | | 小脳失調、[[視力障害]] | ||
|- | |- | ||
| | | 脊髄小脳変性症17 | ||
| | | SCA17 | ||
| [http://omim.org/entry/607136 607136] | | [http://omim.org/entry/607136 607136] | ||
| 6q27 | | 6q27 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | TBP | ||
| | | TATA box binding protein | ||
| 25-42 | | 25-42 | ||
| 47-63 | | 47-63 | ||
| 小脳失調、[[てんかん]]、認知症、精神症状 | | 小脳失調、[[てんかん]]、認知症、精神症状 | ||
|- | |- | ||
| | | 歯状核赤核淡蒼球ルイ体変性症 | ||
| | | DRPLA | ||
| [http://omim.org/entry/125370 125370] | | [http://omim.org/entry/125370 125370] | ||
| 12p13.31 | | 12p13.31 | ||
| エクソン | | エクソン | ||
| (CAG)n | | (CAG)n | ||
| | | Antrophin | ||
| | | | ||
| 7-34 | | 7-34 | ||
| 49-88 | | 49-88 | ||
| 小脳失調、[[舞踏病アテトーゼ]]、認知症、[[ミオクローヌスてんかん]] | | 小脳失調、[[舞踏病アテトーゼ]]、認知症、[[ミオクローヌスてんかん]] | ||
|- | |- style="background-color: rgb(169, 169, 169);" | ||
| colspan="11" | Toxic Gain of Function(RNA)によるもの | |||
|- | |- | ||
| | | 筋緊張性ジストロフィー1型 | ||
| DM1 | |||
| [http://omim.org/entry/160900 160900] | | [http://omim.org/entry/160900 160900] | ||
| 19q13.32 | | 19q13.32 | ||
| 3'UTR | | 3'UTR | ||
| (CTG)n | | (CTG)n | ||
| | | DMPK | ||
| | | dystrophia myotonica-protein kinase | ||
| 5-37 | | 5-37 | ||
| >50 | | >50 | ||
| [[ミオトニア]]、筋力低下、心伝導障害、精神遅滞、[[ | | [[ミオトニア]]、筋力低下、心伝導障害、精神遅滞、[[wikipedia:ja:白内障|白内障]]、糖尿病、性巣萎縮 | ||
|- | |- | ||
| | | 脆弱X関連振戦/運動失調症候群 | ||
| FXTAS | | FXTAS | ||
| [http://omim.org/entry/300623 300623] | | [http://omim.org/entry/300623 300623] | ||
| Xq27.3 | | Xq27.3 | ||
| 5'UTR | | 5'UTR | ||
| (CGC)n | | (CGC)n | ||
| | | FMRP | ||
| | | | ||
| 6-50 | | 6-50 | ||
| 55-200 | | 55-200 | ||
| 小脳失調、[[振戦]]、パーキンソニズム | | 小脳失調、[[振戦]]、パーキンソニズム | ||
|- | |- style="background-color: rgb(169, 169, 169);" | ||
| colspan="11" | 発症機序が不明 | |||
|- | |- | ||
| | | (脊髄小脳変性症) | ||
| | | SCA8 | ||
| [http://omim.org/entry/608768 608768] | | [http://omim.org/entry/608768 608768] | ||
| 13q21 | | 13q21 | ||
| イントロン | | イントロン | ||
| (CTG)n | | (CTG)n | ||
| | | SCA8 RNA | ||
| | | | ||
| 15-50 | | 15-50 | ||
| 71-1300 | | 71-1300 | ||
| 小脳失調、構音障害、[[眼振]] | | 小脳失調、構音障害、[[眼振]] | ||
|- | |- | ||
| | | (常染色体優性遺伝性疾患) | ||
| | | SCA12 | ||
| [http://omim.org/entry/604326 604326] | | [http://omim.org/entry/604326 604326] | ||
| 5q32 | | 5q32 | ||
| 5'UTR | | 5'UTR | ||
| (CAG)n | | (CAG)n | ||
| | | PPP2R2B | ||
| | | protein phosphatase 2, regulatory subunit B, beta | ||
| 7-32 | | 7-32 | ||
| 51-78 | | 51-78 | ||
| 小脳失調、振戦、認知症 | | 小脳失調、振戦、認知症 | ||
|- | |- | ||
| | | | ||
| HDL2 | | HDL2 | ||
| [http://omim.org/entry/606438 606438] | | [http://omim.org/entry/606438 606438] | ||
| 16q24.2 | | 16q24.2 | ||
| | | | ||
| (CTG)n | | (CTG)n | ||
| | | HDL2-CAG | ||
| | | | ||
| 6-28 | | 6-28 | ||
| >41 | | >41 | ||
| | | HDと類似の症状 | ||
|} | |} | ||
トリプレット病 | '''表.トリプレット病の分類''' | ||
トリプレット病 における'''リピート長の伸長は、遺伝子産物(タンパク質・RNA)の機能喪失 (loss of function)または機能獲得(gain of function)の機構を介して、病態を発症させると考えられる。''' | |||
[[Image:トリプレット.jpg|thumb|right|500px|<b>図.トリプレット・リピートの種類と遺伝子内の位置</b>]] | |||
== 機能喪失の機構を介した疾患 == | == 機能喪失の機構を介した疾患 == | ||
| 240行目: | 246行目: | ||
=== 脆弱X症候群 === | === 脆弱X症候群 === | ||
Fragile | Fragile X症候群(FRAXA) | ||
Xq27.3に位置する''[[FMR1]]''遺伝子の5’UTRに存在するCGGリピートの異常伸長による疾患で遺伝性の知的機能障害 (IQ < 70)の原因として欧米では最も頻度が高い疾患として知られている。健常者ではリピート長が55以下であるが、特に母方からの伝播に際してリピートが不安定化し、次世代で伸長を認めることがある。患者はリピート長が200以上に伸長した変異アレルを有し、母親が55から200 CGGリピートの前変異 (permutation)を有することが多い。''FMR1''はRNA結合分子[[FMRP]]をコードしている。変異アレルでは伸長したCGGリピートと近傍の''FMR1''遺伝子[[プロモーター]]領域の[[CpGアイランド]]が過剰な[[ | Xq27.3に位置する''[[FMR1]]''遺伝子の5’UTRに存在するCGGリピートの異常伸長による疾患で遺伝性の知的機能障害 (IQ < 70)の原因として欧米では最も頻度が高い疾患として知られている。健常者ではリピート長が55以下であるが、特に母方からの伝播に際してリピートが不安定化し、次世代で伸長を認めることがある。患者はリピート長が200以上に伸長した変異アレルを有し、母親が55から200 CGGリピートの前変異 (permutation)を有することが多い。''FMR1''はRNA結合分子[[FMRP]]をコードしている。変異アレルでは伸長したCGGリピートと近傍の''FMR1''遺伝子[[プロモーター]]領域の[[CpGアイランド]]が過剰な[[wikipedia:ja:メチル化|メチル化]]修飾を受けるため''FMR1''遺伝子の発現が抑制され、その結果患者男児ではFMRPの発現が欠乏する。変異アレルを有する男児の大多数また女児の約25%は知的機能障害を有する。他の臨床症状として[[注意欠陥]]と[[多動性]]、[[自閉症]]様症状、長い顔、巨大睾丸などが特徴的である。神経病理学的には[[側頭葉]]・[[後頭葉]]の[[大脳皮質]][[神経細胞]]の[[スパイン]]の形態や数の異常が報告されている<ref><pubmed>11223852</pubmed></ref>.FMRPはグループ1[[代謝型グルタミン酸受容体]](mGluR)の下流で特定のmRNAの翻訳を抑制しており,FMRPの欠如によるこの翻訳抑制の解除が脆弱X症候群発症に関与するというmGluR説が提唱されている<ref><pubmed>15219735</pubmed></ref>。 | ||
=== Fragile XE症候群 === | === Fragile XE症候群 === | ||
FRAXE | |||
Xq28に位置する''[[FMR2]]''遺伝子の5’UTRに存在するCCGリピートの異常伸長による[[伴性劣性遺伝疾患]]で, 変異アレルではリピート長が200以上に伸長している。このCCGリピートの伸長はFMR1遺伝子のCGGリピートのそれと同じく、女性生殖細胞でおこるものと考えられている。変異アレルではFMR2遺伝子上流のCpGアイランドが過剰なメチル化修飾を受けるため''FMR2''遺伝子の転写が抑制される。患者は軽度の精神遅滞や学習障害を示す。FMR2タンパク質は核内に存在し、[[転写因子]]として機能すると考えられているが詳細は不明である。 | Xq28に位置する''[[FMR2]]''遺伝子の5’UTRに存在するCCGリピートの異常伸長による[[伴性劣性遺伝疾患]]で, 変異アレルではリピート長が200以上に伸長している。このCCGリピートの伸長はFMR1遺伝子のCGGリピートのそれと同じく、女性生殖細胞でおこるものと考えられている。変異アレルではFMR2遺伝子上流のCpGアイランドが過剰なメチル化修飾を受けるため''FMR2''遺伝子の転写が抑制される。患者は軽度の精神遅滞や学習障害を示す。FMR2タンパク質は核内に存在し、[[転写因子]]として機能すると考えられているが詳細は不明である。 | ||
=== フリードライヒ失調症 === | === フリードライヒ失調症 === | ||
FRDA | |||
欧米では最も頻度の高い遺伝性失調症で、''[[FRDA]]''遺伝子第1イントロンに存在するGAAリピートの伸長による[[ | 欧米では最も頻度の高い遺伝性失調症で、''[[FRDA]]''遺伝子第1イントロンに存在するGAAリピートの伸長による[[wikipedia:ja:常染色体劣性遺伝|常染色体劣性遺伝]]性疾患。典型例は幼少期(10才以下)に発症し、[[固有感覚]]の障害による[[運動失調]]、振戦、構音障害、眼振などを示す。[[wikipedia:ja:凹足|凹足]]・心筋症・糖尿病などの全身性の症候を伴う。患者の多くは30-40歳代で死にいたる。神経病理学的には、[[後索]]や[[脊髄小脳路]]・[[皮質脊髄路]]・[[後根]]などの萎縮が認められる。約90%の患者はGAAリピートが200から1700程度まで伸長した変異アレルのホモ接合であるが、一部の症例では一方のアレルにGAAリピートの異常伸長、他方のアレルに''FRDA''遺伝子[[点突然変異]]を有する。リピート長が長いほど発症年齢が低くなる傾向があり、糖尿病や心筋症は典型的にはリピート長が長いアレルを有する患者で認められる。 | ||
FRDAは[[ | FRDAは[[wikipedia:ja:ミトコンドリア|ミトコンドリア]]内膜に局在する[[フラタキシン]] (frataxin) をコードする。フラタキシンはミトコンドリア内の鉄代謝・鉄の貯蔵を制御しており、[[wikipedia:ja:アコニターゼ|アコニターゼ]]や[[wikipedia:ja:電子伝達系|電子伝達系]]の[[wikipedia:complex I|complex I]], [[wikipedia:complex II|II]], [[wikipedia:complex III|III]]などのFe-Sクラスターを有するミトコンドリア酵素の生合成に重要な役割を果たす<ref><pubmed>22200491</pubmed></ref>。GAAリピートの異常伸長は、FRDAの転写伸長を阻害し、フラタキシン mRNA及びタンパク質の発現量が減少する。患者組織ではミトコンドリア内に鉄が異常に蓄積しており、Fe-Sクラスターを有するミトコンドリア酵素の活性が低下<ref><pubmed>9326946</pubmed></ref>し、[[酸化ストレス]]への感受性が亢進していること<ref><pubmed>9949201</pubmed></ref>が報告された。しかし、フラタキシンホモログを欠損するモデル動物に対する治療法として[[wikipedia:ja:抗酸化物|抗酸化物]]の有効性は認めらなかったことから、酸化ストレスの病態への関与については疑問視されている<ref><pubmed>11223852</pubmed></ref>。 | ||
== 機能獲得の機構を介した疾患 (1) ポリグルタミン病 == | == 機能獲得の機構を介した疾患 (1) ポリグルタミン病 == | ||
トリプレット病のうち9つの疾患については、エクソン内に存在し、ポリグルタミン鎖をコードするCAGリピートが異常伸長することからポリグルタミン病とも呼ばれている。ポリグルタミン病の共通の特徴として、伸長ポリグルタミン鎖を有する変異タンパク質が患者神経細胞内で[[凝集体]]を形成することがしられている。ポリグルタミン鎖の異常伸長はそれぞれの遺伝子産物の折りたたみ構造(コンフォーメーション)に変化をきたし(ミスフォールディング)、異常な折りたたみ構造を呈するタンパク質が次第に凝集体として神経細胞内に蓄積すると考えられる。また、[[ミスフォールディング]] | トリプレット病のうち9つの疾患については、エクソン内に存在し、ポリグルタミン鎖をコードするCAGリピートが異常伸長することからポリグルタミン病とも呼ばれている。ポリグルタミン病の共通の特徴として、伸長ポリグルタミン鎖を有する変異タンパク質が患者神経細胞内で[[凝集体]]を形成することがしられている。ポリグルタミン鎖の異常伸長はそれぞれの遺伝子産物の折りたたみ構造(コンフォーメーション)に変化をきたし(ミスフォールディング)、異常な折りたたみ構造を呈するタンパク質が次第に凝集体として神経細胞内に蓄積すると考えられる。また、[[ミスフォールディング]]の結果、それら遺伝子産物が本来有する機能、特に他の分子とのタンパク質間相互作用を介した機能に変化をきたし、その結果さまざまな細胞内プロセスに変化をきたし、最終的に神経変性に導くと考えられている。 | ||
[[Image:ポリグルタミン病態仮説.png|thumb|right| | [[Image:ポリグルタミン病態仮説.png|thumb|right|400px|<b>図.ポリグルタミン病の病態仮説</b><br />伸長したポリグルタミン鎖はホストタンパク質のコンフォーメーションを変化させ、細胞内に次第に蓄積するとともに[[インタラクトーム]]に変化をきたす。これらの変化は細胞内のさまざまなプロセスに複雑な変化を及ぼし病態発症に導く。]] | ||
=== 球脊髄性筋萎縮症 === | === 球脊髄性筋萎縮症 === | ||
SBMA | |||
[[アンドロゲン]]レセプター遺伝子(''AR'')内のCAGリピートの異常伸長による[[ | [[アンドロゲン]]レセプター遺伝子(''AR'')内のCAGリピートの異常伸長による[[wikipedia:ja:X染色体劣性遺伝性|X染色体劣性遺伝性]]の疾患で、緩徐進行性の筋萎縮(特に近位筋)や[[線維束攣縮]]を主症状とする。中年期に発症することが多く、筋萎縮・脱力は顔面筋・舌筋・咽頭筋・遠位筋にも広がる。アンドロゲンに対する感受性の軽度低下による女性化乳房、睾丸萎縮、生殖能力の低下も見られる。病理学的には[[脊髄前角細胞]]、[[延髄]]の[[下位運動ニュ−ロン]]、[[後根神経節]]細胞の変性が特徴的で、変異アンドロゲンレセプターは神経細胞内で[[核内封入体]]を形成する。 | ||
=== ハンチントン病 === | === ハンチントン病 === | ||
HD | |||
ハンチンチンタンパク質N末端部に存在するポリグルタミン鎖をコードする''[[HTT]]''遺伝子内CAGリピートの異常伸長による疾患で、患者は主に中年期に発症し、舞踏病([[不随意運動]]の一種)に加えて、[[記銘力障害]]、[[人格変化]]、[[うつ]]などの症状を示し、平均10年から15年で死に至る。神経病理学的には[[尾状]]核と[[被殻]]の著明な萎縮が特徴的で、[[GABA]]作動性の投射細胞である[[中型有棘神経細胞]](medium spiny neuron)が最も変性に陥りやすい細胞とされる。2次的に[[線条体]]から投射を受ける[[淡蒼球]]も変性し、また大脳皮質の萎縮も認められるが、[[小脳]][[プルキンエ細胞]]は一般的には保たれる。 20歳以下で発症する若年型HDは全体の5-10%を占め、成人型で観察される症状とはやや臨床像が異なり、重篤な精神機能障害や小脳症状なども認められる。若年型の患者では通常,CAG反復数が60回超のHTTアレルが認められる. ハンチンチンタンパク質の生理機能については不明な点が多いが、タンパク質間相互作用を介する[[HEATリピート構造]]を多数有することから、多彩な生理機能に関与する[[足場(scaffold)タンパク質]]であると考えられている<ref><pubmed>14600292</pubmed></ref>。 | |||
=== | === SCA1 === | ||
[[ | '''脊髄小脳変性症 (SCAs)と歯状核赤核淡蒼球ルイ体変性症 (DRPLA)は小脳及びそれに関連する神経路の変性を主体とする変性疾患で、臨床的には中年期に発症することが多く小脳失調や構音障害などの症状が共通して認められる。''' SCA1は、[[アタキシン1]] (ATXN1)をコードする''SCA1''遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患。患者は小脳性運動失調・構音障害・嚥下障害・外眼筋麻痺・[[錐体路症状]]・認知機能障害などの症状を呈する。表現促進現象が認められる。ATXN1は広く中枢神経系の神経細胞で発現しているが神経病理学的にはプルキンエ細胞・小脳[[歯状核]]・[[赤核]]・[[橋核]]・[[下オリーブ核]]・[[クラーク柱]]・[[脊髄小脳路]]などを中心に選択的変性を認め、残存する神経細胞核内にはATXN1陽性の封入体形成が認められる。ATXN1の生理機能には不明な点が多いが、核移行シグナルを有し、またRNAと結合しうることが示されている。加えてATXN1と相互作用するまたさまざまな因子([[ATXN1L]],[[CIC]],[[RBM17]]など)が同定されており、ポリグルタミン鎖の伸長はそれら因子との相互作用を複雑に変化させ、病態発現に関与していると考えられる<ref><pubmed>18957430</pubmed></ref>。 | ||
=== SCA2 === | |||
[[アタキシン2]] (ATXN2)をコードする''SCA2''遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患で、患者はSCA1と類似の臨床像を示すが、発症早期より眼振を欠く緩徐眼球運動を認めるのが特徴的とされる。健常者ではリピート長が22または23である頻度が高く、患者では35以上に伸長している。神経病理学的には小脳皮質全層・橋核・下オリーブ核の強い変性が主体をなす。ATXN2は、細胞質内の[[wikipedia:ja:RNA|RNA]]の代謝に関与すると考えられている<ref><pubmed> 9462862</pubmed></ref>。最近、ATXN2が[[筋萎縮性側索硬化症]] (ALS)の責任遺伝子産物の1つ[[TDP-43]] (TAR DNA-binding protein)とRNA依存性に相互作用すること、またSCA2遺伝子CAGリピートの中程度の伸長(24以上34以下)が、ALSの危険因子となることが示された<ref><pubmed>20740007</pubmed></ref>。 | |||
=== SCA3 === | |||
アタキシン3 (ATXN3)をコードする''[[MJD1]]''遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患でMachado-Joseph 病とも呼ばれる。臨床症状は多彩で、小脳失調、錐体路徴候、ジストニア、パーキンソニズム、[[末梢神経]]障害などを中核症状として、加えて進行性外眼筋麻痺、[[びっくり眼]]、[[顔面ミオキミア]]などの症状を伴う。病理学的には[[ルイ体淡蒼球内節系]]、[[歯状核赤核系]]、[[黒質]]、橋核、[[脳幹運動神経核]]、脊髄、末梢神経の変性が主体をなす。アタキシン3タンパク質のN末端部にはジョセフィンドメインと呼ばれる[[ユビキチン分解酵素]]活性を示す領域があり、さらにその下流には[[ユビキチン]]と結合する2カ所のUIMと呼ばれるモチーフがあることから、[[ユビキチンプロテアソーム分解系]] (UPS) の調節因子として機能する分子と考えられている<ref><pubmed>14602712</pubmed></ref>。 | |||
=== | === SCA6 === | ||
[[ | SCA6変異アレルでは''CACNA1A''遺伝子の最終エクソンに存在するCAGリピートが軽度に伸長(正常: 4-19, 患者: 19-33)している。''CACNA1A''は[[P/Q 型電位依存性カルシウムチャネル]]のメインサブユニット[[Cav2.1]]をコードし、CAGリピートはチャネルC末端部細胞質内ドメインに存在するポリグルタミンに翻訳される。Cav2.1は[[シナプス終末]]からの[[神経伝達物質]]の放出に重要な役割を果たし、特にプルキンエ細胞に強く発現している。主に40才から50才代の中年に発症する患者が多い。患者は、[[失調性歩行]]、四肢の運動失調、構音障害、[[注視眼振]]などの小脳失調症を呈し、臨床的に小脳症状以外に目立った症状がなく、いわゆる純粋小脳型の特徴を示す。経過は緩徐進行性で生命予後は比較的良好である。神経病理学的には小脳プルキンエ細胞にほぼ限局した選択的な神経脱落を示す。Cav2.1陽性ユビキチン陰性の封入体が細胞質・[[樹状突起]]近位部を中心に認められるのが特徴的である。CAGリピートの伸長はCav2.1チャネルの基本的機能には影響しない<ref><pubmed>18687887</pubmed></ref>。 | ||
=== SCA7 === | |||
[[アタキシン7]] (ATXN7) をコードする''SCA7''遺伝子内のCAGリピートの異常伸長による[[常染色体優性]]遺伝性疾患で、[[網膜黄斑変性症]]を伴うのが特徴的である。視覚障害と小脳失調が主症状で、黄斑変性の他に[[視神経]]萎縮や[[網膜色素変性]]が認められることもある。ATXN7は[[GCN5]][[ヒストンアセチル化酵素複合体]]のサブユニットで転写コアクチベーター機能を有する。変異アタキシン7が含まれるGCN5複合体は[[網膜桿体細胞]]の[[ロドプシン]]遺伝子などのプロモーターに誘導されやすく、H3ヒストンの過剰なアセチル化を介して[[wikipedia:ja:クロマチン|クロマチン]]構造に変化をきたし、これら遺伝子の発現を抑制するのではないかとの説が提唱されている<ref><pubmed>16911843</pubmed></ref>。 | |||
=== SCA17 === | |||
[[ | [[wikipedia:ja:TATA結合タンパク質|TATA結合タンパク質]] (TBP) 遺伝子のCAGリピートの異常伸長による常染色体優性遺伝性疾患で、患者は小脳運動失調に加えて認知症やてんかんなどの症状を示す。神経病理学的にはプルキンエ細胞・線条体・大脳皮質で神経変性が目立つとされる。TBPは[[wikipedia:ja:基本転写因子|基本転写因子]]のひとつで、[[wikipedia:TFIID|TFIID]]複合体を形成し、ひろく様々な細胞で多くの遺伝子の転写の開始段階に関与することが知られている。TBP分子のポリグルタミン鎖の異常伸長は転写機能異常を介して病態の発症に導くと考えられている<ref><pubmed>17994014</pubmed></ref>。 | ||
=== | === DRPLA === | ||
本邦に多い常染色体優性遺伝性疾患。表現促進現象が認められ、中年期に発症する患者では運動失調・[[アテトーゼ]]様不随意運動・認知症を主症状とする脊髄小脳変性症、20才以下の若年発症型では[[ミオクローヌス]]・てんかん・精神遅滞を主症状とするミオクローヌスてんかんの臨床像を示す。若年発症型の大部分は父親からの遺伝である。神経病理学的には歯状核赤核系及び[[淡蒼球外節ルイ体系]]の変性を主体とする。変異アレルでは[[アトロフィン1]](atrophin 1)をコードするDRPLA遺伝子エクソン5に存在するCAGリピートが異常伸長している。アトロフィン1は標的遺伝子の転写を負に制御するコリプレッサーの1つ<ref><pubmed>11792320</pubmed></ref> で、ポリグルタミン鎖の伸長によりその機能が変化し、神経変性に導くものと考えられている。 | |||
本邦に多い常染色体優性遺伝性疾患。表現促進現象が認められ、中年期に発症する患者では運動失調・[[アテトーゼ]] | |||
== 機能獲得の機構を介した疾患 (2) RNA機能獲得による疾患 == | == 機能獲得の機構を介した疾患 (2) RNA機能獲得による疾患 == | ||
=== | === 筋緊張性ジストロフィー 1型 === | ||
DM1 | |||
[[ミオトニア]]([[筋強直症]]、myotonia)と進行性の筋萎縮・筋力低下を主徴とする常染色体優性遺伝性疾患で、白内障、[[ | [[ミオトニア]]([[筋強直症]]、myotonia)と進行性の筋萎縮・筋力低下を主徴とする常染色体優性遺伝性疾患で、白内障、[[wikipedia:ja:心伝導障害|心伝導障害]]、[[wikipedia:ja:インスリン|インスリン]]抵抗性糖尿病、[[睡眠障害]]、精巣萎縮、[[wikipedia:ja:高ガンマグロブリン血症|高ガンマグロブリン血症]]、認知症、若年禿頭などを伴う全身性の疾患である。変異アレルでは''[[DMPK]]''遺伝子の3’UTR領域に存在するCTGリピートが50から数1000の範囲で伸長している。表現促進現象が認められ、ほとんど無症状の母親患者が重症型の臨床症状を示す子供を出生することがある。先天型DM1は生下時の筋緊張低下と全身の著明な筋力低下が特徴で、しばしば呼吸不全を来たし早期に死亡する。 | ||
DM1の発症機構として、変異アレルから転写された伸長CUGリピートを有するRNAのtoxic gain of | DM1の発症機構として、変異アレルから転写された伸長CUGリピートを有するRNAのtoxic gain of functionの機構が考えられている。患者筋では転写された伸長CUGリピートを有するRNAの多くは細胞質内へは移行せず核内にfociを形成してとどまる。伸長CUGリピートは、少なくとも2種類の[[wikipedia:ja:選択的スプライシング|選択的スプライシング]]の制御に関与するRNA結合タンパク質([[MBLN]]と[[CUG-BP1]])のRNA結合能に影響を及ぼすことが知られている。MBLNとCUG-BP1いずれもCUGリピートに結合するが、DM1細胞においては、MBLNの機能が低下し、一方CUG-BP1の機能が亢進し、結果として特定の遺伝子の選択的スプライシングに変化をきたし、病態発症に導くというモデルが提唱されている<ref name="ref2"><pubmed>16776586</pubmed></ref>。実際DM1患者組織においては、特定の遺伝子 ([[CLCN-1]], [[IR]], [[SERCA2]], [[RYR1]], [[APP]], [[MAPT]]など)の選択的スプライシングに異常が認められている<ref name="ref2" />。例えば、患者筋組織では[[塩化物イオンチャネル]]の1つCLCN-1チャネルの胎児型アイソフォームの発現の残存が認められるが、このアイソフォームは分解を受けやすい不安定なチャネルに翻訳されるため、患者筋組織ではCLCN-1チャネルの発現が低下し、ミオトニアを発症させると考えられる。 | ||
=== 脆弱X関連振戦/運動失調症候群 === | === 脆弱X関連振戦/運動失調症候群 === | ||
Fragile X-Associated Tremor Ataxia | Fragile X-Associated Tremor Ataxia; FXTAS | ||
脆弱X症候群の類縁疾患で、'' | 脆弱X症候群の類縁疾患で、''FMR1''遺伝子のCGGリピートが55-200回程度のpremutationを持つ男性で発症し,成人期(通常50才以上)発症,小脳失調,企図振戦、認知機能障害、末梢神経障害、自律神経障害などの症状を呈する。病理学的には[[中小脳脚]]の空胞変性・プルキンエ細胞の脱落に加えて、脳内ニューロン・[[アストロサイト]]でユビキチン陽性核内封入体が認められる。アジア人では本性の発症頻度は稀であるとされるが、最近本邦でも患者の存在が報告されている。
同程度のpremutation expansionを有する保因者の女性のうち、約20%では早期[[wikipedia:ja:卵巣|卵巣]]機能不全症(premature ovarian failure)を来たしたり、FXTASの症状の一部を発症することが報告されている。premutation expansionを有する患者の脳ではFMR1 mRNAの発現が亢進しており、一方FMR1 CGGリピートを含むRNAを[[ショウジョウバエ]]複眼に過剰発現させると[[光受容体]]が変性し、核内封入体形成も認められること<ref><pubmed>12948442</pubmed></ref>からFXTASの発症にはRNA機能獲得の機構が関与しているものと考えられる。FXTAS患者神経細胞ではCGGリピートを含むRNAが核内封入体でfociを形成し、[[hnRNP-A2]], [[MBNL]], [[Sam68]]などの RNA結合タンパク質も取り込まれている<ref><pubmed>16246864</pubmed></ref>。これらのことから、FXTAS患者神経細胞でもDM1と同じく特定の遺伝子の選択的スプライシングのパターンが変化し、病態発症に導くのではないかとの考えが提唱されている。 | ||
== 発症機序が明確でない疾患 == | == 発症機序が明確でない疾患 == | ||
=== | === SCA8 === | ||
[[ | SCA8は13q21に位置するCTG/CAGリピートの異常伸長による脊髄小脳変性症の一型である。ただし、浸透率が低く変異アレルを有しながら発症しない例が多数存在する。このリピートは反対方向に2種類の遺伝子ATXN8OSとATXN8に転写され、それぞれnon-coding CUG リピートRNAとほぼ純粋なポリグルタミン鎖をコードするCAGリピートRNAが産生される。 ATXNOSの繰り返し部分の配列は(CTA)1-21(CTG)nの構造をとっており、患者の多くはその総数が110から250リピートの間にある。臨床的には、中年期に発症する例が多く、典型例では小脳症状以外に目立った症状がない純粋小脳型の特徴を示すとされ、頭部MRIでも萎縮はほぼ小脳に限局する。SCA8の発症機序として、伸長リピートを有するATXN8OS転写産物(CTG方向)が、反対側DNAから転写される''[[KLHL1]]''遺伝子の[[アンチセンスRNA]]としてその発現を抑制することが原因であるとする説<ref><pubmed>10888605</pubmed></ref>。DM1と同様に伸長リピートを有するATXN8OS転写産物がRNA 機能獲得の機構で毒性を発揮するという説 <ref><pubmed>15363905</pubmed></ref>、さらにRNA 機能獲得に加えてATXN8転写物(CAG方向)由来の伸長ポリグルタミンペプチドも機能獲得の機構で[[神経毒性]]に関与するという考え<ref><pubmed>16804541</pubmed></ref>がある。 | ||
=== SCA12 === | |||
''PPP2R2B''遺伝子の5’非翻訳領域に存在するCAGリピートの伸長による常染色体優性遺伝性疾患。''PPP2R2B''は脳特異的に発現し、[[PP2A フォスファターゼ]]をコードする。CAGリピートの伸長がどのようなメカニズムで病態発症につながるのかは不明である。 | |||
=== Huntington disease-like 2 === | |||
HDL2 | |||
ハンチントン病と同様の臨床的・病理学的特徴を有する成人発症の常染色体優性神経変性疾患で、変異アレルでは16q24.3に存在する''JPH3''遺伝子のエクソン2Aの存在するCTGリピートが異常伸長(40-59; 正常6-28)している。患者脳組織で抗ポリグルタミン抗体陽性の神経細胞核内封入体が認められ、また[[BACトランスジェニックマウス]]を用いた解析で、JPH3アンチセンス鎖からポリグルタミン鎖をコードするHDL2-CAGが転写されることが示された<ref><pubmed>21555070</pubmed></ref>ことから、ポリグルタミン病である可能性が高い。一方、JPH3ノックアウトマウスは運動障害を発症し、また患者脳において''JPH3'' がコードする[[junctophilin-3]]の発現が低下していることからloss of functionの機構も病態に関与している可能性がある<ref><pubmed>22367996</pubmed></ref>。 | |||
== 参考文献 == | |||
<references /> | |||
(執筆者:渡瀬啓、水澤英洋 担当編集委員:高橋良輔) | |||
2012年6月14日 (木) 11:26時点における版
英語名:trinucleotide repeat disorders, triplet repeat diseases
同義語:トリプレットリピート病
トリプレット病とはゲノム内の遺伝子に存在する3塩基の繰り返し配列(トリプレット・リピート)が異常に伸長することによっておこる一群の遺伝性神経疾患のことである。これらの疾患においては、リピート長が遺伝学的に不安定で、親から子孫への疾患遺伝子の伝播に伴ってリピート長が変動することが多い。少なくとも17種類の疾患が知られている。トリプレット病 におけるリピート長の伸長は、遺伝子産物(タンパク質・RNA)の機能喪失 (loss of function)または機能獲得(gain of function)の機構を介して、病態を発症させると考えられる。
トリプレット病とは
トリプレット病とはゲノム内の遺伝子に存在する3塩基の繰り返し配列(トリプレット・リピート)が異常に伸長することによっておこる一群の遺伝性神経疾患のことである。これらの疾患においては、リピート長が遺伝学的に不安定で、親から子孫への疾患遺伝子の伝播に伴ってリピート長が変動することが多い。世代を経る毎に発症年齢が若年化し、疾患の病態がより重篤になる表現促進現象 (anticipation)が認められることがあり、従って一般にそれぞれの疾患の表現型は同一家系内でも多様である。現在までに典型的なトリプレット病として、若年性発症の精神遅滞を主徴とする疾患から中年期以降に発症する神経変性疾患まで少なくとも17種類の疾患が知られている。
| 疾患 | 略号 | OMIM | 染色体 | 遺伝子内の局在 | リピート | 遺伝子 | 遺伝子産物 | 正常サイズ | 伸張サイズ | 主な臨床症状 |
| Loss of Funtionによるもの | ||||||||||
| 脆弱X症候群 | FRAXA | 300624 | Xq27.3 | 5'UTR | (CGC)n | FMR1 | fragile X mental retardation 1 | 6-50 | >200 | 精神遅滞、自閉症、巨大睾丸 |
| Fragile XE症候群 | FRAXE | 309548 | Xq28 | 5'UTR | (CCG)n | FMR2 | 4-39 | >200 | 精神遅滞 | |
| フリードライヒ失調症 | FRDA | 229300 | 9q21.11 | イントロン | (GAA)n | FXN | frataxin | 6-32 | 200-1700 | 感覚性失調、心筋症、糖尿病 |
| Toxic Gain of Function(伸長ポリグルタミン鎖)によるもの | ||||||||||
| ハンチントン病 | HD | 143100 | 4p16.3 | エクソン | (CAG)n | HTT | huntingtin | 6-34 | 36-121 | 舞踏病、ジストニア、認知症、精神症状 |
| 球脊髄性筋萎縮症 | SBMA | 313200 | Xq12 | エクソン | (CAG)n | AR | androgen receptor | 9-36 | 38-62 | 筋力低下、女性化乳房 |
| 脊髄小脳変性症1 | SCA1 | 164400 | 6p22.3 | エクソン | (CAG)n | ATXN1 | ataxin 1 | 19-38 | 39-82 | 小脳失調、構音障害、認知症 |
| 脊髄小脳変性症2 | SCA2 | 183090 | 12q24.12 | エクソン | (CAG)n | ATXN2 | ataxin 2 | 13-31 | 35-500 | 小脳失調、腱反射消失、緩徐眼球運動 |
| 脊髄小脳変性症3 | SCA3 | 109150 | 14q32.12 | エクソン | (CAG)n | ATXN3 | ataxin 3 | 14-40 | 61-84 | 小脳失調、パーキンソニズム、下肢の痙性 |
| 脊髄小脳変性症6 | SCA6 | 183086 | 19p13.2 | エクソン | (CAG)n | CACNA1A | calcium channel, voltage-dependent, P/Q type, alpha 1A subunit | 4-19 | 19-33 | 小脳失調、構音障害、眼振 |
| 脊髄小脳変性症7 | SCA7 | 164500 | 3p14.1 | エクソン | (CAG)n | ATXN7 | ataxin 7 | 4-35 | 37-306 | 小脳失調、視力障害 |
| 脊髄小脳変性症17 | SCA17 | 607136 | 6q27 | エクソン | (CAG)n | TBP | TATA box binding protein | 25-42 | 47-63 | 小脳失調、てんかん、認知症、精神症状 |
| 歯状核赤核淡蒼球ルイ体変性症 | DRPLA | 125370 | 12p13.31 | エクソン | (CAG)n | Antrophin | 7-34 | 49-88 | 小脳失調、舞踏病アテトーゼ、認知症、ミオクローヌスてんかん | |
| Toxic Gain of Function(RNA)によるもの | ||||||||||
| 筋緊張性ジストロフィー1型 | DM1 | 160900 | 19q13.32 | 3'UTR | (CTG)n | DMPK | dystrophia myotonica-protein kinase | 5-37 | >50 | ミオトニア、筋力低下、心伝導障害、精神遅滞、白内障、糖尿病、性巣萎縮 |
| 脆弱X関連振戦/運動失調症候群 | FXTAS | 300623 | Xq27.3 | 5'UTR | (CGC)n | FMRP | 6-50 | 55-200 | 小脳失調、振戦、パーキンソニズム | |
| 発症機序が不明 | ||||||||||
| (脊髄小脳変性症) | SCA8 | 608768 | 13q21 | イントロン | (CTG)n | SCA8 RNA | 15-50 | 71-1300 | 小脳失調、構音障害、眼振 | |
| (常染色体優性遺伝性疾患) | SCA12 | 604326 | 5q32 | 5'UTR | (CAG)n | PPP2R2B | protein phosphatase 2, regulatory subunit B, beta | 7-32 | 51-78 | 小脳失調、振戦、認知症 |
| HDL2 | 606438 | 16q24.2 | (CTG)n | HDL2-CAG | 6-28 | >41 | HDと類似の症状 | |||
表.トリプレット病の分類
トリプレット病 におけるリピート長の伸長は、遺伝子産物(タンパク質・RNA)の機能喪失 (loss of function)または機能獲得(gain of function)の機構を介して、病態を発症させると考えられる。

機能喪失の機構を介した疾患
脆弱X症候群
Fragile X症候群(FRAXA)
Xq27.3に位置するFMR1遺伝子の5’UTRに存在するCGGリピートの異常伸長による疾患で遺伝性の知的機能障害 (IQ < 70)の原因として欧米では最も頻度が高い疾患として知られている。健常者ではリピート長が55以下であるが、特に母方からの伝播に際してリピートが不安定化し、次世代で伸長を認めることがある。患者はリピート長が200以上に伸長した変異アレルを有し、母親が55から200 CGGリピートの前変異 (permutation)を有することが多い。FMR1はRNA結合分子FMRPをコードしている。変異アレルでは伸長したCGGリピートと近傍のFMR1遺伝子プロモーター領域のCpGアイランドが過剰なメチル化修飾を受けるためFMR1遺伝子の発現が抑制され、その結果患者男児ではFMRPの発現が欠乏する。変異アレルを有する男児の大多数また女児の約25%は知的機能障害を有する。他の臨床症状として注意欠陥と多動性、自閉症様症状、長い顔、巨大睾丸などが特徴的である。神経病理学的には側頭葉・後頭葉の大脳皮質神経細胞のスパインの形態や数の異常が報告されている[1].FMRPはグループ1代謝型グルタミン酸受容体(mGluR)の下流で特定のmRNAの翻訳を抑制しており,FMRPの欠如によるこの翻訳抑制の解除が脆弱X症候群発症に関与するというmGluR説が提唱されている[2]。
Fragile XE症候群
FRAXE
Xq28に位置するFMR2遺伝子の5’UTRに存在するCCGリピートの異常伸長による伴性劣性遺伝疾患で, 変異アレルではリピート長が200以上に伸長している。このCCGリピートの伸長はFMR1遺伝子のCGGリピートのそれと同じく、女性生殖細胞でおこるものと考えられている。変異アレルではFMR2遺伝子上流のCpGアイランドが過剰なメチル化修飾を受けるためFMR2遺伝子の転写が抑制される。患者は軽度の精神遅滞や学習障害を示す。FMR2タンパク質は核内に存在し、転写因子として機能すると考えられているが詳細は不明である。
フリードライヒ失調症
FRDA
欧米では最も頻度の高い遺伝性失調症で、FRDA遺伝子第1イントロンに存在するGAAリピートの伸長による常染色体劣性遺伝性疾患。典型例は幼少期(10才以下)に発症し、固有感覚の障害による運動失調、振戦、構音障害、眼振などを示す。凹足・心筋症・糖尿病などの全身性の症候を伴う。患者の多くは30-40歳代で死にいたる。神経病理学的には、後索や脊髄小脳路・皮質脊髄路・後根などの萎縮が認められる。約90%の患者はGAAリピートが200から1700程度まで伸長した変異アレルのホモ接合であるが、一部の症例では一方のアレルにGAAリピートの異常伸長、他方のアレルにFRDA遺伝子点突然変異を有する。リピート長が長いほど発症年齢が低くなる傾向があり、糖尿病や心筋症は典型的にはリピート長が長いアレルを有する患者で認められる。
FRDAはミトコンドリア内膜に局在するフラタキシン (frataxin) をコードする。フラタキシンはミトコンドリア内の鉄代謝・鉄の貯蔵を制御しており、アコニターゼや電子伝達系のcomplex I, II, IIIなどのFe-Sクラスターを有するミトコンドリア酵素の生合成に重要な役割を果たす[3]。GAAリピートの異常伸長は、FRDAの転写伸長を阻害し、フラタキシン mRNA及びタンパク質の発現量が減少する。患者組織ではミトコンドリア内に鉄が異常に蓄積しており、Fe-Sクラスターを有するミトコンドリア酵素の活性が低下[4]し、酸化ストレスへの感受性が亢進していること[5]が報告された。しかし、フラタキシンホモログを欠損するモデル動物に対する治療法として抗酸化物の有効性は認めらなかったことから、酸化ストレスの病態への関与については疑問視されている[6]。
機能獲得の機構を介した疾患 (1) ポリグルタミン病
トリプレット病のうち9つの疾患については、エクソン内に存在し、ポリグルタミン鎖をコードするCAGリピートが異常伸長することからポリグルタミン病とも呼ばれている。ポリグルタミン病の共通の特徴として、伸長ポリグルタミン鎖を有する変異タンパク質が患者神経細胞内で凝集体を形成することがしられている。ポリグルタミン鎖の異常伸長はそれぞれの遺伝子産物の折りたたみ構造(コンフォーメーション)に変化をきたし(ミスフォールディング)、異常な折りたたみ構造を呈するタンパク質が次第に凝集体として神経細胞内に蓄積すると考えられる。また、ミスフォールディングの結果、それら遺伝子産物が本来有する機能、特に他の分子とのタンパク質間相互作用を介した機能に変化をきたし、その結果さまざまな細胞内プロセスに変化をきたし、最終的に神経変性に導くと考えられている。
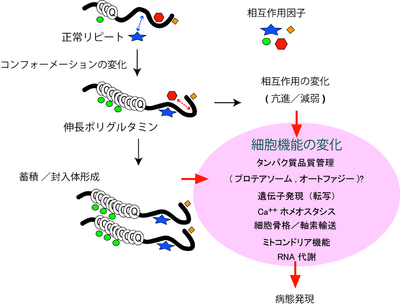
伸長したポリグルタミン鎖はホストタンパク質のコンフォーメーションを変化させ、細胞内に次第に蓄積するとともにインタラクトームに変化をきたす。これらの変化は細胞内のさまざまなプロセスに複雑な変化を及ぼし病態発症に導く。
球脊髄性筋萎縮症
SBMA
アンドロゲンレセプター遺伝子(AR)内のCAGリピートの異常伸長によるX染色体劣性遺伝性の疾患で、緩徐進行性の筋萎縮(特に近位筋)や線維束攣縮を主症状とする。中年期に発症することが多く、筋萎縮・脱力は顔面筋・舌筋・咽頭筋・遠位筋にも広がる。アンドロゲンに対する感受性の軽度低下による女性化乳房、睾丸萎縮、生殖能力の低下も見られる。病理学的には脊髄前角細胞、延髄の下位運動ニュ−ロン、後根神経節細胞の変性が特徴的で、変異アンドロゲンレセプターは神経細胞内で核内封入体を形成する。
ハンチントン病
HD
ハンチンチンタンパク質N末端部に存在するポリグルタミン鎖をコードするHTT遺伝子内CAGリピートの異常伸長による疾患で、患者は主に中年期に発症し、舞踏病(不随意運動の一種)に加えて、記銘力障害、人格変化、うつなどの症状を示し、平均10年から15年で死に至る。神経病理学的には尾状核と被殻の著明な萎縮が特徴的で、GABA作動性の投射細胞である中型有棘神経細胞(medium spiny neuron)が最も変性に陥りやすい細胞とされる。2次的に線条体から投射を受ける淡蒼球も変性し、また大脳皮質の萎縮も認められるが、小脳プルキンエ細胞は一般的には保たれる。 20歳以下で発症する若年型HDは全体の5-10%を占め、成人型で観察される症状とはやや臨床像が異なり、重篤な精神機能障害や小脳症状なども認められる。若年型の患者では通常,CAG反復数が60回超のHTTアレルが認められる. ハンチンチンタンパク質の生理機能については不明な点が多いが、タンパク質間相互作用を介するHEATリピート構造を多数有することから、多彩な生理機能に関与する足場(scaffold)タンパク質であると考えられている[7]。
SCA1
脊髄小脳変性症 (SCAs)と歯状核赤核淡蒼球ルイ体変性症 (DRPLA)は小脳及びそれに関連する神経路の変性を主体とする変性疾患で、臨床的には中年期に発症することが多く小脳失調や構音障害などの症状が共通して認められる。 SCA1は、アタキシン1 (ATXN1)をコードするSCA1遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患。患者は小脳性運動失調・構音障害・嚥下障害・外眼筋麻痺・錐体路症状・認知機能障害などの症状を呈する。表現促進現象が認められる。ATXN1は広く中枢神経系の神経細胞で発現しているが神経病理学的にはプルキンエ細胞・小脳歯状核・赤核・橋核・下オリーブ核・クラーク柱・脊髄小脳路などを中心に選択的変性を認め、残存する神経細胞核内にはATXN1陽性の封入体形成が認められる。ATXN1の生理機能には不明な点が多いが、核移行シグナルを有し、またRNAと結合しうることが示されている。加えてATXN1と相互作用するまたさまざまな因子(ATXN1L,CIC,RBM17など)が同定されており、ポリグルタミン鎖の伸長はそれら因子との相互作用を複雑に変化させ、病態発現に関与していると考えられる[8]。
SCA2
アタキシン2 (ATXN2)をコードするSCA2遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患で、患者はSCA1と類似の臨床像を示すが、発症早期より眼振を欠く緩徐眼球運動を認めるのが特徴的とされる。健常者ではリピート長が22または23である頻度が高く、患者では35以上に伸長している。神経病理学的には小脳皮質全層・橋核・下オリーブ核の強い変性が主体をなす。ATXN2は、細胞質内のRNAの代謝に関与すると考えられている[9]。最近、ATXN2が筋萎縮性側索硬化症 (ALS)の責任遺伝子産物の1つTDP-43 (TAR DNA-binding protein)とRNA依存性に相互作用すること、またSCA2遺伝子CAGリピートの中程度の伸長(24以上34以下)が、ALSの危険因子となることが示された[10]。
SCA3
アタキシン3 (ATXN3)をコードするMJD1遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患でMachado-Joseph 病とも呼ばれる。臨床症状は多彩で、小脳失調、錐体路徴候、ジストニア、パーキンソニズム、末梢神経障害などを中核症状として、加えて進行性外眼筋麻痺、びっくり眼、顔面ミオキミアなどの症状を伴う。病理学的にはルイ体淡蒼球内節系、歯状核赤核系、黒質、橋核、脳幹運動神経核、脊髄、末梢神経の変性が主体をなす。アタキシン3タンパク質のN末端部にはジョセフィンドメインと呼ばれるユビキチン分解酵素活性を示す領域があり、さらにその下流にはユビキチンと結合する2カ所のUIMと呼ばれるモチーフがあることから、ユビキチンプロテアソーム分解系 (UPS) の調節因子として機能する分子と考えられている[11]。
SCA6
SCA6変異アレルではCACNA1A遺伝子の最終エクソンに存在するCAGリピートが軽度に伸長(正常: 4-19, 患者: 19-33)している。CACNA1AはP/Q 型電位依存性カルシウムチャネルのメインサブユニットCav2.1をコードし、CAGリピートはチャネルC末端部細胞質内ドメインに存在するポリグルタミンに翻訳される。Cav2.1はシナプス終末からの神経伝達物質の放出に重要な役割を果たし、特にプルキンエ細胞に強く発現している。主に40才から50才代の中年に発症する患者が多い。患者は、失調性歩行、四肢の運動失調、構音障害、注視眼振などの小脳失調症を呈し、臨床的に小脳症状以外に目立った症状がなく、いわゆる純粋小脳型の特徴を示す。経過は緩徐進行性で生命予後は比較的良好である。神経病理学的には小脳プルキンエ細胞にほぼ限局した選択的な神経脱落を示す。Cav2.1陽性ユビキチン陰性の封入体が細胞質・樹状突起近位部を中心に認められるのが特徴的である。CAGリピートの伸長はCav2.1チャネルの基本的機能には影響しない[12]。
SCA7
アタキシン7 (ATXN7) をコードするSCA7遺伝子内のCAGリピートの異常伸長による常染色体優性遺伝性疾患で、網膜黄斑変性症を伴うのが特徴的である。視覚障害と小脳失調が主症状で、黄斑変性の他に視神経萎縮や網膜色素変性が認められることもある。ATXN7はGCN5ヒストンアセチル化酵素複合体のサブユニットで転写コアクチベーター機能を有する。変異アタキシン7が含まれるGCN5複合体は網膜桿体細胞のロドプシン遺伝子などのプロモーターに誘導されやすく、H3ヒストンの過剰なアセチル化を介してクロマチン構造に変化をきたし、これら遺伝子の発現を抑制するのではないかとの説が提唱されている[13]。
SCA17
TATA結合タンパク質 (TBP) 遺伝子のCAGリピートの異常伸長による常染色体優性遺伝性疾患で、患者は小脳運動失調に加えて認知症やてんかんなどの症状を示す。神経病理学的にはプルキンエ細胞・線条体・大脳皮質で神経変性が目立つとされる。TBPは基本転写因子のひとつで、TFIID複合体を形成し、ひろく様々な細胞で多くの遺伝子の転写の開始段階に関与することが知られている。TBP分子のポリグルタミン鎖の異常伸長は転写機能異常を介して病態の発症に導くと考えられている[14]。
DRPLA
本邦に多い常染色体優性遺伝性疾患。表現促進現象が認められ、中年期に発症する患者では運動失調・アテトーゼ様不随意運動・認知症を主症状とする脊髄小脳変性症、20才以下の若年発症型ではミオクローヌス・てんかん・精神遅滞を主症状とするミオクローヌスてんかんの臨床像を示す。若年発症型の大部分は父親からの遺伝である。神経病理学的には歯状核赤核系及び淡蒼球外節ルイ体系の変性を主体とする。変異アレルではアトロフィン1(atrophin 1)をコードするDRPLA遺伝子エクソン5に存在するCAGリピートが異常伸長している。アトロフィン1は標的遺伝子の転写を負に制御するコリプレッサーの1つ[15] で、ポリグルタミン鎖の伸長によりその機能が変化し、神経変性に導くものと考えられている。
機能獲得の機構を介した疾患 (2) RNA機能獲得による疾患
筋緊張性ジストロフィー 1型
DM1
ミオトニア(筋強直症、myotonia)と進行性の筋萎縮・筋力低下を主徴とする常染色体優性遺伝性疾患で、白内障、心伝導障害、インスリン抵抗性糖尿病、睡眠障害、精巣萎縮、高ガンマグロブリン血症、認知症、若年禿頭などを伴う全身性の疾患である。変異アレルではDMPK遺伝子の3’UTR領域に存在するCTGリピートが50から数1000の範囲で伸長している。表現促進現象が認められ、ほとんど無症状の母親患者が重症型の臨床症状を示す子供を出生することがある。先天型DM1は生下時の筋緊張低下と全身の著明な筋力低下が特徴で、しばしば呼吸不全を来たし早期に死亡する。
DM1の発症機構として、変異アレルから転写された伸長CUGリピートを有するRNAのtoxic gain of functionの機構が考えられている。患者筋では転写された伸長CUGリピートを有するRNAの多くは細胞質内へは移行せず核内にfociを形成してとどまる。伸長CUGリピートは、少なくとも2種類の選択的スプライシングの制御に関与するRNA結合タンパク質(MBLNとCUG-BP1)のRNA結合能に影響を及ぼすことが知られている。MBLNとCUG-BP1いずれもCUGリピートに結合するが、DM1細胞においては、MBLNの機能が低下し、一方CUG-BP1の機能が亢進し、結果として特定の遺伝子の選択的スプライシングに変化をきたし、病態発症に導くというモデルが提唱されている[16]。実際DM1患者組織においては、特定の遺伝子 (CLCN-1, IR, SERCA2, RYR1, APP, MAPTなど)の選択的スプライシングに異常が認められている[16]。例えば、患者筋組織では塩化物イオンチャネルの1つCLCN-1チャネルの胎児型アイソフォームの発現の残存が認められるが、このアイソフォームは分解を受けやすい不安定なチャネルに翻訳されるため、患者筋組織ではCLCN-1チャネルの発現が低下し、ミオトニアを発症させると考えられる。
脆弱X関連振戦/運動失調症候群
Fragile X-Associated Tremor Ataxia; FXTAS
脆弱X症候群の類縁疾患で、FMR1遺伝子のCGGリピートが55-200回程度のpremutationを持つ男性で発症し,成人期(通常50才以上)発症,小脳失調,企図振戦、認知機能障害、末梢神経障害、自律神経障害などの症状を呈する。病理学的には中小脳脚の空胞変性・プルキンエ細胞の脱落に加えて、脳内ニューロン・アストロサイトでユビキチン陽性核内封入体が認められる。アジア人では本性の発症頻度は稀であるとされるが、最近本邦でも患者の存在が報告されている。 同程度のpremutation expansionを有する保因者の女性のうち、約20%では早期卵巣機能不全症(premature ovarian failure)を来たしたり、FXTASの症状の一部を発症することが報告されている。premutation expansionを有する患者の脳ではFMR1 mRNAの発現が亢進しており、一方FMR1 CGGリピートを含むRNAをショウジョウバエ複眼に過剰発現させると光受容体が変性し、核内封入体形成も認められること[17]からFXTASの発症にはRNA機能獲得の機構が関与しているものと考えられる。FXTAS患者神経細胞ではCGGリピートを含むRNAが核内封入体でfociを形成し、hnRNP-A2, MBNL, Sam68などの RNA結合タンパク質も取り込まれている[18]。これらのことから、FXTAS患者神経細胞でもDM1と同じく特定の遺伝子の選択的スプライシングのパターンが変化し、病態発症に導くのではないかとの考えが提唱されている。
発症機序が明確でない疾患
SCA8
SCA8は13q21に位置するCTG/CAGリピートの異常伸長による脊髄小脳変性症の一型である。ただし、浸透率が低く変異アレルを有しながら発症しない例が多数存在する。このリピートは反対方向に2種類の遺伝子ATXN8OSとATXN8に転写され、それぞれnon-coding CUG リピートRNAとほぼ純粋なポリグルタミン鎖をコードするCAGリピートRNAが産生される。 ATXNOSの繰り返し部分の配列は(CTA)1-21(CTG)nの構造をとっており、患者の多くはその総数が110から250リピートの間にある。臨床的には、中年期に発症する例が多く、典型例では小脳症状以外に目立った症状がない純粋小脳型の特徴を示すとされ、頭部MRIでも萎縮はほぼ小脳に限局する。SCA8の発症機序として、伸長リピートを有するATXN8OS転写産物(CTG方向)が、反対側DNAから転写されるKLHL1遺伝子のアンチセンスRNAとしてその発現を抑制することが原因であるとする説[19]。DM1と同様に伸長リピートを有するATXN8OS転写産物がRNA 機能獲得の機構で毒性を発揮するという説 [20]、さらにRNA 機能獲得に加えてATXN8転写物(CAG方向)由来の伸長ポリグルタミンペプチドも機能獲得の機構で神経毒性に関与するという考え[21]がある。
SCA12
PPP2R2B遺伝子の5’非翻訳領域に存在するCAGリピートの伸長による常染色体優性遺伝性疾患。PPP2R2Bは脳特異的に発現し、PP2A フォスファターゼをコードする。CAGリピートの伸長がどのようなメカニズムで病態発症につながるのかは不明である。
Huntington disease-like 2
HDL2
ハンチントン病と同様の臨床的・病理学的特徴を有する成人発症の常染色体優性神経変性疾患で、変異アレルでは16q24.3に存在するJPH3遺伝子のエクソン2Aの存在するCTGリピートが異常伸長(40-59; 正常6-28)している。患者脳組織で抗ポリグルタミン抗体陽性の神経細胞核内封入体が認められ、またBACトランスジェニックマウスを用いた解析で、JPH3アンチセンス鎖からポリグルタミン鎖をコードするHDL2-CAGが転写されることが示された[22]ことから、ポリグルタミン病である可能性が高い。一方、JPH3ノックアウトマウスは運動障害を発症し、また患者脳においてJPH3 がコードするjunctophilin-3の発現が低下していることからloss of functionの機構も病態に関与している可能性がある[23]。
参考文献
- ↑
Irwin, S.A., Patel, B., Idupulapati, M., Harris, J.B., Crisostomo, R.A., Larsen, B.P., ..., & Greenough, W.T. (2001).
Abnormal dendritic spine characteristics in the temporal and visual cortices of patients with fragile-X syndrome: a quantitative examination. American journal of medical genetics, 98(2), 161-7. [PubMed:11223852] [WorldCat] [DOI] - ↑
Bear, M.F., Huber, K.M., & Warren, S.T. (2004).
The mGluR theory of fragile X mental retardation. Trends in neurosciences, 27(7), 370-7. [PubMed:15219735] [WorldCat] [DOI] - ↑
Bulteau, A.L., Planamente, S., Jornea, L., Dur, A., Lesuisse, E., Camadro, J.M., & Auchère, F. (2012).
Changes in mitochondrial glutathione levels and protein thiol oxidation in ∆yfh1 yeast cells and the lymphoblasts of patients with Friedreich's ataxia. Biochimica et biophysica acta, 1822(2), 212-25. [PubMed:22200491] [WorldCat] [DOI] - ↑
Rötig, A., de Lonlay, P., Chretien, D., Foury, F., Koenig, M., Sidi, D., ..., & Rustin, P. (1997).
Aconitase and mitochondrial iron-sulphur protein deficiency in Friedreich ataxia. Nature genetics, 17(2), 215-7. [PubMed:9326946] [WorldCat] [DOI] - ↑
Wong, A., Yang, J., Cavadini, P., Gellera, C., Lonnerdal, B., Taroni, F., & Cortopassi, G. (1999).
The Friedreich's ataxia mutation confers cellular sensitivity to oxidant stress which is rescued by chelators of iron and calcium and inhibitors of apoptosis. Human molecular genetics, 8(3), 425-30. [PubMed:9949201] [WorldCat] [DOI] - ↑
Irwin, S.A., Patel, B., Idupulapati, M., Harris, J.B., Crisostomo, R.A., Larsen, B.P., ..., & Greenough, W.T. (2001).
Abnormal dendritic spine characteristics in the temporal and visual cortices of patients with fragile-X syndrome: a quantitative examination. American journal of medical genetics, 98(2), 161-7. [PubMed:11223852] [WorldCat] [DOI] - ↑
MacDonald, M.E. (2003).
Huntingtin: alive and well and working in middle management. Science's STKE : signal transduction knowledge environment, 2003(207), pe48. [PubMed:14600292] [WorldCat] [DOI] - ↑
Zoghbi, H.Y., & Orr, H.T. (2009).
Pathogenic mechanisms of a polyglutamine-mediated neurodegenerative disease, spinocerebellar ataxia type 1. The Journal of biological chemistry, 284(12), 7425-9. [PubMed:18957430] [PMC] [WorldCat] [DOI] - ↑
Neuwald, A.F., & Koonin, E.V. (1998).
Ataxin-2, global regulators of bacterial gene expression, and spliceosomal snRNP proteins share a conserved domain. Journal of molecular medicine (Berlin, Germany), 76(1), 3-5. [PubMed:9462862] [WorldCat] - ↑
Elden, A.C., Kim, H.J., Hart, M.P., Chen-Plotkin, A.S., Johnson, B.S., Fang, X., ..., & Gitler, A.D. (2010).
Ataxin-2 intermediate-length polyglutamine expansions are associated with increased risk for ALS. Nature, 466(7310), 1069-75. [PubMed:20740007] [PMC] [WorldCat] [DOI] - ↑
Chai, Y., Berke, S.S., Cohen, R.E., & Paulson, H.L. (2004).
Poly-ubiquitin binding by the polyglutamine disease protein ataxin-3 links its normal function to protein surveillance pathways. The Journal of biological chemistry, 279(5), 3605-11. [PubMed:14602712] [WorldCat] [DOI] - ↑
Watase, K., Barrett, C.F., Miyazaki, T., Ishiguro, T., Ishikawa, K., Hu, Y., ..., & Zoghbi, H.Y. (2008).
Spinocerebellar ataxia type 6 knockin mice develop a progressive neuronal dysfunction with age-dependent accumulation of mutant CaV2.1 channels. Proceedings of the National Academy of Sciences of the United States of America, 105(33), 11987-92. [PubMed:18687887] [PMC] [WorldCat] [DOI] - ↑
Helmlinger, D., Tora, L., & Devys, D. (2006).
Transcriptional alterations and chromatin remodeling in polyglutamine diseases. Trends in genetics : TIG, 22(10), 562-70. [PubMed:16911843] [WorldCat] [DOI] - ↑
Friedman, M.J., Shah, A.G., Fang, Z.H., Ward, E.G., Warren, S.T., Li, S., & Li, X.J. (2007).
Polyglutamine domain modulates the TBP-TFIIB interaction: implications for its normal function and neurodegeneration. Nature neuroscience, 10(12), 1519-28. [PubMed:17994014] [WorldCat] [DOI] - ↑
Zhang, S., Xu, L., Lee, J., & Xu, T. (2002).
Drosophila atrophin homolog functions as a transcriptional corepressor in multiple developmental processes. Cell, 108(1), 45-56. [PubMed:11792320] [WorldCat] [DOI] - ↑ 16.0 16.1
Ranum, L.P., & Cooper, T.A. (2006).
RNA-mediated neuromuscular disorders. Annual review of neuroscience, 29, 259-77. [PubMed:16776586] [WorldCat] [DOI] - ↑
Jin, P., Zarnescu, D.C., Zhang, F., Pearson, C.E., Lucchesi, J.C., Moses, K., & Warren, S.T. (2003).
RNA-mediated neurodegeneration caused by the fragile X premutation rCGG repeats in Drosophila. Neuron, 39(5), 739-47. [PubMed:12948442] [WorldCat] [DOI] - ↑
Iwahashi, C.K., Yasui, D.H., An, H.J., Greco, C.M., Tassone, F., Nannen, K., ..., & Hagerman, P.J. (2006).
Protein composition of the intranuclear inclusions of FXTAS. Brain : a journal of neurology, 129(Pt 1), 256-71. [PubMed:16246864] [WorldCat] [DOI] - ↑
Nemes, J.P., Benzow, K.A., Moseley, M.L., Ranum, L.P., & Koob, M.D. (2000).
The SCA8 transcript is an antisense RNA to a brain-specific transcript encoding a novel actin-binding protein (KLHL1). Human molecular genetics, 9(10), 1543-51. [PubMed:10888605] [WorldCat] [DOI] - ↑
Ranum, L.P., & Day, J.W. (2004).
Pathogenic RNA repeats: an expanding role in genetic disease. Trends in genetics : TIG, 20(10), 506-12. [PubMed:15363905] [WorldCat] [DOI] - ↑
Moseley, M.L., Zu, T., Ikeda, Y., Gao, W., Mosemiller, A.K., Daughters, R.S., ..., & Ranum, L.P. (2006).
Bidirectional expression of CUG and CAG expansion transcripts and intranuclear polyglutamine inclusions in spinocerebellar ataxia type 8. Nature genetics, 38(7), 758-69. [PubMed:16804541] [WorldCat] [DOI] - ↑
Wilburn, B., Rudnicki, D.D., Zhao, J., Weitz, T.M., Cheng, Y., Gu, X., ..., & Yang, X.W. (2011).
An antisense CAG repeat transcript at JPH3 locus mediates expanded polyglutamine protein toxicity in Huntington's disease-like 2 mice. Neuron, 70(3), 427-40. [PubMed:21555070] [PMC] [WorldCat] [DOI] - ↑
Seixas, A.I., Holmes, S.E., Takeshima, H., Pavlovich, A., Sachs, N., Pruitt, J.L., ..., & Rudnicki, D.D. (2012).
Loss of junctophilin-3 contributes to Huntington disease-like 2 pathogenesis. Annals of neurology, 71(2), 245-57. [PubMed:22367996] [WorldCat] [DOI]
(執筆者:渡瀬啓、水澤英洋 担当編集委員:高橋良輔)