「覚醒剤」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の17版が非表示) | |||
| 1行目: | 1行目: | ||
覚せい剤は、本邦の覚せい剤取締法(後述)では[[メタンフェタミン]]([[フェニルメチルアミノプロパン]])と[[アンフェタミン]]([[フェニルアミノプロパン]])をはじめとして、これらと同様の作用を持ち制令で指定されたもの、またはそれを含有する物と定義されている。本稿ではメタンフェタミンおよびアンフェタミンについて概説する。 メタンフェタミンは、我が国で[[エフェドリン]]から合成されたものであり、エフェドリンは咳止め効果のある[[wikipedia:ja:生薬|生薬]]の麻黄([[wikipedia:ja:マオウ|マオウ]]、[[wikipedia:ja:エフェドラ|エフェドラ]])の成分である。ここからエフェドリンが抽出され、他の化学物質と反応させ密造される。性状は白色、無臭の結晶で水に溶けやすい。 1941年に[[wikipedia:ja:ヒロポン|ヒロポン]]などの販売名で発売され、第二次世界大戦時には軍需工場の労働者が徹夜作業を行う際にヒロポンを服用した。戦後、大量の覚せい剤が民間に放出され、乱用された。本邦は第二次世界大戦後の第一次覚せい剤乱用期(1945~1958)ののち、第二次覚せい剤乱用期(1970~1995)、第三次覚せい剤乱用期(1995~現在)を経験している。 | |||
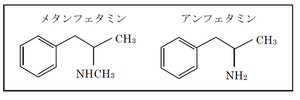
== 化学構造 == | |||
メタンフェタミンとアンフェタミンは化学構造上、ベンゼン環にエチルアミン鎖が結合するという共通点を有している(図1)。アンフェタミンの窒素原子上にメチル基が置換したメタンフェタミンはより脂溶性が高く[[血液脳関門]]を通過しやすいため、強い中枢興奮作用を持つ。 | |||
[[Image:Fig1meth.png|thumb|300px|'''図1.覚せい剤の化学構造''']] | |||
| | |||
== 作用 == | |||
== 作用 | |||
覚せい剤の作用として以下のものが挙げられる<ref>'''小沼杏坪'''<br>「VI章 薬物依存の基礎と臨床 覚せい剤依存の臨床」脳とこころのプライマリケア(8)依存<br>''株式会社シナジー(東京)'':2011</ref>。 <br> | |||
#中枢神経の興奮作用: 気分爽快、自信増加、積極性増加、精力増進、疲労感減少、多弁、[[不眠]]、[[常同行動]] | #中枢神経の興奮作用: 気分爽快、自信増加、積極性増加、精力増進、疲労感減少、多弁、[[不眠]]、[[常同行動]] | ||
#[[交感神経]]の刺激作用: [[wikipedia:ja:瞳孔|瞳孔]]散大、立毛感、[[wikipedia:ja:心悸亢進|心悸亢進]]、[[wikipedia:ja:末梢血管|末梢血管]]の収縮、四肢の冷感、[[wikipedia:ja:血圧|血圧]]上昇、狡猾、[[wikipedia:ja:腱反射|腱反射]]の亢進 | #[[交感神経]]の刺激作用: [[wikipedia:ja:瞳孔|瞳孔]]散大、立毛感、[[wikipedia:ja:心悸亢進|心悸亢進]]、[[wikipedia:ja:末梢血管|末梢血管]]の収縮、四肢の冷感、[[wikipedia:ja:血圧|血圧]]上昇、狡猾、[[wikipedia:ja:腱反射|腱反射]]の亢進 | ||
#[[wikipedia:ja:食欲|食欲]]減退作用 | #[[wikipedia:ja:食欲|食欲]]減退作用 | ||
#強い渇望感を伴う依存の形成 | #強い渇望感を伴う依存の形成 | ||
#[[錯乱]]、[[幻覚]]、[[妄想]]などを伴う中毒性精神病の発現 | #[[錯乱]]、[[幻覚]]、[[妄想]]などを伴う中毒性精神病の発現 | ||
第二次覚せい剤乱用期の1983年に行われた覚せい剤中毒対策に関する専門家会議では、覚せい剤に関連した疾患として、①覚せい剤急性中毒、②覚せい剤依存症、③覚せい剤精神病をあげている。 | |||
①覚せい剤急性中毒<br>覚せい剤の使用後1時間以内に出現する中枢神経系の異常興奮による精神神経症状、交感神経刺激作用などによる身体的中毒症状、さらに薬効の消退に伴って出現し数日間持続する反跳現象などから構成される。意識障害と激しい精神運動性興奮を主とする急性症候群の発現を見ることもある。<br> ②覚せい剤依存症<br>覚せい剤依存徴候および関連した精神身体症状を有するが、明確な幻覚妄想を伴わない状態。<br> ③覚せい剤精神病<br>覚せい剤依存徴候を有するかまたは有していたものに生じた幻覚妄想状態を主とする精神病状態である。 <br> 休薬後には以下の経過類型を示す。<br> a. 早期消退型:休薬後1カ月以内に症状が消退するもの <br>b. 遷延・持続型:休薬後も1カ月以上にわたって病状が持続するもの。<br>なかには6ヶ月以上の長期にわたって症状の小康と増悪を繰り返すものなどある。 | |||
== 標的分作用メカニズム == | |||
[[ドーパミン]]、[[ノルエピネフリン]]、[[セロトニン]]の[[トランスポーター]]および[[シナプス小胞モノアミントランスポーター]](VMAT)2は覚せい剤の標的分子であり、特に[[ドーパミントランスポーター]](DAT)は重要な役割を担っていると考えられている (図2)。主な作用機序は、[[腹側被蓋野]]から[[大脳皮質]]と[[辺縁系]]に投射するドーパミン作動性神経の[[シナプス前終末]]からのドーパミン放出を促進しながらDATや[[ノルエピネフリントランスポーター]]の再取り込みを阻害することで、特に[[側坐核]]内のA10神経付近に細胞質内のドーパミンをシナプス間隙に放出させ、当該部位のドーパミン受容体に大量のドーパミンが曝露することで覚醒作用や快の気分を生じさせることである。 覚せい剤は、DATに作用して交換拡散によってドーパミンを細胞外に放出させることで細胞外ドーパミン濃度を増加させ、また、VMAT2に作用して小胞内のドーパミンを細胞質へ放出させる<ref><pubmed>8494354</pubmed></ref><ref><pubmed>15955613</pubmed></ref><ref><pubmed>11099463</pubmed></ref>。 | |||
マウスやラットなどにメタンフェタミンを急性投与すると低用量(0.25~1.0mg/kg)では移所運動量(例:ケージの中を走り回る)が増加する。さらに高用量(>2.5mg/kg)では移所運動量の増加に引き続き、常同行動(例:一か所で舐める・嗅ぐなどの行動を強迫的に繰り返す)が出現する。このようなメタンフェタミンの行動効果のうち、移所運動量は[[中脳辺縁系]]ドーパミンニューロン(A10、腹側被蓋野から側坐核や[[扁桃体]]に投射)、常同行動は[[黒質]][[線条体]]ドーパミンニューロン(A9、[[黒質緻密層]]から線条体に投射)が関与している<ref>'''秋山一文'''<br>「VI章 薬物依存の基礎と臨床 覚せい剤依存の基礎」脳とこころのプライマリケア(8)依存<br>''株式会社シナジー(東京)'':2011</ref>。 | |||
DATヘテロ欠損マウスおよびVMAT2ヘテロ欠損マウスでは、メタンフェタミン急性投与後の運動増加が野生型マウスより少ないが、DATおよびVMAT2両方の発現が低下したマウスではメタンフェタミン急性投与による運動量増加はDATヘテロ欠損マウスとほぼ等しかったことから、メタンフェタミン投与による急性運動量増加効果にはVMAT2よりもDATの発現変化が大きな影響力を持っている可能性が報告されている<ref name=ref2><pubmed>17377774</pubmed></ref>。 ラットにメタンフェタミンを反復投与すると常同行動の発現潜時が短縮し、急性単回投与で起こる量よりも少ない量で常同行動が起こるようになることが知られており、この過敏反応性は行動感作(逆耐性現象)と呼ばれている。DATヘテロ欠損マウスでは、逆耐性現象の発展が抑制され形成も遅延した。VMAT2ヘテロ欠損マウスにおいても逆耐性現象の形成が遅延したが、発展は野生型と同様であった。DATおよびVMAT2両方の発現が低下したマウスでは、メタンフェタミン反復投与に対して運動量、逆耐性現象の発展・形成はDATヘテロ欠損マウスと差がなく、メタンフェタミン逆耐性現象の形成にはVMAT2の発現低下よりもDATの発現低下がより大きな影響を与えることが示唆されている<ref name=ref2/>。 | |||
[[Image:Fig2meth.png|thumb|300px|'''図2.覚せい剤がDATに与える影響''']] | |||
== 覚せい剤依存の脳神経画像研究 == | |||
覚せい剤の使用は長期にわたり脳内ドーパミン神経終末に障害を及ぼすことが脳神経画像研究から明らかになっている。たとえば、覚せい剤乱用者では、大脳基底核における[[ドーパミンD2受容体]]が減少しており、ドーパミンD2受容体と[[眼窩前頭皮質]]における局所糖代謝率が関連して<ref><pubmed>11729018</pubmed></ref>、[[薬物依存症]]患者の線条体におけるドーパミンD2・[[D3受容体]]利用率が健常者より低下しており、この低下が患者の衝動性と負の相関関係にあることが報告されている<ref><pubmed>19940168 </pubmed></ref>。また、覚せい剤は[[セロトニン神経系]]にも作用する。[[ポジトロン断層法]]を用いた研究により、覚せい剤使用経験者の脳内[[セロトニントランスポーター]](5-hydroxytryptamine transporter: 5-HTT)の密度が健常者よりも低下していること、その低下が彼らの攻撃性の強さと相関していることが報告されている<ref><pubmed>16389202</pubmed></ref>。また断薬後も数年の間は脳内活性型[[ミクログリア]]の密度が健常者よりも上昇しており、このことが神経障害の継続に関連している可能性も示されている<ref><pubmed>18509037</pubmed></ref>。 | |||
== 認知機能への影響 == | |||
[[ | [[wikipedia:ja:ラット|ラット]]におけるメタンフェタミンの自己投与実験により、メタンフェタミンを自己投与できる時間が長いと、その後メタンフェタミンの摂取を中止しても新しい物体の[[認知]]が低下していることが示されている<ref><pubmed>18493748</pubmed></ref>。また、[[海馬]][[歯状回]]では[[下顆粒層細胞]]で[[神経細胞の新生]]が起こることが知られているが、メタンフェタミンを自己投与したラットの海馬歯状回では神経細胞の新生が損なわれており<ref><pubmed>18490002</pubmed></ref>、このような認知機能への影響の背景となっている可能性がある。 ヒトを対象とした研究においてもメタンフェタミン依存者における認知機能の障害が認められている。たとえば、メタンフェタミン依存群と統制群に対してメタンフェタミン関連刺激とニュートラル刺激を用いた[[ゴー・ノーゴー課題]]を実施した実験<ref><pubmed>22257306</pubmed></ref>では、メタンフェタミン関連刺激が提示されていない時にもメタンフェタミン依存群は統制群よりも[[反応時間]]の遅延し、反応抑制エラー率および反応エラー率が高かった。メタンフェタミン関連刺激の提示中、メタンフェタミン依存群のみにおいて反応エラー率と反応抑制エラー率の両方が顕著に上昇しており、その時の彼らの反応エラー率は渇望感スコアと相関が見られた。 | ||
== | == 法律 == | ||
[[wikipedia:ja:覚せい剤取締法|覚せい剤取締法]](昭和26年6月30日法律第252号)は覚せい剤の乱用による保健衛生上の危害を防止するため、覚せい剤及び覚せい剤原料の輸入、輸出、所持、製造、譲渡、譲受及び使用に関して必要な取締を行うことを目的としている(第一条)。 この法律では覚せい剤の定義を①フェニルアミノプロパン、フェニルメチルアミノプロパン及び各その塩類、②①に揚げる物と同種の覚せい作用を有する物であって制令で指定するもの、③②に揚げる物のいずれかを含有する物、としている。 | |||
== | == 統計データ == | ||
[[wikipedia:ja: | [[wikipedia:ja:警察白書|警察白書]]の統計資料によると、平成22年の覚せい剤事犯の検挙件数は16900件(人員は11993名)であった。検挙件数のうち、使用で検挙される件数は密輸出入、所持、譲渡などと比べるとはるかに多く、全体の62.9%を占めている。警察庁の「平成22年中の薬物・銃器情勢」によると、覚せい剤事犯の検挙人員は、薬物事犯全体の検挙人員14529名のうち82.5%を占めている。検挙人員のうち、暴力団構成員等が52.7%を占めているほか、他の薬物事犯と比較して再犯者の構成比率が高いこと(59.3%)や30歳代以上の検挙人員が多いこと等が特徴として挙げられる。年齢別検挙人員の構成比率では、40歳代以上は増加傾向の一方で、20歳代以下の未成年は年々減少している(平成22年は1.9%)。押収量は305.5kgであった。末端密売価格については、前年に引き続き値下がり傾向で推移しており、平均で1gあたり8万円程度と認められる。 | ||
== | == 参考文献 == | ||
<references /> | |||
(執筆者:菅谷渚、池田和隆 担当編集委員:加藤忠史) | |||
2012年7月9日 (月) 13:33時点における版
覚せい剤は、本邦の覚せい剤取締法(後述)ではメタンフェタミン(フェニルメチルアミノプロパン)とアンフェタミン(フェニルアミノプロパン)をはじめとして、これらと同様の作用を持ち制令で指定されたもの、またはそれを含有する物と定義されている。本稿ではメタンフェタミンおよびアンフェタミンについて概説する。 メタンフェタミンは、我が国でエフェドリンから合成されたものであり、エフェドリンは咳止め効果のある生薬の麻黄(マオウ、エフェドラ)の成分である。ここからエフェドリンが抽出され、他の化学物質と反応させ密造される。性状は白色、無臭の結晶で水に溶けやすい。 1941年にヒロポンなどの販売名で発売され、第二次世界大戦時には軍需工場の労働者が徹夜作業を行う際にヒロポンを服用した。戦後、大量の覚せい剤が民間に放出され、乱用された。本邦は第二次世界大戦後の第一次覚せい剤乱用期(1945~1958)ののち、第二次覚せい剤乱用期(1970~1995)、第三次覚せい剤乱用期(1995~現在)を経験している。
化学構造
メタンフェタミンとアンフェタミンは化学構造上、ベンゼン環にエチルアミン鎖が結合するという共通点を有している(図1)。アンフェタミンの窒素原子上にメチル基が置換したメタンフェタミンはより脂溶性が高く血液脳関門を通過しやすいため、強い中枢興奮作用を持つ。
作用
覚せい剤の作用として以下のものが挙げられる[1]。
- 中枢神経の興奮作用: 気分爽快、自信増加、積極性増加、精力増進、疲労感減少、多弁、不眠、常同行動
- 交感神経の刺激作用: 瞳孔散大、立毛感、心悸亢進、末梢血管の収縮、四肢の冷感、血圧上昇、狡猾、腱反射の亢進
- 食欲減退作用
- 強い渇望感を伴う依存の形成
- 錯乱、幻覚、妄想などを伴う中毒性精神病の発現
第二次覚せい剤乱用期の1983年に行われた覚せい剤中毒対策に関する専門家会議では、覚せい剤に関連した疾患として、①覚せい剤急性中毒、②覚せい剤依存症、③覚せい剤精神病をあげている。
①覚せい剤急性中毒
覚せい剤の使用後1時間以内に出現する中枢神経系の異常興奮による精神神経症状、交感神経刺激作用などによる身体的中毒症状、さらに薬効の消退に伴って出現し数日間持続する反跳現象などから構成される。意識障害と激しい精神運動性興奮を主とする急性症候群の発現を見ることもある。
②覚せい剤依存症
覚せい剤依存徴候および関連した精神身体症状を有するが、明確な幻覚妄想を伴わない状態。
③覚せい剤精神病
覚せい剤依存徴候を有するかまたは有していたものに生じた幻覚妄想状態を主とする精神病状態である。
休薬後には以下の経過類型を示す。
a. 早期消退型:休薬後1カ月以内に症状が消退するもの
b. 遷延・持続型:休薬後も1カ月以上にわたって病状が持続するもの。
なかには6ヶ月以上の長期にわたって症状の小康と増悪を繰り返すものなどある。
標的分作用メカニズム
ドーパミン、ノルエピネフリン、セロトニンのトランスポーターおよびシナプス小胞モノアミントランスポーター(VMAT)2は覚せい剤の標的分子であり、特にドーパミントランスポーター(DAT)は重要な役割を担っていると考えられている (図2)。主な作用機序は、腹側被蓋野から大脳皮質と辺縁系に投射するドーパミン作動性神経のシナプス前終末からのドーパミン放出を促進しながらDATやノルエピネフリントランスポーターの再取り込みを阻害することで、特に側坐核内のA10神経付近に細胞質内のドーパミンをシナプス間隙に放出させ、当該部位のドーパミン受容体に大量のドーパミンが曝露することで覚醒作用や快の気分を生じさせることである。 覚せい剤は、DATに作用して交換拡散によってドーパミンを細胞外に放出させることで細胞外ドーパミン濃度を増加させ、また、VMAT2に作用して小胞内のドーパミンを細胞質へ放出させる[2][3][4]。
マウスやラットなどにメタンフェタミンを急性投与すると低用量(0.25~1.0mg/kg)では移所運動量(例:ケージの中を走り回る)が増加する。さらに高用量(>2.5mg/kg)では移所運動量の増加に引き続き、常同行動(例:一か所で舐める・嗅ぐなどの行動を強迫的に繰り返す)が出現する。このようなメタンフェタミンの行動効果のうち、移所運動量は中脳辺縁系ドーパミンニューロン(A10、腹側被蓋野から側坐核や扁桃体に投射)、常同行動は黒質線条体ドーパミンニューロン(A9、黒質緻密層から線条体に投射)が関与している[5]。
DATヘテロ欠損マウスおよびVMAT2ヘテロ欠損マウスでは、メタンフェタミン急性投与後の運動増加が野生型マウスより少ないが、DATおよびVMAT2両方の発現が低下したマウスではメタンフェタミン急性投与による運動量増加はDATヘテロ欠損マウスとほぼ等しかったことから、メタンフェタミン投与による急性運動量増加効果にはVMAT2よりもDATの発現変化が大きな影響力を持っている可能性が報告されている[6]。 ラットにメタンフェタミンを反復投与すると常同行動の発現潜時が短縮し、急性単回投与で起こる量よりも少ない量で常同行動が起こるようになることが知られており、この過敏反応性は行動感作(逆耐性現象)と呼ばれている。DATヘテロ欠損マウスでは、逆耐性現象の発展が抑制され形成も遅延した。VMAT2ヘテロ欠損マウスにおいても逆耐性現象の形成が遅延したが、発展は野生型と同様であった。DATおよびVMAT2両方の発現が低下したマウスでは、メタンフェタミン反復投与に対して運動量、逆耐性現象の発展・形成はDATヘテロ欠損マウスと差がなく、メタンフェタミン逆耐性現象の形成にはVMAT2の発現低下よりもDATの発現低下がより大きな影響を与えることが示唆されている[6]。

覚せい剤依存の脳神経画像研究
覚せい剤の使用は長期にわたり脳内ドーパミン神経終末に障害を及ぼすことが脳神経画像研究から明らかになっている。たとえば、覚せい剤乱用者では、大脳基底核におけるドーパミンD2受容体が減少しており、ドーパミンD2受容体と眼窩前頭皮質における局所糖代謝率が関連して[7]、薬物依存症患者の線条体におけるドーパミンD2・D3受容体利用率が健常者より低下しており、この低下が患者の衝動性と負の相関関係にあることが報告されている[8]。また、覚せい剤はセロトニン神経系にも作用する。ポジトロン断層法を用いた研究により、覚せい剤使用経験者の脳内セロトニントランスポーター(5-hydroxytryptamine transporter: 5-HTT)の密度が健常者よりも低下していること、その低下が彼らの攻撃性の強さと相関していることが報告されている[9]。また断薬後も数年の間は脳内活性型ミクログリアの密度が健常者よりも上昇しており、このことが神経障害の継続に関連している可能性も示されている[10]。
認知機能への影響
ラットにおけるメタンフェタミンの自己投与実験により、メタンフェタミンを自己投与できる時間が長いと、その後メタンフェタミンの摂取を中止しても新しい物体の認知が低下していることが示されている[11]。また、海馬歯状回では下顆粒層細胞で神経細胞の新生が起こることが知られているが、メタンフェタミンを自己投与したラットの海馬歯状回では神経細胞の新生が損なわれており[12]、このような認知機能への影響の背景となっている可能性がある。 ヒトを対象とした研究においてもメタンフェタミン依存者における認知機能の障害が認められている。たとえば、メタンフェタミン依存群と統制群に対してメタンフェタミン関連刺激とニュートラル刺激を用いたゴー・ノーゴー課題を実施した実験[13]では、メタンフェタミン関連刺激が提示されていない時にもメタンフェタミン依存群は統制群よりも反応時間の遅延し、反応抑制エラー率および反応エラー率が高かった。メタンフェタミン関連刺激の提示中、メタンフェタミン依存群のみにおいて反応エラー率と反応抑制エラー率の両方が顕著に上昇しており、その時の彼らの反応エラー率は渇望感スコアと相関が見られた。
法律
覚せい剤取締法(昭和26年6月30日法律第252号)は覚せい剤の乱用による保健衛生上の危害を防止するため、覚せい剤及び覚せい剤原料の輸入、輸出、所持、製造、譲渡、譲受及び使用に関して必要な取締を行うことを目的としている(第一条)。 この法律では覚せい剤の定義を①フェニルアミノプロパン、フェニルメチルアミノプロパン及び各その塩類、②①に揚げる物と同種の覚せい作用を有する物であって制令で指定するもの、③②に揚げる物のいずれかを含有する物、としている。
統計データ
警察白書の統計資料によると、平成22年の覚せい剤事犯の検挙件数は16900件(人員は11993名)であった。検挙件数のうち、使用で検挙される件数は密輸出入、所持、譲渡などと比べるとはるかに多く、全体の62.9%を占めている。警察庁の「平成22年中の薬物・銃器情勢」によると、覚せい剤事犯の検挙人員は、薬物事犯全体の検挙人員14529名のうち82.5%を占めている。検挙人員のうち、暴力団構成員等が52.7%を占めているほか、他の薬物事犯と比較して再犯者の構成比率が高いこと(59.3%)や30歳代以上の検挙人員が多いこと等が特徴として挙げられる。年齢別検挙人員の構成比率では、40歳代以上は増加傾向の一方で、20歳代以下の未成年は年々減少している(平成22年は1.9%)。押収量は305.5kgであった。末端密売価格については、前年に引き続き値下がり傾向で推移しており、平均で1gあたり8万円程度と認められる。
参考文献
- ↑ 小沼杏坪
「VI章 薬物依存の基礎と臨床 覚せい剤依存の臨床」脳とこころのプライマリケア(8)依存
株式会社シナジー(東京):2011 - ↑
Seiden, L.S., Sabol, K.E., & Ricaurte, G.A. (1993).
Amphetamine: effects on catecholamine systems and behavior. Annual review of pharmacology and toxicology, 33, 639-77. [PubMed:8494354] [WorldCat] [DOI] - ↑
Sulzer, D., Sonders, M.S., Poulsen, N.W., & Galli, A. (2005).
Mechanisms of neurotransmitter release by amphetamines: a review. Progress in neurobiology, 75(6), 406-33. [PubMed:15955613] [WorldCat] [DOI] - ↑
Uhl, G.R., Li, S., Takahashi, N., Itokawa, K., Lin, Z., Hazama, M., & Sora, I. (2000).
The VMAT2 gene in mice and humans: amphetamine responses, locomotion, cardiac arrhythmias, aging, and vulnerability to dopaminergic toxins. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(15), 2459-65. [PubMed:11099463] [WorldCat] [DOI] - ↑ 秋山一文
「VI章 薬物依存の基礎と臨床 覚せい剤依存の基礎」脳とこころのプライマリケア(8)依存
株式会社シナジー(東京):2011 - ↑ 6.0 6.1
Fukushima, S., Shen, H., Hata, H., Ohara, A., Ohmi, K., Ikeda, K., ..., & Sora, I. (2007).
Methamphetamine-induced locomotor activity and sensitization in dopamine transporter and vesicular monoamine transporter 2 double mutant mice. Psychopharmacology, 193(1), 55-62. [PubMed:17377774] [WorldCat] [DOI] - ↑
Volkow, N.D., Chang, L., Wang, G.J., Fowler, J.S., Ding, Y.S., Sedler, M., ..., & Pappas, N. (2001).
Low level of brain dopamine D2 receptors in methamphetamine abusers: association with metabolism in the orbitofrontal cortex. The American journal of psychiatry, 158(12), 2015-21. [PubMed:11729018] [WorldCat] [DOI] - ↑
Lee, B., London, E.D., Poldrack, R.A., Farahi, J., Nacca, A., Monterosso, J.R., ..., & Mandelkern, M.A. (2009).
Striatal dopamine d2/d3 receptor availability is reduced in methamphetamine dependence and is linked to impulsivity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(47), 14734-40. [PubMed:19940168] [PMC] [WorldCat] [DOI] - ↑
Sekine, Y., Ouchi, Y., Takei, N., Yoshikawa, E., Nakamura, K., Futatsubashi, M., ..., & Mori, N. (2006).
Brain serotonin transporter density and aggression in abstinent methamphetamine abusers. Archives of general psychiatry, 63(1), 90-100. [PubMed:16389202] [WorldCat] [DOI] - ↑
Sekine, Y., Ouchi, Y., Sugihara, G., Takei, N., Yoshikawa, E., Nakamura, K., ..., & Cadet, J.L. (2008).
Methamphetamine causes microglial activation in the brains of human abusers. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(22), 5756-61. [PubMed:18509037] [PMC] [WorldCat] [DOI] - ↑
Rogers, J.L., De Santis, S., & See, R.E. (2008).
Extended methamphetamine self-administration enhances reinstatement of drug seeking and impairs novel object recognition in rats. Psychopharmacology, 199(4), 615-24. [PubMed:18493748] [PMC] [WorldCat] [DOI] - ↑
Mandyam, C.D., Wee, S., Crawford, E.F., Eisch, A.J., Richardson, H.N., & Koob, G.F. (2008).
Varied access to intravenous methamphetamine self-administration differentially alters adult hippocampal neurogenesis. Biological psychiatry, 64(11), 958-65. [PubMed:18490002] [PMC] [WorldCat] [DOI] - ↑
Tolliver, B.K., Price, K.L., Baker, N.L., LaRowe, S.D., Simpson, A.N., McRae-Clark, A.L., ..., & Brady, K.T. (2012).
Impaired cognitive performance in subjects with methamphetamine dependence during exposure to neutral versus methamphetamine-related cues. The American journal of drug and alcohol abuse, 38(3), 251-9. [PubMed:22257306] [WorldCat] [DOI]
(執筆者:菅谷渚、池田和隆 担当編集委員:加藤忠史)