「FM1-43」の版間の差分
細編集の要約なし |
|||
| (5人の利用者による、間の50版が非表示) | |||
| 1行目: | 1行目: | ||
{{Chembox | {{Chembox | ||
| ImageFile = FM1-43.png | | ImageFile = FM1-43.png | ||
| ImageSize = 220px | | ImageSize = 220px | ||
| ImageAlt = | | ImageAlt = | ||
| IUPACName = 3-[4-[2-[4-(dibutylamino)phenyl]ethenyl]pyridin-1-ium-1-yl]propyl-triethylazanium dibromide | | IUPACName = 3-[4-[2-[4-(dibutylamino)phenyl]ethenyl]pyridin-1-ium-1-yl]propyl-triethylazanium dibromide | ||
| OtherNames = Frie Mao 1-43, SynaptoGreen™ Reagent, SureCN1527120, N-(3-Triethylammoniumpropyl)-4-(p-dibutylaminostyryl)pyridinium, 2Br | | OtherNames = Frie Mao 1-43, SynaptoGreen™ Reagent, SureCN1527120, N-(3-Triethylammoniumpropyl)-4-(p-dibutylaminostyryl)pyridinium, 2Br | ||
| Section1 = {{Chembox Identifiers | | Section1 = {{Chembox Identifiers | ||
| CASNo = 149838-22-2 | | CASNo = 149838-22-2 | ||
| PubChem = 2733618 | | PubChem = 2733618 | ||
| SMILES =CCCCN(CCCC)C1=CC=C(C=C1)C=CC2=CC=[N+](C=C2)CCC[N+](CC)(CC)CC.[Br-].[Br-] }} | | SMILES =CCCCN(CCCC)C1=CC=C(C=C1)C=CC2=CC=[N+](C=C2)CCC[N+](CC)(CC)CC.[Br-].[Br-] }} | ||
| Section2 = {{Chembox Properties | | Section2 = {{Chembox Properties | ||
| Formula = C30H49Br2N3 | | Formula = C30H49Br2N3 | ||
| MolarMass = 611.53816 | | MolarMass = 611.53816 | ||
| Appearance = | | Appearance = | ||
| Density = | | Density = | ||
| MeltingPt = | | MeltingPt = | ||
| BoilingPt = | | BoilingPt = | ||
| Solubility = }} | | Solubility = }} | ||
| Section3 = {{Chembox Hazards | | Section3 = {{Chembox Hazards | ||
| MainHazards = | | MainHazards = | ||
| FlashPt = | | FlashPt = | ||
| Autoignition = }} | | Autoignition = }} | ||
}} | }} | ||
FM色素は[[wikipedia:ja:脂質二重層|脂質二重膜]]を可逆的に染める蛍光色素で、[[シナプス前終末]]の機能や[[wikipedia:ja:分泌|分泌]]現象の計測に活用されている。 | |||
== FM1-43とは == | == FM1-43とは == | ||
[[Image:Takahashinoriko fig 1.jpg|thumb|300px|'''図1''']] | |||
Fei Mao(FM)は[[細胞膜]]を染めるスチリル色素を合成した。FM1-43はその代表格である。[[シナプス前終末]]の機能解析や、分泌小胞の動態解析に広く用いられる。 | |||
色素の特性として次の3つの性質がある。 | |||
#水溶液中に存在する場合に比べ、細胞膜に結合すると量子効率が著増し、強い蛍光を出す。 | |||
色素の特性として次の3つの性質がある。 | #[[wikipedia:ja:脂質二重層|脂質二重膜]]を透過しない。 | ||
# | |||
#[[wikipedia:ja:脂質二重層|脂質二重膜]]を透過しない。 | |||
#[[wikipedia:ja:両親媒性分子|両親媒性]]で可逆的に膜を染める。 | #[[wikipedia:ja:両親媒性分子|両親媒性]]で可逆的に膜を染める。 | ||
== 分子構造 | == 分子構造 == | ||
[[Image:Takahashinoriko fig 2.jpg|thumb| | [[Image:Takahashinoriko fig 2.jpg|thumb|300px|'''図2''']] | ||
構造は、[[wikipedia:ja:親水性|親水性]]領域、[[wikipedia:ja:二重結合|二重結合]]領域、[[wikipedia:ja:疎水性|疎水性]]炭素鎖領域に分けられる。 | |||
親水性領域が正の電荷をもつため、膜を通過しない。二重結合の数は蛍光波長に関連する。 | |||
二重結合が一つの FM1-43・FM1-84・FM2-10 は黄色蛍光を呈し、二重結合が二つの FM4-64・FM5-95 は赤色蛍光を呈する。 | |||
疎水性炭素鎖の長さは細胞膜の染め方に関連し、長いものほど明るく、一旦膜に組み込まれると離脱しがたい<ref><pubmed> 10202529 </pubmed></ref>。 FM1-43 の炭素鎖数は 4であり、解離時定数 τdiss は 8 msを示す。より短い FM2-10(炭素鎖数 2)は、比較的離脱しやすい(τdiss =6.4 ms)。逆に、より長い FM1-84(炭素鎖数 5)は離脱に時間がかかる(τdiss =36 ms)<ref><pubmed> 19580748 </pubmed></ref>。 | |||
== 蛍光特性 == | == 蛍光特性 == | ||
FM1- | FM1-43 の、[[wikipedia:ja:励起状態|励起]]には 1光子では波長 480 nm光、2光子では波長 840 nm 光が頻用される。 | ||
極大蛍光波長はリポソーム中にて 580 nm である。 | |||
波長480nm光の高出力励起(~150 μW)にてジアミノベンゼン(DAB)の光変換(photoconversion) を起こす。そのため、[[wikipedia:ja:アルデヒド|アルデヒド]]で固定可能な色素:FM1-43FX と DAB を細胞に与え、光変換させると、共局在部位で電子密度の高い産物が作られ、[[wikipedia:ja:電子顕微鏡観察|電子顕微鏡観察]]が可能となる。FM1-43 を取り込んだ小胞が、高い電子密度で描出され、微細構造解析に活用されている。 | |||
== 応用例 == | == 応用例 == | ||
=== シナプス前機能の解析 === | |||
==== シナプス前終末における小胞プールの大きさと開口放出確率の測定 ==== | |||
[[Image:Takahashinoriko fig 3.jpg|thumb|300px|'''図3''']] | |||
細胞外を FM1-43 で還流中に、短い放出刺激を与え(例 20 Hz、30 発)、開口放出([[エクソサイトーシス]])した小胞の膜を染める。 | |||
[[シナプス小胞]]は 30-60秒で細胞内部に[[エンドサイトーシス]]で取り込まれる(図 3左)。その後、細胞外を、色素を含まない溶液で還流し、細胞外膜に結合した色素を wash out する。このような loading 過程を経て示される蛍光量は、30回の刺激時に開口放出した小胞にあたり Readily releasable pool (RRP)のサイズの指標となる。カエル [[神経筋接合部]]の場合、RRP の小胞数は神経終末内小胞の約 15%(12-17%)と報告された<ref><pubmed> 15044806 </pubmed></ref>。 | |||
次に、細胞外色素フリーの状態で放出刺激を与えると、前段階で染められたシナプス小胞は細胞膜と融合し、細胞外液への拡散により神経終末の蛍光は減弱する(destaining 図 3右)。この減弱の程度や時間経過から、開口放出の量と速度が評価できる。蛍光減弱の時間経過は single exponential に近似されることから、放出確率 (Release probability, Pr) は蛍光減弱の時定数に反比例すると考えられる。Prの計算法として、(Recycling pool の小胞数×0.63)/ (37%に蛍光減弱するまでに与えた電気パルス数)で示す方法<ref><pubmed> 18701072 </pubmed></ref> が提起された。より簡易的には、FM1-43 の蛍光半減期の逆数<ref><pubmed> 11426227 </pubmed></ref>で示されるケースもある。 | |||
=== | ==== シナプス小胞の動態の解析 ==== | ||
開口放出した顆粒は active zone の周辺から内部に取り込まれ(エンドサイトーシス)、再び放出可能となる(recycle)。このリサイクルにかかる時間は、[[海馬]]培養標本では 20-30秒、[[神経筋接合部]]では 60秒と見積もられた。そこで Recycling pool(= RRP + Reserve pool)の測定は、RRP 測定時よりも長い時間電気刺激を与え、色素をロードする事により達成できる(例 10Hz 900 発)。リサイクルされた小胞は、元来小胞があった領域のほぼ全域に拡散し、core(中央部)への拡散のみが軽度に少なかった。また、リサイクルした小胞は、初めて刺激を受けたプール同様の放出確率を持つことが報告された<ref><pubmed> 1553547 </pubmed></ref> 。 | |||
FM2- | === 膜融合様式の解析 === | ||
FM 色素には、炭素鎖数の異なる複数種類の色素がある。これらが小胞膜を染める頻度を比較することにより、融合細孔の開放時間の長短が識別可能となる。 | |||
FM2-10 や FM1-43 色素を用い、小胞膜から離脱する完全融合型(full fusion)と、離脱しない不完全融合型(incomplete fusion)の識別が行われた<ref><pubmed> 9707119 </pubmed></ref> <ref><pubmed> 12354398 </pubmed></ref>。 | |||
=== 開口放出現象の可視化 === | === 開口放出現象の可視化 === | ||
FM1- | FM1-43 を網膜双極性細胞のシナプス小胞に取り込ませて標識し、[[全反射顕微鏡]]で細胞膜直下(~100nm)の観察を行い、単一小胞の開口放出現象の可視化が報告された<ref><pubmed> 10972279 </pubmed></ref> 。 | ||
また、下垂体前葉細胞 (lactotrophs) や膵島細胞においても、ホルモンを含む大型[[有芯小胞]]の[[膜融合]]に伴い、開口放出部位においてFM1-43 蛍光強度の上昇が報告された <ref><pubmed> 10953007 </pubmed></ref><ref><pubmed>12193788 </pubmed></ref>。 | |||
=== 分泌小胞の直径測定 === | === 分泌小胞の直径測定 === | ||
| 94行目: | 88行目: | ||
シナプス小胞から大型有芯小胞に至るまで、小胞の直径計測に有効である <ref><pubmed> 16150799 </pubmed></ref>。 | シナプス小胞から大型有芯小胞に至るまで、小胞の直径計測に有効である <ref><pubmed> 16150799 </pubmed></ref>。 | ||
水溶性色素(赤色 | 水溶性色素(赤色 sulforhodamine B)と FM1-43 を細胞外液に同時に与え、開口放出を誘発すると、水溶性色素は小胞内部に進入し、FM1-43 は細胞外膜から小胞内膜へ拡散するため、開口放出した小胞が両色素で描出される。この際 [[2光子レーザー走査顕微鏡]]で画像を取得し、双方の色素の増加分の比を求めると小胞直径が計算される(直径=6 ΔSRB/ΔFM1-43)。本法は色素濃度やレンズ特性(point-spread function)によらず、シナプス小胞のような光学[[wikipedia:ja:解像度|解像度]]以下の器官の計測にも応用可能である。 | ||
== 関連項目 == | == 関連項目 == | ||
* | *開口放出([[エクソサイトーシス]]) | ||
*[[膜融合]] | *[[膜融合]] | ||
*[[シナプス]] | *[[シナプス]] | ||
*[[分泌]] | *[[wikipedia:ja:分泌|分泌]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:高橋倫子、河西春郎 担当編集委員:柚崎通介) | |||
2013年2月1日 (金) 07:26時点における版
| FM1-43 | |
|---|---|
| |
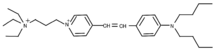
3-[4-[2-[4-(dibutylamino)phenyl]ethenyl]pyridin-1-ium-1-yl]propyl-triethylazanium dibromide | |
別称 Frie Mao 1-43, SynaptoGreen™ Reagent, SureCN1527120, N-(3-Triethylammoniumpropyl)-4-(p-dibutylaminostyryl)pyridinium, 2Br | |
| Identifiers | |
| 149838-22-2 | |
| Jmol-3D images | Image |
| PubChem | 2733618 |
| |
| Properties | |
| Molar mass | 611.53816 |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
FM色素は脂質二重膜を可逆的に染める蛍光色素で、シナプス前終末の機能や分泌現象の計測に活用されている。
FM1-43とは
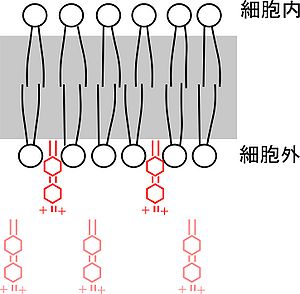
Fei Mao(FM)は細胞膜を染めるスチリル色素を合成した。FM1-43はその代表格である。シナプス前終末の機能解析や、分泌小胞の動態解析に広く用いられる。
色素の特性として次の3つの性質がある。
分子構造
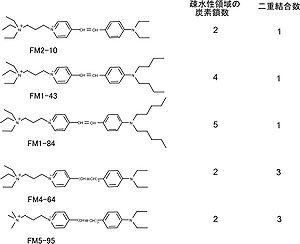
構造は、親水性領域、二重結合領域、疎水性炭素鎖領域に分けられる。
親水性領域が正の電荷をもつため、膜を通過しない。二重結合の数は蛍光波長に関連する。
二重結合が一つの FM1-43・FM1-84・FM2-10 は黄色蛍光を呈し、二重結合が二つの FM4-64・FM5-95 は赤色蛍光を呈する。
疎水性炭素鎖の長さは細胞膜の染め方に関連し、長いものほど明るく、一旦膜に組み込まれると離脱しがたい[1]。 FM1-43 の炭素鎖数は 4であり、解離時定数 τdiss は 8 msを示す。より短い FM2-10(炭素鎖数 2)は、比較的離脱しやすい(τdiss =6.4 ms)。逆に、より長い FM1-84(炭素鎖数 5)は離脱に時間がかかる(τdiss =36 ms)[2]。
蛍光特性
FM1-43 の、励起には 1光子では波長 480 nm光、2光子では波長 840 nm 光が頻用される。
極大蛍光波長はリポソーム中にて 580 nm である。
波長480nm光の高出力励起(~150 μW)にてジアミノベンゼン(DAB)の光変換(photoconversion) を起こす。そのため、アルデヒドで固定可能な色素:FM1-43FX と DAB を細胞に与え、光変換させると、共局在部位で電子密度の高い産物が作られ、電子顕微鏡観察が可能となる。FM1-43 を取り込んだ小胞が、高い電子密度で描出され、微細構造解析に活用されている。
応用例
シナプス前機能の解析
シナプス前終末における小胞プールの大きさと開口放出確率の測定
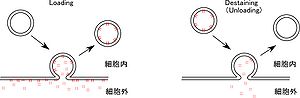
細胞外を FM1-43 で還流中に、短い放出刺激を与え(例 20 Hz、30 発)、開口放出(エクソサイトーシス)した小胞の膜を染める。
シナプス小胞は 30-60秒で細胞内部にエンドサイトーシスで取り込まれる(図 3左)。その後、細胞外を、色素を含まない溶液で還流し、細胞外膜に結合した色素を wash out する。このような loading 過程を経て示される蛍光量は、30回の刺激時に開口放出した小胞にあたり Readily releasable pool (RRP)のサイズの指標となる。カエル 神経筋接合部の場合、RRP の小胞数は神経終末内小胞の約 15%(12-17%)と報告された[3]。
次に、細胞外色素フリーの状態で放出刺激を与えると、前段階で染められたシナプス小胞は細胞膜と融合し、細胞外液への拡散により神経終末の蛍光は減弱する(destaining 図 3右)。この減弱の程度や時間経過から、開口放出の量と速度が評価できる。蛍光減弱の時間経過は single exponential に近似されることから、放出確率 (Release probability, Pr) は蛍光減弱の時定数に反比例すると考えられる。Prの計算法として、(Recycling pool の小胞数×0.63)/ (37%に蛍光減弱するまでに与えた電気パルス数)で示す方法[4] が提起された。より簡易的には、FM1-43 の蛍光半減期の逆数[5]で示されるケースもある。
シナプス小胞の動態の解析
開口放出した顆粒は active zone の周辺から内部に取り込まれ(エンドサイトーシス)、再び放出可能となる(recycle)。このリサイクルにかかる時間は、海馬培養標本では 20-30秒、神経筋接合部では 60秒と見積もられた。そこで Recycling pool(= RRP + Reserve pool)の測定は、RRP 測定時よりも長い時間電気刺激を与え、色素をロードする事により達成できる(例 10Hz 900 発)。リサイクルされた小胞は、元来小胞があった領域のほぼ全域に拡散し、core(中央部)への拡散のみが軽度に少なかった。また、リサイクルした小胞は、初めて刺激を受けたプール同様の放出確率を持つことが報告された[6] 。
膜融合様式の解析
FM 色素には、炭素鎖数の異なる複数種類の色素がある。これらが小胞膜を染める頻度を比較することにより、融合細孔の開放時間の長短が識別可能となる。
FM2-10 や FM1-43 色素を用い、小胞膜から離脱する完全融合型(full fusion)と、離脱しない不完全融合型(incomplete fusion)の識別が行われた[7] [8]。
開口放出現象の可視化
FM1-43 を網膜双極性細胞のシナプス小胞に取り込ませて標識し、全反射顕微鏡で細胞膜直下(~100nm)の観察を行い、単一小胞の開口放出現象の可視化が報告された[9] 。
また、下垂体前葉細胞 (lactotrophs) や膵島細胞においても、ホルモンを含む大型有芯小胞の膜融合に伴い、開口放出部位においてFM1-43 蛍光強度の上昇が報告された [10][11]。
分泌小胞の直径測定
シナプス小胞から大型有芯小胞に至るまで、小胞の直径計測に有効である [12]。
水溶性色素(赤色 sulforhodamine B)と FM1-43 を細胞外液に同時に与え、開口放出を誘発すると、水溶性色素は小胞内部に進入し、FM1-43 は細胞外膜から小胞内膜へ拡散するため、開口放出した小胞が両色素で描出される。この際 2光子レーザー走査顕微鏡で画像を取得し、双方の色素の増加分の比を求めると小胞直径が計算される(直径=6 ΔSRB/ΔFM1-43)。本法は色素濃度やレンズ特性(point-spread function)によらず、シナプス小胞のような光学解像度以下の器官の計測にも応用可能である。
関連項目
参考文献
- ↑
Cochilla, A.J., Angleson, J.K., & Betz, W.J. (1999).
Monitoring secretory membrane with FM1-43 fluorescence. Annual review of neuroscience, 22, 1-10. [PubMed:10202529] [WorldCat] [DOI] - ↑
Wu, Y., Yeh, F.L., Mao, F., & Chapman, E.R. (2009).
Biophysical characterization of styryl dye-membrane interactions. Biophysical journal, 97(1), 101-9. [PubMed:19580748] [PMC] [WorldCat] [DOI] - ↑
Rizzoli, S.O., & Betz, W.J. (2004).
The structural organization of the readily releasable pool of synaptic vesicles. Science (New York, N.Y.), 303(5666), 2037-9. [PubMed:15044806] [WorldCat] [DOI] - ↑
Branco, T., Staras, K., Darcy, K.J., & Goda, Y. (2008).
Local dendritic activity sets release probability at hippocampal synapses. Neuron, 59(3), 475-85. [PubMed:18701072] [PMC] [WorldCat] [DOI] - ↑
Zakharenko, S.S., Zablow, L., & Siegelbaum, S.A. (2001).
Visualization of changes in presynaptic function during long-term synaptic plasticity. Nature neuroscience, 4(7), 711-7. [PubMed:11426227] [WorldCat] [DOI] - ↑
Betz, W.J., & Bewick, G.S. (1992).
Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science (New York, N.Y.), 255(5041), 200-3. [PubMed:1553547] [WorldCat] [DOI] - ↑
Klingauf, J., Kavalali, E.T., & Tsien, R.W. (1998).
Kinetics and regulation of fast endocytosis at hippocampal synapses. Nature, 394(6693), 581-5. [PubMed:9707119] [WorldCat] [DOI] - ↑
Zenisek, D., Steyer, J.A., Feldman, M.E., & Almers, W. (2002).
A membrane marker leaves synaptic vesicles in milliseconds after exocytosis in retinal bipolar cells. Neuron, 35(6), 1085-97. [PubMed:12354398] [WorldCat] [DOI] - ↑
Zenisek, D., Steyer, J.A., & Almers, W. (2000).
Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature, 406(6798), 849-54. [PubMed:10972279] [WorldCat] [DOI] - ↑
Cochilla, A.J., Angleson, J.K., & Betz, W.J. (2000).
Differential regulation of granule-to-granule and granule-to-plasma membrane fusion during secretion from rat pituitary lactotrophs. The Journal of cell biology, 150(4), 839-48. [PubMed:10953007] [PMC] [WorldCat] [DOI] - ↑
Takahashi, N., Kishimoto, T., Nemoto, T., Kadowaki, T., & Kasai, H. (2002).
Fusion pore dynamics and insulin granule exocytosis in the pancreatic islet. Science (New York, N.Y.), 297(5585), 1349-52. [PubMed:12193788] [WorldCat] [DOI] - ↑
Kasai, H., Hatakeyama, H., Kishimoto, T., Liu, T.T., Nemoto, T., & Takahashi, N. (2005).
A new quantitative (two-photon extracellular polar-tracer imaging-based quantification (TEPIQ)) analysis for diameters of exocytic vesicles and its application to mouse pancreatic islets. The Journal of physiology, 568(Pt 3), 891-903. [PubMed:16150799] [PMC] [WorldCat] [DOI]
(執筆者:高橋倫子、河西春郎 担当編集委員:柚崎通介)