「細胞接着分子」の版間の差分
細編集の要約なし |
Yutakafurutani (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の39版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Cell adhesion molecules | |||
細胞が互いに認識・結合し、組織や器官を形成し、これらが集まり合うことで[[wikipedia:jp:多細胞生物|多細胞生物]]の個体が形作られる。また、細胞外環境に存在する[[細胞外マトリックス]]分子や分泌因子あるいは他の細胞の膜蛋白質など、多種多様な細胞外情報が細胞接着・認識分子群によって読み取られ、移動・接着・シグナル伝達・分化などの細胞の行動・運命が決定される。このように生物のかたちの形成と維持のみならず、生体機能の発現過程において多種多様な細胞接着分子群が機能している。神経系の発生・発達・機能発現の諸過程においても細胞接着分子群が重要な役割を果たしている。例えば、[[wikipedia:jp:幹細胞|幹細胞]]の維持、細胞移動、軸索伸長・ガイダンス、[[wikipedia:jp:樹状突起|樹状突起]]形成、[[シナプス]]形成、[[ニューロン]]-[[グリア細胞]]間結合、[[シナプス可塑性]]などの様々な場面における細胞接着分子群の機能が報告されている。<br> 細胞接着は、細胞同士の結合、細胞と細胞外マトリックス(細胞外基質)との結合に大別される。細胞同士の結合はさらに、[[カドヘリン]]や[[免疫グロブリンスーパーファミリー]]などによる膜蛋白質同士の相互作用による特異的認識と接着、[[wikipedia:jp:密着結合|タイトジャンクション]]における強固な細胞間接着に分類することができる。細胞外マトリックス分子との接着はおもに[[wikipedia:integrin|インテグリン]]・ファミリー分子群が細胞膜受容体としてはたらく。 | |||
細胞が互いに認識・結合し、組織や器官を形成し、これらが集まり合うことで[[wikipedia:jp:多細胞生物|多細胞生物]] | |||
== 細胞接着における分子間の結合様式 == | == 細胞接着における分子間の結合様式 == | ||
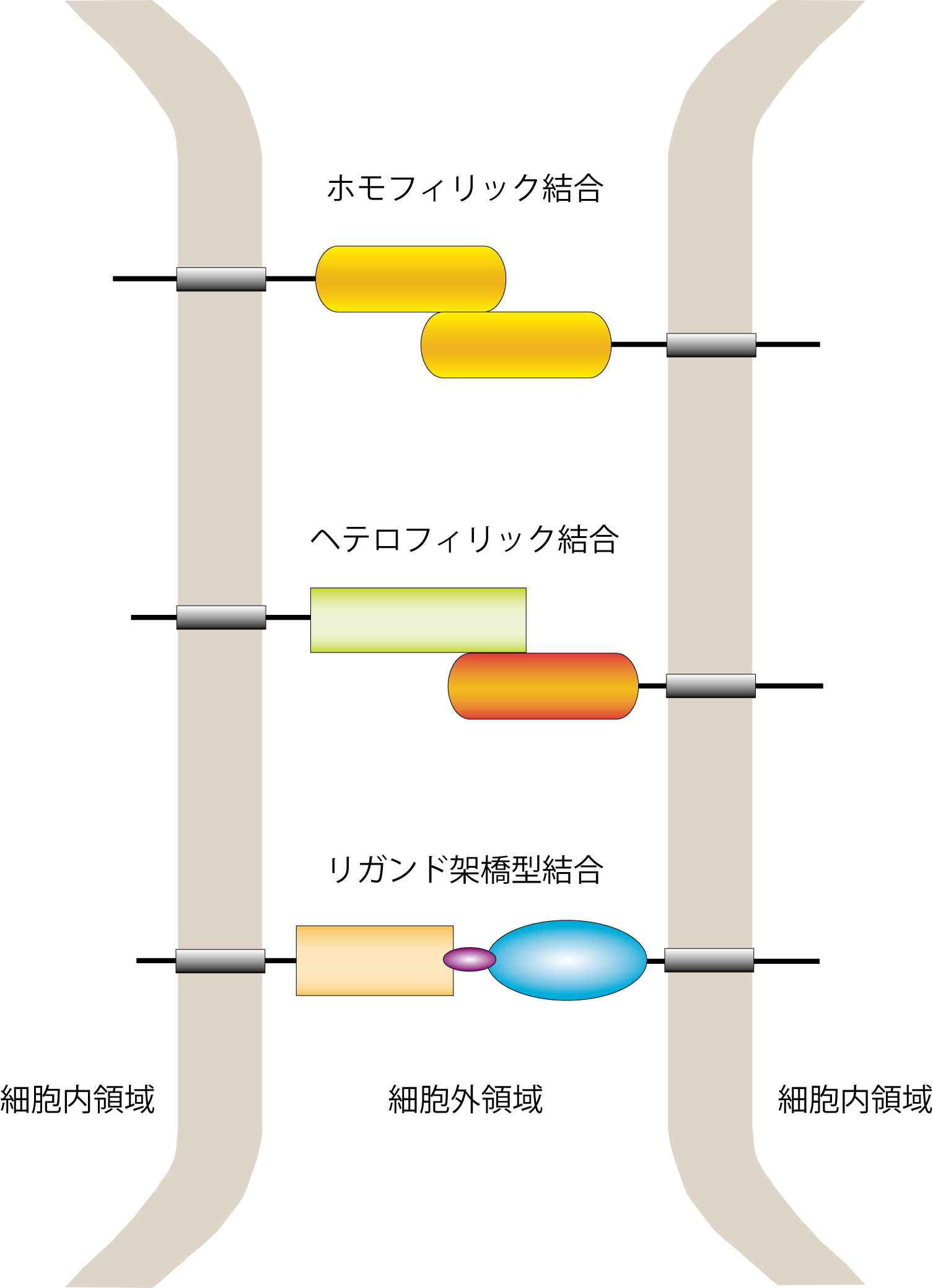
細胞間の接着は以下の3つの様式に分類される(図1)。 [[Image:Furutani_fig_1.jpg]] | |||
=== ホモフィリック結合(同種分子親和性結合 Homophilic adhesion) === | |||
同種の分子が結合する様式をホモフィリック結合という。神経系に発現する代表的なホモフィリック結合分子として、[[カドヘリン]]、NCAM,[[L1]], P0などが挙げられる。同じタイプの神経細胞を集めて配置する神経核の形成過程や、同じタイプの軸索を集めて束化する軸索束形成過程において、細胞接着分子によるホモフィリック結合が重要な役割を果たす。 | |||
=== ヘテロフィリック結合(異種分子親和性結合Heterophilic adhesion) === | |||
異種の分子が特異性をもって結合する様式をヘテロフィリック結合という。代表的なヘテロフィリック結合ペアとして、[[L1]]ファミリーとContactinファミリーの結合、ICAMファミリーとβ2インテグリンファミリーの結合などが報告されている。異なったタイプの細胞間の相互作用で使われる接着様式であり、最も研究が進展している例として、ニューロンとシュワン細胞(あるいはオリゴデンドロサイト)の接着による軸索の髄鞘化における[[免疫グロブリンスーパーファミリー]]分子群(Contactin, TAG-1, NrCAM, Neurofascin, Neclなど)の役割が知られている(詳細は「[[免疫グロブリンスーパーファミリー]]」の項を参照)。また、シナプス前部に存在する多様なNeurexinアイソフォームとシナプス後部のNeuroliginファミリーが選択的ヘテロフィリック結合をすることによって、シナプス形成の特異性を規定すると考えられている。 | |||
=== リガンド架橋型結合(Ligand-bridged adhesion) === | |||
細胞表面の接着分子の間をリガンド分子が架橋しできる結合である。GDNFを介したGFRα1同士の結合やCbln1を介したNeurexinをGluD2の結合が、特異的なシナプス形成に関与することが報告されている<ref><pubmed>17310246</pubmed></ref><ref><pubmed>23189042</pubmed></ref><ref><pubmed>21342763</pubmed></ref>。 | |||
== | == 細胞接着分子の構造と機能 == | ||
神経系で発現・機能する細胞接着分子群はそれらの分子構造に基づいて以下のように分類される。 | 神経系で発現・機能する細胞接着分子群はそれらの分子構造に基づいて以下のように分類される。 | ||
=== | === カドヘリン・スーパーファミリー(Cadherin superfamily) === | ||
[[Image: | [[Image:Furutani_fig_2.jpg]][[カドヘリン]]・スーパーファミリーは、細胞外領域にカドヘリン様ドメインを有し、カルシウムイオン依存的なホモフィリック結合により細胞接着活性を現す膜蛋白質群の総称である<ref><pubmed>17133224</pubmed></ref>。マウスにおいて少なくとも80種類のメンバーが存在する(図2)。これまでのカドヘリン分子群の発見及び機能解析においては、多くの日本人研究者が中心的役割と果たしてきた。1980年代に竹市雅俊らによって次々と発見されたクラシックカドヘリンファミリー(N-, E-, P-, R-カドヘリン)は、細胞内領域でカテニンと結合し、アクチン細胞骨格系や様々なシグナル伝達を制御する<ref><pubmed>2197976</pubmed></ref>。1993年、鈴木信太郎らは新たなカドヘリン多重遺伝子群の神経系における発現を報告した<ref><pubmed>8508762</pubmed></ref>。さらに1998年、八木健らはチロシンリン酸化酵素Fynに結合する分子としてCNR(プロトカドヘリン)を発見した<ref><pubmed>9655502</pubmed></ref>。プロトカドヘリンα、β、γは、複数の可変領域エクソンと1つの定常領域エクソンからmRNAの選択的スプライシングによって多様性が形成されるユニークな細胞接着分子群である。個々のニューロンごとに異なった組み合わせのプロトカドヘリンが発現し、神経回路構築・シナプス形成に重要な役割を果たすと予想されている<ref><pubmed>10817752</pubmed></ref>。また、上村匡らは7回膜貫通型カドヘリン(ショウジョウバエのFlamingo; マウスのCelsr)を発見した<ref><pubmed>10490098</pubmed></ref>。(詳細は「[[カドヘリン]]」の項を参照) | ||
=== 免疫グロブリンスーパーファミリー(Immunoglobulin superfamily) === | |||
[[Image:Furutani_fig_3.jpg]][[wikipedia:jp:抗体|抗体]]分子(免疫グロブリン:Ig)の構造と類似した免疫グロブリン様ドメイン(Igドメイン)を細胞外領域に有する膜蛋白質群を免疫グロブリンスーパーファミリー(IgSF)と総称する<ref><pubmed>1710044</pubmed></ref><ref><pubmed>8528906</pubmed></ref>。1987年、EdelmanらはIgドメインを有し、神経細胞に発現する膜蛋白質NCAM(Neural cell adhesion molecule)を最初に発見した<ref><pubmed>3576199</pubmed></ref>(Cunningham et al., 1987)。その後、神経系に発現する100種類以上ものIgSFが同定された(図3)。代表的なIgSF分子として、軸索伸長・ガイダンスに機能する[[L1]], Contactin, DCC, [[Robo]]、樹状突起発達、シナプス形成に関与するTelencephalin, SynCAM, Dscam, Sidekick、髄鞘形成を司るP0などがあり、神経系発達の様々な過程で機能的役割を果たしている(詳細は「[[免疫グロブリンスーパーファミリー]]」の項を参照)。 | |||
=== インテグリン・ファミリー(Integrin family) === | |||
[[Image:Furutani_fig_4.jpg]] [[wikipedia:integrin|インテグリン]]はαサブユニットとβサブユニットのヘテロ2量体からなる2価カチオン(Mg2+あるいはCa2+)依存性の接着分子である。マウスでは16種類のαサブユニットと8種類のβサブユニット遺伝子が存在し、図4に示す組み合わせにより機能的なヘテロ2量体を形成する。多くのインテグリンは、[[wikipedia:jp:コラーゲン|コラーゲン]], [[wikipedia:Vitronectin|ビトロネクチン]], [[wikipedia:Laminin|ラミニン]], [[wikipedia:jp:フィブロネクチン|フィブロネクチン]]などの細胞外マトリックス蛋白質をリガンドとして細胞−基質間の接着を司る。一方、一部のインテグリンはIgSFや[[カドヘリン]]と結合することで細胞間接着を担う。例えばβ2サブユニットを含むインテグリンLFA-1(αLβ2; CD11a/CD18)は、Telencephalin(ICAM-5)などのICAMファミリーIgSF分子群と結合し、免疫系および神経系における細胞間認識・接着において機能することが報告されている<ref><pubmed>17201681</pubmed></ref><ref><pubmed>18367254</pubmed></ref>。インテグリンの細胞内領域はTalin, α-Actinin, Vinculinなどと結合し、アクチン細胞骨格系や様々な細胞内シグナル伝達系を制御する<ref><pubmed>12297042</pubmed></ref>。神経系におけるインテグリンの機能として、ニューロンの移動、軸索の伸長、シナプスの形成、神経可塑性の制御などが報告されている<ref><pubmed>15250583</pubmed></ref><ref><pubmed>17049262</pubmed></ref><ref><pubmed>16567651</pubmed></ref><ref><pubmed>19047646</pubmed></ref><ref><pubmed>19758485</pubmed></ref><ref><pubmed>22232691</pubmed></ref><ref><pubmed>23083738</pubmed></ref>。 | |||
=== | === その他のシナプス接着分子 === | ||
上述した分子の他に、Netrin-G1, -G2などのロイシンリッチリピート蛋白質、Neurexins / Neuroligins、Neuropilins / Plexins / Semaphorins、Ephrins / Ephs、Syndecansなどの細胞認識・接着分子がシナプス部位に局在しており、シナプス形成・維持・可塑性を制御している(詳細は「[[シナプス接着因子]]」の項目を参照)<ref><pubmed>15882774</pubmed></ref><ref><pubmed>18923512</pubmed></ref><ref><pubmed>21740233</pubmed></ref><ref><pubmed>22449939</pubmed></ref><ref><pubmed>22895477</pubmed></ref>。また、[[wikipedia:G protein-coupled receptor|膜7回貫通型受容体]]膜7回貫通型受容体であるLatrophilin, Celsr, Brain-specific angiogenesis inhibitor (BAI)は脳において高発現している。これらの細胞外領域には[[細胞外マトリックス]]蛋白質や[[カドヘリン]]と共通するドメインを持っているため、細胞接着に関連するドメインを介した相互作用によりシナプス形成を調節すると考えられる<ref><pubmed>21724987</pubmed></ref><ref><pubmed>21262840</pubmed></ref><ref><pubmed>22262843</pubmed></ref><ref><pubmed>22405201</pubmed></ref>。 | |||
=== | === 細胞外マトリックス分子(Extracellular Matrix Molecules) === | ||
細胞外マトリックスは主にコラーゲンやラミニンに代表される分泌蛋白質と[[wikipedia:jp:ヒアルロン酸|ヒアルロン酸]]や[[wikipedia:jp:コンドロイチン硫酸|コンドロイチン硫酸]]などの糖から構成されており、これらの分子が自己組織化することにより細胞の周囲にシート状またはメッシュ状の線維を形成する。それぞれの細胞は細胞外マトリックス分子を分泌し、その細胞自体に適した細胞外環境を構築している。また、細胞外マトリックス分子は[[wikipedia:Matrix metalloproteinase|Matrix metalloproteinase]]などの細胞外プロテアーゼによって分解され、細胞外環境を随時最適なものにカスタマイズしている。<br> 細胞外マトリックスは単に細胞間を埋め尽くしているだけでなく、細胞を支える構造体となり、細胞の増殖、分化、行動、運命などを決定する。細胞外マトリックス分子の情報は主にインテグリンを介して細胞内へと伝えられる。その他、Telencephalin, NeclなどのIgSF分子群もビトロネクチンなどの細胞外マトリックス蛋白質と結合することで細胞内へと情報を伝える<ref><pubmed>17446174</pubmed></ref><ref name="ref33"><pubmed>23019340</pubmed></ref>。<br> 運動ニューロンと筋細胞のシナプス([[神経筋接合部]])ではシート状の細胞外マトリックス([[基底膜]])が存在し、細胞外マトリックス蛋白質がシナプス形成を制御している<ref><pubmed>10202544</pubmed></ref>。一方、中枢神経系におけるシナプスでは明らかな細胞外マトリックス構造が見られないが、[[wikipedia:Vitronectin|ビトロネクチン]]や[[wikipedia:thrombospondin|トロンボスポンジン]]などの細胞外マトリックス蛋白質がスパイン成熟やシナプス形成を制御している<ref><pubmed>22405201</pubmed></ref><ref name="ref33" />。また、細胞外マトリックス分子はシナプス形成のみならず、幹細胞の維持、細胞移動の制御、軸索伸長の促進・抑制などにも関与している<ref><pubmed>20497467</pubmed></ref><ref><pubmed>21898854</pubmed></ref><ref><pubmed>23083738</pubmed></ref>。(詳細は「[[細胞外マトリックス]]」の項を参照) | |||
== ギャップジャンクション(Gap Junction) == | |||
[[Image:Furutani_fig_5.jpg]] 約1000ダルトン以下の低分子を通すことのできる細胞間チャネルを有する接着構造を[[wikipedia:Gap junction|ギャップジャンクション]]という。ギャップジャンクションを介して、栄養素、代謝産物、セカンドメッセンジャー、陽イオン、陰イオンなどの様々な分子が細胞間で輸送される。この細胞間チャネルはConnexinsとPannexinsにより形成され、ヒトやマウスのゲノムには約20種類のConnexin遺伝子と、3種類のPannexin遺伝子が存在する。ニューロン間のギャップジャンクションは、主に6種類のConnexin-26, -30.2, -31.1, 36, -45, -57と2種類のPannexin-1, -2で構成される。Connexinsは細胞膜でホモまたはヘテロ6量体(Connexon)として存在し、対面する細胞膜のConnexonどうしでさらにホモフィリックあるいはヘテロフィリックに結合することで細胞間接合部チャネル、すなわちギャップジャンクションを形成する(図5)。ギャップジャンクションはニューロン間のみならず、[[小脳プルキンエ細胞]]と[[バーグマングリア]]の接着部位などにも存在し、[[ニューロン]]−[[グリア細胞]]間の情報伝達にも機能している<ref><pubmed>15738956</pubmed></ref>。 | |||
== タイトジャンクション(Tight Junction) == | |||
神経細胞における[[wikipedia:tight junction|タイトジャンクション]]の存在に関しての報告はないが、[[wikipedia:Blood-Brain Barrier|血液−脳関門]](Blood-Brain Barrier: BBB)の維持におけるタイトジャンクションの役割は欠かせない。血管内皮細胞同士がタイトジャンクションを介して強固に結合することで、脳実質内への血液の浸潤を妨げるバリア構造が形成される。タイトジャンクションはClaudins、Occludins、JAMsによるホモフィリック結合を基盤として構築され、これら分子の細胞内領域がZonula occludens (ZO)を介してアクチン細胞骨格と結合する[[Image:Furutani_fig_6.jpg]]ことで、強固な細胞間接着構造が形成される(図6)<ref><pubmed>11283726</pubmed></ref><ref><pubmed>21349151</pubmed></ref>。また、末梢神経系でのシュワン細胞による軸索の髄鞘形成においては、Claudin-19を介したタイトジャンクション構造が重要な役割を果たしている<ref><pubmed>15883201</pubmed></ref>。 | |||
<br> | |||
図1 細胞接着における3種類の結合様式<br>上から順にホモフィリック結合、ヘテロフィリック結合、リガンド架橋型結合を示す。 | |||
図2 カドヘリン・スーパーファミリー<br>カドヘリンは細胞外領域に複数のカドヘリンドメインを持つ蛋白質である。プロトカドヘリン1-21のカドヘリン様ドメイン数は分子によって異なる(6個または7個)。 | |||
図3 神経系に発現する免疫グロブリンスーパーファミリー<br>細胞外領域に1つまたは複数のIgドメインを持つ蛋白質群を免疫グロブリンスーパーファミリー(IgSF)と総称する。神経系には100種類以上のIgSF分子群が存在する。<br>Cys: Cysteine-rich domain, EGF: epidermal growth factor-like repeat, Kr: Kringle domain, LRR: leucine-rich repeat, MAM: meprin/A5/protein tyrosine phosphatase domain, Sema: semaphorin domain, TK: tyrosine kinase, TP: tyrosine phosphatase, TS: thrombospondin domain. | |||
図4 インテグリン<br>A, インテグリンの構造。インテグリンはα、βサブユニットのヘテロ2量体からなる。<br>B, α、βサブユニットの組み合わせとそのリガンド分子。Col: Collagen, Fb: Fibrinogen, Fn: Fibronectin, FX; factor X, ICAM: Intercellular adhesion molecule, Ln: Laminin, MadCAM: Mucosal addressin cell adhesion molecule, Tn: Tenascin, VCAM: Vascular cell adhesion molecules, vWF: von Willebrand’s factor. | |||
図5 ギャップジャンクション<br>Connexinsはホモまたはヘテロ6量体(Connexon)として細胞膜に存在し、対面する細胞膜にあるConnexonと細胞間チャネルを形成する。 | |||
図6 タイトジャンクション<br>Occuludins、Claudins、JAMsはホモフィリック結合を形成し、その細胞内ではZOとの結合を介してアクチン骨格に固定され強固なタイトジャンクションとして機能する。 | |||
== 関連項目 == | == 関連項目 == | ||
| 109行目: | 74行目: | ||
*[[基底膜]] | *[[基底膜]] | ||
*[[神経筋接合部]] | *[[神経筋接合部]] | ||
*[[ | *[[ギャップジャンクション(電気シナプス)]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
<br> <br> (執筆者:古谷 裕、吉原良浩、担当編集委員:大隅典子) | |||
2013年3月8日 (金) 11:10時点における版
英語名:Cell adhesion molecules
細胞が互いに認識・結合し、組織や器官を形成し、これらが集まり合うことで多細胞生物の個体が形作られる。また、細胞外環境に存在する細胞外マトリックス分子や分泌因子あるいは他の細胞の膜蛋白質など、多種多様な細胞外情報が細胞接着・認識分子群によって読み取られ、移動・接着・シグナル伝達・分化などの細胞の行動・運命が決定される。このように生物のかたちの形成と維持のみならず、生体機能の発現過程において多種多様な細胞接着分子群が機能している。神経系の発生・発達・機能発現の諸過程においても細胞接着分子群が重要な役割を果たしている。例えば、幹細胞の維持、細胞移動、軸索伸長・ガイダンス、樹状突起形成、シナプス形成、ニューロン-グリア細胞間結合、シナプス可塑性などの様々な場面における細胞接着分子群の機能が報告されている。
細胞接着は、細胞同士の結合、細胞と細胞外マトリックス(細胞外基質)との結合に大別される。細胞同士の結合はさらに、カドヘリンや免疫グロブリンスーパーファミリーなどによる膜蛋白質同士の相互作用による特異的認識と接着、タイトジャンクションにおける強固な細胞間接着に分類することができる。細胞外マトリックス分子との接着はおもにインテグリン・ファミリー分子群が細胞膜受容体としてはたらく。
細胞接着における分子間の結合様式
ホモフィリック結合(同種分子親和性結合 Homophilic adhesion)
同種の分子が結合する様式をホモフィリック結合という。神経系に発現する代表的なホモフィリック結合分子として、カドヘリン、NCAM,L1, P0などが挙げられる。同じタイプの神経細胞を集めて配置する神経核の形成過程や、同じタイプの軸索を集めて束化する軸索束形成過程において、細胞接着分子によるホモフィリック結合が重要な役割を果たす。
ヘテロフィリック結合(異種分子親和性結合Heterophilic adhesion)
異種の分子が特異性をもって結合する様式をヘテロフィリック結合という。代表的なヘテロフィリック結合ペアとして、L1ファミリーとContactinファミリーの結合、ICAMファミリーとβ2インテグリンファミリーの結合などが報告されている。異なったタイプの細胞間の相互作用で使われる接着様式であり、最も研究が進展している例として、ニューロンとシュワン細胞(あるいはオリゴデンドロサイト)の接着による軸索の髄鞘化における免疫グロブリンスーパーファミリー分子群(Contactin, TAG-1, NrCAM, Neurofascin, Neclなど)の役割が知られている(詳細は「免疫グロブリンスーパーファミリー」の項を参照)。また、シナプス前部に存在する多様なNeurexinアイソフォームとシナプス後部のNeuroliginファミリーが選択的ヘテロフィリック結合をすることによって、シナプス形成の特異性を規定すると考えられている。
リガンド架橋型結合(Ligand-bridged adhesion)
細胞表面の接着分子の間をリガンド分子が架橋しできる結合である。GDNFを介したGFRα1同士の結合やCbln1を介したNeurexinをGluD2の結合が、特異的なシナプス形成に関与することが報告されている[1][2][3]。
細胞接着分子の構造と機能
神経系で発現・機能する細胞接着分子群はそれらの分子構造に基づいて以下のように分類される。
カドヘリン・スーパーファミリー(Cadherin superfamily)
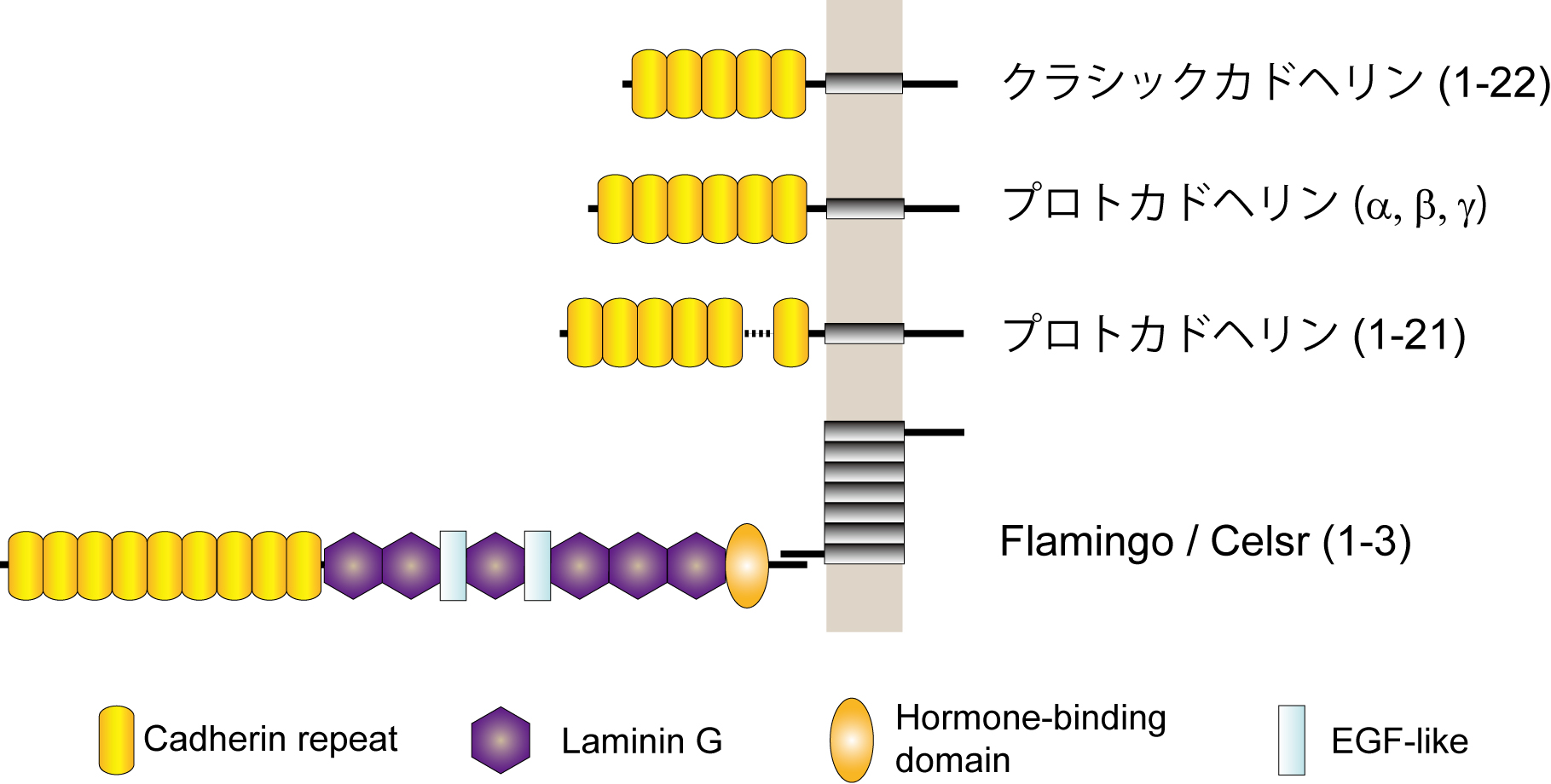 カドヘリン・スーパーファミリーは、細胞外領域にカドヘリン様ドメインを有し、カルシウムイオン依存的なホモフィリック結合により細胞接着活性を現す膜蛋白質群の総称である[4]。マウスにおいて少なくとも80種類のメンバーが存在する(図2)。これまでのカドヘリン分子群の発見及び機能解析においては、多くの日本人研究者が中心的役割と果たしてきた。1980年代に竹市雅俊らによって次々と発見されたクラシックカドヘリンファミリー(N-, E-, P-, R-カドヘリン)は、細胞内領域でカテニンと結合し、アクチン細胞骨格系や様々なシグナル伝達を制御する[5]。1993年、鈴木信太郎らは新たなカドヘリン多重遺伝子群の神経系における発現を報告した[6]。さらに1998年、八木健らはチロシンリン酸化酵素Fynに結合する分子としてCNR(プロトカドヘリン)を発見した[7]。プロトカドヘリンα、β、γは、複数の可変領域エクソンと1つの定常領域エクソンからmRNAの選択的スプライシングによって多様性が形成されるユニークな細胞接着分子群である。個々のニューロンごとに異なった組み合わせのプロトカドヘリンが発現し、神経回路構築・シナプス形成に重要な役割を果たすと予想されている[8]。また、上村匡らは7回膜貫通型カドヘリン(ショウジョウバエのFlamingo; マウスのCelsr)を発見した[9]。(詳細は「カドヘリン」の項を参照)
カドヘリン・スーパーファミリーは、細胞外領域にカドヘリン様ドメインを有し、カルシウムイオン依存的なホモフィリック結合により細胞接着活性を現す膜蛋白質群の総称である[4]。マウスにおいて少なくとも80種類のメンバーが存在する(図2)。これまでのカドヘリン分子群の発見及び機能解析においては、多くの日本人研究者が中心的役割と果たしてきた。1980年代に竹市雅俊らによって次々と発見されたクラシックカドヘリンファミリー(N-, E-, P-, R-カドヘリン)は、細胞内領域でカテニンと結合し、アクチン細胞骨格系や様々なシグナル伝達を制御する[5]。1993年、鈴木信太郎らは新たなカドヘリン多重遺伝子群の神経系における発現を報告した[6]。さらに1998年、八木健らはチロシンリン酸化酵素Fynに結合する分子としてCNR(プロトカドヘリン)を発見した[7]。プロトカドヘリンα、β、γは、複数の可変領域エクソンと1つの定常領域エクソンからmRNAの選択的スプライシングによって多様性が形成されるユニークな細胞接着分子群である。個々のニューロンごとに異なった組み合わせのプロトカドヘリンが発現し、神経回路構築・シナプス形成に重要な役割を果たすと予想されている[8]。また、上村匡らは7回膜貫通型カドヘリン(ショウジョウバエのFlamingo; マウスのCelsr)を発見した[9]。(詳細は「カドヘリン」の項を参照)
免疫グロブリンスーパーファミリー(Immunoglobulin superfamily)
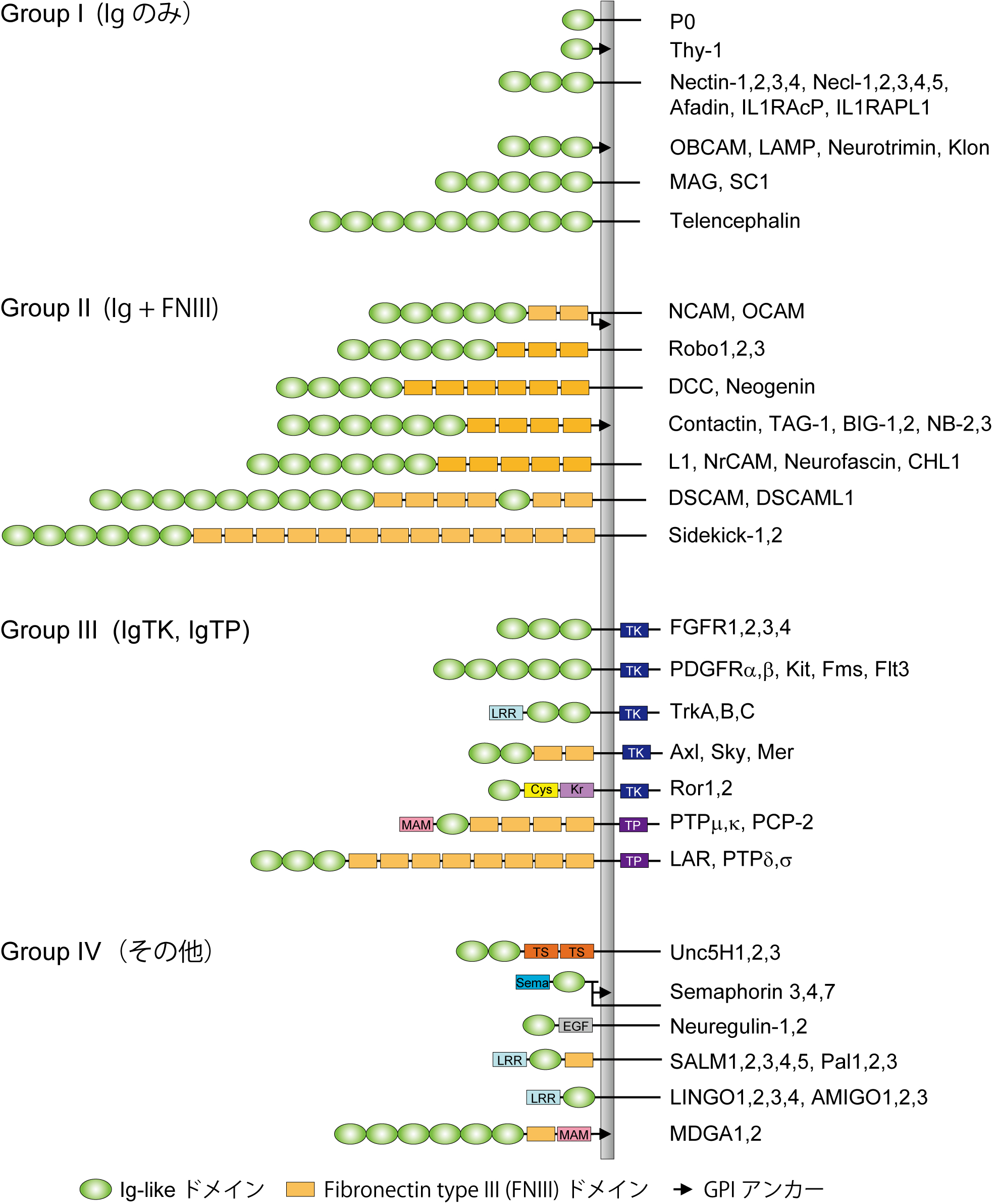 抗体分子(免疫グロブリン:Ig)の構造と類似した免疫グロブリン様ドメイン(Igドメイン)を細胞外領域に有する膜蛋白質群を免疫グロブリンスーパーファミリー(IgSF)と総称する[10][11]。1987年、EdelmanらはIgドメインを有し、神経細胞に発現する膜蛋白質NCAM(Neural cell adhesion molecule)を最初に発見した[12](Cunningham et al., 1987)。その後、神経系に発現する100種類以上ものIgSFが同定された(図3)。代表的なIgSF分子として、軸索伸長・ガイダンスに機能するL1, Contactin, DCC, Robo、樹状突起発達、シナプス形成に関与するTelencephalin, SynCAM, Dscam, Sidekick、髄鞘形成を司るP0などがあり、神経系発達の様々な過程で機能的役割を果たしている(詳細は「免疫グロブリンスーパーファミリー」の項を参照)。
抗体分子(免疫グロブリン:Ig)の構造と類似した免疫グロブリン様ドメイン(Igドメイン)を細胞外領域に有する膜蛋白質群を免疫グロブリンスーパーファミリー(IgSF)と総称する[10][11]。1987年、EdelmanらはIgドメインを有し、神経細胞に発現する膜蛋白質NCAM(Neural cell adhesion molecule)を最初に発見した[12](Cunningham et al., 1987)。その後、神経系に発現する100種類以上ものIgSFが同定された(図3)。代表的なIgSF分子として、軸索伸長・ガイダンスに機能するL1, Contactin, DCC, Robo、樹状突起発達、シナプス形成に関与するTelencephalin, SynCAM, Dscam, Sidekick、髄鞘形成を司るP0などがあり、神経系発達の様々な過程で機能的役割を果たしている(詳細は「免疫グロブリンスーパーファミリー」の項を参照)。
インテグリン・ファミリー(Integrin family)
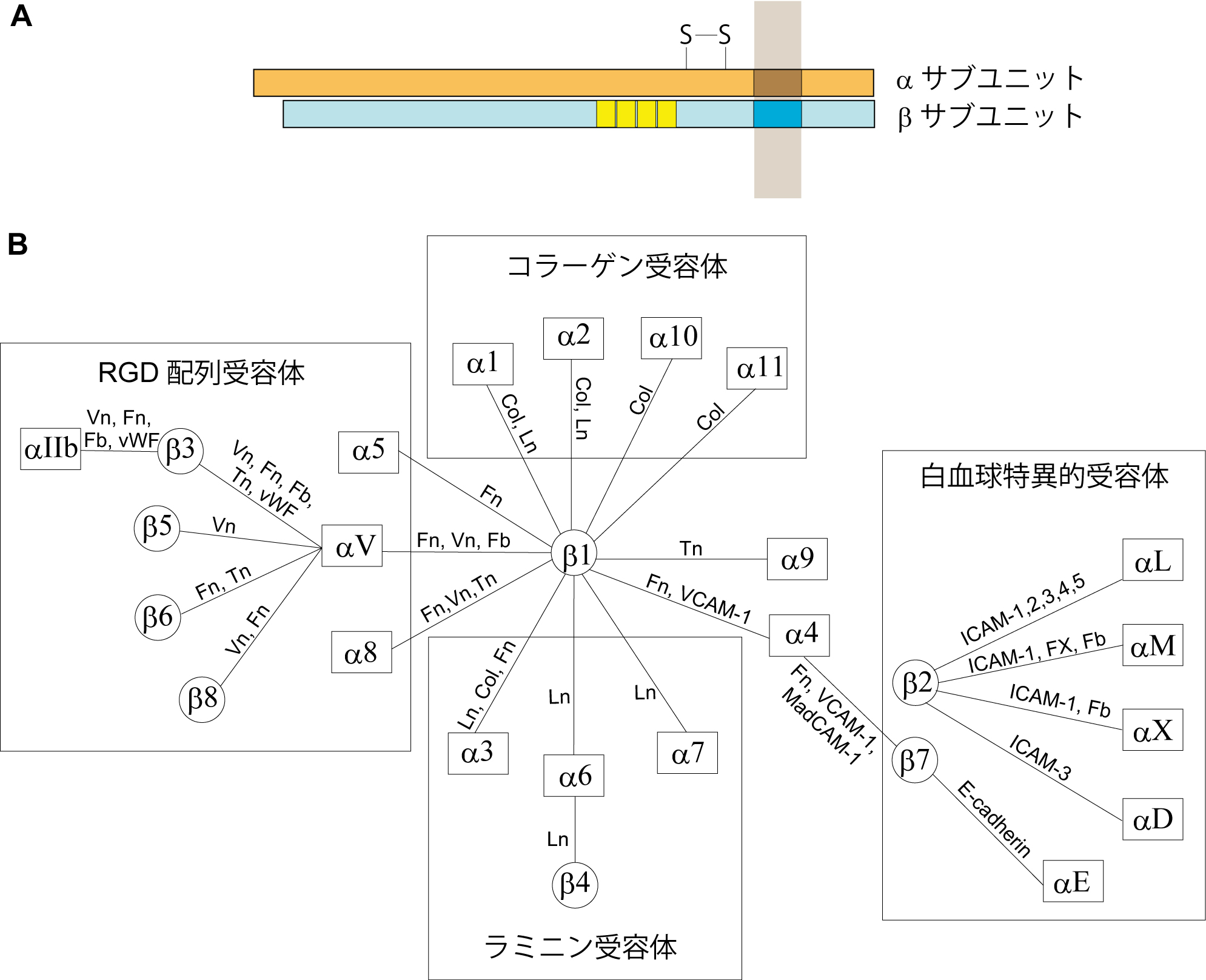 インテグリンはαサブユニットとβサブユニットのヘテロ2量体からなる2価カチオン(Mg2+あるいはCa2+)依存性の接着分子である。マウスでは16種類のαサブユニットと8種類のβサブユニット遺伝子が存在し、図4に示す組み合わせにより機能的なヘテロ2量体を形成する。多くのインテグリンは、コラーゲン, ビトロネクチン, ラミニン, フィブロネクチンなどの細胞外マトリックス蛋白質をリガンドとして細胞−基質間の接着を司る。一方、一部のインテグリンはIgSFやカドヘリンと結合することで細胞間接着を担う。例えばβ2サブユニットを含むインテグリンLFA-1(αLβ2; CD11a/CD18)は、Telencephalin(ICAM-5)などのICAMファミリーIgSF分子群と結合し、免疫系および神経系における細胞間認識・接着において機能することが報告されている[13][14]。インテグリンの細胞内領域はTalin, α-Actinin, Vinculinなどと結合し、アクチン細胞骨格系や様々な細胞内シグナル伝達系を制御する[15]。神経系におけるインテグリンの機能として、ニューロンの移動、軸索の伸長、シナプスの形成、神経可塑性の制御などが報告されている[16][17][18][19][20][21][22]。
インテグリンはαサブユニットとβサブユニットのヘテロ2量体からなる2価カチオン(Mg2+あるいはCa2+)依存性の接着分子である。マウスでは16種類のαサブユニットと8種類のβサブユニット遺伝子が存在し、図4に示す組み合わせにより機能的なヘテロ2量体を形成する。多くのインテグリンは、コラーゲン, ビトロネクチン, ラミニン, フィブロネクチンなどの細胞外マトリックス蛋白質をリガンドとして細胞−基質間の接着を司る。一方、一部のインテグリンはIgSFやカドヘリンと結合することで細胞間接着を担う。例えばβ2サブユニットを含むインテグリンLFA-1(αLβ2; CD11a/CD18)は、Telencephalin(ICAM-5)などのICAMファミリーIgSF分子群と結合し、免疫系および神経系における細胞間認識・接着において機能することが報告されている[13][14]。インテグリンの細胞内領域はTalin, α-Actinin, Vinculinなどと結合し、アクチン細胞骨格系や様々な細胞内シグナル伝達系を制御する[15]。神経系におけるインテグリンの機能として、ニューロンの移動、軸索の伸長、シナプスの形成、神経可塑性の制御などが報告されている[16][17][18][19][20][21][22]。
その他のシナプス接着分子
上述した分子の他に、Netrin-G1, -G2などのロイシンリッチリピート蛋白質、Neurexins / Neuroligins、Neuropilins / Plexins / Semaphorins、Ephrins / Ephs、Syndecansなどの細胞認識・接着分子がシナプス部位に局在しており、シナプス形成・維持・可塑性を制御している(詳細は「シナプス接着因子」の項目を参照)[23][24][25][26][27]。また、膜7回貫通型受容体膜7回貫通型受容体であるLatrophilin, Celsr, Brain-specific angiogenesis inhibitor (BAI)は脳において高発現している。これらの細胞外領域には細胞外マトリックス蛋白質やカドヘリンと共通するドメインを持っているため、細胞接着に関連するドメインを介した相互作用によりシナプス形成を調節すると考えられる[28][29][30][31]。
細胞外マトリックス分子(Extracellular Matrix Molecules)
細胞外マトリックスは主にコラーゲンやラミニンに代表される分泌蛋白質とヒアルロン酸やコンドロイチン硫酸などの糖から構成されており、これらの分子が自己組織化することにより細胞の周囲にシート状またはメッシュ状の線維を形成する。それぞれの細胞は細胞外マトリックス分子を分泌し、その細胞自体に適した細胞外環境を構築している。また、細胞外マトリックス分子はMatrix metalloproteinaseなどの細胞外プロテアーゼによって分解され、細胞外環境を随時最適なものにカスタマイズしている。
細胞外マトリックスは単に細胞間を埋め尽くしているだけでなく、細胞を支える構造体となり、細胞の増殖、分化、行動、運命などを決定する。細胞外マトリックス分子の情報は主にインテグリンを介して細胞内へと伝えられる。その他、Telencephalin, NeclなどのIgSF分子群もビトロネクチンなどの細胞外マトリックス蛋白質と結合することで細胞内へと情報を伝える[32][33]。
運動ニューロンと筋細胞のシナプス(神経筋接合部)ではシート状の細胞外マトリックス(基底膜)が存在し、細胞外マトリックス蛋白質がシナプス形成を制御している[34]。一方、中枢神経系におけるシナプスでは明らかな細胞外マトリックス構造が見られないが、ビトロネクチンやトロンボスポンジンなどの細胞外マトリックス蛋白質がスパイン成熟やシナプス形成を制御している[35][33]。また、細胞外マトリックス分子はシナプス形成のみならず、幹細胞の維持、細胞移動の制御、軸索伸長の促進・抑制などにも関与している[36][37][38]。(詳細は「細胞外マトリックス」の項を参照)
ギャップジャンクション(Gap Junction)
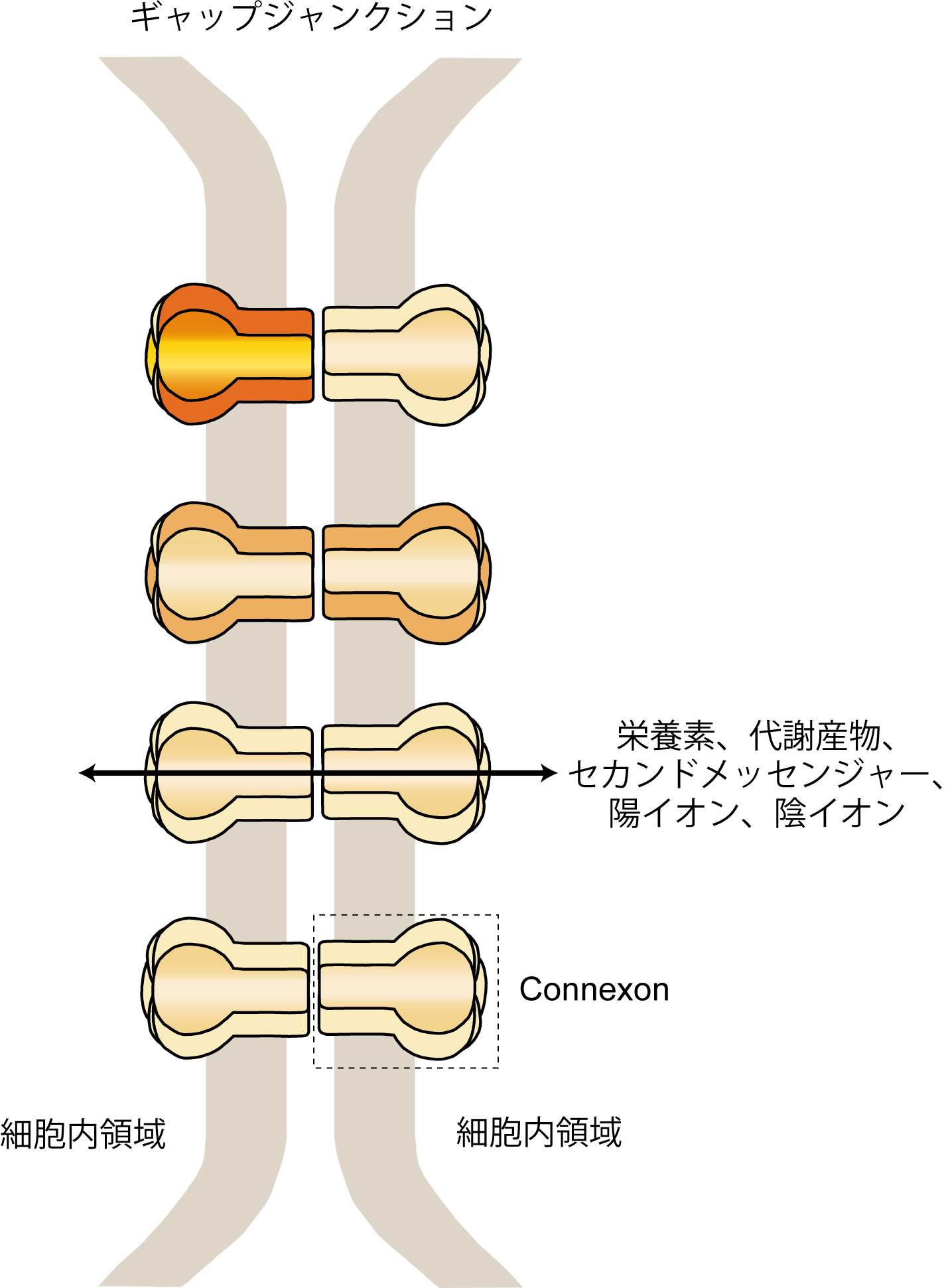 約1000ダルトン以下の低分子を通すことのできる細胞間チャネルを有する接着構造をギャップジャンクションという。ギャップジャンクションを介して、栄養素、代謝産物、セカンドメッセンジャー、陽イオン、陰イオンなどの様々な分子が細胞間で輸送される。この細胞間チャネルはConnexinsとPannexinsにより形成され、ヒトやマウスのゲノムには約20種類のConnexin遺伝子と、3種類のPannexin遺伝子が存在する。ニューロン間のギャップジャンクションは、主に6種類のConnexin-26, -30.2, -31.1, 36, -45, -57と2種類のPannexin-1, -2で構成される。Connexinsは細胞膜でホモまたはヘテロ6量体(Connexon)として存在し、対面する細胞膜のConnexonどうしでさらにホモフィリックあるいはヘテロフィリックに結合することで細胞間接合部チャネル、すなわちギャップジャンクションを形成する(図5)。ギャップジャンクションはニューロン間のみならず、小脳プルキンエ細胞とバーグマングリアの接着部位などにも存在し、ニューロン−グリア細胞間の情報伝達にも機能している[39]。
約1000ダルトン以下の低分子を通すことのできる細胞間チャネルを有する接着構造をギャップジャンクションという。ギャップジャンクションを介して、栄養素、代謝産物、セカンドメッセンジャー、陽イオン、陰イオンなどの様々な分子が細胞間で輸送される。この細胞間チャネルはConnexinsとPannexinsにより形成され、ヒトやマウスのゲノムには約20種類のConnexin遺伝子と、3種類のPannexin遺伝子が存在する。ニューロン間のギャップジャンクションは、主に6種類のConnexin-26, -30.2, -31.1, 36, -45, -57と2種類のPannexin-1, -2で構成される。Connexinsは細胞膜でホモまたはヘテロ6量体(Connexon)として存在し、対面する細胞膜のConnexonどうしでさらにホモフィリックあるいはヘテロフィリックに結合することで細胞間接合部チャネル、すなわちギャップジャンクションを形成する(図5)。ギャップジャンクションはニューロン間のみならず、小脳プルキンエ細胞とバーグマングリアの接着部位などにも存在し、ニューロン−グリア細胞間の情報伝達にも機能している[39]。
タイトジャンクション(Tight Junction)
神経細胞におけるタイトジャンクションの存在に関しての報告はないが、血液−脳関門(Blood-Brain Barrier: BBB)の維持におけるタイトジャンクションの役割は欠かせない。血管内皮細胞同士がタイトジャンクションを介して強固に結合することで、脳実質内への血液の浸潤を妨げるバリア構造が形成される。タイトジャンクションはClaudins、Occludins、JAMsによるホモフィリック結合を基盤として構築され、これら分子の細胞内領域がZonula occludens (ZO)を介してアクチン細胞骨格と結合する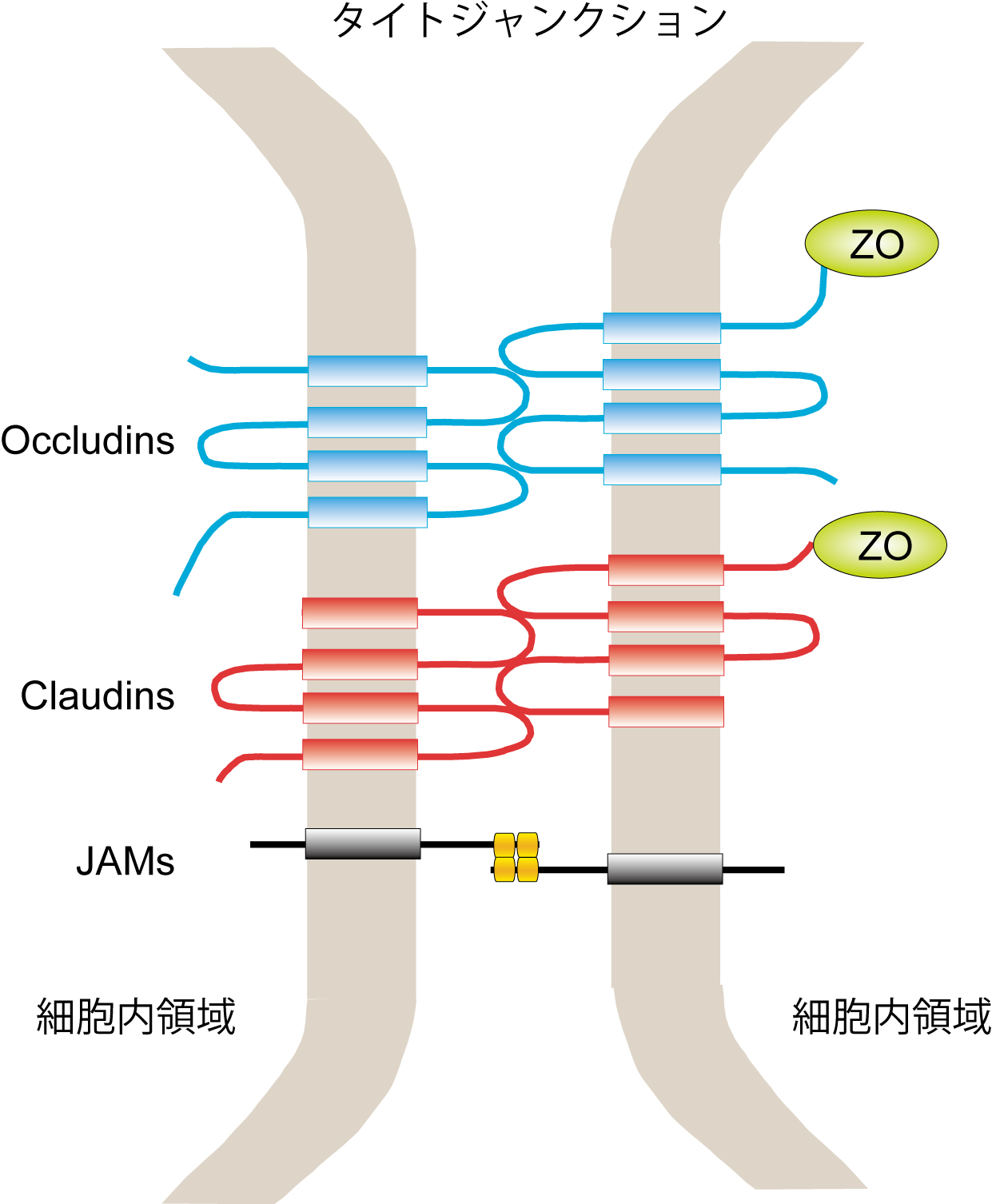 ことで、強固な細胞間接着構造が形成される(図6)[40][41]。また、末梢神経系でのシュワン細胞による軸索の髄鞘形成においては、Claudin-19を介したタイトジャンクション構造が重要な役割を果たしている[42]。
ことで、強固な細胞間接着構造が形成される(図6)[40][41]。また、末梢神経系でのシュワン細胞による軸索の髄鞘形成においては、Claudin-19を介したタイトジャンクション構造が重要な役割を果たしている[42]。
図1 細胞接着における3種類の結合様式
上から順にホモフィリック結合、ヘテロフィリック結合、リガンド架橋型結合を示す。
図2 カドヘリン・スーパーファミリー
カドヘリンは細胞外領域に複数のカドヘリンドメインを持つ蛋白質である。プロトカドヘリン1-21のカドヘリン様ドメイン数は分子によって異なる(6個または7個)。
図3 神経系に発現する免疫グロブリンスーパーファミリー
細胞外領域に1つまたは複数のIgドメインを持つ蛋白質群を免疫グロブリンスーパーファミリー(IgSF)と総称する。神経系には100種類以上のIgSF分子群が存在する。
Cys: Cysteine-rich domain, EGF: epidermal growth factor-like repeat, Kr: Kringle domain, LRR: leucine-rich repeat, MAM: meprin/A5/protein tyrosine phosphatase domain, Sema: semaphorin domain, TK: tyrosine kinase, TP: tyrosine phosphatase, TS: thrombospondin domain.
図4 インテグリン
A, インテグリンの構造。インテグリンはα、βサブユニットのヘテロ2量体からなる。
B, α、βサブユニットの組み合わせとそのリガンド分子。Col: Collagen, Fb: Fibrinogen, Fn: Fibronectin, FX; factor X, ICAM: Intercellular adhesion molecule, Ln: Laminin, MadCAM: Mucosal addressin cell adhesion molecule, Tn: Tenascin, VCAM: Vascular cell adhesion molecules, vWF: von Willebrand’s factor.
図5 ギャップジャンクション
Connexinsはホモまたはヘテロ6量体(Connexon)として細胞膜に存在し、対面する細胞膜にあるConnexonと細胞間チャネルを形成する。
図6 タイトジャンクション
Occuludins、Claudins、JAMsはホモフィリック結合を形成し、その細胞内ではZOとの結合を介してアクチン骨格に固定され強固なタイトジャンクションとして機能する。
関連項目
参考文献
- ↑
Ledda, F., Paratcha, G., Sandoval-Guzmán, T., & Ibáñez, C.F. (2007).
GDNF and GFRalpha1 promote formation of neuronal synapses by ligand-induced cell adhesion. Nature neuroscience, 10(3), 293-300. [PubMed:17310246] [WorldCat] [DOI] - ↑
Mishina, M., Uemura, T., Yasumura, M., & Yoshida, T. (2012).
Molecular mechanism of parallel fiber-Purkinje cell synapse formation. Frontiers in neural circuits, 6, 90. [PubMed:23189042] [PMC] [WorldCat] [DOI] - ↑
Yuzaki, M. (2011).
Cbln1 and its family proteins in synapse formation and maintenance. Current opinion in neurobiology, 21(2), 215-20. [PubMed:21342763] [WorldCat] [DOI] - ↑
Takeichi, M. (2007).
The cadherin superfamily in neuronal connections and interactions. Nature reviews. Neuroscience, 8(1), 11-20. [PubMed:17133224] [WorldCat] [DOI] - ↑
Takeichi, M. (1990).
Cadherins: a molecular family important in selective cell-cell adhesion. Annual review of biochemistry, 59, 237-52. [PubMed:2197976] [WorldCat] [DOI] - ↑
Sano, K., Tanihara, H., Heimark, R.L., Obata, S., Davidson, M., St John, T., ..., & Suzuki, S. (1993).
Protocadherins: a large family of cadherin-related molecules in central nervous system. The EMBO journal, 12(6), 2249-56. [PubMed:8508762] [PMC] [WorldCat] - ↑
Kohmura, N., Senzaki, K., Hamada, S., Kai, N., Yasuda, R., Watanabe, M., ..., & Yagi, T. (1998).
Diversity revealed by a novel family of cadherins expressed in neurons at a synaptic complex. Neuron, 20(6), 1137-51. [PubMed:9655502] [WorldCat] [DOI] - ↑
Yagi, T., & Takeichi, M. (2000).
Cadherin superfamily genes: functions, genomic organization, and neurologic diversity. Genes & development, 14(10), 1169-80. [PubMed:10817752] [WorldCat] - ↑
Usui, T., Shima, Y., Shimada, Y., Hirano, S., Burgess, R.W., Schwarz, T.L., ..., & Uemura, T. (1999).
Flamingo, a seven-pass transmembrane cadherin, regulates planar cell polarity under the control of Frizzled. Cell, 98(5), 585-95. [PubMed:10490098] [WorldCat] [DOI] - ↑
Yoshihara, Y., Oka, S., Ikeda, J., & Mori, K. (1991).
Immunoglobulin superfamily molecules in the nervous system. Neuroscience research, 10(2), 83-105. [PubMed:1710044] [WorldCat] [DOI] - ↑
Brümmendorf, T., & Rathjen, F.G. (1994).
Cell adhesion molecules. 1: immunoglobulin superfamily. Protein profile, 1(9), 951-1058. [PubMed:8528906] [WorldCat] - ↑
Cunningham, B.A., Hemperly, J.J., Murray, B.A., Prediger, E.A., Brackenbury, R., & Edelman, G.M. (1987).
Neural cell adhesion molecule: structure, immunoglobulin-like domains, cell surface modulation, and alternative RNA splicing. Science (New York, N.Y.), 236(4803), 799-806. [PubMed:3576199] [WorldCat] [DOI] - ↑
Luo, B.H., Carman, C.V., & Springer, T.A. (2007).
Structural basis of integrin regulation and signaling. Annual review of immunology, 25, 619-47. [PubMed:17201681] [PMC] [WorldCat] [DOI] - ↑
Gahmberg, C.G., Tian, L., Ning, L., & Nyman-Huttunen, H. (2008).
ICAM-5--a novel two-facetted adhesion molecule in the mammalian brain. Immunology letters, 117(2), 131-5. [PubMed:18367254] [WorldCat] [DOI] - ↑
Hynes, R.O. (2002).
Integrins: bidirectional, allosteric signaling machines. Cell, 110(6), 673-87. [PubMed:12297042] [WorldCat] [DOI] - ↑
Gall, C.M., & Lynch, G. (2004).
Integrins, synaptic plasticity and epileptogenesis. Advances in experimental medicine and biology, 548, 12-33. [PubMed:15250583] [WorldCat] [DOI] - ↑
Milner, R., & Campbell, I.L. (2006).
Increased expression of the beta4 and alpha5 integrin subunits in cerebral blood vessels of transgenic mice chronically producing the pro-inflammatory cytokines IL-6 or IFN-alpha in the central nervous system. Molecular and cellular neurosciences, 33(4), 429-40. [PubMed:17049262] [PMC] [WorldCat] [DOI] - ↑
Kramár, E.A., Lin, B., Rex, C.S., Gall, C.M., & Lynch, G. (2006).
Integrin-driven actin polymerization consolidates long-term potentiation. Proceedings of the National Academy of Sciences of the United States of America, 103(14), 5579-84. [PubMed:16567651] [PMC] [WorldCat] [DOI] - ↑
Wang, X.B., Bozdagi, O., Nikitczuk, J.S., Zhai, Z.W., Zhou, Q., & Huntley, G.W. (2008).
Extracellular proteolysis by matrix metalloproteinase-9 drives dendritic spine enlargement and long-term potentiation coordinately. Proceedings of the National Academy of Sciences of the United States of America, 105(49), 19520-5. [PubMed:19047646] [PMC] [WorldCat] [DOI] - ↑
Cingolani, L.A., & Goda, Y. (2008).
Differential involvement of beta3 integrin in pre- and postsynaptic forms of adaptation to chronic activity deprivation. Neuron glia biology, 4(3), 179-87. [PubMed:19758485] [WorldCat] [DOI] - ↑
Pozo, K., Cingolani, L.A., Bassani, S., Laurent, F., Passafaro, M., & Goda, Y. (2012).
β3 integrin interacts directly with GluA2 AMPA receptor subunit and regulates AMPA receptor expression in hippocampal neurons. Proceedings of the National Academy of Sciences of the United States of America, 109(4), 1323-8. [PubMed:22232691] [PMC] [WorldCat] [DOI] - ↑
Sekine, K., Kawauchi, T., Kubo, K., Honda, T., Herz, J., Hattori, M., ..., & Nakajima, K. (2012).
Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrin α5β1. Neuron, 76(2), 353-69. [PubMed:23083738] [PMC] [WorldCat] [DOI] - ↑
Ethell, I.M., & Pasquale, E.B. (2005).
Molecular mechanisms of dendritic spine development and remodeling. Progress in neurobiology, 75(3), 161-205. [PubMed:15882774] [WorldCat] [DOI] - ↑
Südhof, T.C. (2008).
Neuroligins and neurexins link synaptic function to cognitive disease. Nature, 455(7215), 903-11. [PubMed:18923512] [PMC] [WorldCat] [DOI] - ↑
de Wit, J., Hong, W., Luo, L., & Ghosh, A. (2011).
Role of leucine-rich repeat proteins in the development and function of neural circuits. Annual review of cell and developmental biology, 27, 697-729. [PubMed:21740233] [WorldCat] [DOI] - ↑
Hruska, M., & Dalva, M.B. (2012).
Ephrin regulation of synapse formation, function and plasticity. Molecular and cellular neurosciences, 50(1), 35-44. [PubMed:22449939] [PMC] [WorldCat] [DOI] - ↑
Pasterkamp, R.J. (2012).
Getting neural circuits into shape with semaphorins. Nature reviews. Neuroscience, 13(9), 605-18. [PubMed:22895477] [WorldCat] [DOI] - ↑
Silva, J.P., Lelianova, V.G., Ermolyuk, Y.S., Vysokov, N., Hitchen, P.G., Berninghausen, O., ..., & Ushkaryov, Y.A. (2011).
Latrophilin 1 and its endogenous ligand Lasso/teneurin-2 form a high-affinity transsynaptic receptor pair with signaling capabilities. Proceedings of the National Academy of Sciences of the United States of America, 108(29), 12113-8. [PubMed:21724987] [PMC] [WorldCat] [DOI] - ↑
Bolliger, M.F., Martinelli, D.C., & Südhof, T.C. (2011).
The cell-adhesion G protein-coupled receptor BAI3 is a high-affinity receptor for C1q-like proteins. Proceedings of the National Academy of Sciences of the United States of America, 108(6), 2534-9. [PubMed:21262840] [PMC] [WorldCat] [DOI] - ↑
Boucard, A.A., Ko, J., & Südhof, T.C. (2012).
High affinity neurexin binding to cell adhesion G-protein-coupled receptor CIRL1/latrophilin-1 produces an intercellular adhesion complex. The Journal of biological chemistry, 287(12), 9399-413. [PubMed:22262843] [PMC] [WorldCat] [DOI] - ↑
O'Sullivan, M.L., de Wit, J., Savas, J.N., Comoletti, D., Otto-Hitt, S., Yates, J.R., & Ghosh, A. (2012).
FLRT proteins are endogenous latrophilin ligands and regulate excitatory synapse development. Neuron, 73(5), 903-10. [PubMed:22405201] [PMC] [WorldCat] [DOI] - ↑
Minami, Y., Ikeda, W., Kajita, M., Fujito, T., Amano, H., Tamaru, Y., ..., & Takai, Y. (2007).
Necl-5/poliovirus receptor interacts in cis with integrin alphaVbeta3 and regulates its clustering and focal complex formation. The Journal of biological chemistry, 282(25), 18481-96. [PubMed:17446174] [WorldCat] [DOI] - ↑ 33.0 33.1
Furutani, Y., Kawasaki, M., Matsuno, H., Mitsui, S., Mori, K., & Yoshihara, Y. (2012).
Vitronectin induces phosphorylation of ezrin/radixin/moesin actin-binding proteins through binding to its novel neuronal receptor telencephalin. The Journal of biological chemistry, 287(46), 39041-9. [PubMed:23019340] [PMC] [WorldCat] [DOI] - ↑
Sanes, J.R., & Lichtman, J.W. (1999).
Development of the vertebrate neuromuscular junction. Annual review of neuroscience, 22, 389-442. [PubMed:10202544] [WorldCat] [DOI] - ↑
O'Sullivan, M.L., de Wit, J., Savas, J.N., Comoletti, D., Otto-Hitt, S., Yates, J.R., & Ghosh, A. (2012).
FLRT proteins are endogenous latrophilin ligands and regulate excitatory synapse development. Neuron, 73(5), 903-10. [PubMed:22405201] [PMC] [WorldCat] [DOI] - ↑
Gundelfinger, E.D., Frischknecht, R., Choquet, D., & Heine, M. (2010).
Converting juvenile into adult plasticity: a role for the brain's extracellular matrix. The European journal of neuroscience, 31(12), 2156-65. [PubMed:20497467] [WorldCat] [DOI] - ↑
Kazanis, I., & ffrench-Constant, C. (2011).
Extracellular matrix and the neural stem cell niche. Developmental neurobiology, 71(11), 1006-17. [PubMed:21898854] [PMC] [WorldCat] [DOI] - ↑
Sekine, K., Kawauchi, T., Kubo, K., Honda, T., Herz, J., Hattori, M., ..., & Nakajima, K. (2012).
Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrin α5β1. Neuron, 76(2), 353-69. [PubMed:23083738] [PMC] [WorldCat] [DOI] - ↑
Söhl, G., Maxeiner, S., & Willecke, K. (2005).
Expression and functions of neuronal gap junctions. Nature reviews. Neuroscience, 6(3), 191-200. [PubMed:15738956] [WorldCat] [DOI] - ↑
Tsukita, S., Furuse, M., & Itoh, M. (2001).
Multifunctional strands in tight junctions. Nature reviews. Molecular cell biology, 2(4), 285-93. [PubMed:11283726] [WorldCat] [DOI] - ↑
Redzic, Z. (2011).
Molecular biology of the blood-brain and the blood-cerebrospinal fluid barriers: similarities and differences. Fluids and barriers of the CNS, 8(1), 3. [PubMed:21349151] [PMC] [WorldCat] [DOI] - ↑
Miyamoto, T., Morita, K., Takemoto, D., Takeuchi, K., Kitano, Y., Miyakawa, T., ..., & Tsukita, S. (2005).
Tight junctions in Schwann cells of peripheral myelinated axons: a lesson from claudin-19-deficient mice. The Journal of cell biology, 169(3), 527-38. [PubMed:15883201] [PMC] [WorldCat] [DOI]
(執筆者:古谷 裕、吉原良浩、担当編集委員:大隅典子)